Similar presentations:
Аморфные материалы
1. АМОРФНЫЕ МАТЕРИАЛЫ
2.
КЛАССИФИКАЦИЯ СТЕКОЛпо химическому составу
Элементарные стекла. Это материалы, образованные одним элементом,
таким, как Si, Ge, B, P, Se.
Оксидные стекла. Их основа оксиды SiO2, B2O3, P2O5 и др.
Халькогенидные стекла. Образованы сульфидами, селенидами и
теллуридами элементов, например GeS2, P4Se4, As2Te.
Металлические стекла. Различают металлические стекла типа металл-металл
(Cu50Zr50, Ni60Nb40) и типа металл-металлоид (Fe80B20, Pd80Si20).
Галогенидные стекла. Получают на основе стеклообразующего компонента
BeF2. Многокомпонентные составы фторбериллатных стекол содержат также
фториды алюминия, кальция, магния, стронция, бария.
Полимерные стекла. Образуются полимерами с нерегулярными
последовательностями мономеров, а также разветвленными полимерами.
по типу связи:
• ковалентные (оксиды, элементы, органические полимеры)
• ионные (галогениды, нитраты)
• с водородной связью (водные растворы солей)
• молекулярная связь (органические жидкости)
• металлическая связь (сплавы)
3.
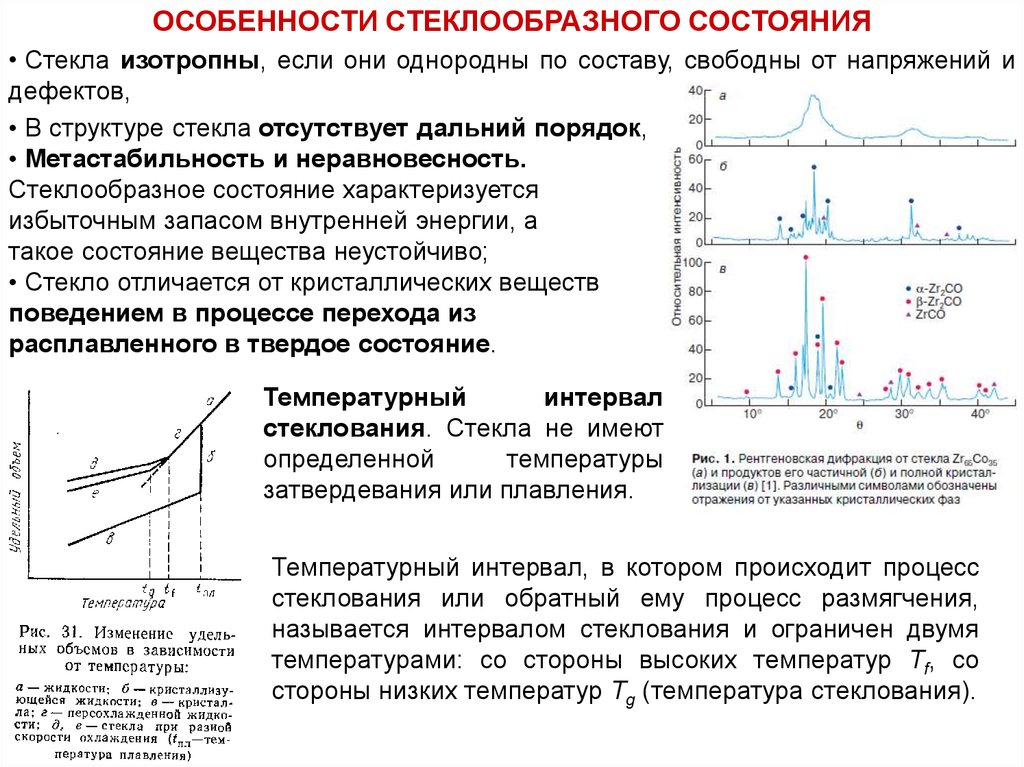
ОСОБЕННОСТИ СТЕКЛООБРАЗНОГО СОСТОЯНИЯ• Стекла изотропны, если они однородны по составу, свободны от напряжений и
дефектов,
• В структуре стекла отсутствует дальний порядок,
• Метастабильность и неравновесность.
Стеклообразное состояние характеризуется
избыточным запасом внутренней энергии, а
такое состояние вещества неустойчиво;
• Стекло отличается от кристаллических веществ
поведением в процессе перехода из
расплавленного в твердое состояние.
Температурный
интервал
стеклования. Стекла не имеют
определенной
температуры
затвердевания или плавления.
Температурный интервал, в котором происходит процесс
стеклования или обратный ему процесс размягчения,
называется интервалом стеклования и ограничен двумя
температурами: со стороны высоких температур Tf, со
стороны низких температур Тg (температура стеклования).
4.
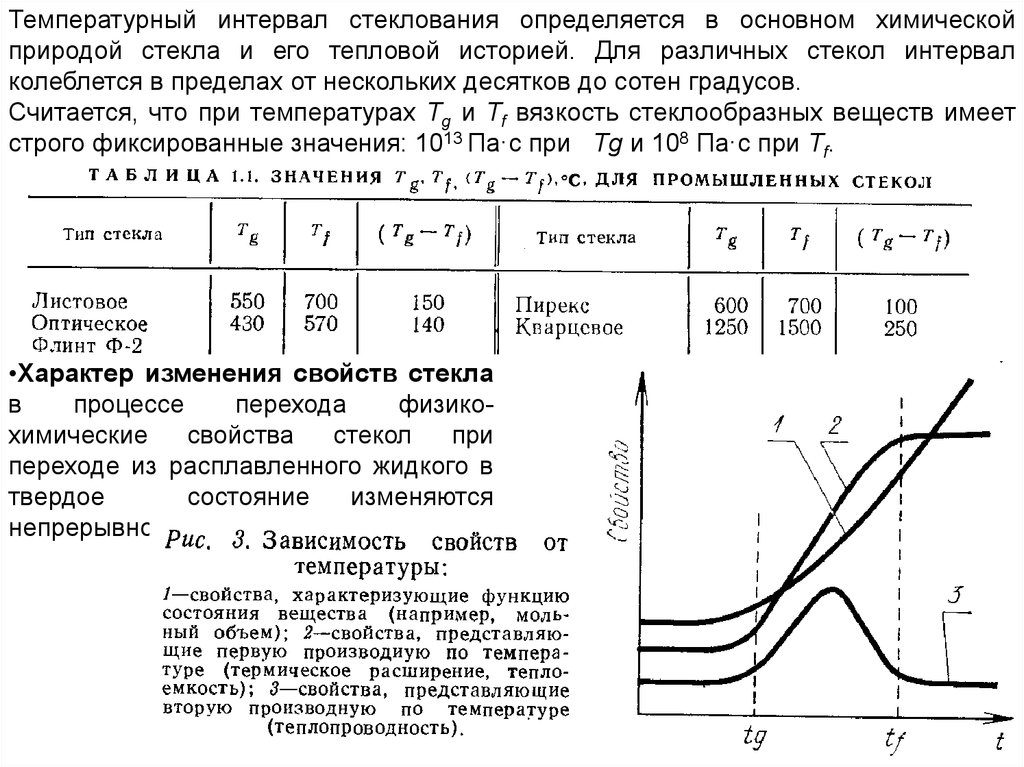
Температурный интервал стеклования определяется в основном химическойприродой стекла и его тепловой историей. Для различных стекол интервал
колеблется в пределах от нескольких десятков до сотен градусов.
Считается, что при температурах Тg и Tf вязкость стеклообразных веществ имеет
строго фиксированные значения: 1013 Па·с при Тg и 108 Па·с при Tf.
•Характер изменения свойств стекла
в
процессе
перехода
физикохимические
свойства
стекол
при
переходе из расплавленного жидкого в
твердое
состояние
изменяются
непрерывно.
5.
УСЛОВИЯ СТЕКЛООБРАЗОВАНИЯПроцесс стеклообразования определяется следующими факторами:
1) внутренними, зависящими от природы веществ, находящихся в расплавленном
состоянии; связаны со строением атомов, входящих в состав расплава, и
характером сил взаимодействия между ними;
2) внешними, зависящими от условий термообработки.
Условия стеклообразования, определяемые природой исходных веществ.
Критерий Гольдшмита – к стеклообразованию склонны соединения, структура
которых образована тетраэдрами (MeO4)n-, а соотношение ионных радиусов
катиона и аниона rk/ra изменяется в пределах равным 0,2-0,4.
Условия Захариасена
1. каждый ион кислорода должен быть связан не более чем с двумя катионами;
2. координационное число окруженных ионами кислорода центральных катионов
должно быть небольшим, не более 4;
3. кислородные многогранники могут связываться друг с другом через общие углы
таким образом, что образуются трехмерные пространственные решетки;
4. каждый многогранник должен быть связан с другими по крайней мере тремя
общими углами.
простые оксиды:
- Нестеклообразующие R2O и RO
- Стеклообразующие RO2 и R2O5 (SiO2, В2О3, Р2O5, GeO2)
- промежуточные. R2O3
6.
Критерий Сана - чем прочнее связь МеО, тем легче образуется стекло.В оксидах-стеклообразователях прочность связи Ме–О гораздо выше (350-500
кДж/моль ), чем в оксидах-модификаторах (50-150 кДж/моль).
Критерий Роусона выражается отношением энергии связи Ме-О к температуре
плавления соединения: Кр = ЕМе-О/Тпл. Для SiO2 Кр = 0,053 – типичный
стеклообразователь; для ZrО2 Кр = 0,023 – нестеклообразующий оксид. Чем выше
значение Кр, тем выше способность соединения образовывать стекло.
7.
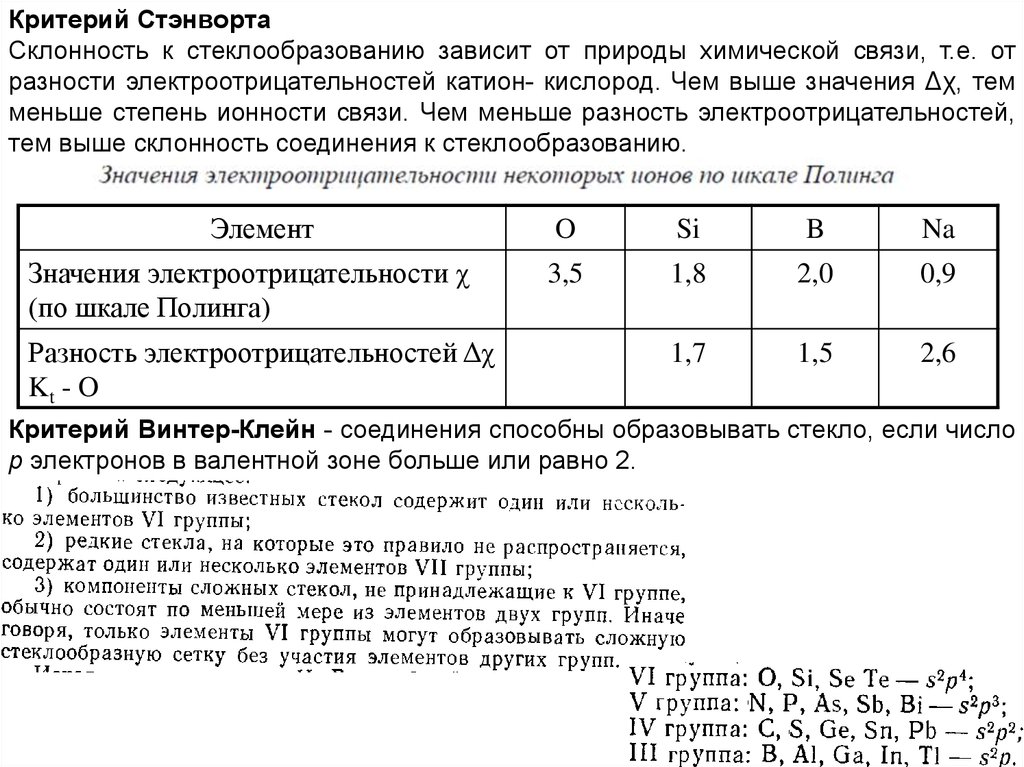
Критерий СтэнвортаСклонность к стеклообразованию зависит от природы химической связи, т.е. от
разности электроотрицательностей катион- кислород. Чем выше значения Δχ, тем
меньше степень ионности связи. Чем меньше разность электроотрицательностей,
тем выше склонность соединения к стеклообразованию.
Элемент
Значения электроотрицательности χ
(по шкале Полинга)
Разность электроотрицательностей Δχ
Kt - O
O
Si
B
Na
3,5
1,8
2,0
0,9
1,7
1,5
2,6
Критерий Винтер-Клейн - соединения способны образовывать стекло, если число
p электронов в валентной зоне больше или равно 2.
8.
Критерий Куманина и Мухиной для многокомпонентных составов – состав болеесклонен к стеклообразованию, если на диаграмме состояния он расположен
вблизи точки эвтектики. Чем ближе точка состава к составу определенного
химического соединения, тем легче он кристаллизуется.
Критерий Тернбулла и Коэна (на основе теории Таммана о кристаллизации
расплавов) – стеклообразование может быть вызвано как малой скоростью роста
кристаллов, так и малой скоростью образования центров кристаллизации.
Кинетические теории стеклообразования
Зависимость скорости гомогенной
кристаллизации
и роста кристаллов от степени переохлаждения
Зависимость скорости образования
центров кристаллизации I1 и линейной
скорости роста ристаллов I2 от
температуры
а – расплав кристаллизуется в
интервале Т1-Т2; б – расплав
интенсивно кристаллизуется в
широком интервале температур, не
склонен к стеклообразованию; в –
расплав склонен к стеклообразованию
9.
Если температурный интервал между Ts и Tg невелик, то такоевещество легко аморфизируется.
Для легко аморфизирующихся веществ характерна сильная
зависимость вязкости от температуры, а в случае металлов эта
зависимость чрезвычайно слабая.
Такое различие прямо связано с диффузионной подвижностью
атомов или молекул данного вещества. Вязкость η и
коэффициент диффузии D связаны между собой соотношением
η = 3 π а D/ kT,
где а – диаметр диффундирующих атомов; k - постоянная
Больцмана; Т – абсолютная температура.
Коэффициент диффузии, выражающий подвижность атомов
различен для разных веществ. У металлов связь между атомами
слабая, то коэффициент диффузии большой, и наоборот, у тех
веществ, для которых характерна сильная связь между атомами,
коэффициент диффузии мал.
10.
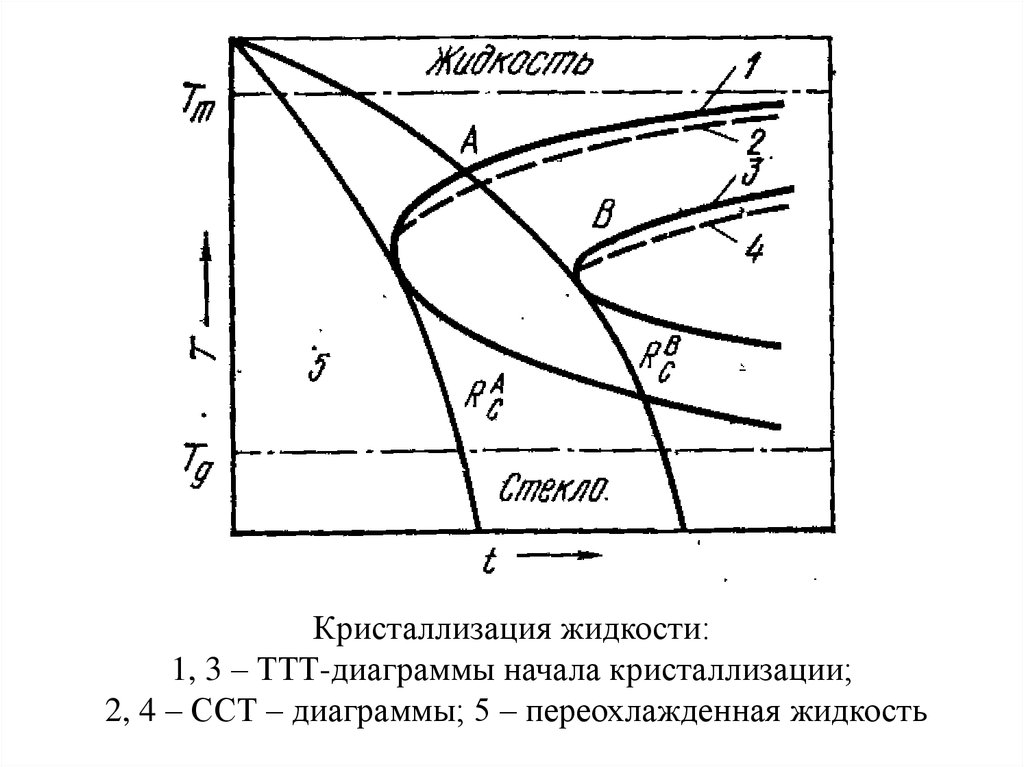
Кристаллизация жидкости:1, 3 – ТТТ-диаграммы начала кристаллизации;
2, 4 – ССТ – диаграммы; 5 – переохлажденная жидкость
11.
СТРОЕНИЕ СТЕКЛАСоздание теории о строении стекла принадлежит Д.И.Менделееву,
стеклообразное состояние следует рассматривать в связи со строением и
свойствами природных и искусственных кристаллических силикатов.
Кристаллитная гипотеза была высказана Лебедевым А.А.
Первоначальное
предположение
силикатное
стекло
имеет
скрытнокристаллическое строение.
Гипотеза - структуру стекол можно рассматривать как скопление
микроструктурных образований с упорядоченным расположением атомов
(кристаллитов).
Центральная
часть
кристаллитов
характеризуется
упорядоченным расположением частиц, близких к такому у кристалла, а
периферия является переходом от одной микрообласти к другой.
Отличительной особенностью кристаллитов является отсутствие границ
раздела.
Гипотеза о структуре стекла в виде непрерывной беспорядочной сетки
(Захариасен и Уоррен) сформулирована на основе данных кристаллохимии
силикатов.
Атомы в стекле, так же как и в кристалле, должны образовывать непрерывную
трехмерную решетку. Однако эта решетка в отличие от решетки кристалла
несимметрична и непериодична.
В качестве первичного структурного элемента кристаллических силикатов
принимается кремнекислородный анион-тетраэдр [SiO4]4-.
12.
13.
14.
Ликвация в стеклахРасслаивание – это процесс разделения гомогенной жидкости на две
жидкие фазы, когда однофазная жидкость при охлаждении попадает в
область несмешиваемости диаграммы состояния.
Если при смешивании двух компонентов
свободная энергия понижается, смесь
остается гомогенной.
Если же свободная энергия понижается
при разделении смеси на два
компонента, то при благоприятных
кинетических факторах произойдет расслоение.
ΔG = ΔH - T ΔS
Энтальпия смешения:
1. Суммарное изменение энтальпии смешения компонентов либо
отрицательна, либо равно нулю. Тогда ΔH≤0. Поскольку ΔS>0, то ΔG<0 и
жидкости смешиваются при любой температуре.
2. Суммарная энтальпия смешения положительна.
Поэтому если ΔH> T ΔS, то происходит расслаивание, т.к. ΔG>0.
Механизм расслаивания
1. Образование и рост зародышей;
2. Спинодальный распад жидкости.
15.
Т1 – расслаивания нет, уменьшение свободнойэнергии;
Т2 – происходит расслаивание.
e → f + g, жидкость состава е устойчива при
небольших флуктуациях и неустойчива при
сильных. Расслоение идет по механизму 1.
разделение фаз не происходит спонтанно. И
жидкость состава е является метастабильной.
Жидкость
состава
h
при
небольшой
флуктуации состава распадается на j и k
спонтанно, потенциальный барьер для такого
распада отсутствует. Спинодальный распад.
16.
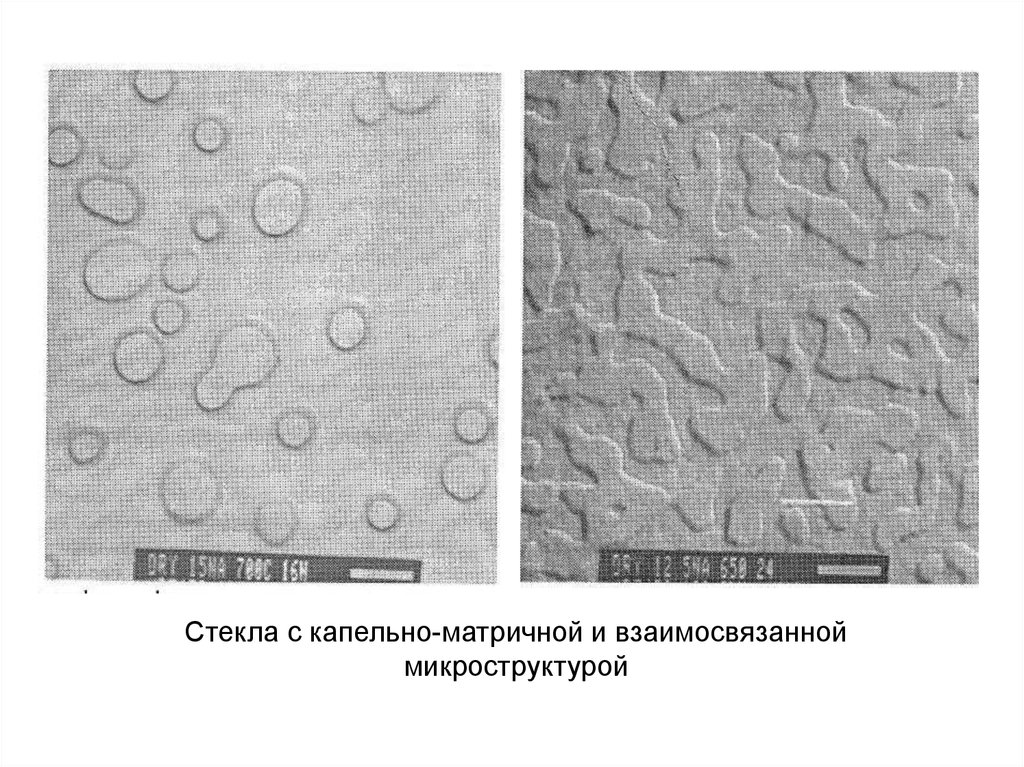
Некоторые различия в микроструктуре стекол,образующихся в результате спинодального распада
и возникновения и роста зародышей
17.
Стекла с капельно-матричной и взаимосвязанноймикроструктурой
18.
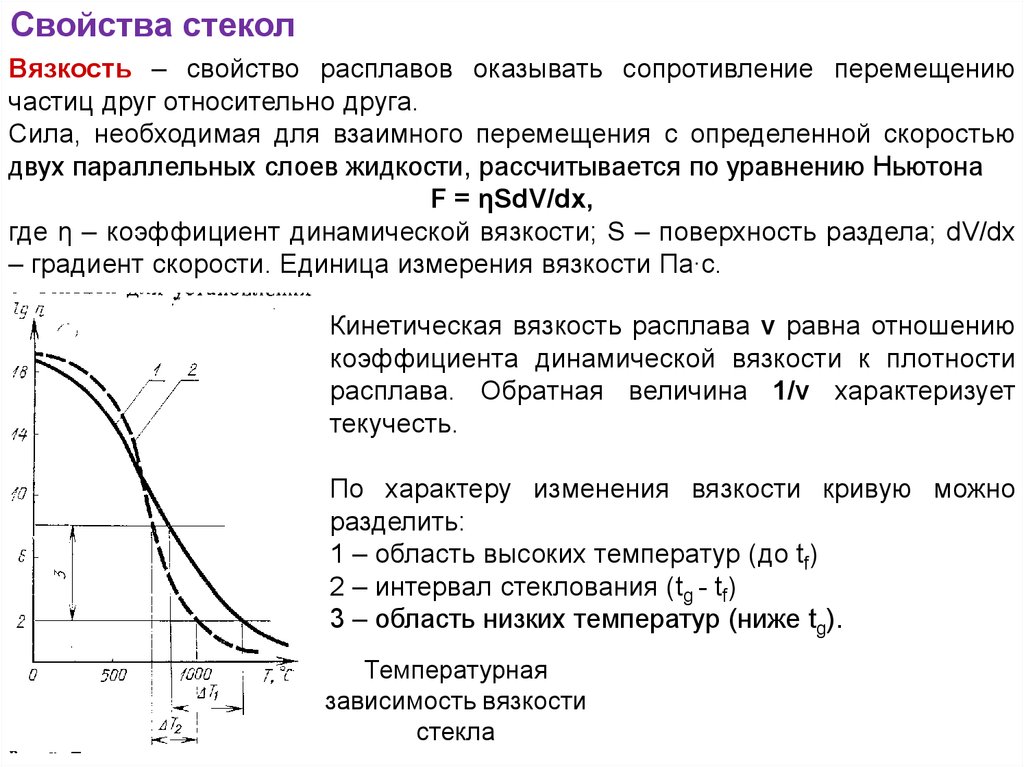
Свойства стеколВязкость – свойство расплавов оказывать сопротивление перемещению
частиц друг относительно друга.
Сила, необходимая для взаимного перемещения с определенной скоростью
двух параллельных слоев жидкости, рассчитывается по уравнению Ньютона
F = ηSdV/dx,
где η – коэффициент динамической вязкости; S – поверхность раздела; dV/dх
– градиент скорости. Единица измерения вязкости Па∙с.
Кинетическая вязкость расплава ν равна отношению
коэффициента динамической вязкости к плотности
расплава. Обратная величина 1/ν характеризует
текучесть.
По характеру изменения вязкости кривую можно
разделить:
1 – область высоких температур (до tf)
2 – интервал стеклования (tg - tf)
3 – область низких температур (ниже tg).
Температурная
зависимость вязкости
стекла
19.
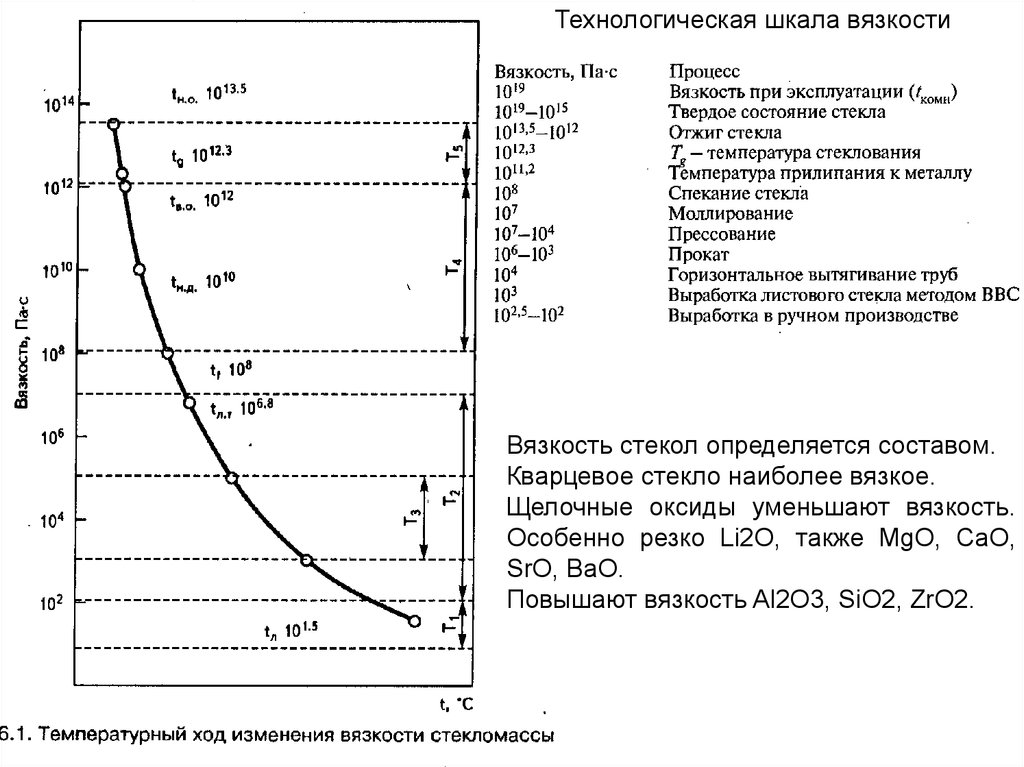
Технологическая шкала вязкостиВязкость стекол определяется составом.
Кварцевое стекло наиболее вязкое.
Щелочные оксиды уменьшают вязкость.
Особенно резко Li2O, также MgO, CaO,
SrO, BaO.
Повышают вязкость Al2O3, SiO2, ZrO2.
20.
Поверхностное натяжениеПлотность
Изменяется в пределах от 2,2 до 7,5 г/см3.
Зависит от состава, строения пространственного каркаса, теплового
прошлого стекла, температуры окружающей среды.
Кварцевое стекло – минимальная плотность.
Твердость
21.
ЭлектропроводностьБольшая группа оксидных стекол – изоляторы.
Удельная объемная электропроводность – 10-7…10-15 (Ом∙м)-1
Носители тока – катионы щелочных или щелочноземельных металлов.
Зависит от концентрации щелочных компонентов и от их подвижности.
Кварцевое стекло – почти идеальный изолятор.
Ионы Ca, Ba, Pb снижают подвижность ионов натрия и тем самым
электропроводность.
Теплофизические свойства
В интервале 0-100 град.С в зависимости от состава силикатных стекол
теплопроводность составляет 0,6-1,34 Вт/м∙ºС.
Теплоемкость стекол возрастает по мере увеличения концентрации
легких элементов (Li2O, BeO, MgO). Наиболее низкая теплоемкость у
систем с высоким содержание (PbO, BaO).
ТКЛР – самое низкое значение для кварцевого стекла. Повышение
оксидов модификаторов (МеО2) увеличивает ТКЛР, а повышение
содержания SiO2, Al2O3, B2O3, MgO – к уменьшению.
Термостойкость – максимальная для кварцевого стекла (1000 ºС), у
большинства промышленных стекол 80-90 ºС, боросиликатных – 200-250
ºС
22.
Оптические свойства стеклаПоказатель преломления.
23.
Химическая устойчивость стеклаЗависит от химической природы действующего реагента.
24.
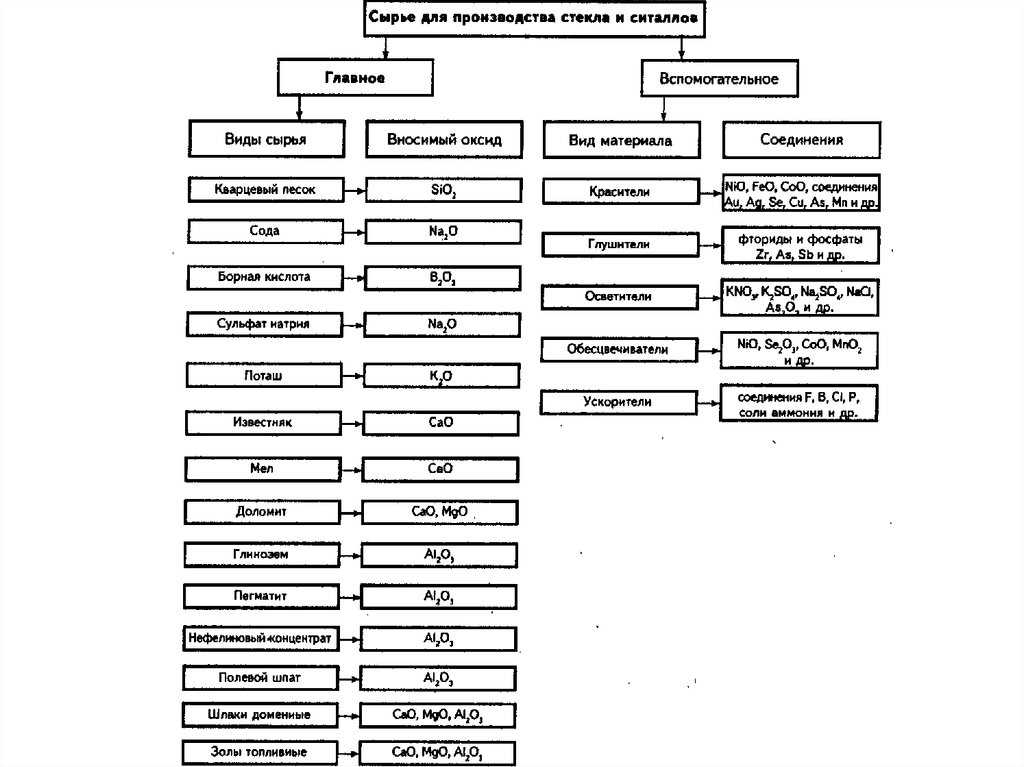
Основы стекловаренияСырьевые материалы
Главные
Создают основу стекла и состоят из оксида алюминия, кислотных,
щелочных, щелочноземельных и др. оксидов.
Влияние на свойства:
25.
26.
27.
28.
29.
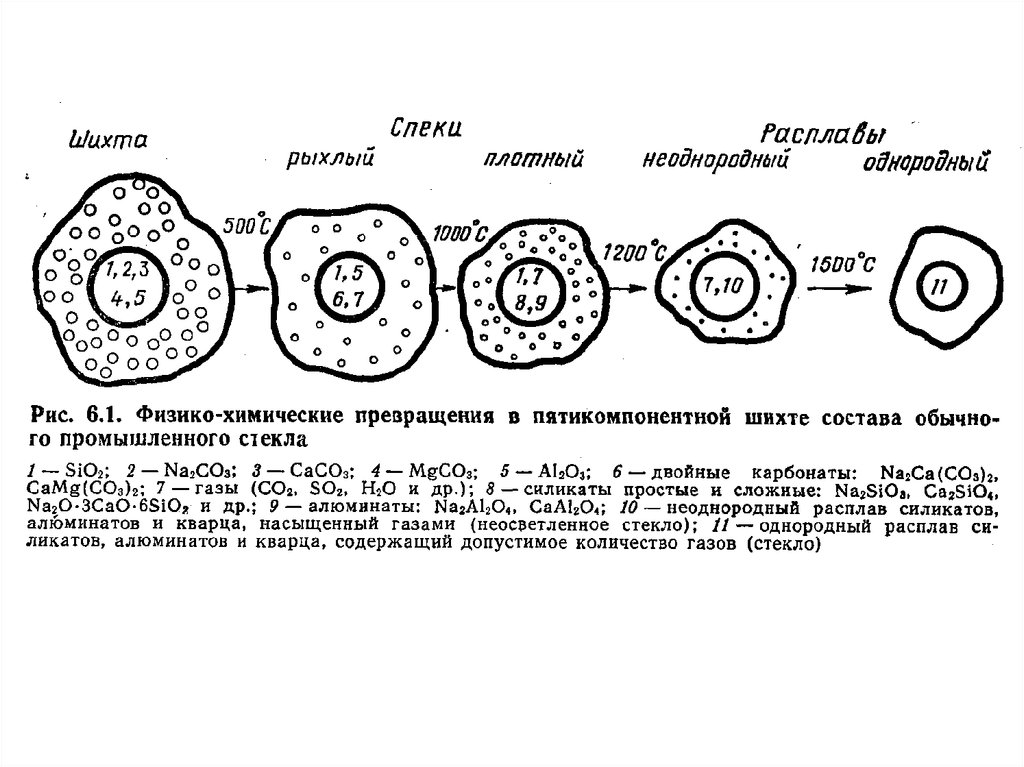
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ СТЕКЛОВАРЕНИЯСтекловарение – это термический процесс, в результате которого смесь
разнородных компонентов образует однородный расплав.
ЭТАПЫ СТЕКЛОВАРЕНИЯ
Силикатообразование: в начале нагревания в шихте протекают:
Испарение влаги,
Полиморфные превращения.
Термическое разложение компонентов
Начинаются химические реакции между компонентами шихты (<400 ºС),
Появляется жидкая фаза за счет плавления эвтектических смесей и
солей.
Завершается
при 950-1150 ºС.
Схема
процессов
силикатообразования для
шихты
СаO-Na2O-SiO2
30.
31.
Физические процессыНагревание шихты
Испарение влаги
Плавление компонентов шихты
Растворение компонентов в
образовавшейся жидкости
Полиморфные превращения
Улетучивание некоторых
компонентов
Химические процессы
Диссоциация гидратов
Удаление химически связанной
воды
Диссоциация карбонатов,
сульфатов, нитратов и
перекисей
Взаимодействие разных
компонентов и образование
силикатов
32.
33.
ОКРАШИВАНИЕ СТЕКЛАИонные красители – катионы переходных и редкоземельных элементов
(3d- и 4f-элементы), особенность электронного строения которых состоит в
том, что в ионном состоянии имеют неспаренные электроны или
незаполненные орбитали.
Молекулярные красители – сульфиды, селениды и смешанные
кристаллы сульфоселенидов тяжелых металлов – кадмия, сурьмы,
висмута,
свинца,
железа
и
др.
Эти
соединения
являются
полупроводниками. В стекле присутствуют в виде микрокристаллических
образований размером не более 50 нм.
34.
35.
Кристаллизация силикатных стеколСиталлы – это стеклокристаллические материалы, получаемые
регулируемой кристаллизацией при специальной тепловой обработке.
По структуре ситаллы занимают промежуточное положение между
обычными стеклами и керамикой. В связи с этим ситаллы иногда
называют стеклокерамикой.
Высокий уровень свойств: высокой механической прочностью,
твердостью, химической и термической устойчивостью, малым
термическим расширением и другими полезными свойствами.
Технические ситаллы получают на основе систем:
Li2O-Al2O3-SiO2, MO-Al2O3-SiO2, Li2O-MO-Al2O3-SiO2, где M - Mg, Ca, Zn,
Ba, Sr и др.;
MgO-Al2O3-SiO2-K2O-F; MO-B2O3-Al2O3 (где M - Ca, Sr, Pb, Zn);
PbO-ZnO-B2O3-Al2O3-SiO2и др.
По основному свойству и назначению подразделяются на
высокопрочные, радиопрозрачные химически стойкие, прозрачные
термостойкие, износостойкие и химически стойкие, фотоситаллы,
слюдоситаллы, биоситаллы, ситаллоцементы, ситаллоэмали, ситаллы
со специальными электрическими свойствами.
36.
37.
ПОЛУЧЕНИЕ АМОРФНЫХ МЕТАЛЛОВАморфная структура получена у более чем 20 чистых металлов и
полупроводниковых материалов и более 110 сплавов.
Аморфные сплавы делят на два типа:
металл-металлоид: сплавы переходных и благородных
металлов (Fe, Co Ni, Re, Ti и др.) с металлоидами (В, С, Р, Si),
атомное содержание которых составляет 15-25 %.
Состав аморфного сплава должен отвечать формуле М80Х20, где
М – один или несколько переходных металлов; Х – элементы,
добавляемые для образования и стабилизации аморфной
структуры.
металл-металл: сплавы переходных, благородных (и Cu)
металлов друг с другом (Nb-Ni, Zr-Pd);
сплавы простых металлов друг с другом (Mg-Zn, Mg-Cu); сплавы
простых металлов с переходными (Ti-Be, Zr-Be);
сплавы простых металлов с редкоземельными (La-Al);
сплавы переходных металлов с редкоземельными (Gd-Co, TbCo).
38.
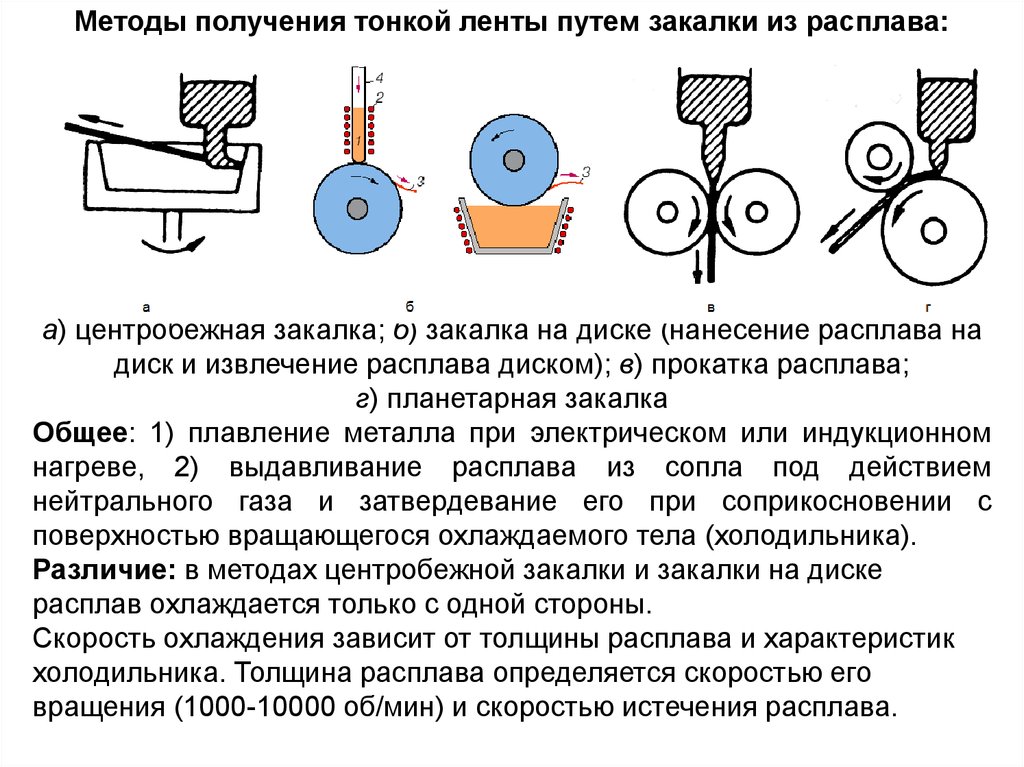
Методы закалки из жидкого состоянияМетоды получения тонких пластин
39.
Методы получения тонкой ленты путем закалки из расплава:а) центробежная закалка; б) закалка на диске (нанесение расплава на
диск и извлечение расплава диском); в) прокатка расплава;
г) планетарная закалка
Общее: 1) плавление металла при электрическом или индукционном
нагреве, 2) выдавливание расплава из сопла под действием
нейтрального газа и затвердевание его при соприкосновении с
поверхностью вращающегося охлаждаемого тела (холодильника).
Различие: в методах центробежной закалки и закалки на диске
расплав охлаждается только с одной стороны.
Скорость охлаждения зависит от толщины расплава и характеристик
холодильника. Толщина расплава определяется скоростью его
вращения (1000-10000 об/мин) и скоростью истечения расплава.
40.
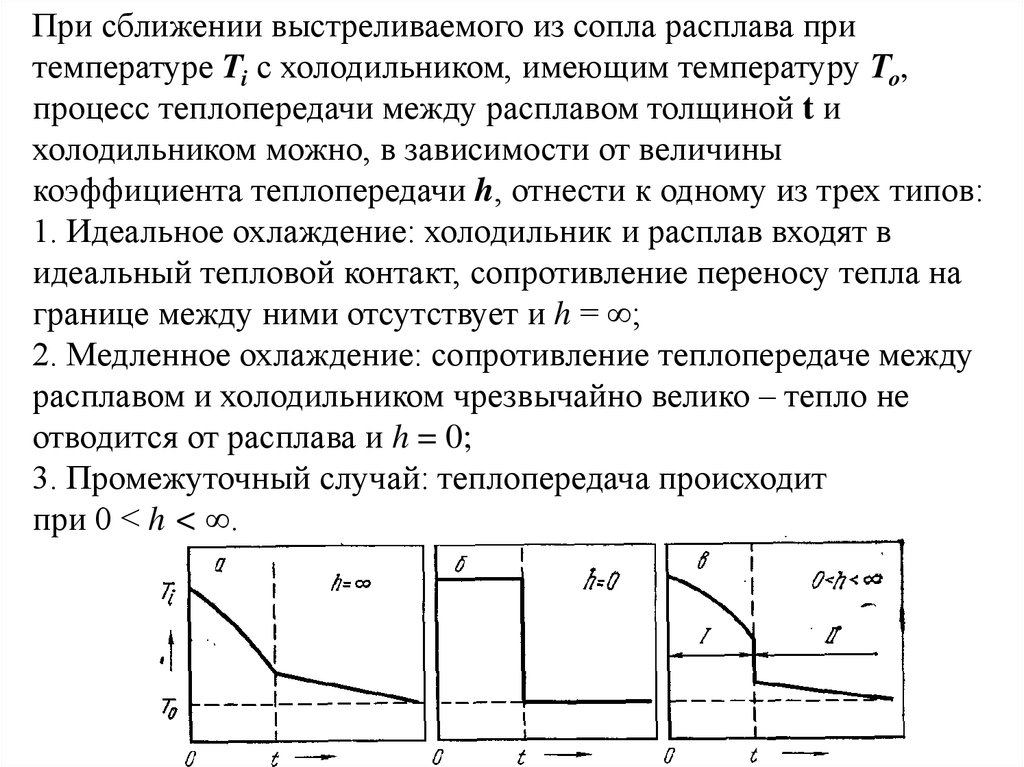
При сближении выстреливаемого из сопла расплава притемпературе Ti с холодильником, имеющим температуру То,
процесс теплопередачи между расплавом толщиной t и
холодильником можно, в зависимости от величины
коэффициента теплопередачи h, отнести к одному из трех типов:
1. Идеальное охлаждение: холодильник и расплав входят в
идеальный тепловой контакт, сопротивление переносу тепла на
границе между ними отсутствует и h = ∞;
2. Медленное охлаждение: сопротивление теплопередаче между
расплавом и холодильником чрезвычайно велико – тепло не
отводится от расплава и h = 0;
3. Промежуточный случай: теплопередача происходит
при 0 < h < ∞.
41.
Реально происходит промежуточный процесс, т.к. имеетсяконечная величина сопротивления передаче тепла на границе
между расплавом и холодильником. Скорость охлаждения
может быть выражена как
R = h (Ti – To) / cp ρ t
где cp - удельная теплоемкость расплава; ρ – плотность
расплава; t – толщина расплава.
Когда расплав имеет постоянный состав, то Ti и To постоянны, а
скорость охлаждения пропорциональна h и обратно
пропорциональна t.
Максимальная толщина аморфной ленты зависит от
критической скорости охлаждения сплава и возможностей
установки для закалки. Если скорость охлаждения меньше
критической, то аморфизация не произойдет.
42.
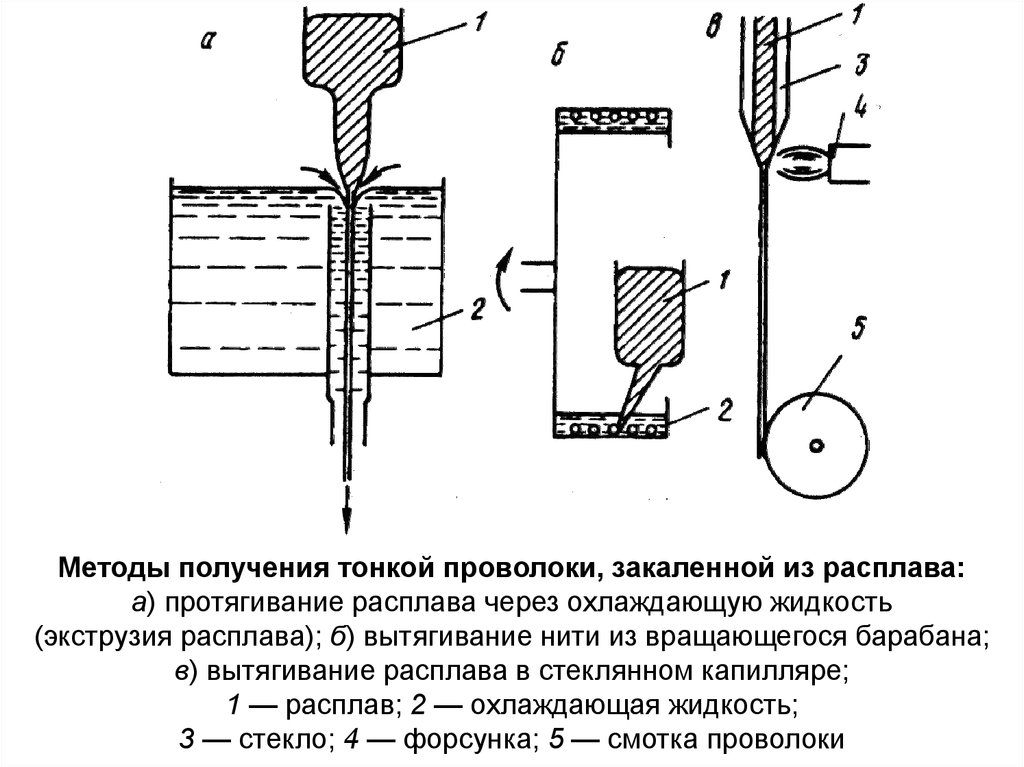
Методы получения тонкой проволоки, закаленной из расплава:а) протягивание расплава через охлаждающую жидкость
(экструзия расплава); б) вытягивание нити из вращающегося барабана;
в) вытягивание расплава в стеклянном капилляре;
1 — расплав; 2 — охлаждающая жидкость;
3 — стекло; 4 — форсунка; 5 — смотка проволоки
43.
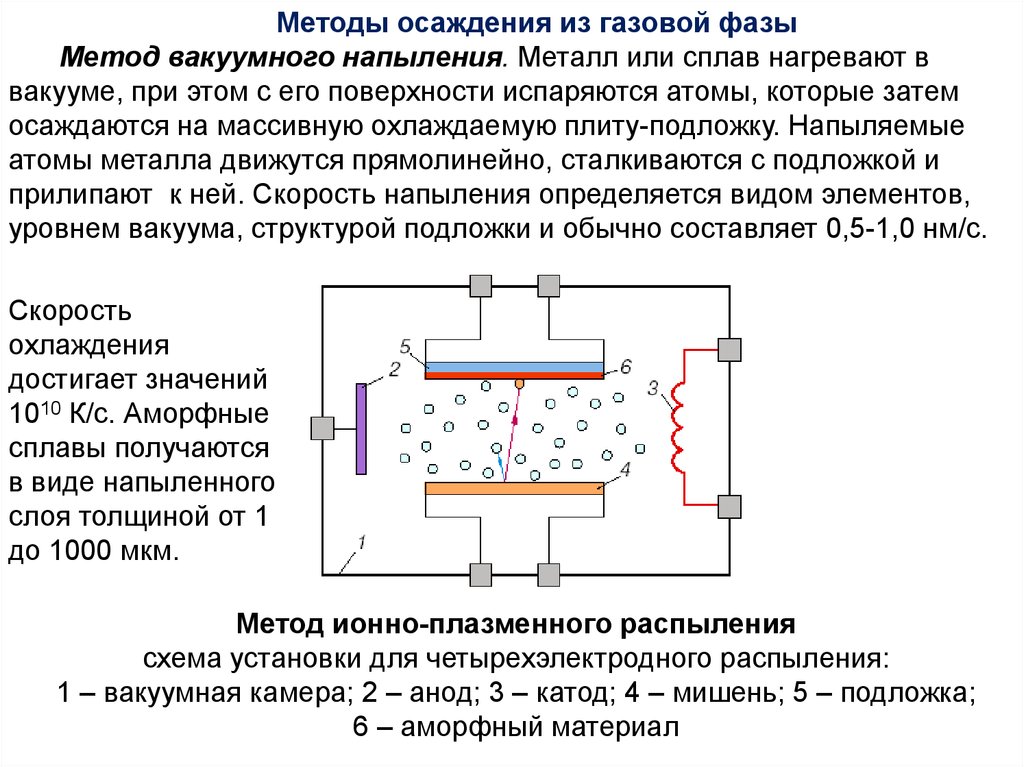
Методы осаждения из газовой фазыМетод вакуумного напыления. Металл или сплав нагревают в
вакууме, при этом с его поверхности испаряются атомы, которые затем
осаждаются на массивную охлаждаемую плиту-подложку. Напыляемые
атомы металла движутся прямолинейно, сталкиваются с подложкой и
прилипают к ней. Скорость напыления определяется видом элементов,
уровнем вакуума, структурой подложки и обычно составляет 0,5-1,0 нм/с.
Скорость
охлаждения
достигает значений
1010 К/с. Аморфные
сплавы получаются
в виде напыленного
слоя толщиной от 1
до 1000 мкм.
Метод ионно-плазменного распыления
схема установки для четырехэлектродного распыления:
1 – вакуумная камера; 2 – анод; 3 – катод; 4 – мишень; 5 – подложка;
6 – аморфный материал
44.
Получение аморфного состояния из твердогокристаллического
Перевод кристаллических твердых тел в аморфное состояние
нетермическими способами основан на достаточно сильном
воздействии на них внешних сил. При этом атомы могут
покидать свои равновесные позиции за счет получения извне
импульса энергии. Основными методами получения аморфных
структур этой группы являются:
ионная имплантация - имплантирование (внедрение) ионов в
поверхность металлических материалов
механическая обработка - получение аморфной структуры в
приповерхностных слоях металлических сплавов в результате
длительной механической обработки материалов.
твердофазные реакции - например, отжиг многослойных
композиций поликристаллических металлов при температуре
ниже температуры стеклования образующейся фазы. Аморфная
структура образуется на границе двух металлических слоев в
результате встречной диффузии атомов разного сорта.
45.
Кристаллизация аморфных сплавовВ зависимости от условий закалки из жидкого состояния можно
выделить три типа наноструктур:
• полная кристаллизация непосредственно в процессе закалки
из расплава и образование одно- или многофазной как обычной
поликристаллической структуры, так и наноструктуры;
• кристаллизация в процессе закалки из расплава протекает не
полностью и образуется аморфно-кристаллическая структура;
•закалка из расплава приводит к образованию аморфного
состояния, которое трансформируется в наноструктуру только
при последующей термической обработке.
46.
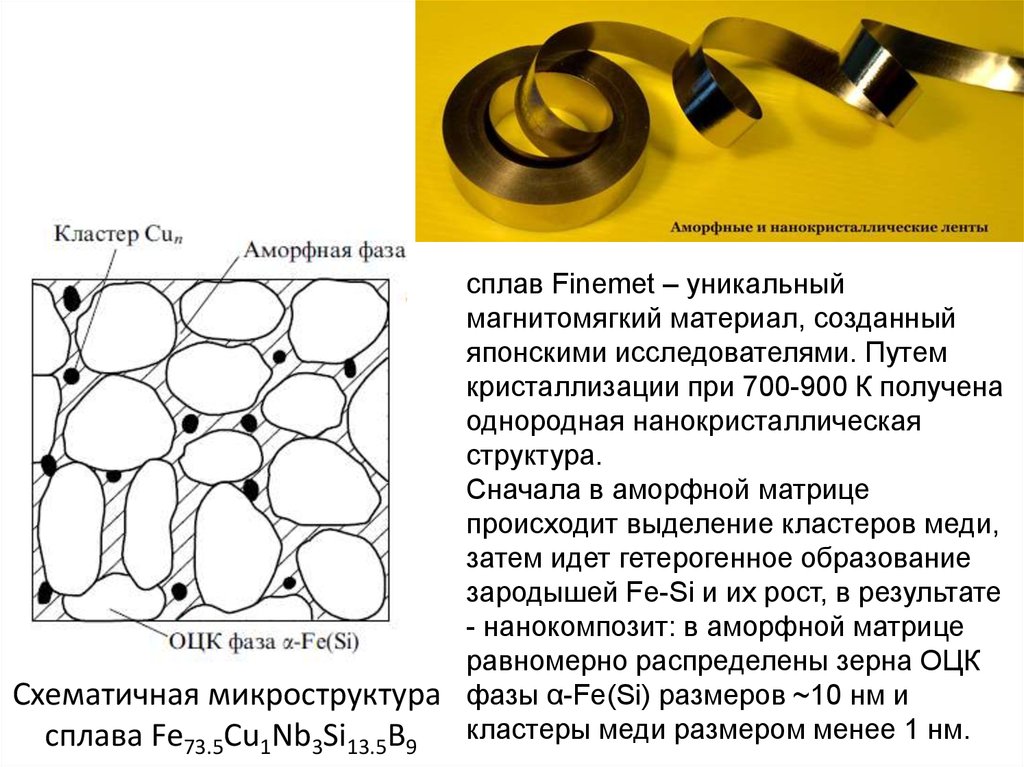
сплав Finemet – уникальныймагнитомягкий материал, созданный
японскими исследователями. Путем
кристаллизации при 700-900 К получена
однородная нанокристаллическая
структура.
Сначала в аморфной матрице
происходит выделение кластеров меди,
затем идет гетерогенное образование
зародышей Fe-Si и их рост, в результате
- нанокомпозит: в аморфной матрице
равномерно распределены зерна ОЦК
Схематичная микроструктура фазы α-Fe(Si) размеров ~10 нм и
сплава Fe73.5Cu1Nb3Si13.5B9 кластеры меди размером менее 1 нм.
47.
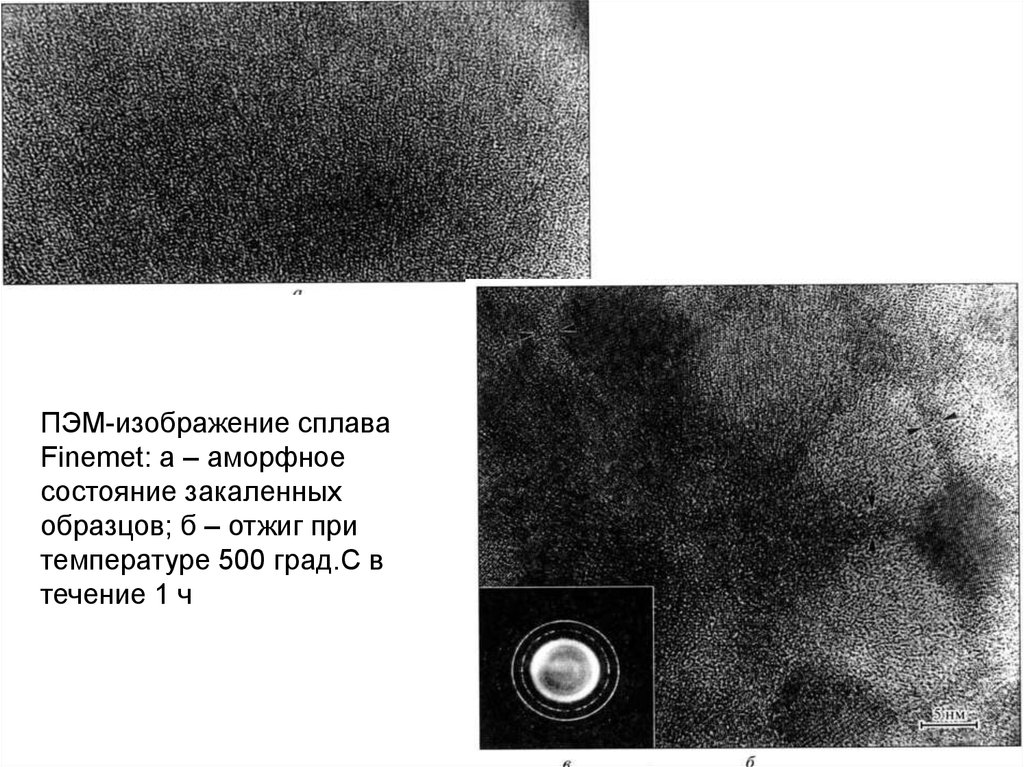
ПЭМ-изображение сплаваFinemet: а – аморфное
состояние закаленных
образцов; б – отжиг при
температуре 500 град.С в
течение 1 ч
48.
49.
50.
НЕПРЕРЫВНОЕ РАВНОКАНАЛЬНОЕ УГЛОВОЕ ПРЕССОВАНИЕ ПОСХЕМЕ CONFORM
В основе способа - использование активных
1 – рабочее колесо;
2 – П-образная канавка;
3 – башмак;
4 – кольцевая вставка;
5 – упор;
6 – заготовка; 7 - изделие
сил трения. Устройство состоит из
движущегося контейнера (колеса) и
неподвижного инструмента (башмака),
который вместе с колесом создает закрытый
калибр. Заготовка задается в зазор между
башмаком и колесом, силами трения
втягивается в зону перед матрицей, где
подвергается интенсивному пластическому
деформированию. По мере поворота колеса
давление перед матрицей увеличивается и за
счет этого заготовка прессуется через матрицу.
Наибольшая деформация происходит в конце
прессового канала перед упором.




































 chemistry
chemistry








