Similar presentations:
Элементы физики твердого тела. Кристаллические и аморфные вещества. Кристаллическая решетка. (Лекция 9)
1.
Кафедра физикиЛЕКЦИЯ 9а
ПЛАН ЛЕКЦИИ
1. Элементы физики твердого тела. Кристаллические и
аморфные вещества. Кристаллическая решетка.
2. Виды межатомных связей в твердых телах.
Общая физика. «Элементы квантовой статистики»
1
2. Элементы физики твёрдого тела
Кафедра физикиЭлементы физики твёрдого тела
Предмет физики твёрдого тела - изучение состава твёрдых тел, их
атомно-электронной структуры, установление зависимости между
составом и структурой и физическими свойствами.
Основные виды твёрдых тел. Кристаллы
Существуют два вида твёрдых веществ, отличающиеся структурой:
кристаллические и аморфные.
Кристаллические вещества - твёрдые тела, в которых атомы
расположены упорядоченно, образуя трёхмерно-периодическую
пространственную укладку - кристаллическую решётку.
Аморфные тела не имеют упорядоченной структуры и их можно
рассматривать как жидкости с очень высоким коэффициентом
вязкости.
Общая физика. «Элементы физики твердого тела»
2
3.
Элементы физики твёрдого телаКафедра физики
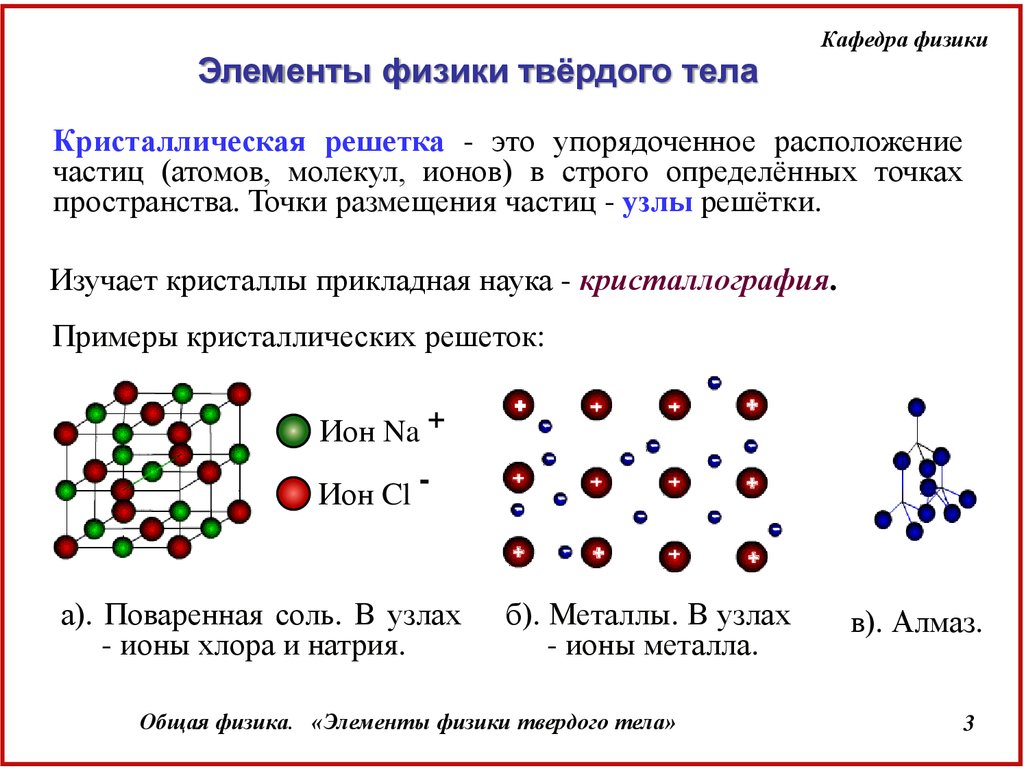
Кристаллическая решетка - это упорядоченное расположение
частиц (атомов, молекул, ионов) в строго определённых точках
пространства. Точки размещения частиц - узлы решётки.
Изучает кристаллы прикладная наука - кристаллография.
Примеры кристаллических решеток:
Ион Na +
+
+
Ион Cl -
+
+
а). Поваренная соль. В узлах
- ионы хлора и натрия.
+
+
б). Металлы. В узлах
- ионы металла.
Общая физика. «Элементы физики твердого тела»
в). Алмаз.
3
4.
Кафедра физикиЭлементы физики твёрдого тела
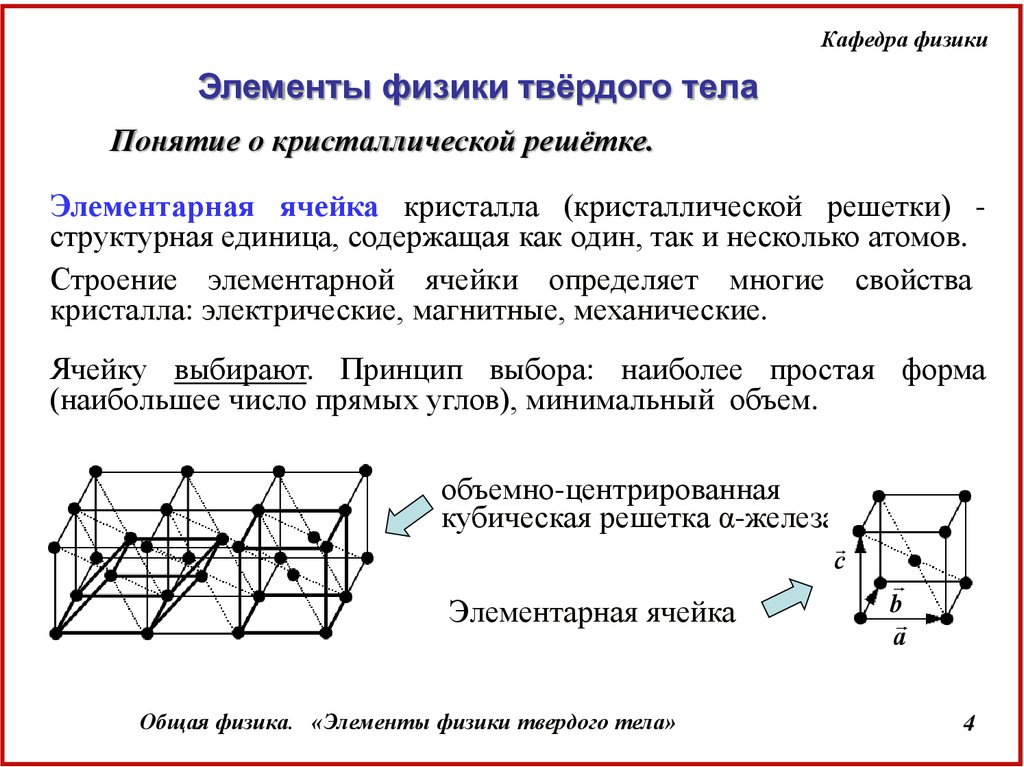
Понятие о кристаллической решётке.
Элементарная ячейка кристалла (кристаллической решетки) структурная единица, содержащая как один, так и несколько атомов.
Строение элементарной ячейки определяет многие свойства
кристалла: электрические, магнитные, механические.
Ячейку выбирают. Принцип выбора: наиболее простая форма
(наибольшее число прямых углов), минимальный объем.
объемно-центрированная
кубическая решетка α-железа
с
Элементарная ячейка
Общая физика. «Элементы физики твердого тела»
b
а
4
5.
Кафедра физикиЭлементы физики твёрдого тела
Понятие о кристаллической решётке.
с
Выбранную элементарную ячейку и кристалл в
целом нужно как-то характеризовать (описывать).
Ячейку характеризуют тремя векторами а , b , с ,
b
а
совпадающими с ее тремя ребрами, сходящимися в
одной точке, и углами α, β, γ между ними.
с b
а
Для полного описания структуры кристалла
необходимо
дополнительно
задать
пространственную решетку и базис.
Эти параметры содержатся во всех справочниках по структуре
веществ
Общая физика. «Элементы физики твердого тела»
5
6.
Кафедра физикиЭлементы физики твёрдого тела
Понятие о кристаллической решётке.
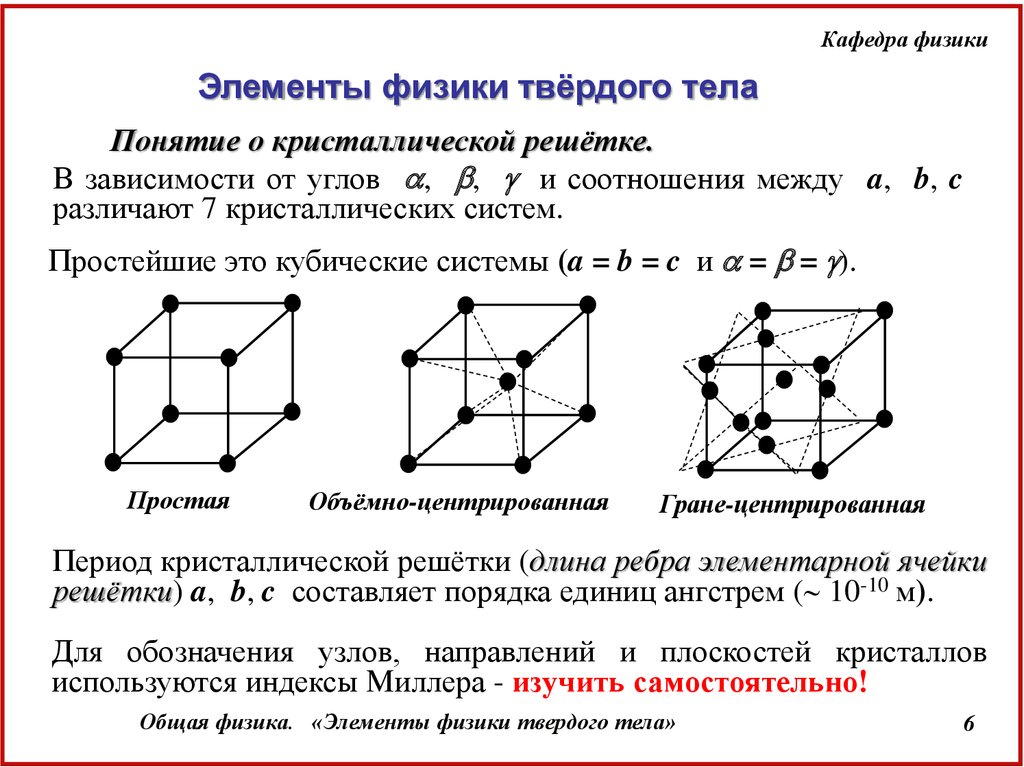
В зависимости от углов , , и соотношения между a, b, c
различают 7 кристаллических систем.
Простейшие это кубические системы (a = b = c и = = ).
Простая
Объёмно-центрированная
Гране-центрированная
Период кристаллической решётки (длина ребра элементарной ячейки
решётки) a, b, c составляет порядка единиц ангстрем ( 10-10 м).
Для обозначения узлов, направлений и плоскостей кристаллов
используются индексы Миллера - изучить самостоятельно!
Общая физика. «Элементы физики твердого тела»
6
7.
Элементы физики твёрдого телаКафедра физики
Виды межатомных связей (типы кристаллов) в твёрдых
телах
Атомы заставляет объединяться и формировать разные типы
кристаллической
решетки
электростатическая
энергия
взаимодействия зарядов.
По характеру связи атомов выделяют 5 типов кристаллов:
- ионные кристаллы,
- ковалентные кристаллы,
- металлические кристаллы,
- Ван-дер-Ваальсовы (молекулярные) кристаллы,
- молекулярные кристаллы с водородными связями.
Деление условное, существуют
характером связей (переходные).
кристаллы
Общая физика. «Элементы физики твердого тела»
со
смешанным
7
8.
Элементы физики твёрдого телаКафедра физики
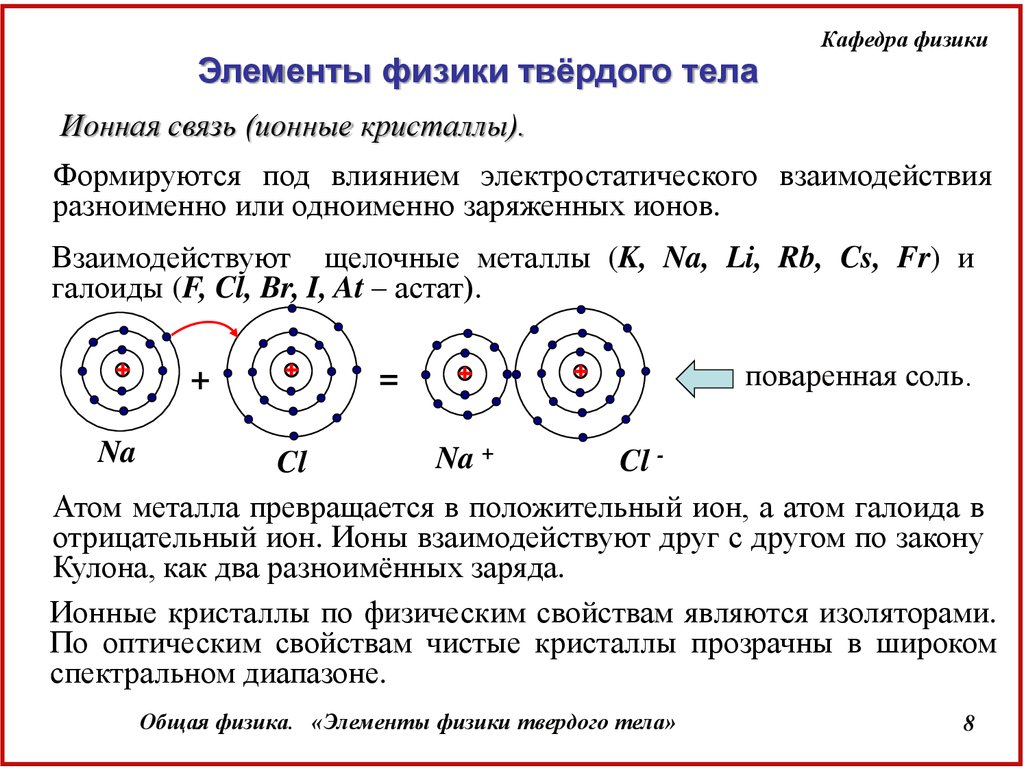
Ионная связь (ионные кристаллы).
Формируются под влиянием электростатического взаимодействия
разноименно или одноименно заряженных ионов.
Взаимодействуют щелочные металлы (K, Na, Li, Rb, Cs, Fr) и
галоиды (F, Cl, Br, I, At – астат).
+
=
поваренная соль.
Na
Na +
Cl Cl
Атом металла превращается в положительный ион, а атом галоида в
отрицательный ион. Ионы взаимодействуют друг с другом по закону
Кулона, как два разноимённых заряда.
Ионные кристаллы по физическим свойствам являются изоляторами.
По оптическим свойствам чистые кристаллы прозрачны в широком
спектральном диапазоне.
Общая физика. «Элементы физики твердого тела»
8
9.
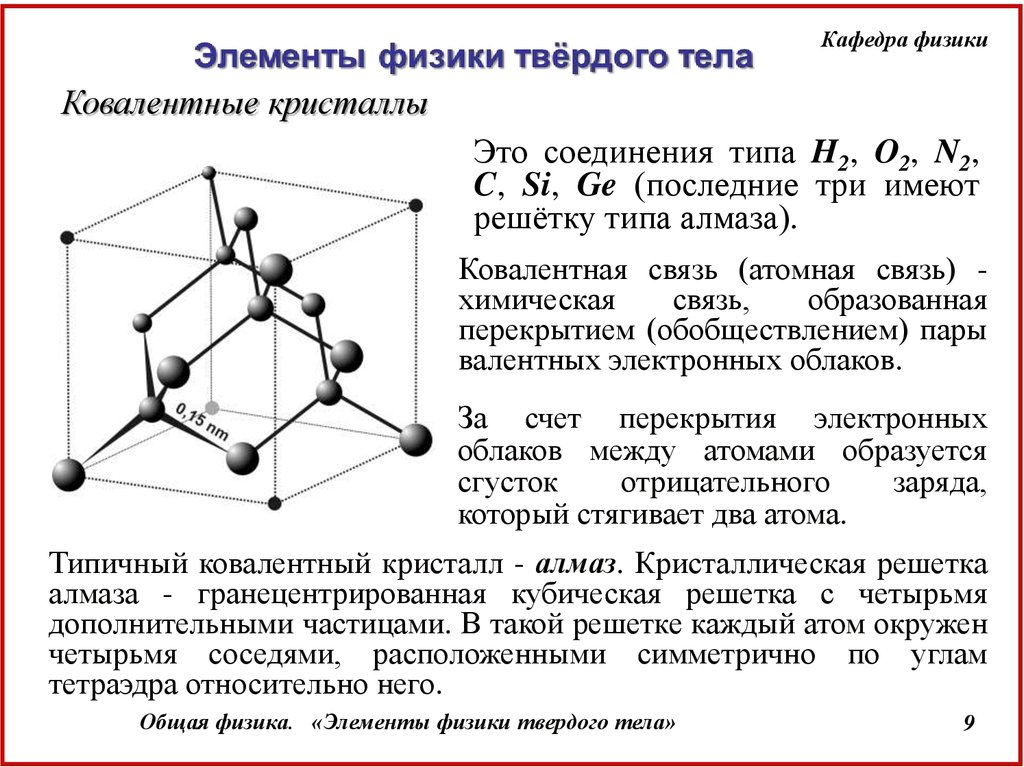
Кафедра физикиКовалентные кристаллы
Это соединения типа H2, O2, N2,
C, Si, Ge (последние три имеют
решётку типа алмаза).
Ковалентная связь (атомная связь) химическая
связь,
образованная
перекрытием (обобществлением) пары
валентных электронных облаков.
За счет перекрытия электронных
облаков между атомами образуется
сгусток
отрицательного
заряда,
который стягивает два атома.
Типичный ковалентный кристалл - алмаз. Кристаллическая решетка
алмаза - гранецентрированная кубическая решетка с четырьмя
дополнительными частицами. В такой решетке каждый атом окружен
четырьмя соседями, расположенными симметрично по углам
тетраэдра относительно него.
Общая физика. «Элементы физики твердого тела»
9
10.
Элементы физики твёрдого телаКафедра физики
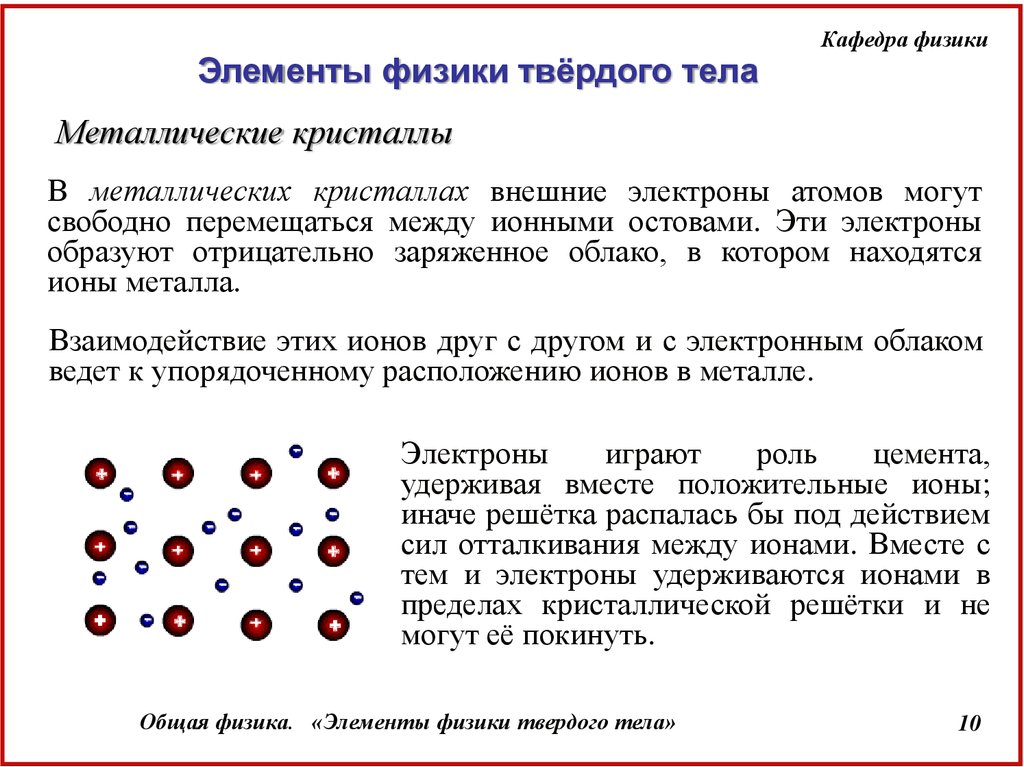
Металлические кристаллы
В металлических кристаллах внешние электроны атомов могут
свободно перемещаться между ионными остовами. Эти электроны
образуют отрицательно заряженное облако, в котором находятся
ионы металла.
Взаимодействие этих ионов друг с другом и с электронным облаком
ведет к упорядоченному расположению ионов в металле.
+
+
+
+
+
+
Электроны
играют
роль
цемента,
удерживая вместе положительные ионы;
иначе решётка распалась бы под действием
сил отталкивания между ионами. Вместе с
тем и электроны удерживаются ионами в
пределах кристаллической решётки и не
могут её покинуть.
Общая физика. «Элементы физики твердого тела»
10
11.
Элементы физики твёрдого телаКафедра физики
Ван-дер-Ваальсовы кристаллы
Образуются из электрически нейтральных атомов за счет диполь дипольного взаимодействия между ними.
Такие системы в твёрдом состоянии образуют молекулярные
кристаллы. Силы обусловлены поляризацией атомов при сближении
друг с другом.
до сближения
после сближения
Связь Ван-дер-Ваальса наиболее универсальна. Возникает между
любыми частицами, но это наиболее слабая связь, энергия ее
примерно на два порядка ниже энергии ионной и ковалентной связи.
Общая физика. «Элементы физики твердого тела»
11
12.
Элементы физики твёрдого телаКафедра физики
Молекулярные кристаллы с водородными связями
Разновидность молекулярной связи (связи Ван-дер-Ваальса) водородная связь.
При определённых условиях атом водорода может быть связан
прочно с двумя другими атомами. Один из атомов забирает себе
электрон водорода, превращая его в протон, которому иногда
энергетически выгоднее оказаться между двумя отрицательно
заряженными ионами, чем быть связанным только с одним из
атомов.
Наибольшее значимыми являются те водородные связи, которые
образуются между двумя электроотрицательными атомами, в
особенности между атомами N, O, F.
F
-
H
+
O
Пример: H2, N2, O2, CO2, H2O.
-
Общая физика. «Элементы физики твердого тела»
12






 physics
physics








