Similar presentations:
Репликация ДНК и РНК
1.
РепликацияДНК
РНК
2.
ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТКАК ГЕНЕТИЧЕСКОГО МАТЕРИАЛА
Хранение, передача и реализация генетической информации
Хранение – содержание информации в неизменном виде
Передача – копирование информации в неизменном виде
Реализация – извлечение и преобразование информации
3.
Центральная догма молекулярной биологииДНК
РНК
Белок
ДНК
РНК
Белок
© Bettmann/CORBIS
Фрэнсис Крик
(Francis Harry Compton Crick)
1916 - 2004
Crick, F.H.C. (1958): On Protein Synthesis. Symp. Soc. Exp. Biol. XII, 139—163. (черновик, 1956)
4.
Хранение и передача нуклеиновымикислотами генетической информации
в неизменном виде
ДНК
5.
РепликацияУдвоение ДНК в ходе деления клетки
2n
2n
4n
2n
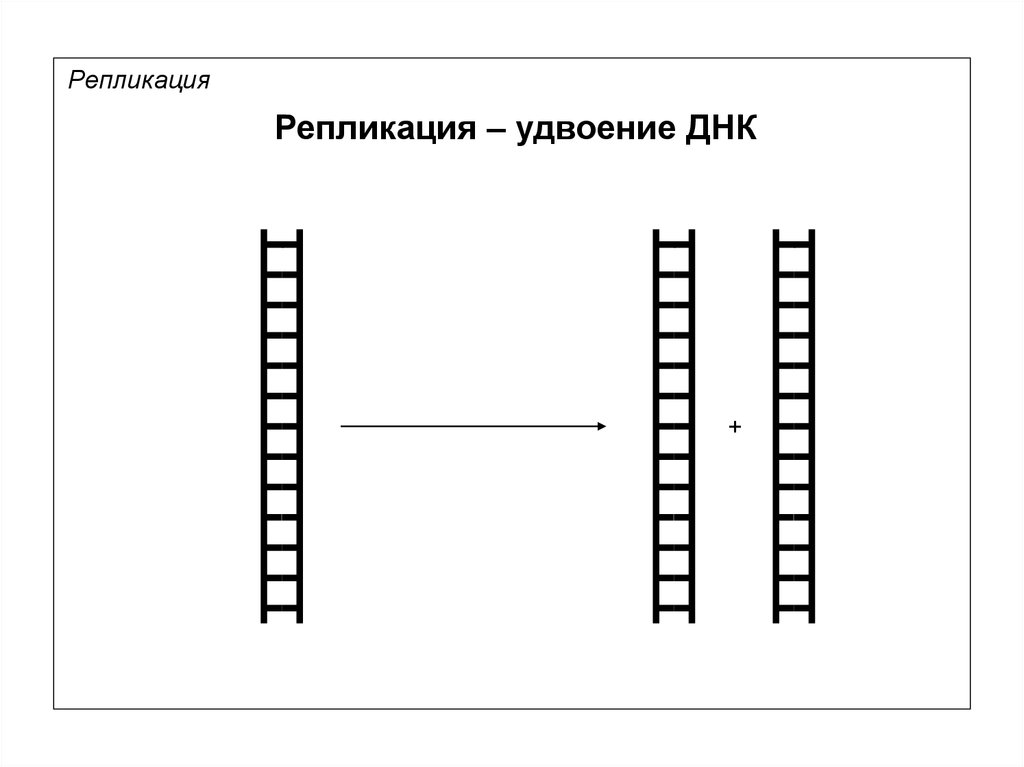
6.
РепликацияРепликация – удвоение ДНК
+
7.
РепликацияМодели репликации
Консервативный
механизм
+
Полуконсервативный
механизм
+
Дисперсивный
механизм
+
8.
РепликацияПолуконсервативный механизм репликации
PNAS.-2004.-V.101.-No.52.-P.17889-17894
Мэтью Стэнли Мезенсон Франклин Уильям Сталь
Matthew Stanley Meselson Franklin William Stahl
1930 г.р. 1929 г.р.
Frederic Lawrence Holmes
Meselson, Stahl, and the Replication of DNA:
A History of
“The Most Beautiful Experiment in Biology”
(История самого красивого эксперимента в биологии)
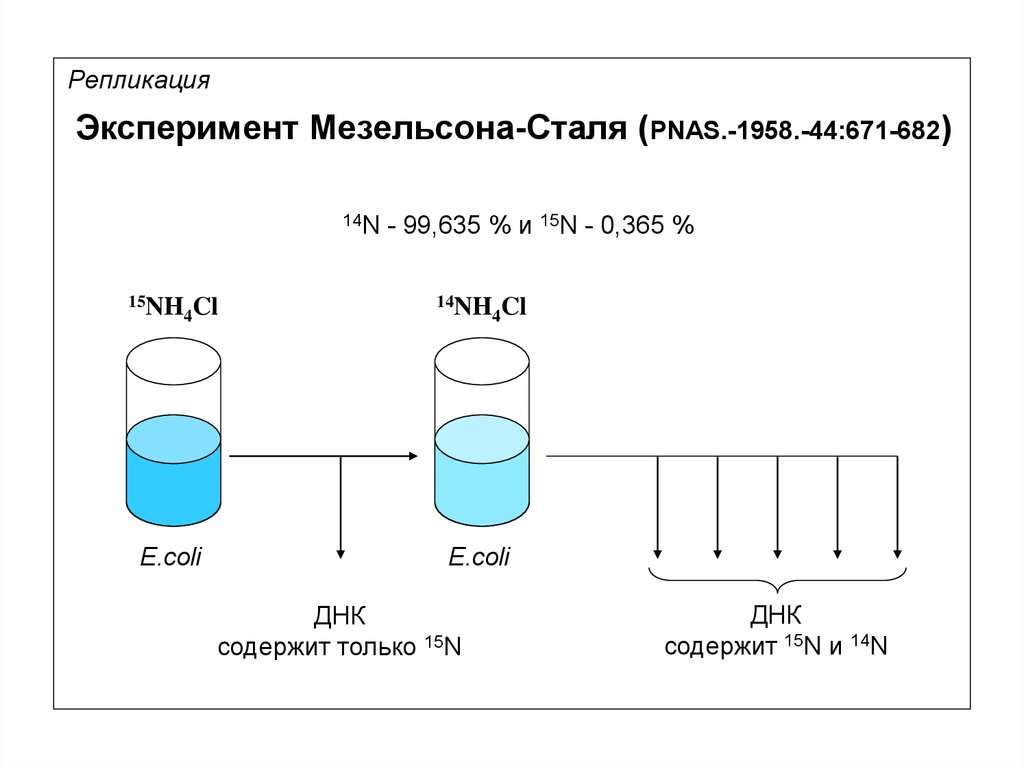
9.
РепликацияЭксперимент Мезельсона-Сталя (PNAS.-1958.-44:671-682)
14N
15NH
4Cl
E.coli
- 99,635 % и 15N - 0,365 %
14NH
4Cl
E.coli
ДНК
cодержит только 15N
ДНК
cодержит 15N и 14N
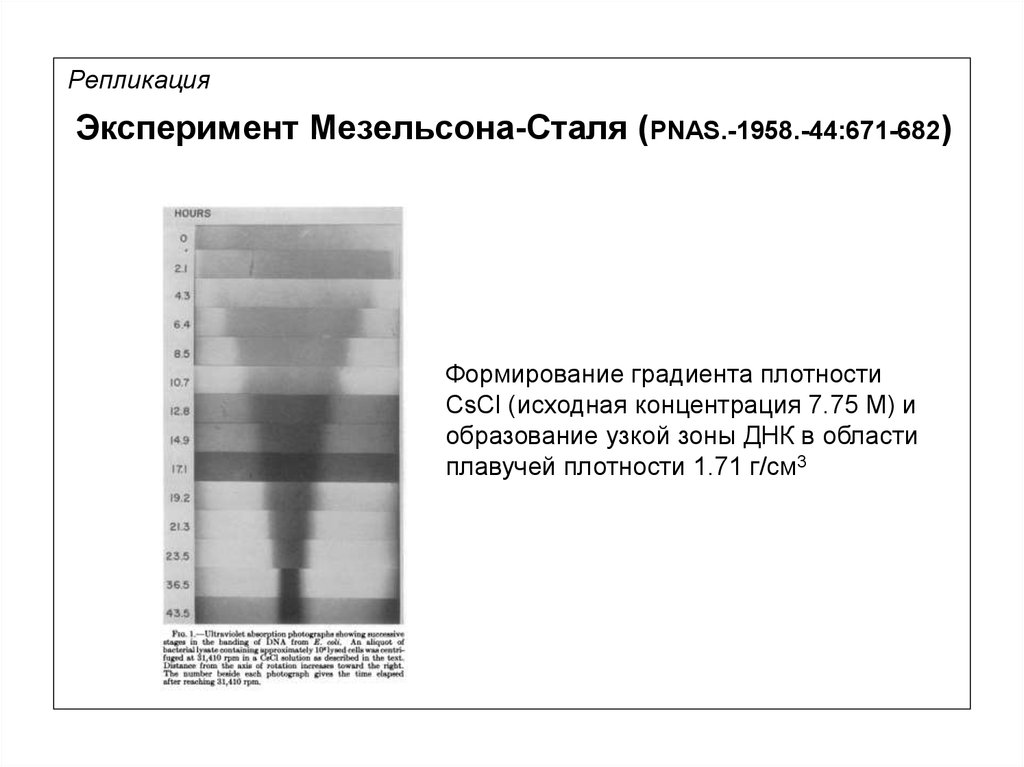
10.
РепликацияЭксперимент Мезельсона-Сталя (PNAS.-1958.-44:671-682)
Формирование градиента плотности
CsCl (исходная концентрация 7.75 М) и
образование узкой зоны ДНК в области
плавучей плотности 1.71 г/см3
11.
РепликацияЭксперимент Мезельсона-Сталя (PNAS.-1958.-44:671-682)
Зоны ДНК, очищенной из E.coli после
выращивания с 15NH4Cl и c 14NH4Cl.
Разница в плавучих плотностях
0.014 г/см3.
Время увеличения
количества бактерий вдвое
(т.е. время одного деления, генерации)
≈50 мин.
12.
РепликацияЭксперимент Мезельсона-Сталя (PNAS.-1958.-44:671-682)
15N
ДНК из E.coli после выращивания с 15NH4Cl
15N/14N
Замена 15NH4Cl на 14NH4Cl
ДНК из E.coli после выращивания с 14NH4Cl
в течение 1 генерации
14N 15N/14N
ДНК из E.coli после выращивания с 14NH4Cl
в течение 2 генераций
14N 15N/14N
ДНК из E.coli после выращивания с 14NH4Cl
в течение 3 генераций
14N 15N/14N
ДНК из E.coli после выращивания с 14NH4Cl
в течение 4 генераций
13.
РепликацияЧто доказывает эксперимент Мезельсона-Сталя?
Консервативный
механизм
15N
Полуконсервативный
механизм
15N
Дисперсивный
механизм
15N
0
1
2
14N
15N
14N/15N
14N
15N
14N 14N/15N
14N
15N
14N 14N/15N
14N/15N
14N/15N
14N/15N
3
Полуконсервативный механизм репликации
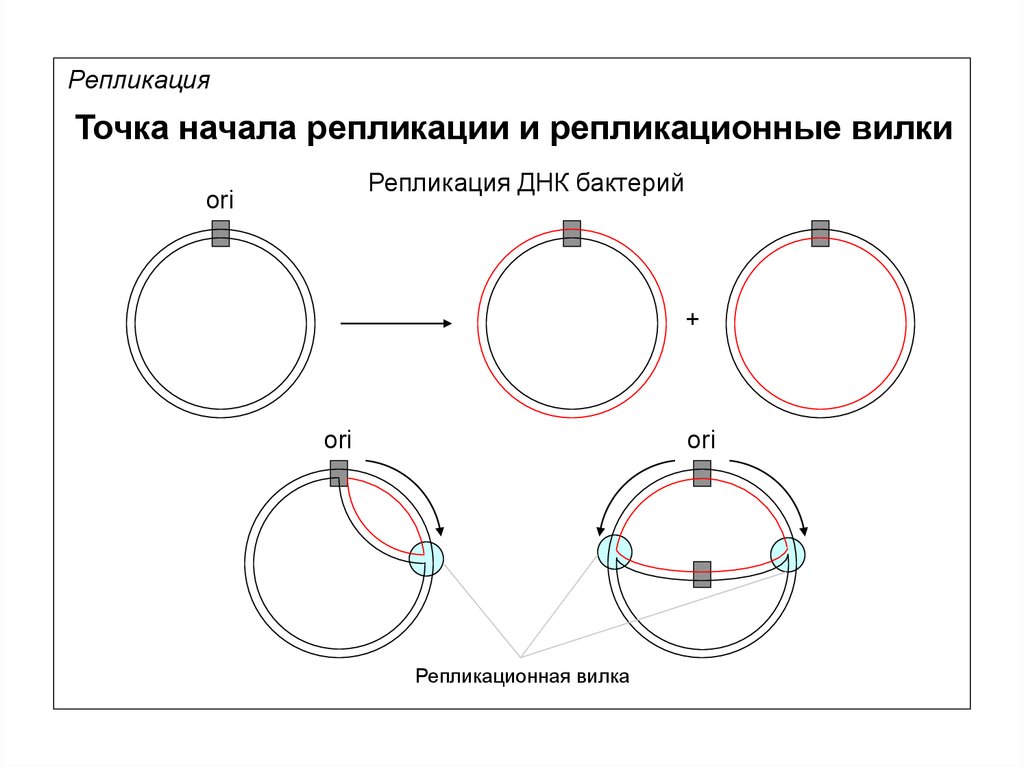
14.
РепликацияТочка начала репликации и репликационные вилки
Репликация ДНК бактерий
ori
+
ori
ori
Репликационная вилка
15.
РепликацияТочка начала репликации и репликационные вилки
Эксперимент с меченными нуклеотидами разной удельной активности
[3H]-тимин
с низкой удельной
радиоактивностью
13-19 мин
[3H]-тимидин
с высокой удельной
радиоактивностью
2.5 мин
ori
ori
PNAS.-1972.-69:2842-2845
Очистка ДНК,
авторадиография
16.
РепликацияРепликация кольцевой ДНК
механизм «катящегося кольца»
Дочерняя ДНК
17.
РепликацияРепликация ДНК эукариот
множественные точки начала репликации
ori
ori
ori
18.
Небольшое отступлениеКольцевая и псевдокольцевая ДНК
Надцарство прокариот
(3.5 млрд. лет)
Надцарство эукариот
(1.5-2 млрд. лет)
© Rocky Mountain Laboratories
Кольцевые хромосомы
Линейные хромосомы
Петли ДНК с фиксированными концами
19.
20.
Небольшое отступлениеФерменты
Классы ферментов
1. Оксидоредуктазы A(окисл) + B(восст) → A(восст) + B(окисл)
2. Трансферазы A-X + B → A + B-X
3. Гидролазы A + H2O → B-H + C-OH
4. Лиазы A → B + C
5. Изомеразы A → A’
6. Лигазы A + B → C
21.
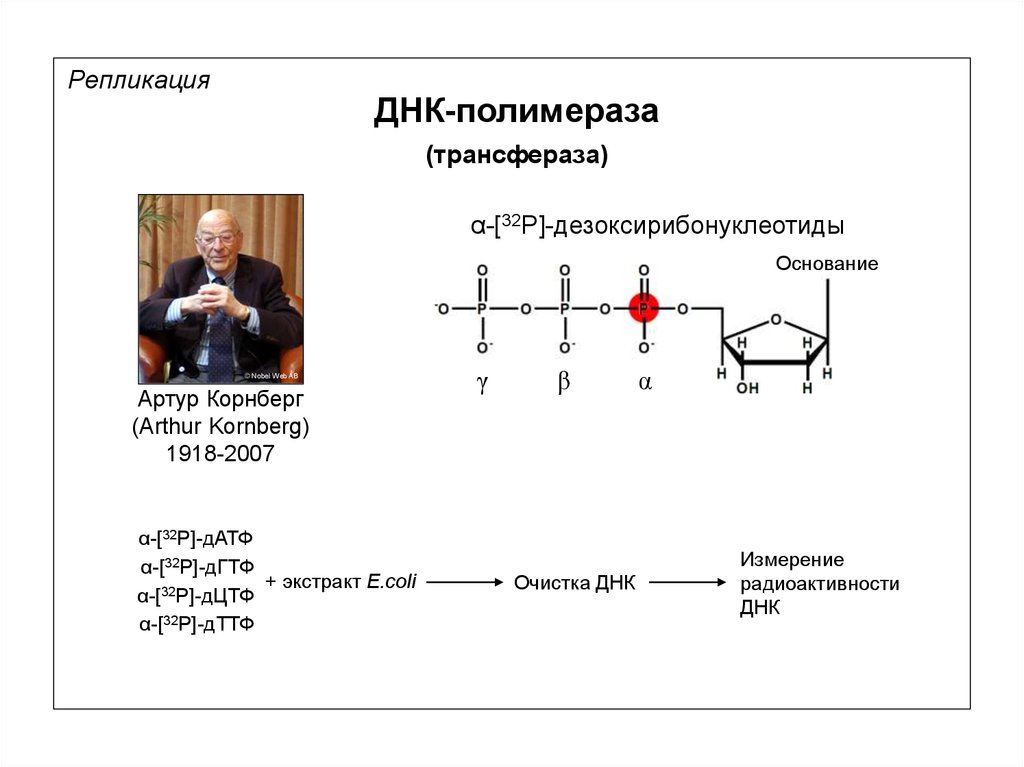
РепликацияДНК-полимераза
(трансфераза)
α-[32P]-дезоксирибонуклеотиды
Основание
© Nobel Web AB
Артур Корнберг
(Arthur Kornberg)
1918-2007
α-[32P]-дАТФ
α-[32P]-дГТФ
+ экстракт E.coli
α-[32P]-дЦТФ
α-[32P]-дТТФ
γ
β
Очистка ДНК
α
Измерение
радиоактивности
ДНК
22.
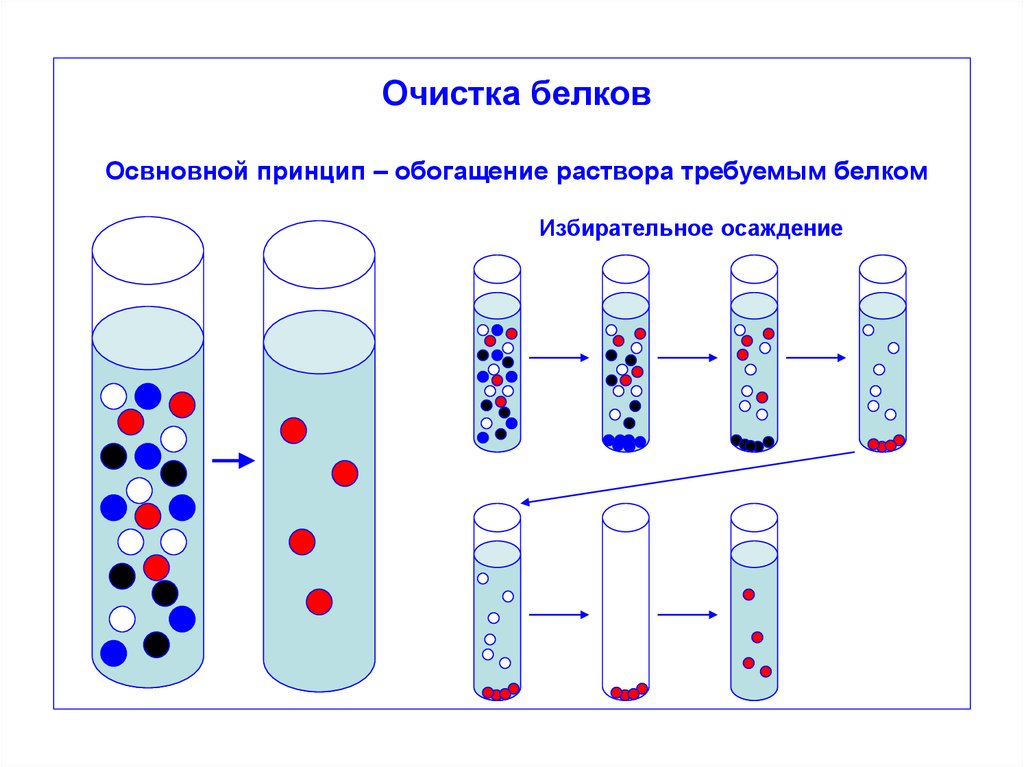
Очистка белковОсвновной принцип – обогащение раствора требуемым белком
Избирательное осаждение
23.
Очистка белковИзбирательное осаждение белков
Изоэлектрическая точка и зависимость растворимости от pH
R
+
H3N CH
pH < pI
R
R
-H+
+
H3N CH
COOH
+H+
pH = pI
Основные радикалы
аргинин
лизин
-
H2N CH
+H+
-
COO
pH > pI
Кислотные радикалы
аспарагиновая кислота
глутаминовая кислота
–
+
pH < pI
COO
-H+
pH = pI
pH > pI
24.
Очистка белковИзбирательное осаждение белков
Изоэлектрическая точка и зависимость растворимости от pH
pH < 6
Лиз
Асп
6 < pH < 8
Лиз
Глу
Асп
–
+
Лиз
Лиз
Глу
Асп
–
Лиз
Асп
Глу
–
–
+
pI
pH > 8
Лиз
Асп
Асп
–
–
+
+
pI
Глу
Арг
+
Лиз
Арг
Глу
+
–
+
Лиз
+
Арг
Глу
pI
–
Лиз
25.
Очистка белковИзбирательное осаждение белков
Изоэлектрическая точка и зависимость растворимости от pH
pH < pI
Растворимость
+
+
+
–+
+
– –+
–
+
pH
–+
+
+
pH > pI
+
–
++
+
pH = pI
–
–
–
–
–
–
26.
Очистка белковИзбирательное осаждение белков
Высаливание
+
H
-
- O
H
+
В водном растворе белки связывают
часть молекул воды.
При замораживании незамороженными (не
участвующими в образовании
користаллической решетки льда) остаются
~2 молекулы воды на 1 аминокислоту (~0.4 г
воды на 1 г белка).
OH
+
–
+
27.
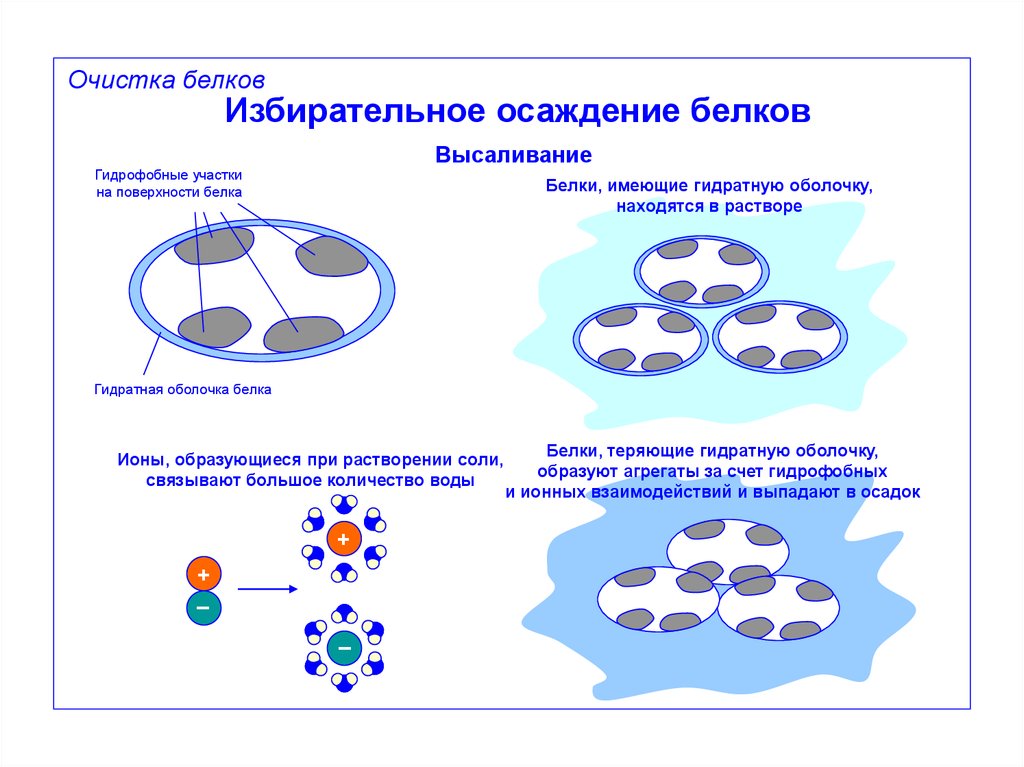
Очистка белковИзбирательное осаждение белков
Высаливание
Гидрофобные участки
на поверхности белка
Белки, имеющие гидратную оболочку,
находятся в растворе
Гидратная оболочка белка
Ионы, образующиеся при растворении соли,
связывают большое количество воды
+
+
–
–
Белки, теряющие гидратную оболочку,
образуют агрегаты за счет гидрофобных
и ионных взаимодействий и выпадают в осадок
28.
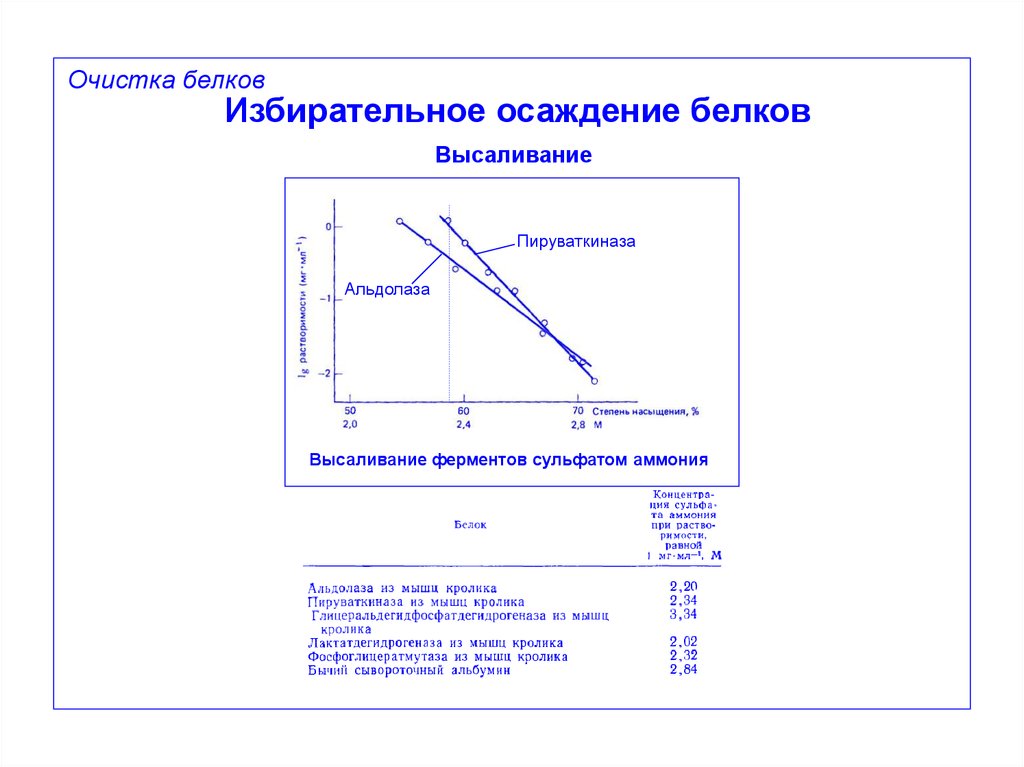
Очистка белковИзбирательное осаждение белков
Высаливание
Пируваткиназа
Альдолаза
Высаливание ферментов сульфатом аммония
29.
Очистка белковИзбирательное осаждение белков
Денатурация
(удаление из смеси ненужных белков)
pH (сильный сдвиг)
Температура
Денатурация
(потеря третичной структуры)
Органические растворители
Агрегация и осаждение
стали доступны
для взаимодействий
многие группы,
скрытые в белковой глобуле
30.
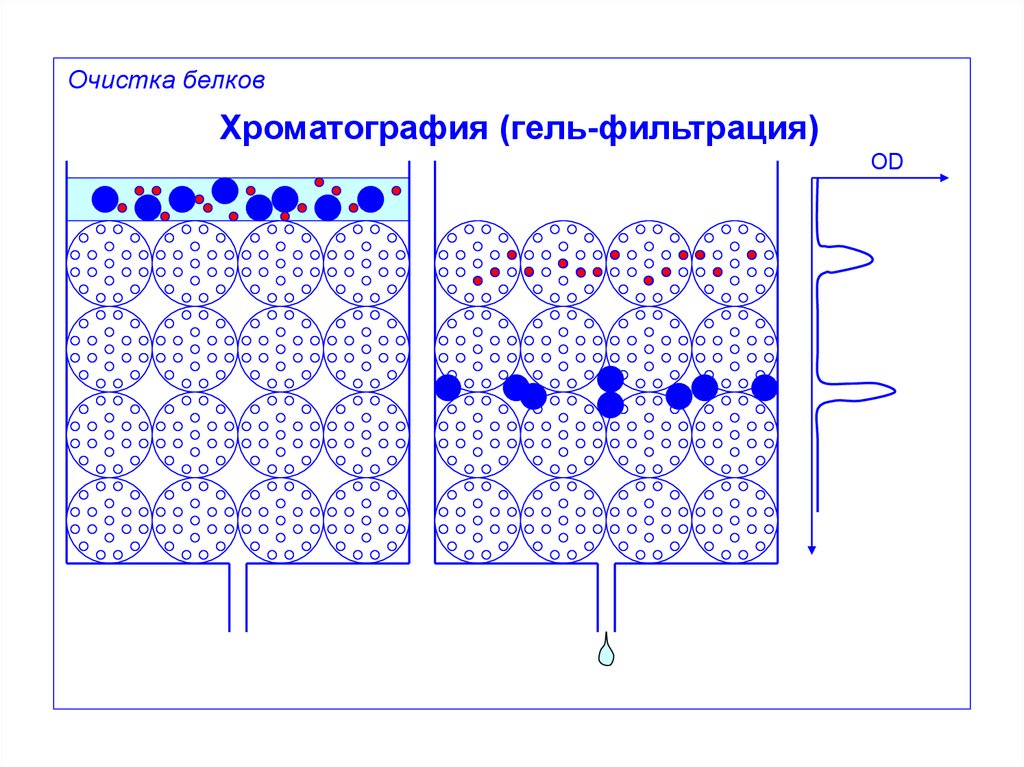
Очистка белковХроматография (гель-фильтрация)
OD
31.
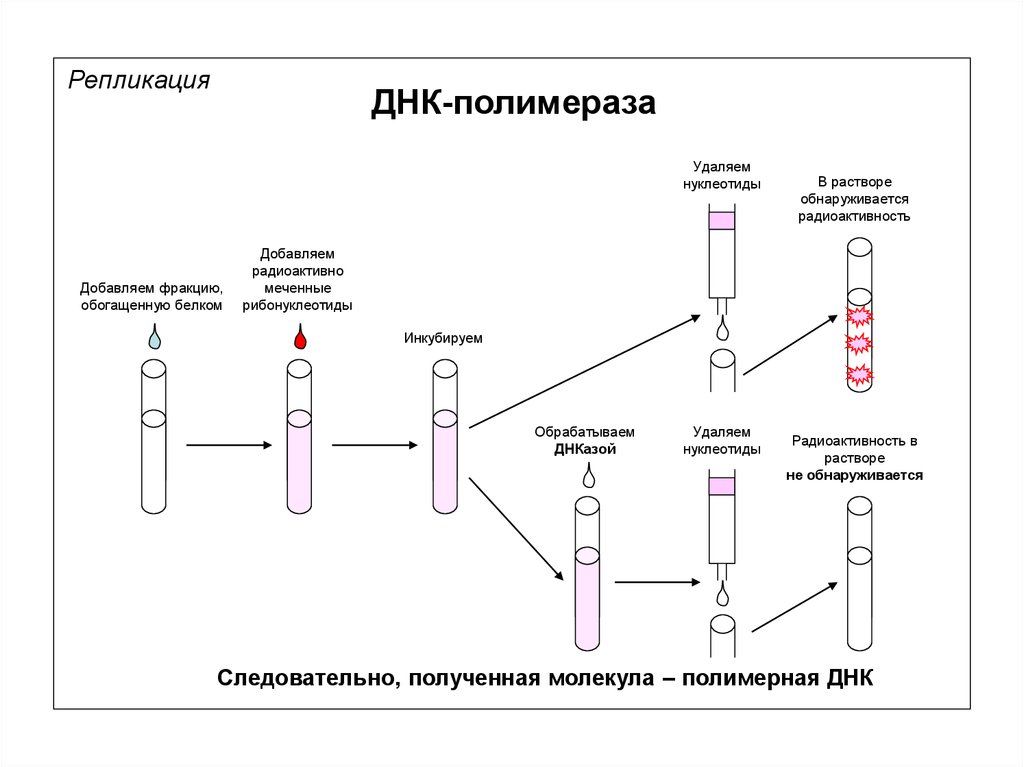
РепликацияДНК-полимераза
Фракция, обогащенная белком
(ДНК-полимеразой)
Добавляем фракцию,
обогащенную белком
Добавляем радиоактивно
меченные
дезоксирибонуклеотиды
Инкубируем
Экстракт ткани
Удаляем нуклеотиды
В растворе
обнаруживается
радиоактивность
Следовательно, метка включилась в полимер нуклеиновой кислоты
32.
РепликацияДНК-полимераза
Удаляем
нуклеотиды
Добавляем фракцию,
обогащенную белком
В растворе
обнаруживается
радиоактивность
Добавляем
радиоактивно
меченные
рибонуклеотиды
Инкубируем
Обрабатываем
ДНКазой
Удаляем
нуклеотиды
Радиоактивность в
растворе
не обнаруживается
Следовательно, полученная молекула – полимерная ДНК
33.
РепликацияДНК-полимераза
Добавляем фракцию,
обогащенную белком
Добавляем
радиоактивно
меченные
рибонуклеотиды
Удаляем
нуклеотиды
Инкубируем
Обрабатываем
ДНКазой
В растворе
обнаруживается
радиоактивность
Радиоактивность в
растворе
не обнаруживается
Следовательно, для синтеза ДНК нужна полимерная ДНК
34.
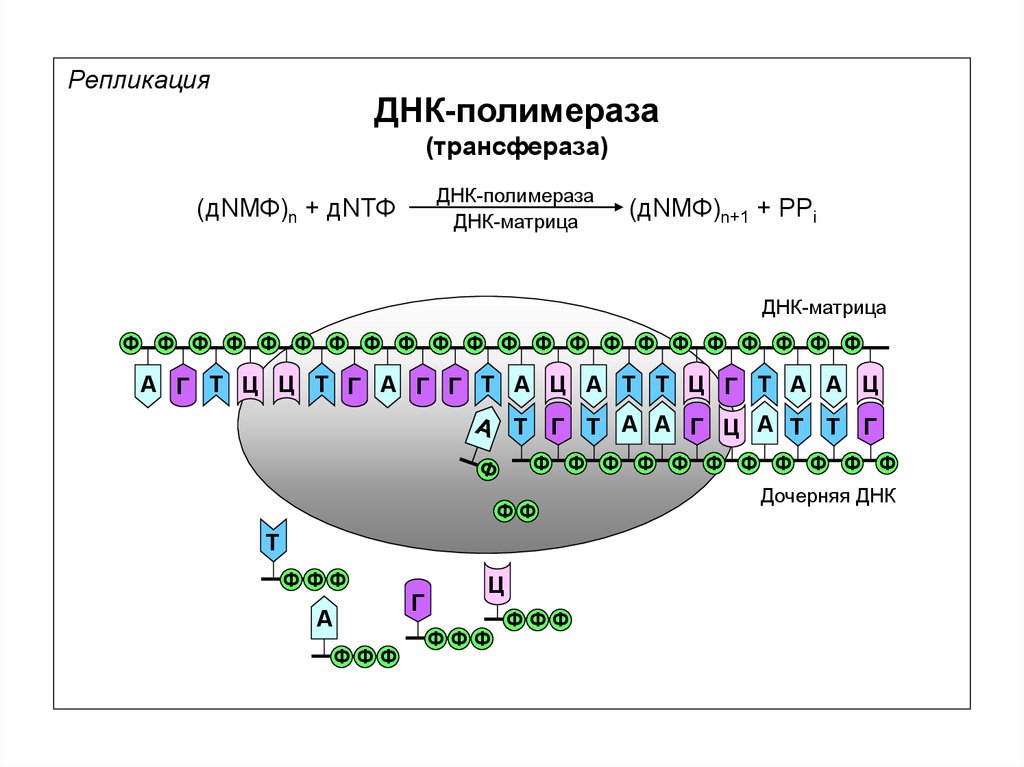
РепликацияДНК-полимераза
(трансфераза)
ДНК-полимераза
ДНК-матрица
(дNМФ)n + дNТФ
(дNМФ)n+1 + PPi
ДНК-матрица
Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф
А Г Т Ц Ц Т Г А Г Г Т А Ц А Т Т Ц Г Т А А Ц
Г Т А А Г Ц А Т Т
Т
Г
Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф Ф
ФФ
Т
ФФФ
А
ФФФ
Г
Ц
ФФФ
ФФФ
Дочерняя ДНК
35.
36.
РепликацияДНК-полимераза
1. ДНК-полимераза требует наличия матрицы (материнской ДНК).
2. ДНК-полимераза присоединяет дезоксирибонуклеозидмонофосфат
в соответствии с правилом комплементарности относительно
нуклеотида матрицы.
3. ДНК-полимераза работает только на одноцепочечной ДНК.
4. ДНК-полимераза не может начать синтез ДНК с первого нуклеотида,
она присоединяет дезоксирибонуклеозидмонофосфат только к уже
существующей ДНК (РНК).
5. ДНК-полимераза присоединяет дезоксирибонуклеозидмонофосфат к
3’-ОН группе дезоксирибозы.
37.
Первичная структура ДНКNH2
N
N
O
5’
-
O
P
O
N
O
O
-
5’
P
NH2
N
N
H
H
O
H
H
H
N
P
O
O
O
P
O
O
H
O-
N
H
H
O
O
P
N
H
O
O
N
NH
H
H
O
P
P
H
H
O
P
NH2
O
O-
P
NH
H
N
H
O
O
NH2
O
O-
H
O
H
H
O
H
P
N
O
O
H
O-
H
OH
3’
H
G
T
C
O
5’-pApCpGpTpC-3’
H
H
C
3’
N
H
A
38.
РепликацияДНК-полимераза
ДНК-полимераза работает только на одноцепочечной ДНК
3’
5’
5’
3’
Для работы ДНК-полимеразы требуется расплетание двухцепочечной ДНК
3’
5’
3’
5’
39.
РепликацияДНК-полимераза
ДНК-полимераза не может начать синтез ДНК с первого нуклеотида,
она присоединяет дезоксирибонуклеотидмонофосфат
только к уже существующей ДНК
5’
3’
3’
5’
5’
3’
3’
5’
Для работы ДНК-полимеразы требуется затравка (праймер)
3’
5’
3’
5’
3’
5’
3’
5’
40.
РепликацияДНК-полимераза
ДНК-полимераза присоединяет дезоксирибонуклеотидмонофосфат
к 3’-ОН группе дезоксирибозы
Дочерняя нить ДНК растет в направлении 5’-3’
Матрицей служит материнская нить в направлении 3’-5’
3’
5’
5’
3’
5’
3’
3’
5’
3’
5’
3’
5’
41.
РепликацияЛидирующая и отстающая нити ДНК
3’ Лидирующая нить
5’
3’
5’ Отстающая нить
3’
С отстающей нитью
связывается праймер
(РНК)
5’
3’
5’
3’
ДНК-полимераза
синтезирует дочернюю
ДНК с отстающей нити,
начиная от праймера
5’
3’
5’
42.
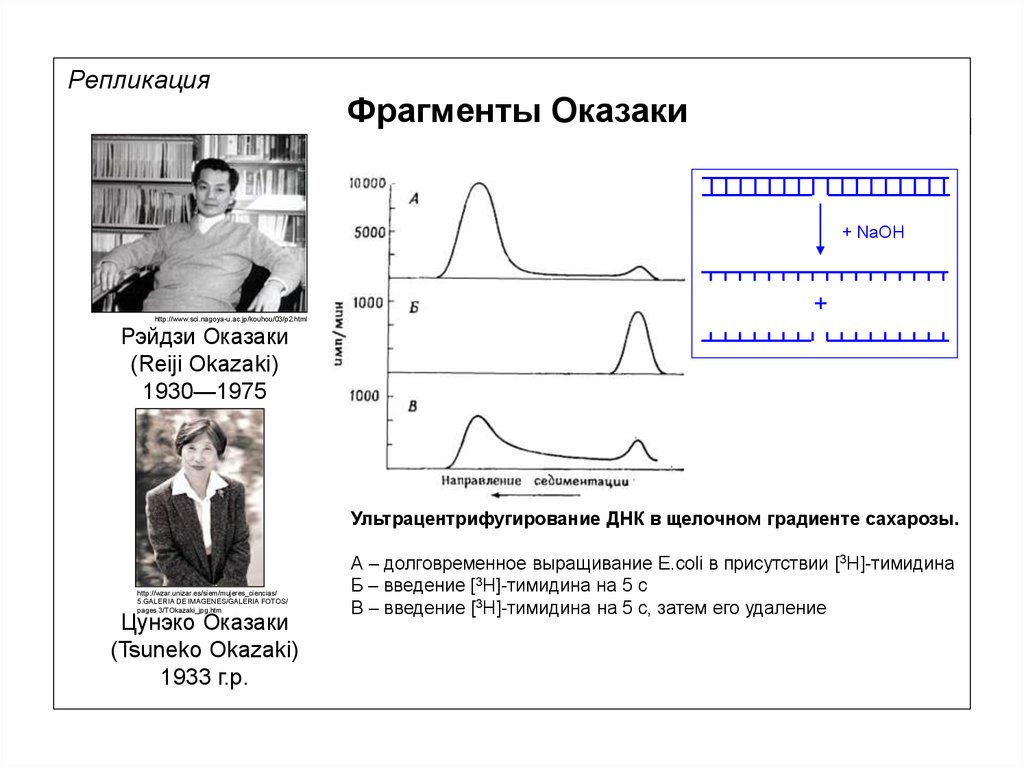
РепликацияФрагменты Оказаки
+ NaOH
http://www.sci.nagoya-u.ac.jp/kouhou/03/p2.html
+
Рэйдзи Оказаки
(Reiji Okazaki)
1930—1975
Ультрацентрифугирование ДНК в щелочном градиенте сахарозы.
http://wzar.unizar.es/siem/mujeres_ciencias/
5.GALERIA DE IMAGENES/GALERIA FOTOS/
pages 3/TOkazaki_jpg.htm
Цунэко Оказаки
(Tsuneko Okazaki)
1933 г.р.
А – долговременное выращивание E.coli в присутствии [3H]-тимидина
Б – введение [3H]-тимидина на 5 с
В – введение [3H]-тимидина на 5 с, затем его удаление
43.
РепликацияФрагменты Оказаки
Фрагменты Оказаки
Вырезание праймеров
и застройка бреши
44.
45.
РепликацияЭтапы репликации
1.
2.
3.
4.
5.
6.
7.
Расплетание ДНК
Синтез праймера для начала считывания лидирующей цепи
Синтез нуклеотидов + синтез лидирующей цепи
Синтез праймеров для отстающей цепи
Синтез нуклеотидов + синтез фрагментов Оказаки
Вырезание праймеров
Застройка разрыва
46.
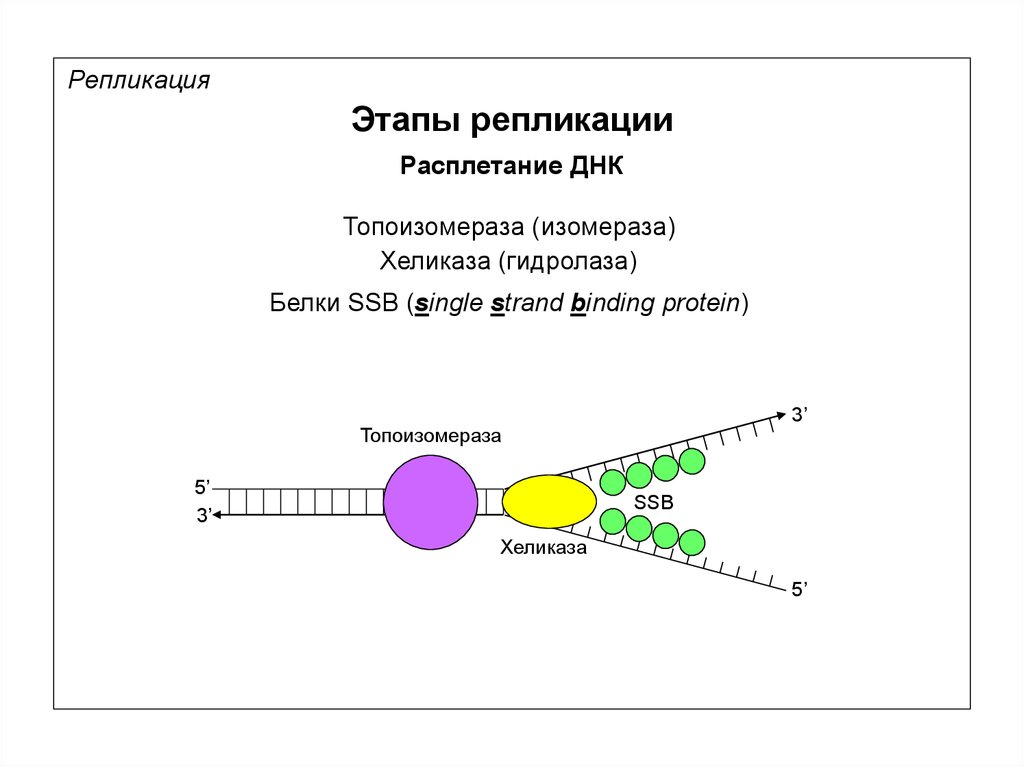
РепликацияЭтапы репликации
Расплетание ДНК
Топоизомераза (изомераза)
Хеликаза (гидролаза)
Белки SSB (single strand binding protein)
3’
Топоизомераза
5’
3’
SSB
Хеликаза
5’
47.
РепликацияЭтапы репликации
Синтез праймера для начала считывания лидирующей цепи
Праймаза – ДНК-полимераза α (трансфераза)
На одноцепочечной ДНК праймаза синтезирует РНК праймер (~ 10 н.),
затем продолжает синтезировать ДНК (~ 20-50 н.),
после чего синтез ДНК продолжает другая ДНК-полимераза
Праймаза
3’
5’
3’
5’
48.
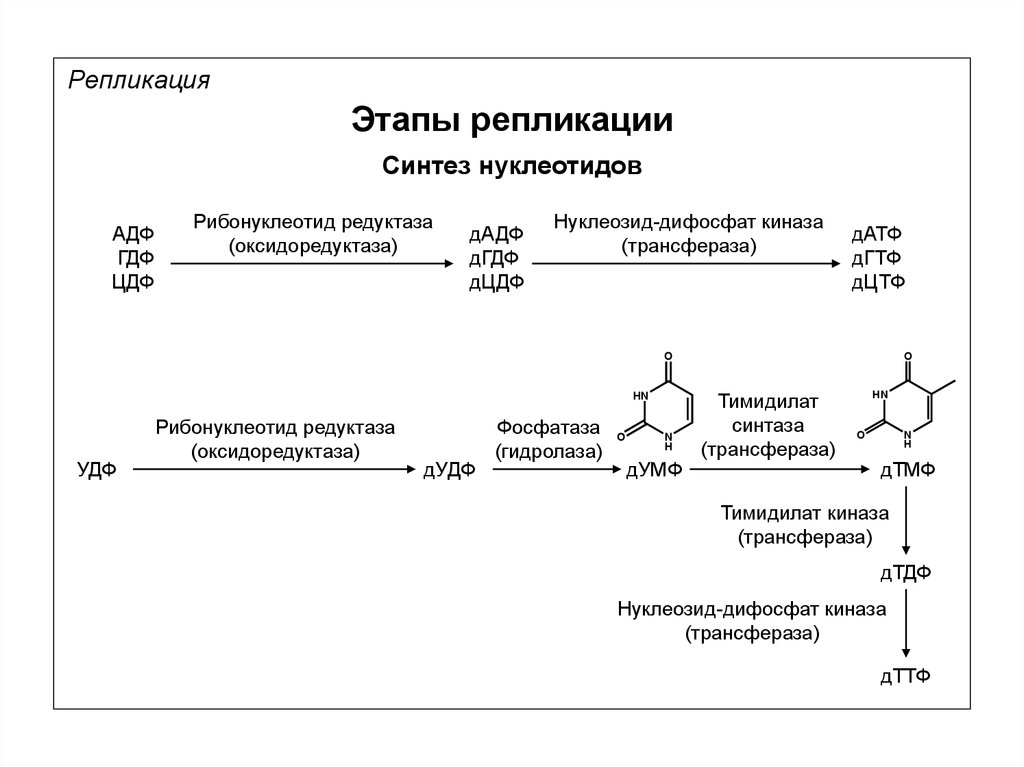
РепликацияЭтапы репликации
Синтез нуклеотидов
АДФ
ГДФ
ЦДФ
Рибонуклеотид редуктаза
(оксидоредуктаза)
дАДФ
дГДФ
дЦДФ
Нуклеозид-дифосфат киназа
(трансфераза)
дАТФ
дГТФ
дЦТФ
O
O
HN
УДФ
Рибонуклеотид редуктаза
(оксидоредуктаза)
дУДФ
Фосфатаза
(гидролаза)
O
N
H
дУМФ
Тимидилат
синтаза
(трансфераза)
HN
O
N
H
дТМФ
Тимидилат киназа
(трансфераза)
дТДФ
Нуклеозид-дифосфат киназа
(трансфераза)
дТТФ
49.
РепликацияЭтапы репликации
Синтез ДНК на лидирующей цепи
ДНК-полимераза ε (трансфераза)
ДНК-полимераза ε
3’
5’
3’
5’
50.
РепликацияЭтапы репликации
Синтез праймеров для отстающей цепи
Праймаза – ДНК-полимераза α (трансфераза)
3’
5’
3’
Праймаза
5’
51.
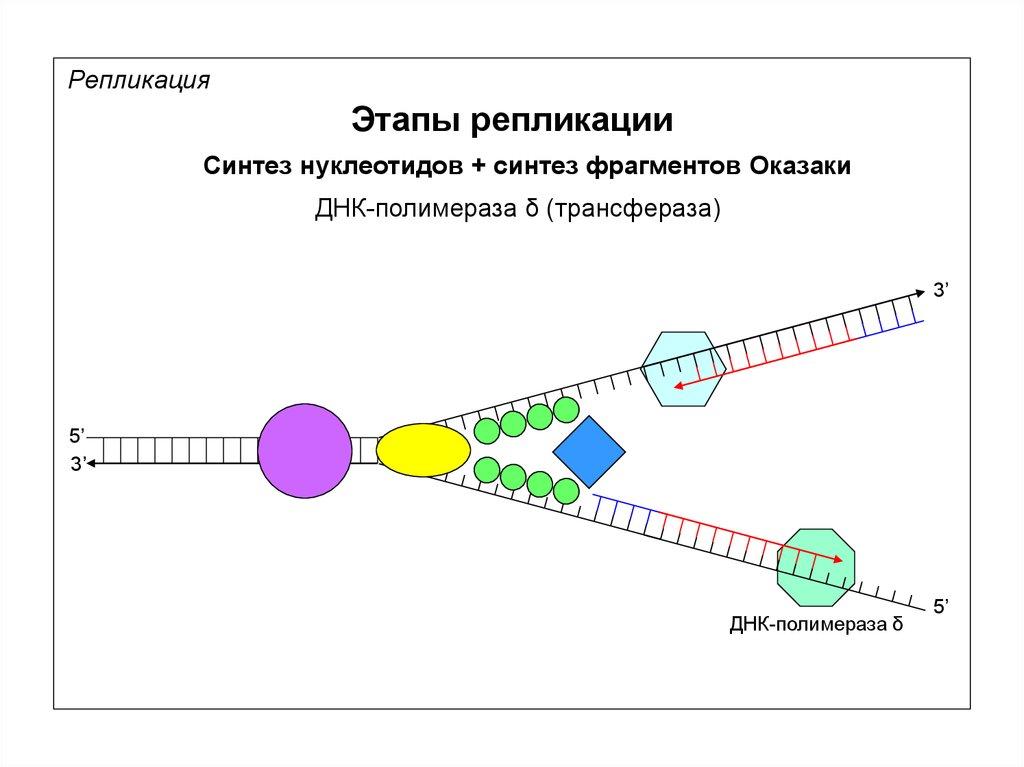
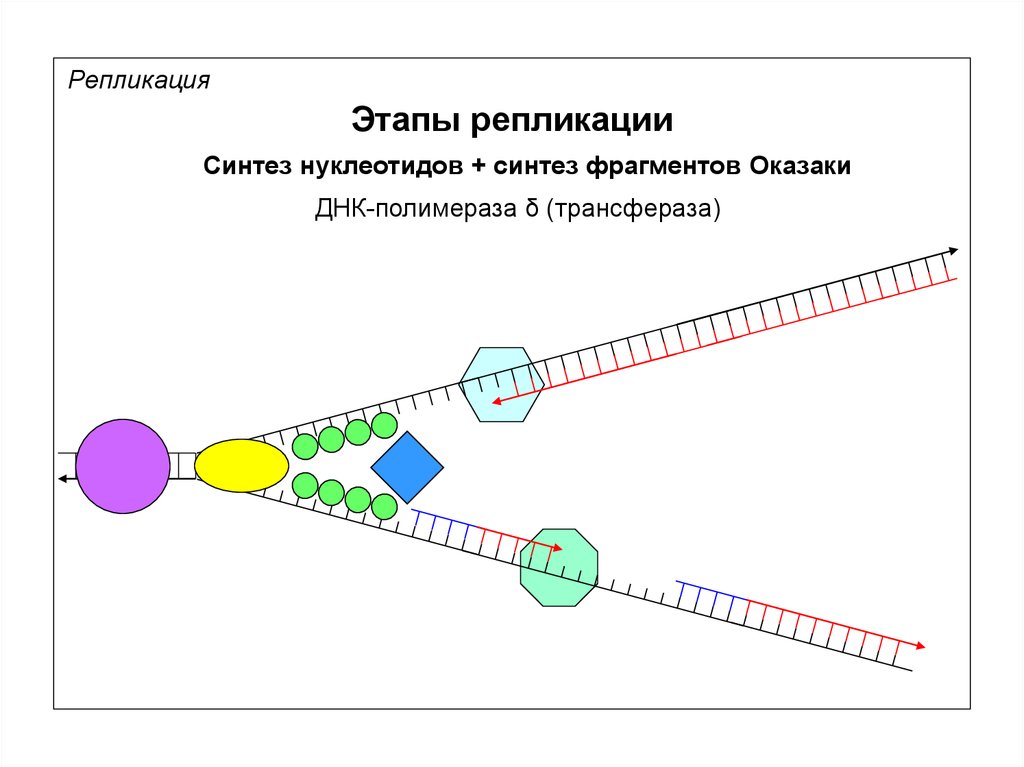
РепликацияЭтапы репликации
Синтез нуклеотидов + синтез фрагментов Оказаки
ДНК-полимераза δ (трансфераза)
3’
5’
3’
ДНК-полимераза δ
5’
52.
РепликацияЭтапы репликации
Продвижение репликационной вилки (~1000 п.н.)
53.
РепликацияЭтапы репликации
Синтез праймеров для отстающей цепи
Праймаза – ДНК-полимераза α (трансфераза)
54.
РепликацияЭтапы репликации
Синтез нуклеотидов + синтез фрагментов Оказаки
ДНК-полимераза δ (трансфераза)
55.
РепликацияЭтапы репликации
Вырезание праймеров
ДНК-полимераза δ вытесняет РНК праймер
Эндонуклеаза (гидролаза)
отрезает праймер
Эндонуклеаза
(гидролаза)
Однонитевой
разрыв
56.
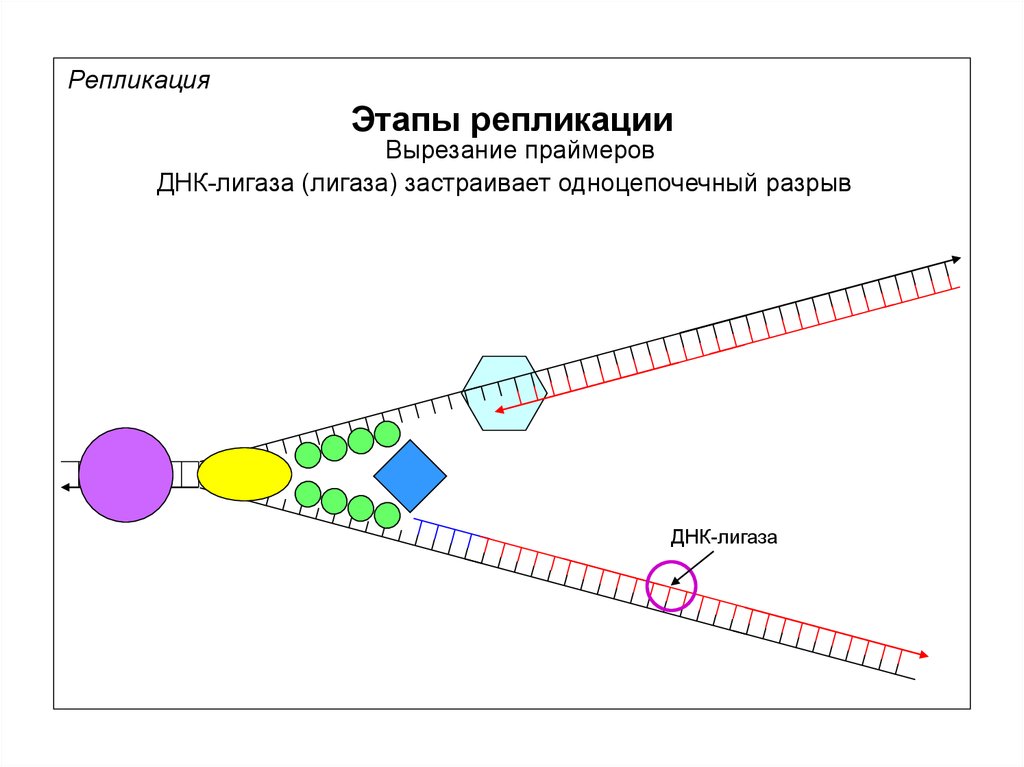
РепликацияЭтапы репликации
Вырезание праймеров
ДНК-лигаза (лигаза) застраивает одноцепочечный разрыв
ДНК-лигаза
57.
58.
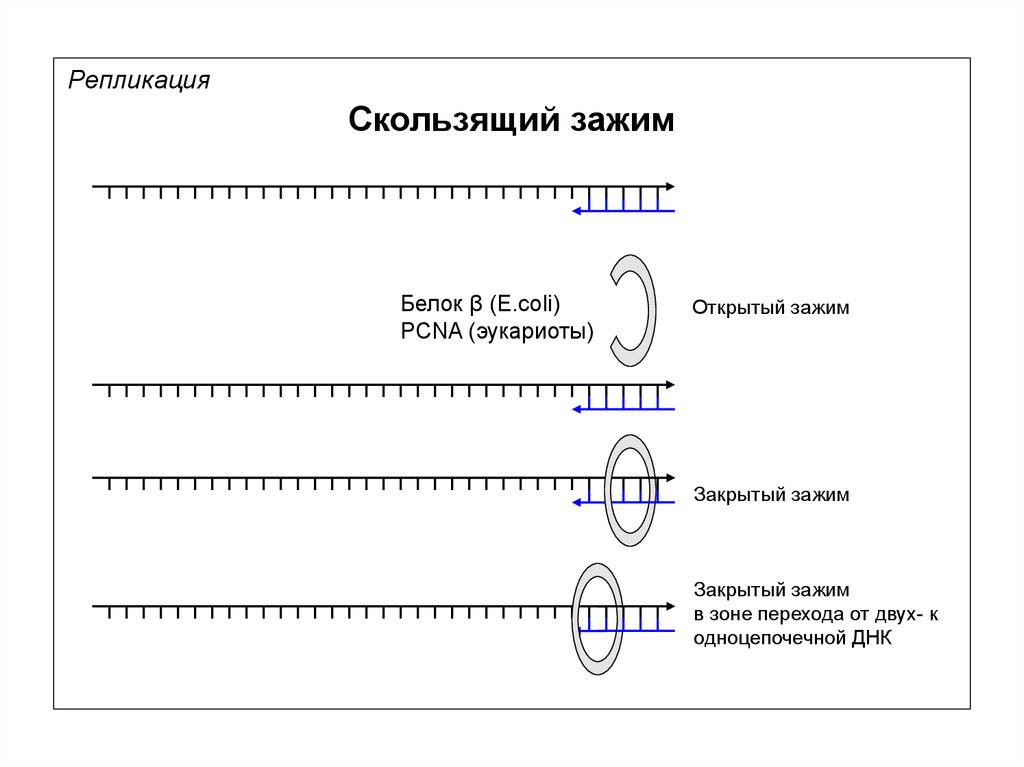
РепликацияСкользящий зажим
Белок β (E.coli)
PCNA (эукариоты)
Открытый зажим
Закрытый зажим
Закрытый зажим
в зоне перехода от двух- к
одноцепочечной ДНК
59.
РепликацияСкользящий зажим
Белок β
PCNA
Белок β и двухцепочечная ДНК
60.
РепликацияСкользящий зажим
+ PPi
61.
РепликацияСкользящий зажим
ДНК-полимераза
62.
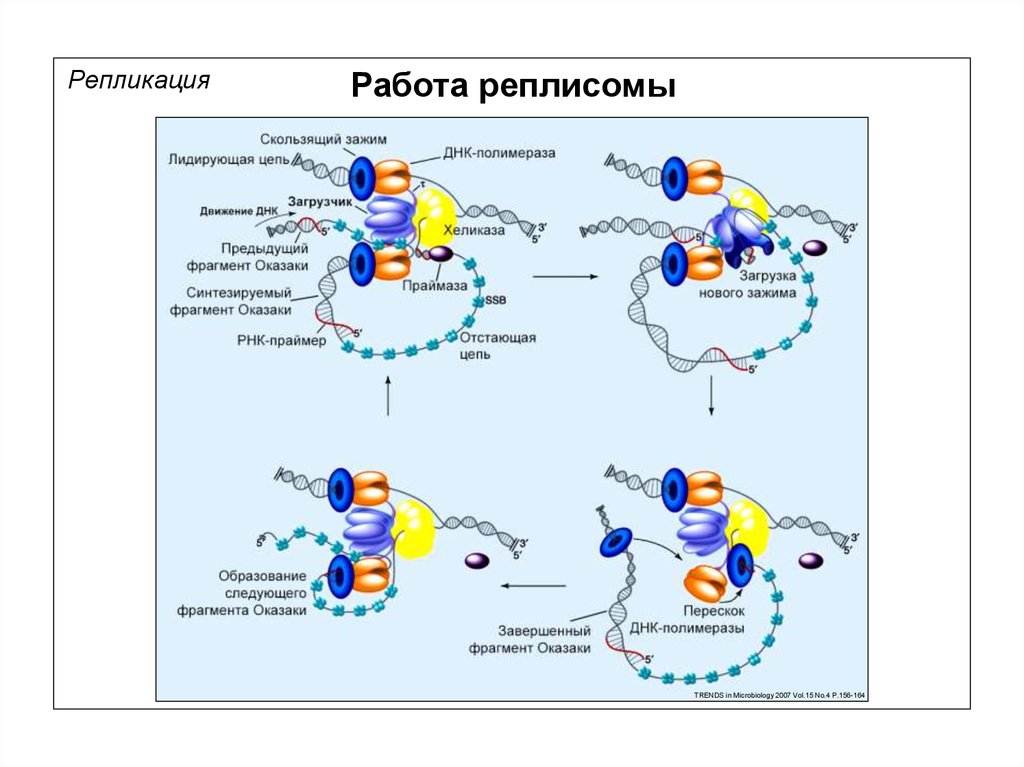
РепликацияРабота реплисомы
TRENDS in Microbiology 2007 Vol.15 No.4 P.156-164
63.
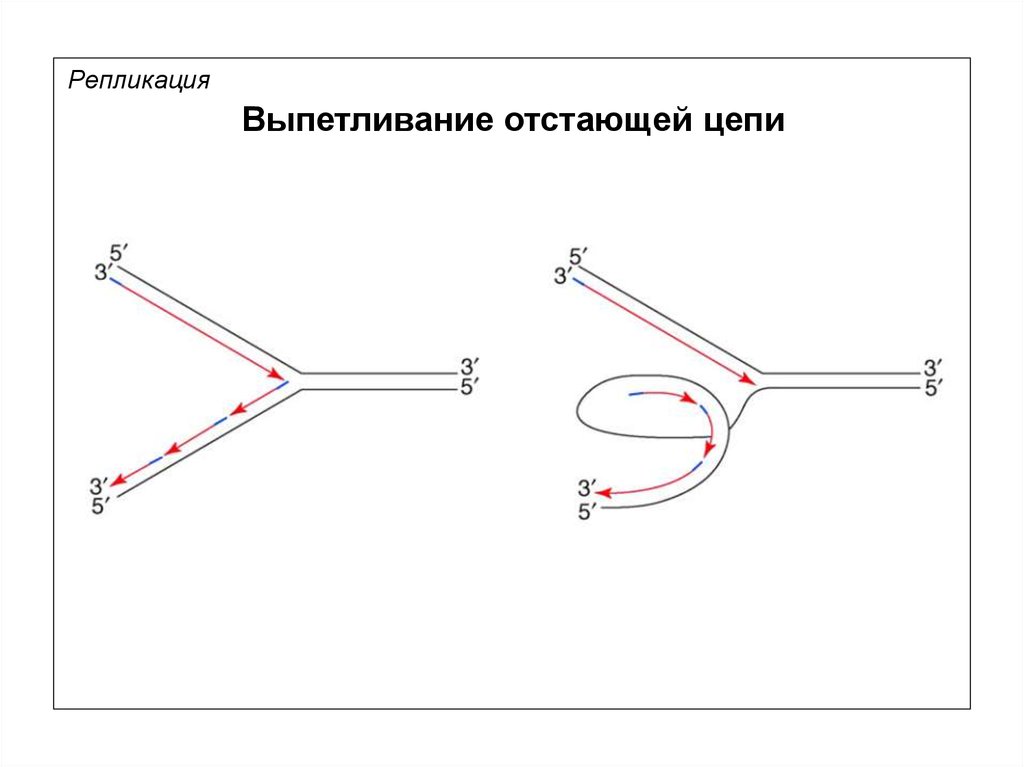
РепликацияВыпетливание отстающей цепи
64.
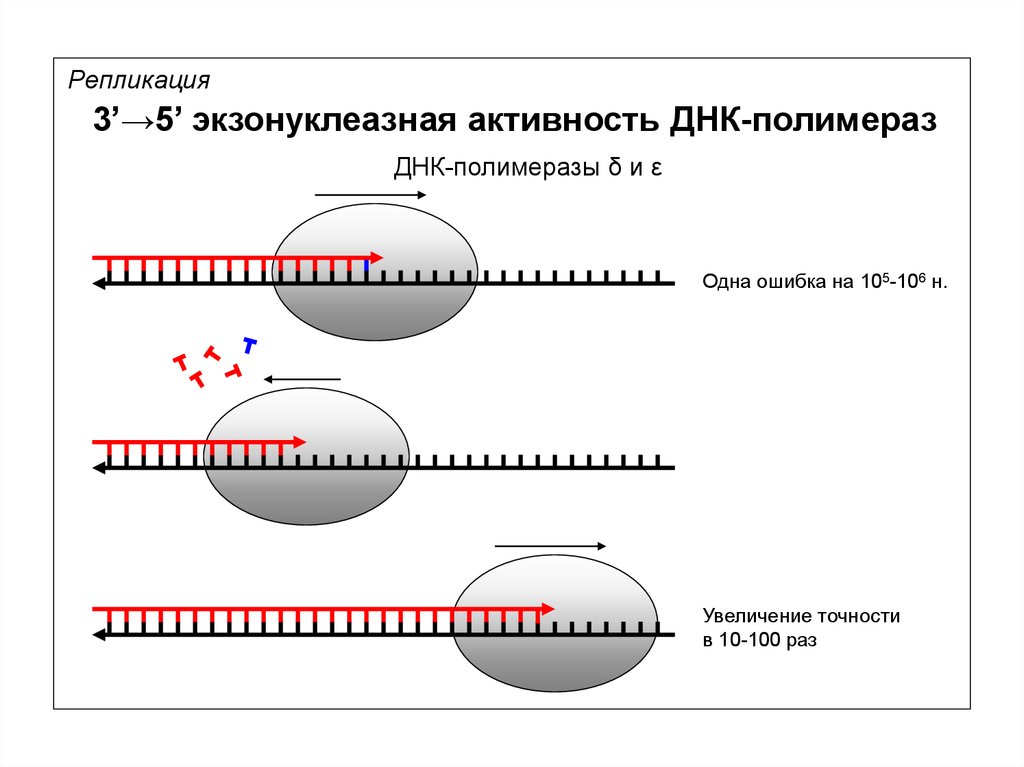
Репликация3’→5’ экзонуклеазная активность ДНК-полимераз
ДНК-полимеразы δ и ε
Одна ошибка на 105-106 н.
Увеличение точности
в 10-100 раз
65.
66.
РепликацияПроблема концов хромосом эукариот
Лимит Хайфлика (1961)
Нормальные (не опухолевые) клетки человека при выращивании
в культуре погибают после ~50 делений.
Nat.Rev.Mol.Cell Biol.-2000.-1:72-76
Леонард Хайфлик
(Leonard Hayflick)
1928 г.р.
Маргинотомия (1971)
http://freetowns.ru
Алексей Матвеевич Оловников
1936 г.р.
Каждый раунд удвоения приводит к укорачиванию хромосомы
на 3-6 п.н.
67.
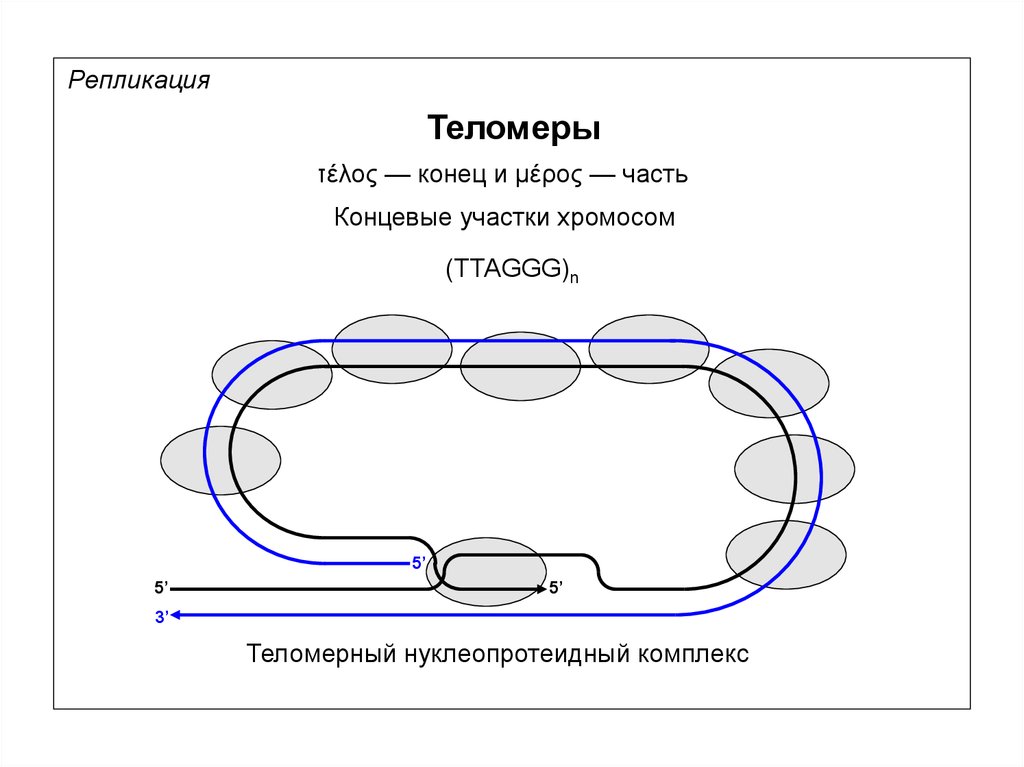
РепликацияТеломеры
τέλος — конец и μέρος — часть
Концевые участки хромосом
(TTAGGG)n
5’
5’
5’
3’
Теломерный нуклеопротеидный комплекс
68.
РепликацияТеломеры
Участки закрепления хромосомы
на ядерной оболочке
Укорачивание теломеров до n < 13 вызывает слияние хромосом.
Укорачивание теломеров приводит к остановке деления (хотя маргинотомия не объясняет
лимит Хайфлика, поскольку за 50 делений дает слишком малое укорачивание).
Усиленное укорачивание теломеров ( на 20-100 п.н. на удвоение хромосомы) может быть
вызвано окислительным стрессом или радиацией (эрозия теломеров).
69.
РепликацияТеломераза
РНК-зависимая ДНК-полимераза (трансфераза)
Добавляет фрагменты TTAGGG к 3’-концу хромосомы
CAAUCCCAAUC
TTAGGGTTAGGGTTAGGGTTAGGGTTAGGGTTAGGG
CAAUCCCAAUC
http://www.uic.edu
TTAGGGTTAGGGTTAGGGTTAGGGTTAGGGTTAGGGTTAGGG
70.
РепликацияТеломераза
Кэрол Грейдер
Элизабет Элен Блэкбёрн
Джек Шостак
(Carolyn Widney Greider) (Elizabeth Helen Blackburn) (Jack William Szostak)
1961 г.р.
1948 г.р.
1952 г.р.
Нобелевская премия 2009 г.
за открытие механизмов защиты хромосом теломерами
и фермента теломеразы
71.
72.
Клеточный циклИнтерфаза (I)
Митоз (М)
© Aaron Straight, Stanford University School of Medicine
73.
Клеточный циклИнтерфаза
Телофаза
Митоз
Профаза
Анафаза
Прометафаза
Метафаза
Alberts Bю et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002.
74.
Клеточный циклИнтерфаза
Циклическое изменение размера делящейся клетки
M
I
Размер клетки
I
Время
M
75.
ИнтерфазаКлеточный цикл
Потребление клеткой
дезоксинуклеотидов
Циклическое изменение потребления нуклеотидов
в делящейся клетке
M
I
G1
M
I
G1
1-я промежуточная
фаза
1-я промежуточная
фаза
G2
S
фаза синтеза
2-я промежуточная
фаза
Время
G2
2-я промежуточная
фаза синтеза
фаза
S
Фазы клеточного цикла
G1
S
G2
M
G1
76.
Клеточный циклG0
G1
G0
S
G2
M
Alberts B. et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002.
77.
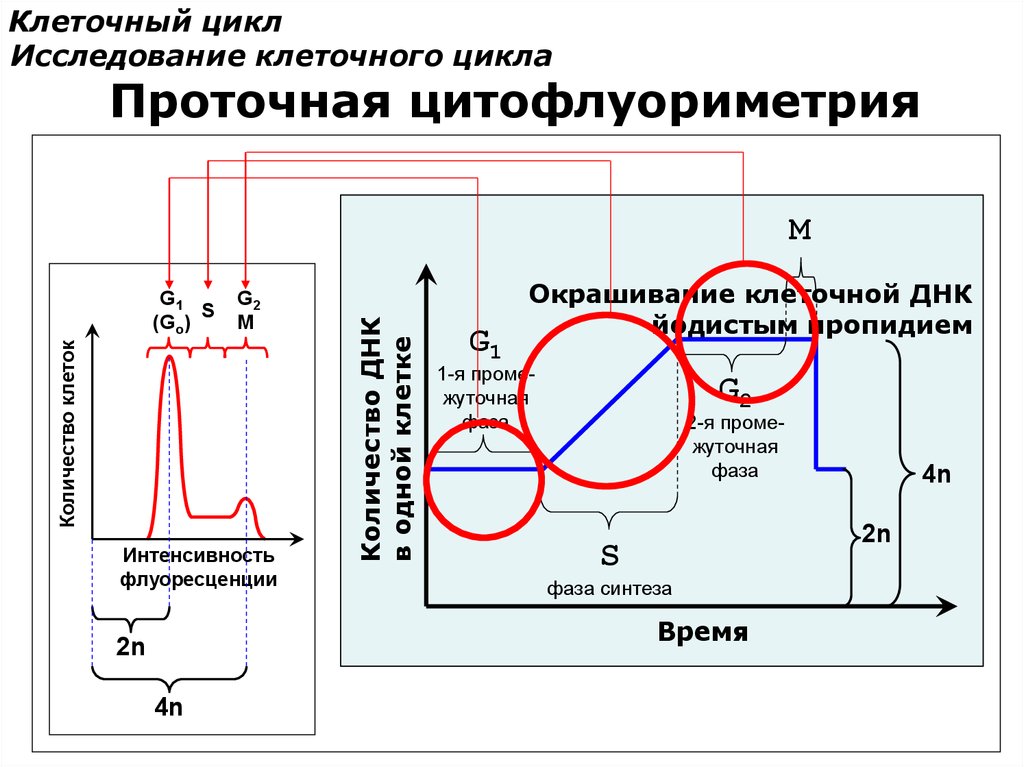
Клеточный циклИсследование клеточного цикла
http://www.cbp.pitt.edu/faculty/yong_wan/index.html
78.
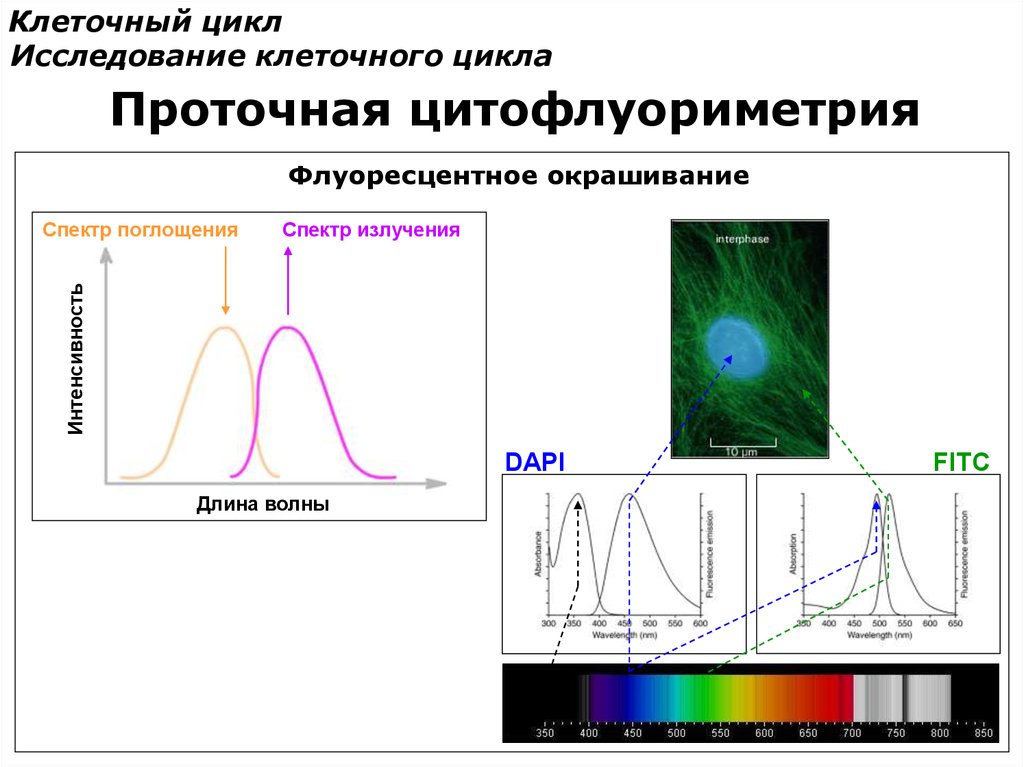
Клеточный циклИсследование клеточного цикла
Проточная цитофлуориметрия
Флуоресцентное окрашивание
Спектр излучения
Интенсивность
Спектр поглощения
DAPI
Длина волны
FITC
79.
Клеточный циклИсследование клеточного цикла
Проточная цитофлуориметрия
Циклическое изменение количества ДНК в делящейся клетке
M
Количество ДНК
в одной клетке
I
G1
M
I
G1
1-я промежуточная
фаза
G2
1-я промежуточная
фаза
G2
2-я промежуточная
фаза
2-я промежуточная
фаза
S
S
фаза синтеза
фаза синтеза
Время
4n
2n
80.
Клеточный циклИсследование клеточного цикла
Проточная цитофлуориметрия
Схема прибора
Лазер
Флуориметр
81.
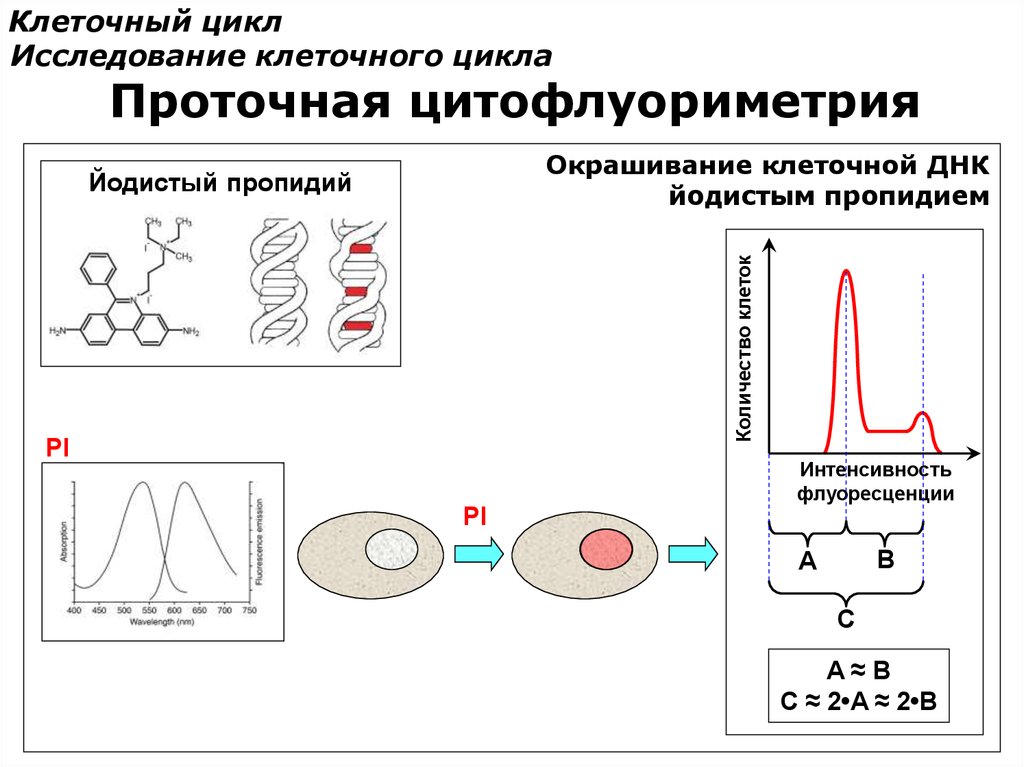
Клеточный циклИсследование клеточного цикла
Проточная цитофлуориметрия
Окрашивание клеточной ДНК
йодистым пропидием
Количество клеток
Йодистый пропидий
PI
Интенсивность
флуоресценции
PI
B
A
C
A≈B
C ≈ 2•A ≈ 2•B
82.
Клеточный циклИсследование клеточного цикла
Проточная цитофлуориметрия
G2
M
Количество клеток
G1
S
(Go)
Интенсивность
флуоресценции
Количество ДНК
в одной клетке
M
G1
Окрашивание клеточной ДНК
йодистым пропидием
1-я промежуточная
фаза
G2
2-я промежуточная
фаза
2n
S
фаза синтеза
Время
2n
4n
4n
83.
Клеточный циклИсследование клеточного цикла
Проточная цитофлуориметрия
Типичные гистограммы окрашивания ДНК
при разных механизмах клеточного ответа
на внешние воздействия
Остановка цикла
в фазе G1
Остановка цикла
в фазе G2
Остановка цикла
в фазе S
Переход клеток
в фазу G0
Контроль
G2
M
Количество клеток
G1
S
(Go)
Интенсивность
флуоресценции
84.
85.
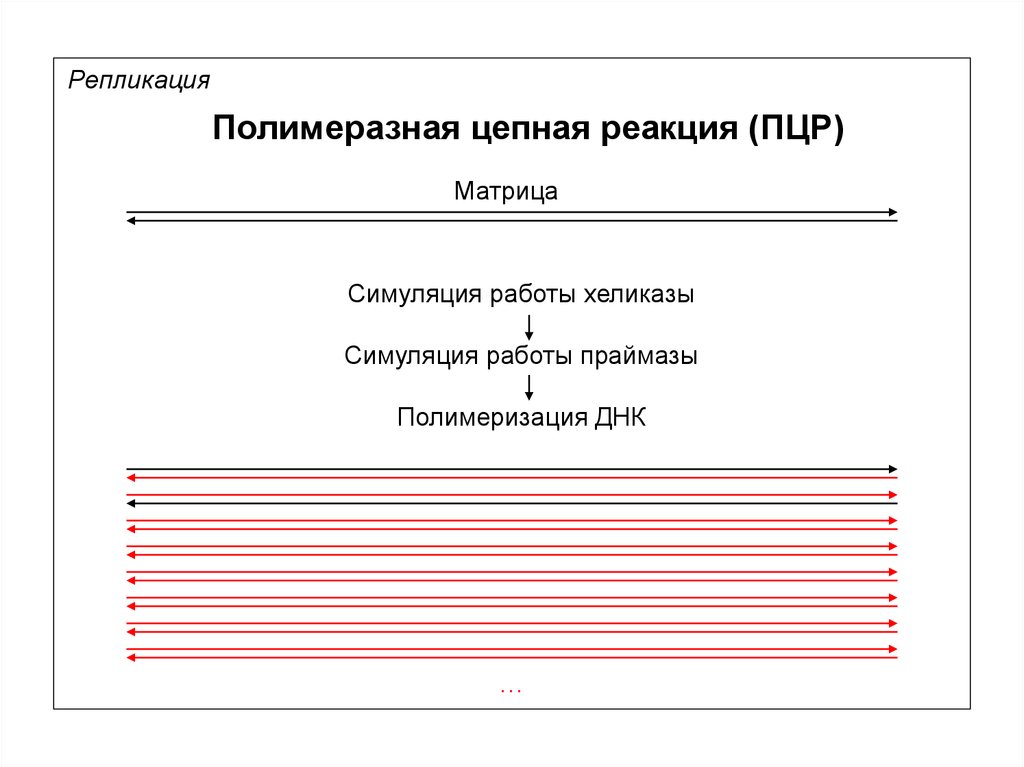
РепликацияПолимеразная цепная реакция (ПЦР)
Матрица
Симуляция работы хеликазы
Симуляция работы праймазы
Полимеризация ДНК
…
86.
РепликацияПолимеразная цепная реакция (ПЦР)
Симуляция работы хеликазы
Плавление ДНК
96°С
87.
РепликацияПолимеразная цепная реакция (ПЦР)
Симуляция работы праймазы
Подбор и заказ праймеров
Отжиг праймеров
88.
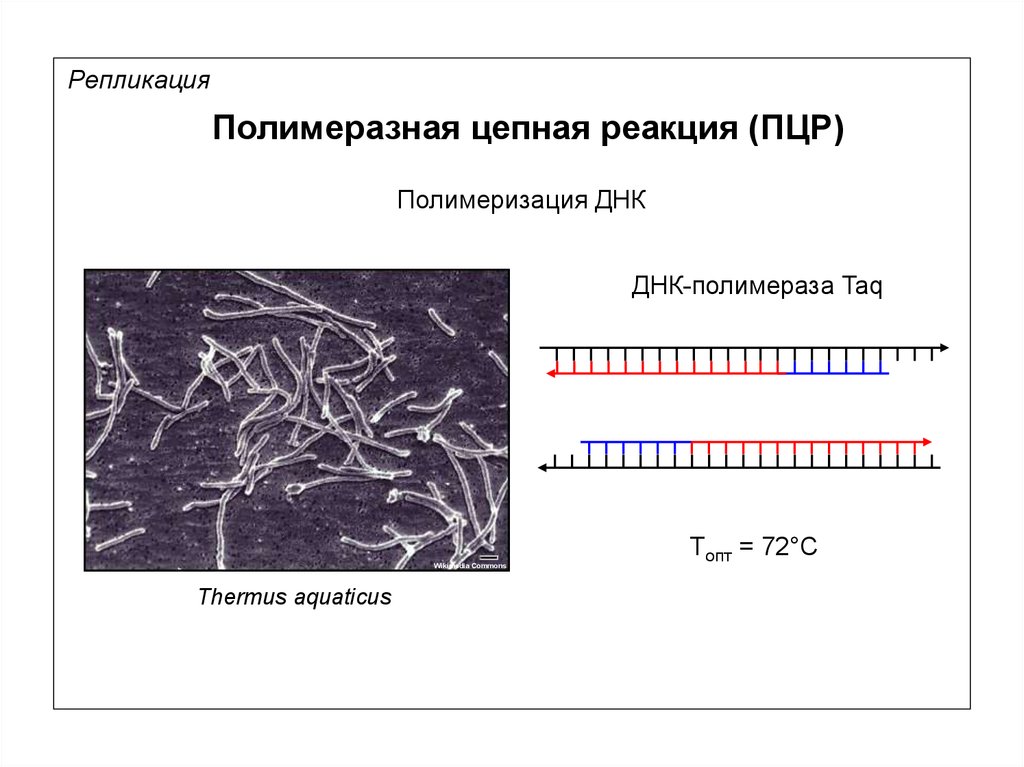
РепликацияПолимеразная цепная реакция (ПЦР)
Полимеризация ДНК
ДНК-полимераза Taq
Wikimedia Commons
Thermus aquaticus
Tопт = 72°С
89.
РепликацияПЦР
1-й цикл
Плавление
Отжиг
Полимеризация
1 матрица (2 нити) + 1 полупродукт (2 нити)
90.
Репликация2-й цикл
ПЦР
Плавление
Отжиг
Полимеризация
1 матрица (2 нити) + 2 полупродукта (4 нити) + 1 продукт (2 нити)
91.
Репликация3-й цикл
ПЦР
Плавление
Отжиг
Полимеризация
1 матрица (2 нити) + 3 полупродукта (6 нитей) + 4 продукта (8 нитей)
92.
РепликацияПЦР
Количество циклов - n
если n=40
Матриц - 1
Матриц - 1
Полупродуктов – n
Продуктов – 2n-(n+1)
Полупродуктов – 40
Продуктов – 240-(40+1) = 1.099.511.627.735 ≈ 1012
С 1 молекулы можно получить
до 100 нг продукта длиной 100 п.н.
Продукт
Метод ПЦР позволяет определить наличие 7-10 молекул


































































 biology
biology chemistry
chemistry








