Similar presentations:
Радиационная биофизика. Детерминированные и стохастические, соматические и генетические эффекты облучения. (Лекция 3)
1.
Лекция 32.
Детерминированные и стохастические,соматические и генетические
эффекты облучения
3.
Детерминированные и стохастические эффекты облучения.Определения
Детерминированные (нестохастические) эффекты облучения
(детерминированный – определенный, причинно обусловленный
предшествующими событиями; от лат. determino – определяю) –
биологические эффекты, вызванные ионизирующим излучением в
облученном организме, которые возникают при достижении
определенного дозового порога, а выше дозового порога вероятность
их появления и степень проявления (т.е. тяжесть) увеличиваются с
дальнейшим повышением дозы.
Стохастические эффекты облучения (стохастический – случайный,
вероятностный; от греч. stochastikós – умеющий угадывать) –
биологические эффекты, вызванные ионизирующим излучением в
облученном организме или его потомстве, не имеющие дозового порога
возникновения, вероятность появления которых увеличивается при
повышении доз, а тяжесть проявления не зависит от дозы.
4.
Детерминированные эффекты облучения. ПримерыДетерминированные эффекты облучения возникают, главным образом, в
результате гибели клеток, приводящей к нарушению функции ткани, которую они
составляют.
К ним относятся, в частности, непосредственные проявления острого лучевого
поражения, радиационные синдромы, нарушение репродуктивной функции,
поражение кожи, возникновение катаракты.
Наблюдаются в основном в ближайшие сроки после облучения, реже – в
отдаленные сроки (например, катаракта).
Порог для разных детерминированных эффектов может наблюдаться при дозах
от 0,1 Гр до нескольких десятков грей.
Так, например, порог временной (обратимой) стерильности мужчин при
однократном облучении семенников составляет около 0,15 Гр, а порог
постоянной (необратимой) стерильности – 3,5-6 Гр. Порог для постоянной
стерильности женщин при остром облучении – 2,5-6 Гр.
Порог возникновения катаракты у человека при остром воздействии - или
рентгеновского излучения лежит в диапазоне 2-6 Гр; для нейтронного излучения
порог в 3-9 раз ниже.
Порог достоверного подавления кроветворения в красном костном мозге
человека при остром облучении наблюдается при 0,15 Гр.
5.
Стохастические эффекты облучения. ПримерыСтохастические эффекты облучения возникают в результате мутагенного
действия ионизирующего излучения, т.е. когда клетка под действием излучения
не погибает, но в ней происходит повреждение генома.
Стохастические эффекты облучения могут возникать как в самом облученном
организме, так и у потомства облученного организма.
К стохастическим эффектам облучения относятся радиоиндуцированные
опухоли, возникающие в различных тканях облученного организма. Наиболее
часто встречаются злокачественные опухоли кожи, костей, молочной и
щитовидной желез, яичников, легких, а также лейкозы.
Стохастические эффекты возникают через длительное время после облучения,
т.е. являются отдаленными последствиями облучения.
Поскольку существуют механизмы клеточного восстановления, стохастические
эффекты при малых дозах маловероятны, однако с увеличением дозы
облучения их вероятность возрастает. Тяжесть же этих эффектов не зависит от
дозы.
Лучевые изменения половых клеток могут привести к возникновению
стохастических эффектов в виде наследственных болезней или уродств у
потомства облученного организма.
6.
Соматические и генетические эффекты облучения.Определения
Соматические эффекты облучения (от греч. sṓma – тело) – вредные
биологические эффекты, вызванные ионизирующим излучением в
соматических (т.е. не половых) тканях облученного организма.
Могут быть как детерминированными, так и стохастическими, как ранними
(проявления острой лучевой болезни и локальные лучевые повреждения), так и
отдаленными (сокращение продолжительности жизни, возникновение опухолей,
катаракты и др.).
Генетические (наследственные) эффекты облучения – вызванные
ионизирующим излучением биологические эффекты, обусловленные
повреждением генома (появление доминантных и рецессивных генных мутаций)
половых клеток облученного организма и проявляющиеся у его потомства.
Относятся к стохастическим эффектам облучения. Могут быть как
неблагоприятными (вредными), так и благоприятными (полезными).
Полезные генетические эффекты используют для выведения более
продуктивных штаммов микроорганизмов и сортов растений.
7.
Как соотносятся между собой детерминированные и стохастические,соматические и генетические эффекты
8.
Генетические эффекты облучения у человекаДо настоящего времени не найдены радиационно-индуцированные
наследственные эффекты в потомстве облученных людей (включая
пострадавших от атомных бомбардировок в Японии, от радиационных
воздействий на Южном Урале и в результате Чернобыльской аварии).
Весь прогноз наследственных заболеваний (т.н. генетического риска) у
человека пока целиком основан на экстраполяции результатов опытов
на животных.
В ряду дрозофила – мышь – человек выход мутаций на единицу дозы,
максимально выраженный у дрозофилы, резко снижается у мыши и
практически нивелируется у человека.
По-видимому, это связано с тем, что по мере эволюции степень
эффективности механизма репарации повышалась и достигла
максимума у человека.
Повышению эффективности репарационных процессов, вероятно,
способствует и фактор времени – т.е. удлинение всех жизненных
циклов у человека (в том числе, сперматогенеза и эмбрионального
развития).
9.
Дозовые кривые выживаемости клеток.Теория мишени. Радиочувствительность
разных стадий клеточного цикла
10.
Кривые выживаемости клетокКривые выживаемости культивируемых клеток в обычных (т.е.
линейных) координатах, в которых по оси абсцисс откладывается доза
облучения, а по оси ординат – доля выживших клеток, могут выглядеть
следующим образом:
1,0
Доля выживших клеток ( N|N0)
Доля выживших клеток ( N|N0)
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
Доза облучения, Гр
Доза облучения, Гр
11.
Какие клетки считаются выжившими?Выжившими считаются клетки, непотерявшие клоногенной способности.
Под клоногенной (т.е. колониеобразующей) способностью понимают
способность клетки образовать видимую невооруженным глазом колонию. За
такую колонию принимают колонию, состоящую из более чем 50 клеток
(ориентировочно – это колония диаметром 0,5 мм).
Для образования такой колонии клетка должна совершить не менее 5-6
успешных делений, т.е. таких делений, в результате которых образуются
дочерние клетки также способные к делению. (После 5 делений образуется
25=32 клеток, а после 6 делений – 26=64 клетки)
Учет выживаемости культивируемых клеток грызунов обычно проводят через
5-8 дней их роста после облучения, а для культивируемых клеток человека –
через 2 недели. Разные сроки связаны с разной длительность клеточного
цикла. Например, для часто используемых в экспериментах клеток HeLa (клетки
карциномы шейки матки человека) длительность клеточного цикла – 24 часов, а
для клеток V79 (фибробласты легких китайского хомячка) – 11 часов.
12.
Сравнение кривых выживаемости клеток при действии ядов иионизирующего излучения
Наличие подобного рода зависимости выживаемости
клеток от дозы облучения было продемонстрировано еще в
20-е годы ХХ в.
При этом уже в то время было отмечено, что кривые
выживаемости клеток после воздействия излучения
отличаются от кривых выживаемости клеток после
воздействия каких-либо токсических агентов химической
природы, например ядов:
13.
Кривая выживаемости клеток при действии ядовКривые выживаемости клеток, получаемые при
действии химических агентов, характеризуются
наличием пороговой концентрации, ниже которой все
клетки выживают, а выше которой происходит резкое
снижение доли выживших.
Переход от 100%-ной выживаемости до нулевой
выживаемости происходит в очень узком диапазоне
концентраций.
Тот факт, что часть клеток гибнет, а другая часть
клеток выживает при какой-либо концентрации внутри
этого узкого концентрационного диапазона,
объясняют обычно с т.н. «биологических» позиций, а
именно исходя из наличия индивидуальных различий
клеток в клеточной популяции, подвергнутой этому
воздействию.
Чем меньше выражены индивидуальные различия, тем круче наклон кривой
выживаемости, т.е. быстрее переход выживаемости от 100% до 0%.
Ясно, что популяция генетически однородных клеток не может иметь клеток, сильно
различающихся по чувствительности к какому-либо воздействию.
14.
Форма кривых выживаемости клеток при действии излучения не можетбыть объяснена индивидуальными различиями клеток
На кривых выживаемости клеток, подвергнутых
облучению, отсутствует четкий порог: гибель
части клеток наблюдается даже при очень низких
дозах облучения, а гибель другой части клеток той
же популяции – лишь при значительно более
высоких дозах.
Объяснить этот феномен с «биологических»
позиций (т.е. исходя из индивидуальных различий
клеток к облучению) было невозможно, т.к. внутри
генетически однородной популяции не могут
находиться клетки, различающиеся по
устойчивости к облучению в сотни и тысячи раз.
Поэтому в 20-е годы прошлого века в противовес «биологическому» подходу
сформировался «физический» (или «биофизический») подход к объяснению и
интерпретации кривых выживаемости клеток, подвергнутых действию ионизирующего
излучения.
15.
Теория «точечного тепла». Основные положенияВ основе «биофизического» направления лежала «теория точечного тепла»,
разработанная Дессауэром (Dessauer) в 1922 г. Эта теория опиралась на
следующие основные идеи:
1. Несмотря на то, что плотность поглощенной энергии в облучаемом объекте
в среднем очень низкая, энергия самих актов поглощения весьма велика и
поэтому в микрообъемах вещества, в которых произошли акты поглощения
энергии, происходит его локальное нагревание (т.е. появление т.н.
«точечного тепла»), в результате чего вещество претерпевает значительные
локальные изменения, обусловленные разрывом химических связей или
активацией химических реакций.
2. Пространственное распределение мест локализации «точечного тепла»
внутри облученной клетки имеет случайный характер, т.е является чисто
статистической (т.е. вероятностной) функцией.
3. Клетка гетерогенна (т.е. неоднородна) по своему объему в
отношении чувствительности к облучению и имеет как
исключительно важные для жизни области, повреждение которых
приводит клетку к гибели, так и области, относительно
несущественные для выживания клетки.
16.
Форма кривых выживаемости клеток при действии излученияобъясняется вероятностным характером действия излучения на
жизненно важные области клетки
Т.о. теория «точечного тепла» заявила, что конечный эффект в клетке
(например, гибель) определяется вероятностью осуществления акта
поглощения энергии (т.е. появления «точечного тепла») в жизненно важных
областях (микрообъемах) клетки.
При увеличении дозы облучения вероятность осуществления акта поглощения
энергии в этих клеточных областях возрастает, при снижении дозы –
уменьшается.
Однако, даже при очень высокой дозе облучения существует определенная
вероятность того, что в каком-то количестве клеток не произошло актов
поглощения энергии в жизненно важных клеточных областях и поэтому эти
клетки останутся неповрежденными облучением.
И наоборот – даже при очень низкой дозе существует вероятность того,
что в каком-то количестве клеток произойдут акты поглощения энергии в
жизненно важных клеточных областях, что вызовет гибель этих клеток.
17.
Фридрих Дессауэр (1881-1963)Фридрих Дессауэр (Friedrich Dessauer, 1881-1963) –
известный немецкий физик, биофизик,
изобретатель, предприниматель, публицист,
философ, политический деятель.
В 1921 г. основал Институт физических основ
медицины в г. Франкфурт-на-Майне. Главная цель
института – изучение возможности медицинского
применения излучений, в частности X-лучей. Этот
институт стал ведущим исследовательским
центром в области исследования биологического
действия ионизирующего излучения.
В 1922 г. сформулировал теорию «точечного тепла»
(или «точечного нагрева»), объясняющую
поражение клетки ионизирующим излучением,
исходя из дискретной природы излучения и
вероятностного характера взаимодействия
излучения с веществом. Данную теорию
рассматривают в качестве важной вехи в развитии
радиобиологии, знаменующей начало второго
этапа ее развития – этапа количественной
радиобиологии.
18.
Два фундаментальных положения в радиобиологииВ 20-30-е годы прошлого столетия основные идеи теории «точечного
тепла» получили дальнейшее развитие в работах таких исследователей,
как:
• Дж. Кроутер (J.A. Crowther; в русскоязычной литературе встречаются
также и другие варианты написания фамилии этого исследователя —
Краузер, Кроузер),
• Д. Ли (D.E. Lea),
• К. Циммер (K.G. Zimmer)
• Н.В. Тимофеев-Ресовский
В результате этих работ была сформулирована т.н. «теория мишени», в
основе которой лежали два фундаментальных положения:
• принцип попадания и
• принцип мишени.
19.
Принцип попаданияПринцип попадания может быть сформулирован следующим образом:
Поглощение энергии в облучаемом объеме происходит в
результате дискретных актов взаимодействия квантов
излучения с веществом – т.н. «попаданий», пространственное
распределение которых в облучаемом объеме имеет случайный
характер.
Таким образом, «принцип попадания» отмечает дискретность и
вероятностный (случайный) характер актов взаимодействия излучения
с веществом.
Фактически попаданием считается возникновение акта ионизации какихлибо молекул в облучаемом объеме.
20.
Принцип мишениПринцип мишени может быть сформулирован следующим образом:
Клетка имеет в своем составе как исключительно важные для
выживания области – т.н. «мишени», радиационное
повреждение которых приводит клетку к гибели, так и области,
относительно несущественные для выживания клетки.
Таким образом, «принцип мишени» отмечает биологическую
гетерогенность различных областей (микрообъемов) внутри клетки в
отношении чувствительности к облучению, а именно, наличие внутри
клетки «мишеней» – чувствительных областей, радиационное
повреждение которых приводит клетку к гибели.
21.
Мишени:какие они могут быть и сколько их может быть в клетке?
Чисто теоретически можно представить, что могут существовать:
одноударные мишени (когда мишень считается пораженной при
одном попадании) и
многоударные мишени (когда мишень считается пораженной при 2,
3, 4, …, n попаданиях).
Можно также предположить наличие в клетке:
только одной мишени (одномишенная клетка)
или нескольких мишеней (многомишенная клетка)
Причем гибель многомишенной клетки может наступить лишь после
того, как все мишени получат определенное число попаданий (при этом
каждая из этих мишеней может отличаться по ударности).
22.
Простейшие модели, описывающие кривые выживаемостиДля описания кривых пострадиационной выживаемости клеток
используют различные математические модели.
Двумя простейшими моделями, описывающими кривые
пострадиационной выживаемости клеток и базирующимися на теории
мишени, являются:
Многоударная-одномишенная модель
Одноударная-многомишенная модель
23.
Имеет ли смысл использовать более сложныемногоударные-многомишенные модели?
Использовать другие более сложные многоударные-многомишенные
модели (основанные на теории мишени) весьма ненадежно, т.к. по
форме кривых выживаемости невозможно сделать однозначный
вывод об ударности и мишенности объекта. Практически
одинаковые по форме кривые выживаемости можно получить
варьируя число мишеней и их ударность.
Так, например, кривая выживаемости для 10-ударных-16-мишенных
объектов очень хорошо совпадает с кривой выживаемости для 48ударных-1-мишенных объектов.
Кроме того, теория мишени не учитывает наличия в клетке
репарационных процессов, которые существенно затрудняют
интерпретацию кривых выживаемости только с позиций мишенности
и ударности объекта.
24.
Одноударная-многомишенная модель — чисто формальноеиспользование
На практике во многих случаях для описания
кривых выживаемости клеток чисто
формально используется одноударнаямногомишенная модель.
25.
Одноударная-многомишенная кривая (1)Исходные допущения для одноударной-многомишенной модели:
Каждая клетка имеет n одинаковых мишеней.
Для поражения каждой из n мишеней необходимо 1 попадание в эту мишень.
Клетка погибает при поражении всех n мишеней.
Доля выживших клеток ( N /N0)
1
Кривая
выживаемости
в общем виде имеет
плечо и
прямолинейный
участок
0,1
0,01
0
Доза облучения, Гр
Кривая выживаемости для такой
модели описывается следующим
уравнением:
n
N
kD
1 1 e
N0
где N0 – исходное количество клеток;
N – количество клеток, выживших
после облучения в дозе D;
k – коэффициент;
n – число мишеней.
Выживаемость клеток представляют обычно не в линейных координатах, а в
полулогарифмических координатах (с использованием логарифмической шкалы
ординат). По оси абсцисс – доза, а по оси ординат (в логарифмическом масштабе) – доля
выживших клеток.
26.
Одноударная-многомишенная кривая (2)То, что эта кривая выживаемости имеет прямолинейный участок, легко понять из
следующих преобразований:
При D уравнение
n
N
kD
1 1 e
N0
После логарифмирования получаем:
ln
преобразуется в следующее:
N
kD ln n
N0
N
ne kD
N0
, т.е. уравнение прямой линии.
Т.о., при D кривая выживаемости в полулогарифмическом масштабе асимптотически
приближается к прямой линии, наклон которой равен k.
n
Доля выживших клеток( N /N0 )
10
Значение ординаты n точки пересечения
экстраполированного участка этой прямой с осью
ординат называют экстраполяционным числом.
1
Как ясно видно из уравнения, описывающего эту
прямую, экстраполяционное число равно числу
мишеней.
0,1
0,01
0
Доза облучения, Гр
27.
Одноударная-одномишенная кривая – частный случай одноударноймногомишенной кривойЕсли число мишеней n=1, то уравнение
преобразуется в следующее:
n
N
kD
1 1 e
N0
N
e kD
N0
После логарифмирования получаем:
N
ln
kD
N0
Доля выживших клеток ( N /N0)
1
Кривая выживаемости
без плеча (т.е.
представляет собой
прямую линию)
0,1
Т.о., видно, что кривая выживаемости, не
имеющая плеча, является частным
случаем, для варианта, когда и число
мишеней n=1, и ударность мишени тоже
равна 1.
Ясно, что экстраполяционное число n для
этого варианта равно 1.
0,01
0
Доза облучения, Гр
28.
Параметры, характеризующие кривые выживаемости с «плечом»1. n – экстраполяционное число –
определяется как значение ординаты
точки пересечения
экстраполированного прямолинейного
участка кривой выживаемости с осью
ординат (в одноударноймногомишенной модели n равно числу
мишеней);
n
Доля выживших клеток
Для описания кривой выживаемости,
имеющей плечо, используются
параметры:
10
1
0,1
Dq
D37
e
D0
0,01
0
Доза облучения, Гр
2. Dq – доза, соответствующая точке пересечения экстраполированного прямолинейного
участка кривой выживаемости с прямой параллельной оси абсцисс, проведенной на
уровне 100%-ной выживаемости (Dq характеризует величину плеча);
3. D0 – определяется как прирост дозы, при котором выживаемость снижается в е раз на
прямолинейном участке кривой выживаемости;
4. D37 – доза, при которой выживает 37% облученных клеток.
29.
Взаимосвязь D0, Dq и nПараметры D0, Dq и n связаны друг с другом следующим соотношением:
D0
Dq
ln n
30.
Доля выживших клеток ( N /N0)Параметры, характеризующие кривые выживаемости без «плеча»
1
Для описания кривой
выживаемости, не имеющей плеча,
используется величина:
уменьшение числа выживших
клеток в e раз
0.37
D0
0,1
доза D0, которая определяется как
доза, при которой выживаемость
уменьшается в e раз;
или доза D37 – доза, при которой
выживает 37% облученных клеток.
0,01
0
D0 = D37
Доза облучения, Гр
Для кривых выживаемости, не имеющих плеча, D0 = D37, что следует из
следующих расчетов:
N 1
1
0,368 0,37.
N 0 e 2, 718
Таким образом, при уменьшении выживаемости в e раз от исходного уровня (т.е.
при облучении в дозе D0) выживаемость составит 37%, т.е. D0=D37.
31.
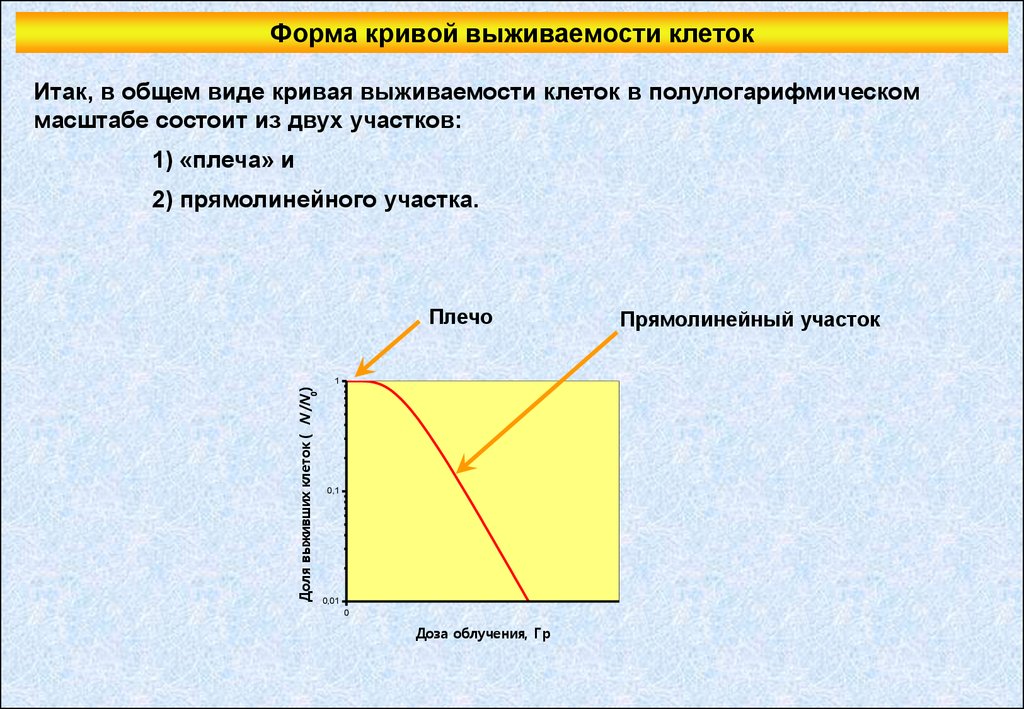
Форма кривой выживаемости клетокИтак, в общем виде кривая выживаемости клеток в полулогарифмическом
масштабе состоит из двух участков:
1) «плеча» и
2) прямолинейного участка.
Плечо
Доля выживших клеток ( N /N0)
1
0,1
0,01
0
Доза облучения, Гр
Прямолинейный участок
32.
О чем говорит наличие плеча и величина Dq?В соответствии с теорией мишени наличие плеча говорит о том, что для
поражения объекта недостаточно одного попадания. Это может наблюдаться,
когда:
либо объект является многомишенным,
либо мишень является многоударной.
Однако, в соответствии с современными
представлениями наличие плеча трактуется не как
наличие многоударности или многомишенности, а как
свидетельство протекания в клетке
восстановительных (репарационных) процессов.
При этом величину Dq используют в качестве показателя
способности клетки осуществлять репарационные
процессы: чем больше значение Dq (т.е. чем больше
плечо), тем выше репарационная способность клетки.
33.
От чего зависит наличие «плеча» на кривых выживаемости клеток?В целом наличие (и величина) «плеча» на кривых
выживаемости зависит:
1) от облучаемого объекта (т.е. от наличия или
отсутствия у него способности осуществлять репарацию), а
также
2) от вида излучения.
34.
Зависимость наличия «плеча» от вида ионизирующего излучения• Кривые выживаемости клеток, имеющие четко
выраженное «плечо», могут наблюдаться только при
облучении редкоионизирующим излучением (например,
рентгеновским или -излучением).
• При облучении плотноионизирующим излучением
кривые выживаемости клеток имеют слабовыраженное
плечо или вовсе его не имеют (например, в случае излучения). Это связано с тем, что при действии
плотноионизирующего излучения образуются в
основном двунитевые разрывы ДНК, которые являются
нерепарабельными (или плохорепарабельными)
повреждениями (даже при наличии в клетке
репарационных процессов) и однозначно приводят
клетку к гибели.
35.
Зависимость наличия плеча от облучаемого объектаНадо четко понимать, что:
• Если кривые выживаемости клеток после облучения
редкоионизирующим излучением не имеют плеча, значит
эти клетки не обладают способностью репарировать ДНК.
• Плечо не наблюдается при облучении
редкоионизирующим излучением вирусов, а также
макромолекул в простых модельных системах (например,
растворов ферментов), т.к. они не обладают
репарационной способностью.
36.
Молекулы ДНК – основная клеточная мишень для ионизирующегоизлучения
Что же является основной клеточной мишенью при действии радиации?
Основной мишенью в клетке является клеточное ядро (а точнее – молекулы
ДНК). [Второй по значению мишенью в клетке, как считают некоторые исследователи,
являются мембраны].
Тот факт, что ядро является основной мишенью было доказано в следующих
экспериментах:
Эксперименты по определению размеров
мишени в клетке
Размер клеточной мишени совпадает с
размером клеточного ядра
Эксперименты по локальному облучению
различных областей клетки
Облучение клеточного ядра приводит к
гибели клетки; при облучении других
клеточных областей гибель клетки
происходит при значительно более
высоких дозах
37.
Радиочувствительность разныхстадий клеточного цикла
38.
Клеточный циклПролиферирующие клетки эукариот в
своем развитии проходят несколько
фаз, совокупность которых получила
название клеточного цикла
(синонимы – митотический цикл,
жизненный цикл клетки).
Первая идентифицированная фаза
клеточного цикла – митоз – фаза
собственно деления клетки.
Временной интервал между
окончанием одного митоза и началом
следующего митоза получил название
интерфазы. В интерфазе
осуществляется подготовка клетки к
последующему делению.
39.
ИнтерфазаИнтерфаза подразделяется на
3 фазы:
G1-фазу;
S-фазу;
G2-фазу.
S-фаза (от слова synthesis – синтез) –
синтетическая фаза, в течение которой
основным событием в клетке является
удвоение (редупликация, или репликация)
ДНК. При этом синтезируются также
гистоны – белки, входящие вместе с ДНК в
состав хромосом. В хромосомах
формируется вторая хроматида.
G1-фаза (от англ. gap – промежуток,
интервал) – предсинтетическая фаза,
определяемая как интервал между
митозом и S-фазой. В G1-фазе происходит
синтез мРНК, белков и других компонентов
клетки.
G2-фаза – постсинтетическая фаза,
определяемая как интервал между S-фазой
и митозом. G2-фаза является конечным
этапом подготовки клетки к делению.
40.
Продолжительность фаз клеточного циклаДлительность клеточного цикла у активно пролиферирующих клеток
млекопитающих обычно составляет от 10 до 24 час., но в некоторых тканях может
достигать 200 и более часов.
Митоз – наиболее короткая фаза (от 0,5 до
1,5 час. – обычно около 1 час).
G1-фаза – наиболее вариабельная по
длительности фаза (часто является
наиболее продолжительной и именно ее
длительность определяет
продолжительность клеточного цикла в
целом).
S-фаза длится обычно 6-8 час. (довольно
стабильная по длительности фаза; никогда
не превышает 15 час.).
G2-фаза – обычно это самая короткая фаза в
интерфазе, а в клеточном цикле – вторая по
длительности после митоза.
41.
Продолжительность фаз клеточного цикла у 2-х частоиспользуемых линий клеток, культивируемых in vitro
Фаза клеточного
цикла
Линия HeLa
(клетки карциномы шейки
матки человека)
Линия V79
(фибробласты легких
китайского хомячка)
Митоз
1
1
G1-фаза
11
1
S-фаза
8
6
G2-фаза
4
3
Клеточный цикл
в целом
24
11
Наиболее характерный пример соотношения
продолжительности фаз клеточного цикла для
культивируемых клеток млекопитающих
Линия клеток HeLa была получена из карциномы шейки матки
пациентки Генриетты Лакс (Henrietta Lacks) в 1951 г.
42.
G0-фазаG0
В медленно обновляющихся тканях
большинство клеток находится в т.н.
G0-фазе – фазе покоя, когда после
завершения митоза клетка не
вступает в следующий клеточный цикл
и длительное время остается в
состоянии покоя.
Длительность G0-фазы может
составлять недели, месяцы и даже
годы (например, у клеток ЦНС).
Из этого состояния она может быть
выведена внешними стимулирующими
(митогенными) воздействиями.
Покоящиеся клетки – это резерв для
репопуляции (регенерации) ткани в
случае гибели части клеточного пула
вследствие каких-либо причин.
43.
Синхронизация клетокОбычная популяция пролиферирующих клеток включает клетки, находящиеся на
разных стадиях клеточного цикла: в митозе, G1-фазе, S-фазе и G2-фазе. Это т.н.
асинхронная популяция.
Однако, для изучения радиочувствительности отдельных стадий клеточного
цикла необходимо, чтобы все клетки популяции находились в момент облучения
на одной и той же стадии цикла.
Для этого проводят т.н. синхронизацию культивируемых клеток.
Один из наиболее мягких и эффективных методов синхронизации был
предложен Т.Терасимой и Л.Толмахом (T.Terasima, L.Tolmach) в 1963 г. Этот метод
синхронизации может быть применен только для клеток, растущих в
монослойных культурах. Он основан на том факте, что на стадии митоза клетки
округляются и становятся хуже прикреплены к поверхности ростовой среды. Эти
округленные клетки можно легко смыть с поверхности путем легкого
встряхивания культурального сосуда и концентрировать последующим
центрифугированием.
Так можно получить клеточную массу,
в которой 90-95% клеток находится на
стадии митоза.
После посева такие клетки будут
синхронно проходить все три фазы
первого клеточного цикла.
44.
Радиочувствительность клеток на разных стадияхклеточного цикла (1)
Изменение радиочувствительности клеток
по фазам цикла исследовано для разных
клеточных линий.
На рисунке приведены данные, для клеток
V79 и HeLa (W.Sinclair, 1969).
Общие выводы из этих и других
экспериментов следующие:
1. Наиболее чувствительны клетки в
фазе митоза.
2. Наиболее устойчивы клетки в поздней
S-фазе.
3. Клетки в G2-фазе чувствительны
примерно также как и при митозе.
45.
Исключения из общих закономерностейОписанные выше закономерности о радиочувствительности
разных стадий клеточного цикла нельзя, однако, полностью и без
проверки распространять на другие клеточные линии, т.к.
известны и случаи, когда наибольшая радиоустойчивость
характерна для клеток, находящихся в G1-фазе (например, у
фибробластов мышей линии L).
46.
Кривые выживаемости клеток на разных стадияхклеточного цикла (Sinclair, 1968, 1970)
Варьирование радиочувствительности
клеток в течение клеточного цикла
обусловлено изменением параметров
кривых выживаемости клеток –
величины D0 (обратно пропорциональной
наклону прямолинейного участка кривой)
и Dq (характеризующей размер плеча).
Стадия цикла
D0, Гр
n
М-фаза
1,3
1
G1-фаза
1,6
>1
Ранняя S-фаза
1, 9
2-3
Поздняя S-фаза
2,0
10
G2-фаза
1,3
1
Кривая выживаемости клеток в S-фазе
имеет наиболее выраженное плечо и
наибольшие значения D0 и
экстраполяционного числа n. – Это
означает, что клетки, находящиеся в Sфазе обладают наиболее высокой
способностью к репарации.
Клетки в М-фазе и G2-фазе не имеют
плеча на кривых выживаемости и
характеризуются наименьшими
значениями D0.
47.
Как сильно различается выживаемость клеток, облученныхна разных стадиях клеточного цикла?
Из приведенного рисунка можно
рассчитать, что выживаемость
клеток, облученных в поздней Sфазе, превышает выживаемость
клеток, облученных в G1-фазе:
примерно в 3 раза при дозе 3 Гр;
примерно в 20 раз при дозе 8 Гр;
примерно в 35 раз при дозе 12 Гр.
Таким образом, с увеличением дозы
облучения возрастают и отличия в
выживаемости клеток, облученных на
разных стадиях клеточного цикла.
Это означает, что в результате облучения асинхронных популяций
преимущественно выживают клетки, находившиеся в момент облучения в S-фазе.
Таким образом, облучение выступает в качестве синхронизирующего агента,
вызывающего перераспределение клеток между фазами клеточного цикла.
48.
Вызванное облучением перераспределение клеток междуфазами клеточного цикла можно использовать в качестве
важного сенсибилизирующего фактора
Эффект перераспределения клеток между фазами клеточного цикла очень
важен для выбора оптимального режима фракционирования дозы при
радиотерапии опухолей.
Наиболее эффективно применять повторное облучение опухоли через такой
интервал времени, который соответствует временному промежутку,
необходимому для перехода клеток, облученных в резистентной S-фазе, в
наиболее чувствительные к облучению фазы G2 и митоза.
Клетки же, находившиеся в момент первого облучения в наиболее
чувствительных к облучению фазах G2 и митоза, в значительной степени
погибнут уже после первой фракции облучения.
Таким образом, можно существенно сенсибилизировать популяцию опухолевых
клеток к повторной фракции облучения.
При этом такая сенсибилизация будет иметь место только в отношении быстро
пролиферирующих клеток – т.е. опухолевых клеток, и не будет происходить в
отношении медленно пролиферирующих клеток – т.е. клеток нормальной ткани,
окружающей опухоль.
49.
Прямое и непрямое (косвенное) действиеионизирующих излучений. Радиолиз воды.
Антиоксидантные защитные системы
50.
Теория мишени - так ли всё в действительности?В 30-е гг. прошлого века теория мишени, базирующаяся на
двух основополагающих принципах – принципе попадания и
принципе мишени, получила широкое распространение,
применение и признание среди биологов и физиков,
занимающихся изучением воздействия ионизирующих
излучений на живые организмы и органические молекулы.
Однако, уже в эти же 30-е годы и особенно в 40-е годы в
научной литературе стали появляться результаты
экспериментов, которые не находили объяснения с позиций
теории мишени, а именно с позиций принципа попадания,
т.е. идеи о том, что для поражения какой-либо молекулы
необходимо осуществление акты взаимодействия (т.е.
попадания) с ней ионизирующей частицы или кванта.
51.
Эксперименты ДейлаВ начале 1940-х гг. Уолтер Дейл (Walter Dale) проводил эксперименты с
облучением разбавленных растворов различных ферментов и показал, что
число инактивированных облучением молекул фермента не зависит от
исходной концентрации фермента в некотором концентрационном диапазоне (в
области низких конц-ий).
Очевидно, что эти результаты противоречили господствовавшей в то время
теории мишени: с позиций теории мишени число разрушенных молекул
фермента должно было возрастать с увеличением исходно конц-ии фермента
(т.е. чем больше исходная конц-ия мишеней, тем больше должно быть и число
поврежденных излучением мишеней).
Обнаруженный Дейлом эффект получил название «эффект разведения», или
«эффект Дейла».
52.
Прямое и непрямое (косвенное) действиеионизирующих излучений
В результате исследований Дейла и
других исследователей было
установлено, что в основе
повреждающего действия радиации
на органические молекулы, в
частности на такие жизненно важные
молекулы (ЖВМ), как ДНК, белки,
липиды и др., могут лежать 2
механизма.
H2O
1-й механизм обусловлен повреждением молекулы в результате
непосредственного взаимодействия излучения с этой молекулой (это
механизм получил название «прямое действие»).
2-й механизм обусловлен повреждением молекулы, осуществляемым
активными продуктами, образовавшимися из молекул H2O в результате
их непосредственного взаимодействия с излучением. Таким образом, в
этом случае повреждение ЖВМ происходит в результате непрямого
(косвенного) действия излучения.
53.
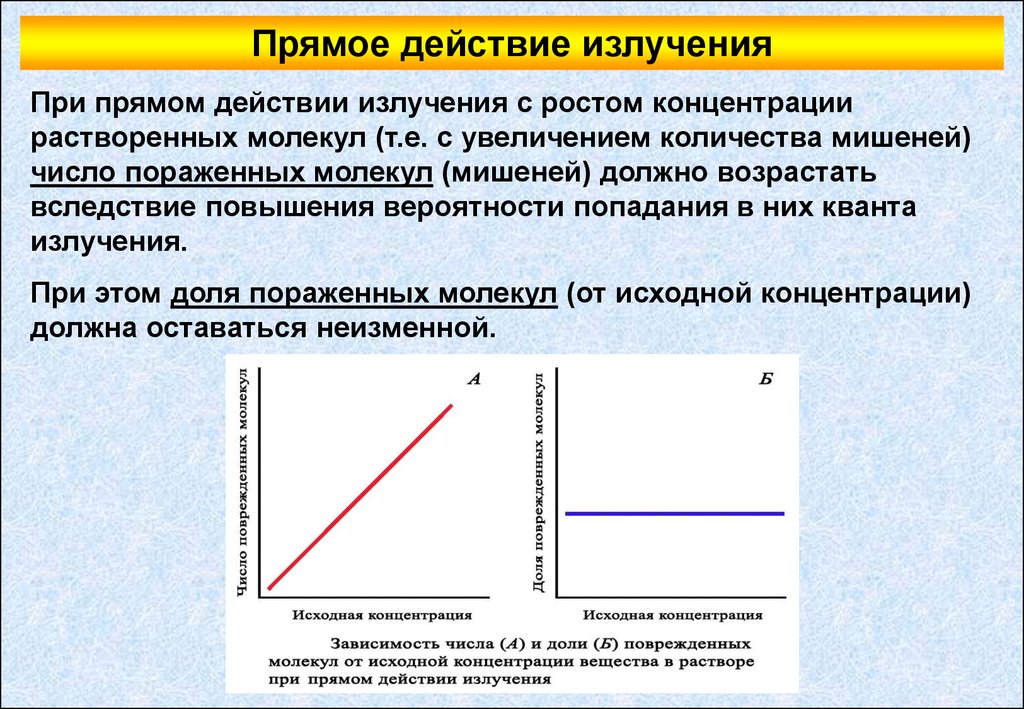
Прямое действие излученияПри прямом действии излучения с ростом концентрации
растворенных молекул (т.е. с увеличением количества мишеней)
число пораженных молекул (мишеней) должно возрастать
вследствие повышения вероятности попадания в них кванта
излучения.
При этом доля пораженных молекул (от исходной концентрации)
должна оставаться неизменной.
54.
Непрямое (косвенное) действие излученияПри непрямом действии излучения лимитирующим параметром для
появления поврежденных молекул в некотором концентрационном
диапазоне является не исходная концентрация растворенного вещества,
а количество образовавшихся при данной дозе облучения активных
продуктов радиолиза воды. Поэтому, начиная с какой-то концентрации
растворенного вещества, дальнейшее увеличение концентрации не
приводит к росту числа пораженных молекул.
Доля пораженных молекул при непрямом действии излучения
снижается с увеличением исходной концентрации этих молекул.
55.
Непрямое действие преобладает тольков разбавленных растворах
Иными словами отсутствие зависимости числа поврежденных
молекул от концентрации растворенных молекул объясняется
тем, что, начиная с какой-то концентрации, не всем растворенным
молекулам «достаются» активные продукты радиолиза воды,
образующиеся в определенном количестве при данной дозе
облучения.
Повышение же числа поврежденных молекул при больших
исходных концентрациях растворенных молекул (изображено на
рисунке пунктиром) связано с тем, что здесь заметный вклад в их
повреждение начинает вносить прямое действие излучения.
Таким образом, непрямое действие излучения преобладает
только в разбавленных растворах.
56.
Сравнение радиационных эффектовпри облучении макромолекул в растворенном и
сухом состоянии
В качестве критерия для оценки вклада прямого и
непрямого действия излучения на какие-либо органические
соединения и макромолекулы используют сравнение
эффективности облучения этих объектов в растворенном и
сухом состоянии.
Если в растворенном состоянии эти объекты становятся
значительно более чувствительными к облучению, то
считают, что существенный вклад в их повреждение вносят
продукты радиолиза воды.
57.
В растворенном состоянии макромолекулы обычноболее радиочувствительны, чем сухом состоянии
Обычно в растворенном в воде
состоянии макромолекулы на
несколько порядков более
чувствительны к облучению, чем в
сухом состоянии.
Например, доза D37 при облучении
РНК-азы γ-излучением 60Со составляет
42 Мрад в сухом состоянии и
0,42 Мрад в водном растворе, т.е.
различается в 100 раз.
Это говорит о том, что в водном
растворе только примерно 1%
молекул РНК-азы инактивируется
непосредственно за счет поглощения
энергии излучения, тогда как 99%
инактивируются продуктами
радиолиза воды.
58.
Соотношение прямого и непрямого действияизлучения в клетке
Представления о вкладе непрямого действия излучения в лучевое
поражение клетки существенно трансформировались со времени их
возникновения в 40-е годы прошлого века.
В настоящее время считается, что на уровне клетки во многих
радиобиологических эффектах непрямое действие радиации играет
столь же существенную роль, как и прямое действие.
И даже более того, вклад непрямого действия ионизирующего
излучения в отношении появления радиационных повреждений таких
критических клеточных структур, как молекулы ДНК, достигает 70-90%.
Открытие непрямого действия излучения стало очень важной вехой в
понимании механизмов биологического действия ионизирующих
излучений и стало основой для становления новых направлений
радиобиологических исследований, в частности такого важного
раздела радиобиологии, как химическая противолучевая защита.
59.
Рассмотрим теперь основные активные продукты,образующиеся при радиолизе воды и
обеспечивающие осуществление непрямого
действия ионизирующего излучения.
60.
Радиолиз воды (1)I. Если энергия кванта ионизирующего излучения составляет
более 12,56 эВ, происходит ионизация молекулы воды:
h 12,56 эВ
H 2O
H 2O e
т.е. из молекулы воды выбивается электрон.
Образовавшийся положительный ион воды взаимодействует с
молекулой воды с образованием иона гидроксония и
гидроксильного радикала:
H 2 O H 2 O H 3O OH
а электрон взаимодействует с молекулой воды с образованием
гидроксильного иона и радикала водорода:
e H 2O OH H
61.
Гидратированный электронОбразовавшийся электрон может также стабилизироваться до
относительно долгоживущего состояния, известного под названием
«гидратированный электрон» (е–aq, или e–гидр), путем структурирования
окружающих его молекул воды, являющихся, как известно, полярными
молекулами:
aq
e nH2O e
Первая гидратная оболочка гидратированного
электрона состоит из 6 молекул воды,
расположенных в вершинах октаэдра и
повернутых в сторону электрона одним из
своих атомов водорода.
Гидратированный электрон может диффундировать на значительно
более далекие расстояния, чем свободный электрон, и взаимодействует
с растворенными биологическими молекулами уже вдали от места
своего появления в результате радиолиза воды.
62.
Что такое свободные радикалы?Свободные радикалы – это нейтральные частицы
(молекулы или осколки молекул), которые содержат по
крайней мере один непарный (часто говорят –
неспаренный) электрон на внешней электронной оболочке.
Имея неспаренный электрон, такие частицы стремятся
заполнить электронную оболочку еще одним электроном,
отняв его у других молекул.
Именно поэтому свободные радикалы являются обычно
очень реакционноспособными.
63.
Радиолиз воды (2)II. Если энергия кванта ионизирующего излучения менее 12,56эВ,
но более 7 эВ, молекула воды переходит в возбужденное
состояние и распадается непосредственно с образованием двух
радикалов — радикала водорода и гидроксильного радикала:
7 эВ h 12,56 эВ
H 2 O H 2O H OH
*
64.
Вторичные продукты радиолиза воды,образовавшиеся при рекомбинации радикалов
При рекомбинации радикалов Н• и ОН• возникают
вторичные молекулярные продукты радиолиза воды —
водород Н2 и перекись водорода Н2О2.
H H H2
OH OH H 2O2
65.
Радиационно-химический выход основныхпродуктов радиолиза воды
В области рН от 3 до 10 радиационно-химический выход G (т.е.
кол-во радикалов или др. продуктов, образовавшихся на 100 эВ
поглощенной энергии ионизирующего электромагнитного
излучения) для основных продуктов радиолиза воды имеет
следующие значения:
GH 0,6
GOH 2,3
Ge- 2,3
aq
GH 2 0,45
GH 2O 2 0,75
66.
Дополнительные продукты радиолиза воды,образующиеся в присутствии кислорода
При наличии в воде растворенного кислорода O2 количество
возможных продуктов, образующихся в результате радиолиза
воды возрастает.
Так, например, могут возникать:
- супероксиданионрадикал по реакции:
aq
2
e O2 O
- перекисный радикал H―O―O• по реакции:
H O2 HO
2
67.
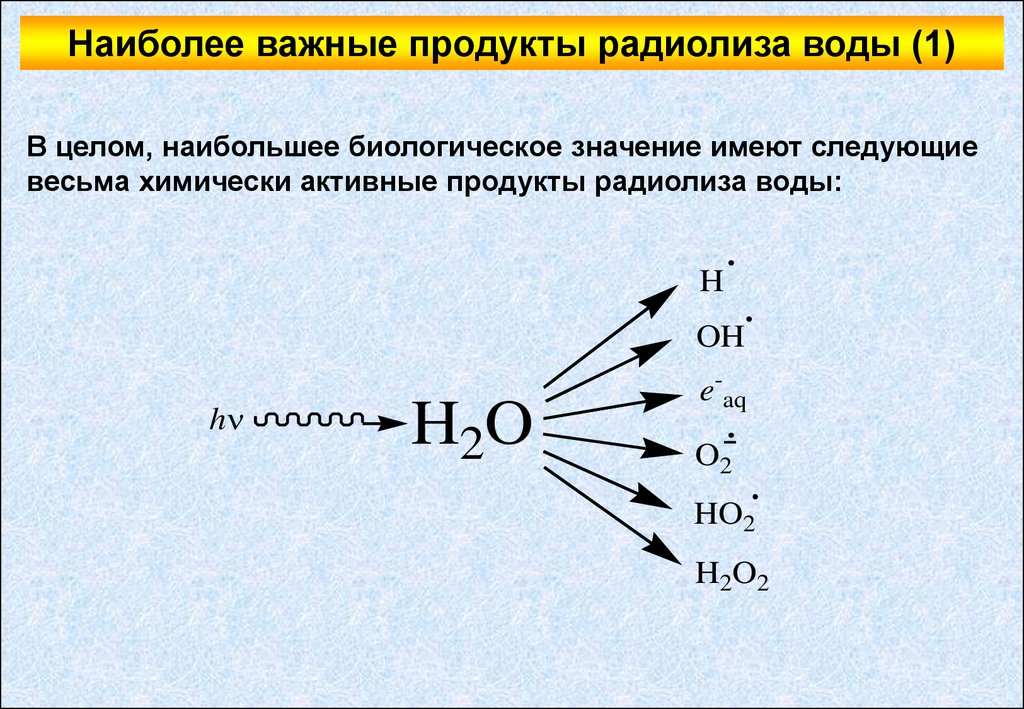
Наиболее важные продукты радиолиза воды (1)В целом, наибольшее биологическое значение имеют следующие
весьма химически активные продукты радиолиза воды:
H
OH
h
H2O
e-aq
O2
HO2
H2O2
68.
Наиболее важные продукты радиолиза воды (2)Как видно из вышеприведенной схемы, среди основных продуктов
радиолиза воды есть и радикалы (радикал водорода, гидроксильный
радикал, перекисный радикал и супероксиданионрадикал), и
нерадикальные продукты (гидратированный электрон и перекись
водорода).
Гидроксильный радикал является мощным окислителем и считается
наиболее активным продуктом радиолиза воды.
Гидратированный электрон также обладает высокой реакционной
способностью, однако, уже в качестве восстановителя.
Перекись водорода представляет собой очень неустойчивое
соединение и распадается с образованием различных радикальных
продуктов (в первую очередь, гидроксильного радикала).
В присутствии ионов Fe2+ скорость распада перекиси водорода с
образованием гидроксильного радикала (реакция Фентона)
значительно возрастает (примерно на 3 порядка):
2
3
H 2O2 Fe OH OH Fe
-
69.
Основные реакции продуктов радиолиза водыс жизненно важными молекулами
Продукты радиолиза воды могут диффундировать от места
образования к жизненно важным молекулам клетки и вызывать их
модификацию, т.е. повреждение, например, в результате следующих
реакций (МН здесь любая молекула — ДНК, РНК, белка, липида и др.):
MH + H• → M• + H2,
MH + H• → MH2•,
MH + OH• → M• + H2O,
MH + OH• → MHOH•,
MH + HO2• → MOOH + H
и многих других реакций.
70.
Последствия модификации жизненно важныхмолекул продуктами радиолиза воды
Образовавшиеся в этих реакциях свободные радикалы
биомолекул могут привести:
1) к внутримолекулярным перестройкам этих молекул (т.е. к
внутримолекулярным сшивкам),
2) к взаимодействию этих молекул с другими имеющимися
в клетке соединениями (например, с кислородом или
какими-либо другими органическими молекулами).
В результате этих изменений биомолекулы могут изменить
свои физико-химические свойства и потерять
функциональную активность.
71.
Продукты радиолиза воды не являются чем-тонеобычным для клетки!
И радикальные, и нерадикальные продукты, образующиеся при
радиолизе воды, не являются какими-либо специфическими
соединениями, возникающими только в процессе радиолиза.
Такие же продукты образуются и в различных метаболических
процессах, протекающих в клетке в норме в отсутствие облучения. В
нормальных условиях, однако, их уровень существенно ниже.
Большинство из этих радикальных продуктов имеют в своем составе
кислород и поэтому получили название активных форм кислорода
(АФК, Reactive Oxygen Species – ROS).
Повышенный уровень АФК может наблюдаться и при многих других
патологических состояниях, а не только при облучении.
72.
Важность антиоксидантных системДля предотвращения избыточного накопления АФК и
интенсификации деструктивных окислительных процессов в
организме имеется сложный комплекс защитных антиоксидантных
(антиокислительных) систем ферментативной и
неферментативной природы, которые могут предотвращать
образование АФК или осуществлять детоксикацию АФК.
В связи с тем, что гидроксильный радикал OH• является наиболее
сильной АФК, действие антиокислительных защитных систем
фактически направлено (либо непосредственно, либо косвенно)
на предотвращение его образование или на его удаление.
В свете вышесказанного понятна исключительно важная роль
эндогенных антиоксидантных систем как в нормальном
клеточном метаболизме, так и при различных патологиях,
сопровождающихся накоплением АФК.
73.
Три уровня эндогенной защиты клетки в условияхрадиационного воздействия
В клетках можно выделить 3 уровня эндогенных защитных ресурсов,
предназначенных для обеспечения сохранности нативного состояния
клеток в организме в условиях радиационного воздействия:
• 1-й уровень защиты – антиоксидантные системы и факторы,
обеспечивающие инактивацию активных форм кислорода (АФК), а
также других продуктов радиолиза воды и радикалов и
предотвращающие их деструктивное действие на жизненно важные
молекулы и структуры клетки;
• 2-й уровень защиты – системы репарации молекул ДНК,
осуществляющие репарацию (восстановление) поврежденных
молекул ДНК;
• 3-й уровень защиты – системы клеточного апоптоза,
обеспечивающие удаление из популяции клеток, в которых не
удалось осуществить репарацию поврежденных молекул ДНК.
74.
Антиоксидантные системыНизкомолекулярные
антиоксиданты
Ферментативные (белковые)
антиоксидантные системы
Водорастворимые (восст.
глутатион, аскорбат и др.)
Супероксиддисмутаза,
церулоплазмин (удаление
супероксиданион-радикала O2•–)
Липорастворимые (αтокоферол, билирубин, βкаротин и др.)
Каталаза, глутатионпероксидазная
система (удаление H2O2 и
органических гидроперекисей)
Ферритин (связывает ионы Fe2+),
церулоплазмин (окисляет Fe2+ в Fe3+),
трансферрин (связывает ионы Fe3+)
Гемоксигеназа (множественное
антиоксидантное действие
75.
Общая схема взаимных превращений АФК76.
Низкомолекулярные антиоксидантыОдним из механизмов антиокислительного действия
низкомолекулярных антиоксидантов является перехват
активных свободных радикалов с образованием
малоактивного радикала антиоксиданта:
R• + InH → RH + In
где R• – любой активный свободный радикал (H•, OH•, HO2•, L•,
LO•, LOO• и др.),
InH – антиоксидант (в восстановленной форме),
In• – радикал антиоксиданта (малоактивный).
77.
Полиморфизм супероксиддисмутазыСОД представляет собой первую линию ферментативной защиты клетки
от АФК
СОД
Mn-СОД
(в матриксе
митохондрий)
Cu,Zn-СОД
(в межмембранном
пространстве
митохондрий и
цитоплазме)
EC-СОД
(внеклеточная СОД, также
содержит в своем
составе Cu и Zn)
Суммарная реакция, осуществляемая СОД:
2O2•‾ + 2H+ → O2 + H2O2
78.
ЦерулоплазминОсновные функции
церулоплазмина
Транспорт и запасание меди в
организме
Окисление железа:
4Fe2+ + 4H+ + O2 → 4Fe3+ + 2H2O
Разложение супероксиданионрадикала с
образованием воды:
4O2•‾ + 4H+ + O2 → 4O2 + 2H2O
Эффективность церулоплазмина в отношении супероксиданионрадикала в 100 раз ниже чем у СОД. Однако концентрация
церулоплазмина в плазме крови значительно превышает конц-ию СОД и
поэтому церулоплазмин рассматривают в качестве основного
антиоксидантного белка в плазме крови.
79.
КаталазаКатализирует превращение перекиси водорода в воду:
Catalase
2H 2O 2 2H 2O O 2
В клетках каталаза локализована, главным образом, в пероксисомах (до
80%), а также в цитозоле.
80.
Глутатионпероксидаза (GPx)Глутатионпероксидаза является одним из важнейших антиоксидантных
ферментов, т.к. осуществляет детоксикацию не только перекиси
водорода (до воды), но и органических перекисей (до соответствующих
спиртов) без образования радикальных продуктов.
Считают, что глутатионпероксидаза играет более важную роль в
удалении перекиси водорода, чем каталаза, т.к.:
• глутатионпероксидаза локализована в тех же внутриклеточных
компартментах (митохондриях и цитозоле), что и СОД – основной
производитель перекиси водорода в клетке;
• по сравнению с каталазой глутатионпероксидаза характеризуется
более низкими значениями KM (константы Михаэлиса) в отношении
перекиси водорода, т.е. действует в отношении низких концентраций
перекиси водорода гораздо более эффективно, чем каталаза.
Глутатионпероксидаза осуществляет детоксикацию H2O2 и органических
перекисей действуя совместно с восстановленным глутатионом (GSH),
глутатионредуктазой (GRed) и восстановленным НАДФ, образуя т.н.
глутатионпероксидазную систему.
81.
Глутатиопероксидазная системаROOH
H2O2
ROH
H2O
GPx
GSH
Glutathione
redox cycle
GSSG
Глутатионпероксидаза (GPx) осуществляет
детоксикацию перекиси водорода H2O2 (до H2O) и
органической гидроперекиси ROOH (до
соответствующего спирта ROH) с сопутствующим
окислением 2 молекул восстановленного глутатиона
(GSH) и образованием окисленного глутатиона,
который представляет собой дисульфид (GSSG).
GSSG быстро восстанавливается до GSH под
действием глутатионредуктазы (GRed), использующей
НАДФН (NADPH) в качестве донора электрона.
ROOH + 2GSH
GPx
ROH + GSSG + H2O
H2O2 + 2GSH
GPx
GSSG + 2H2O
GRed
2GSH + 2NADP+
GRed
NADP+
NADPH
GSSG + 2NADPH
В условиях сильного окислительного стресса GRed не успевает восстанавливать
большие количества образовавшегося окисленного глутатиона GSSG, что
приводит к нарушению баланса GSH/GSSG, накоплению АФК и окислительным
повреждениям в клетке.
82.
Полиморфизм глутатиопероксидазыСелен-содержащие
GPx
Неселеновые GPx
(глутатион-S-трансферазы [GSTs])
Цитозольная (клеточная)
GPx (cGPx или GPx-1)
Желудочно-кишечная GPx
(giGPx или GPx-2)
Внеклеточная (плазматическая)
GPx (pGPx или GPx-3)
GPx гидроперекисей
фосфолипидов (PhGPx или GPx-4)
83.
Глутатиопероксидаза гидроперекисейфосфолипидов (PhGPx)
PhGPx (в отличие от других форм) способна восстанавливать
гидроперекиси жирных кислот фосфолипидов до соответствующих
спиртов без предварительного отщепления жирной кислоты от
фосфолипида фосфолипазой, т.е. прямо в мембране. Это
исключительно важно для осуществления антиоксидантной защиты
митохондриальных мембран.
Сравнение субстратной специфичности cGPx и PhGPx:
PhGPx оказалась также способна восстанавливать гидроперекиси
тимина, которые образуются при действии АФК на тиминовые остатки
ДНК (константа скорости для PhGPx на 4 порядка выше, чем для cGPx).
84.
Восстановленный глутатион – важнейшийкомпонент антиоксидантной защиты
glutamyl
cysteinyl
glycine
В глутатионпероксидазной системе вторым по
важности компонентом после
глутатионпероксидазы является
восстановленный глутатион GSH.
Reduced
glutathione
(GSH)
Oxidized
glutathione
(GSSG)
GSH представляет собой трипептид γглутамилцистеинилглицин (т.е. состоит из 3-х
аминокислотных остатков), в котором, однако
аминогруппа (—NH2) цистеина соединена с
глутаматом через карбоксильную группу (—
СООН) боковой цепи глутамата, а не через αкарбоксильную группу как должно быть при
обычной пептидной связи.
GSH играет исключительно важную роль в клетке,
осуществляя различные защитные и
регуляторные функции.
85.
Основные функции глутатиона в клеткеРедокс-регуляция
активности тиол- или
дисульфид-содержащих
низкомолекулярных
регуляторных белков
Антиоксидантная
защита
Неферментативная
антиоксидантная
защита
Перехват
свободных
радикалов
Участие в детоксикации
ксенобиотиков,
осуществляемой
глутатион-S-трансферазой
Ферментативная
антиоксидантная
защита
Детоксикация перекиси водорода H2O2 и
органических гидроперекисей ROOH
глутатионпероксидазной системой
86.
Восстановленный глутатион – важнейшийнебелковый тиол в клетке
Внутриклеточные концентрации восстановленного глутатиона (GSH) являются
весьма высокими и варьируют от 1 до 10 мМ в разных тканях.
Восстановленый глутатион – это основной небелковый тиол в клетке. Его доля
составляет 75-90% от общего содержания небелковых тиолов в клетке.
Среди других небелковых тиолов наибольшие концентрации имеют цистеин и
коэнзим А.
Большая часть внутриклеточного глутатиона представлена восстановленным
глутатионом (ориентировочно 95%).
GSSG
5%
Other NPSH
10-25%
GSH
75-90%
GSH
95%
87.
ГемоксигеназаГемоксигеназа – это фермент, который окисляет гем (тип b).
При этом образуется 3 продукта: биливердин, моноокись углерода CO и Fe2+.
CO
O2
Fe2+
Heme
oxygenase
Heme
(type b)
NADPH
M = methyl (-CH3), V = vinyl (-CH=CH2),
P = propionic acid (-CH2-CH2-COOH)
NADP+
Side chains of pyrrole rings
in type b heme
Biliverdin
88.
Полиморфизм гемоксигеназы89.
Почему гемоксигеназу относят к антиоксидантнымферментам?
Для ответа на этот вопрос рассмотрим подробнее
исходный субстрат (гем) и образующиеся продукты
(биливердин и Fe2+).
90.
Гем и его основные функции в организмеГем является составной частью – т.н. простетической группой многих жизненно
важных белков, в том числе ферментов.
ПРОСТЕТИЧЕСКАЯ ГРУППА (от греч. prosthetikos - прибавляющий) – это
небелковая часть молекул сложных белков, в т.ч. ферментов.
ГЕМОПРОТЕИНЫ (т.е. белки, в состав которых входит гем) выполняют в
организме множество исключительно важных функций, таких как:
• связывание и перенос кислорода (гемоглобин, миоглобин);
• клеточное дыхание и перенос электронов (цитохромы a, b, c);
• биотрансформация ксенобиотиков и стероидов (цитохром P-450);
• инактивация перекиси водорода и органических гидроперекией (каталаза и
глутатионпероксидаза);
• окисление различных субстратов, опосредованное перекисью водорода
(миелопероксидаза, лактопероксидаза и др. пероксидазы);
• синтез простагландинов (циклооксигеназа);
• сигнальная трансдукция (гуанилатциклаза, синтаза оксида азота)
• и другие функции.
У позвоночных встречается несколько типов гема, различающихся боковыми цепями пиррольных
колец. Гем типа b наиболее распространен и является простетической группой всех
гемопротеинов за исключением цитохромов c и a, в состав которых входит гем типа c и гем типа a,
соответственно.
91.
Свободный гем – сильный прооксидантВремя жизни молекул белков (в том числе и гемопротеинов) в организме
очень небольшой и они в конце концов распадаются в результате
протеолиза.
Высвобождающийся при распаде гемопротеинов гем также подвергается
дальнейшей утилизации. Единственный физиологически значимый путь
утилизации свободного гема в организме – это его окисление
гемоксигеназой.
Свободный гем имеет в своем составе ион Fe и поэтому является как и
свободный ион Fe мощным прооксидантом, вызывая распад
органических гидроперекисей ROOH с образованием радикалов RO• и
ROO• и распад перекиси водорода H2O2 с образованием гидроксильного
радикала OH• (по реакции Фентона):
H2O2 + гем(Fe2+) OH- + OH• + гем(Fe3+).
Благодаря своим гидрофобным свойствам и, соответственно хорошей
растворимости в липидах, свободный гем является эффективным
промотором перекисного окисления липидов, которое очень вредно для
липидного слоя биомембран и клетки в целом.
92.
Биливердин превращается в билирубинБИЛИФЕРДИН – основной продукт окисления гема гемоксигеназой – быстро
восстанавливается под действием фермента БИЛИВЕРДИНРЕДУКТАЗА в
БИЛИРУБИН.
БИЛИРУБИН, как оказалось, является сильным перехватчиком кислородсодержащих свободных радикалов, сравнимым по эффективности с известным
мощным антиоксидантом α–токоферолом (витамином E). Под действием этих
радикалов билирубин окисляется в биливердин.
Biliverdin
reductase
NADPH
NADP+
Biliverdin
Bilirubin
Oxygen free radicals
(OFR)
Conjugation
Excretion
93.
Гемоксигеназа – антиоксидантный ферментТаким образом, гемоксигеназа участвует в превращении гема (сильного
прооксиданта) в билирубин (сильный антиоксидант).
Именно поэтому гемоксигеназу рассматривают как антиоксидантный фермент.
Высвобождающееся железо (в форме Fe2+) при окислении свободного гема
гемоксигеназой, конечно, является прооксидантом. Однако, под действием
избыточных количеств ионов Fe2+ в клетке быстро индуцируется железозапасающий белок ФЕРРИТИН, который связывает свободные ионы Fe2+ и
окисляет их до Fe3+. Каждая молекула ферритина связывает до 4500 ионов
железа!!!
Ферритин представляет собой глобулярный белок,
состоящий из 24 субъединиц (2-х типов),
образующих полую сферическую оболочку, внутри
которой запасается железо.
Поскольку ферритин удаляет из цитозоля клетки
избыточные количества двухвалентного железа
Fe2+ (являющегося сильным прооксидантом), он
также рассматривается как антиоксидантный
белок.
94.
Внутриклеточная локализация основныхантиоксидантных ферментов
Catalase
Mitochondrion
Matrix:
• Mn-SOD
Extracellular fluids
and interstitium:
Intermembrane
space:
• PhGPx (long form)
• Cu,Zn-SOD
ECSOD
Cytosol
• cGPx
• PhGPx (short form)
• non-Se GPx
• Cu,Zn-SOD
Heme oxygenase



























































































 biology
biology physics
physics








