Similar presentations:
Иммунитет в защите и повреждении организма. (Лекция 6)
1. ИММУНИТЕТ В ЗАЩИТЕ И ПОВРЕЖДЕНИИ ОРГАНИЗМА
Лекция 6Лечебный факультет 3 курс
Доцент Чудилова Г.А.
2. Часть1 Противоинфекционный иммунитет
3. Противоинфекционныи иммунитет
ПРОТИВОИНФЕКЦИОННЫИ ИММУНИТЕТ– первая область приложения иммунологических
принципов
Особенности иммунного ответа определяются:
1. путями поступления и распространения инфекционных
агентов
2. локализацией инфекционных агентов вне- или внутри
клеток
3. особенностями патогенов микроорганизмов
4. модификацией активности иммунной системы
компонентами патогенов.
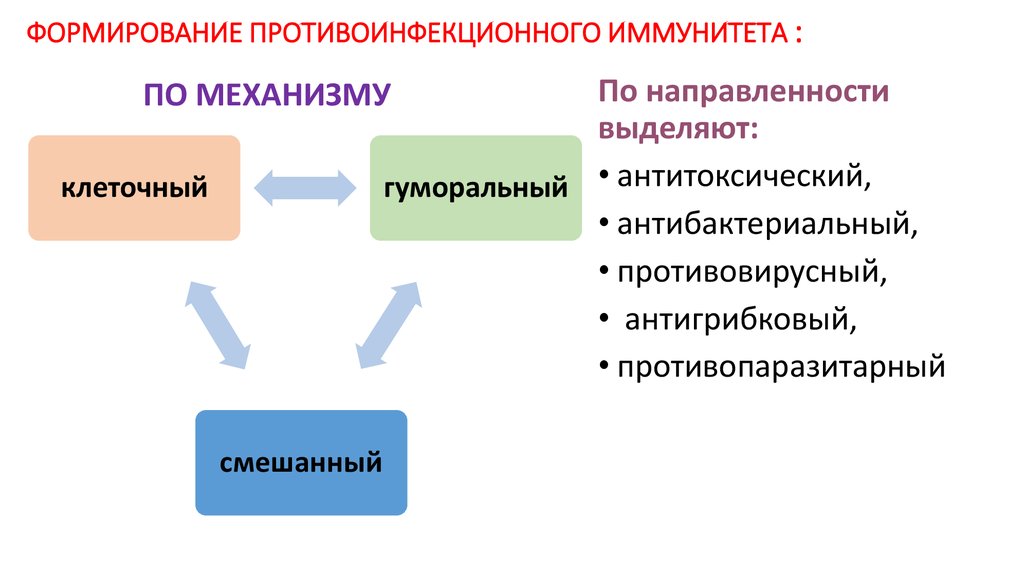
4. ФОРМИРОВАНИЕ ПРОТИВОИНФЕКЦИОННОГО ИММУНИТЕТА :
По направленностивыделяют:
гуморальный • антитоксический,
• антибактериальный,
• противовирусный,
• антигрибковый,
• противопаразитарный
ПО МЕХАНИЗМУ
клеточный
смешанный
5. Пути поступления и распространения инфекционных агентов
ПУТИ ПОСТУПЛЕНИЯ И РАСПРОСТРАНЕНИЯ ИНФЕКЦИОННЫХАГЕНТОВ
определяют:
• первичную локализацию иммунного процесса
• преобладающие механизмы иммунного ответа
Первая линия обороны-иммунная система слизистых
( дыхательной, пищеварительной и мочеполовой систем).
Проникновение патогена в субэпителиальное пространство
возможно:
• при адгезии патогена на клетках эпителия.
• через поврежденные барьеры, дефекты эпителия.
«первичный очаг» инфекции- место проникновения.
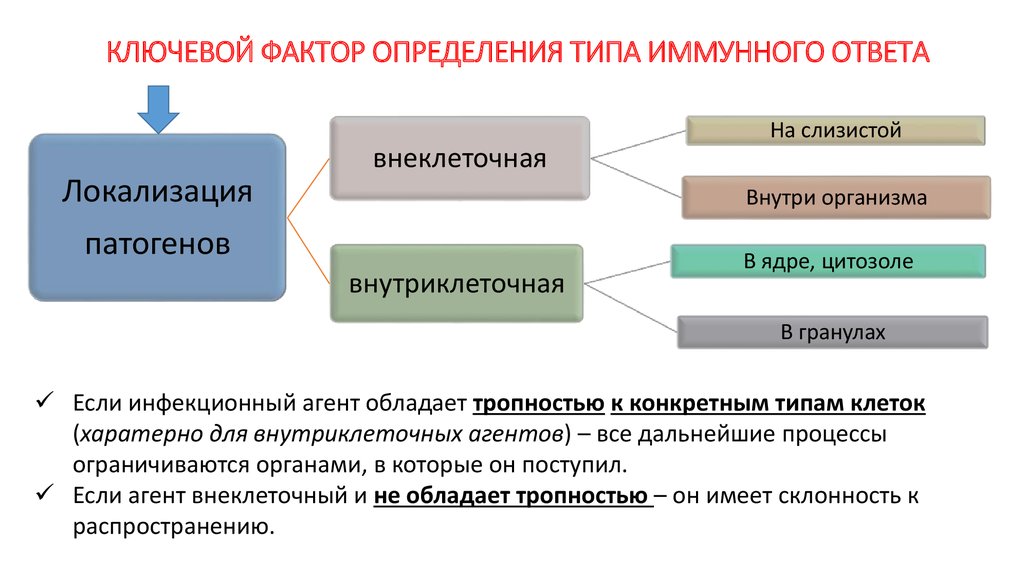
6. КЛЮЧЕВОЙ ФАКТОР ОПРЕДЕЛЕНИЯ ТИПА ИММУННОГО ОТВЕТА
На слизистойвнеклеточная
Локализация
Внутри организма
патогенов
внутриклеточная
В ядре, цитозоле
В гранулах
Если инфекционный агент обладает тропностью к конкретным типам клеток
(харатерно для внутриклеточных агентов) – все дальнейшие процессы
ограничиваются органами, в которые он поступил.
Если агент внеклеточный и не обладает тропностью – он имеет склонность к
распространению.
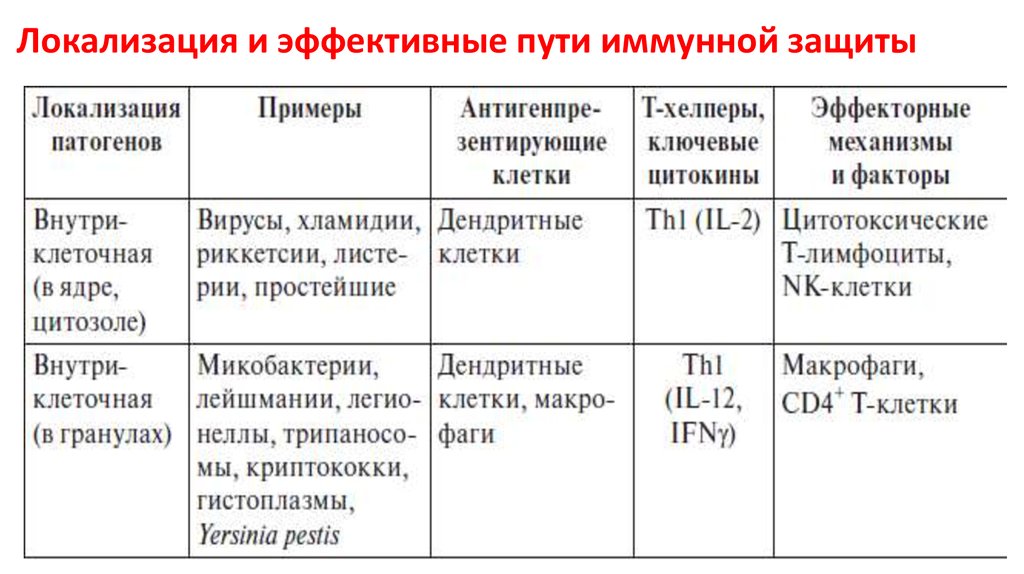
7. Локализация и эффективные пути иммунной защиты
8. Локализация и эффективные пути иммунной защиты
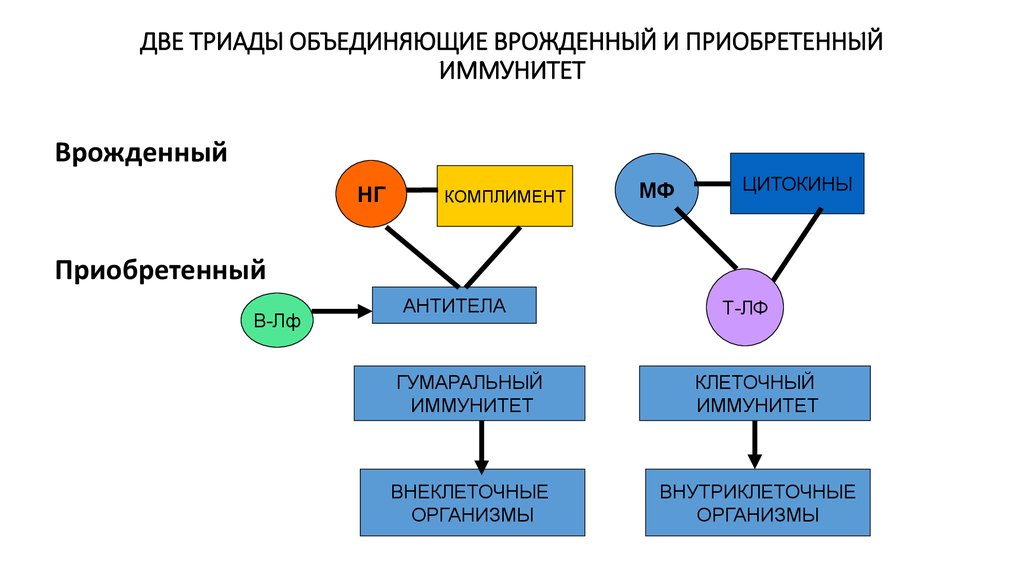
9. ДВЕ ТРИАДЫ ОБЪЕДИНЯЮЩИЕ ВРОЖДЕННЫЙ И ПРИОБРЕТЕННЫЙ ИММУНИТЕТ
ВрожденныйНГ
КОМПЛИМЕНТ
МФ
ЦИТОКИНЫ
Приобретенный
В-Лф
АНТИТЕЛА
Т-ЛФ
ГУМАРАЛЬНЫЙ
ИММУНИТЕТ
КЛЕТОЧНЫЙ
ИММУНИТЕТ
ВНЕКЛЕТОЧНЫЕ
ОРГАНИЗМЫ
ВНУТРИКЛЕТОЧНЫЕ
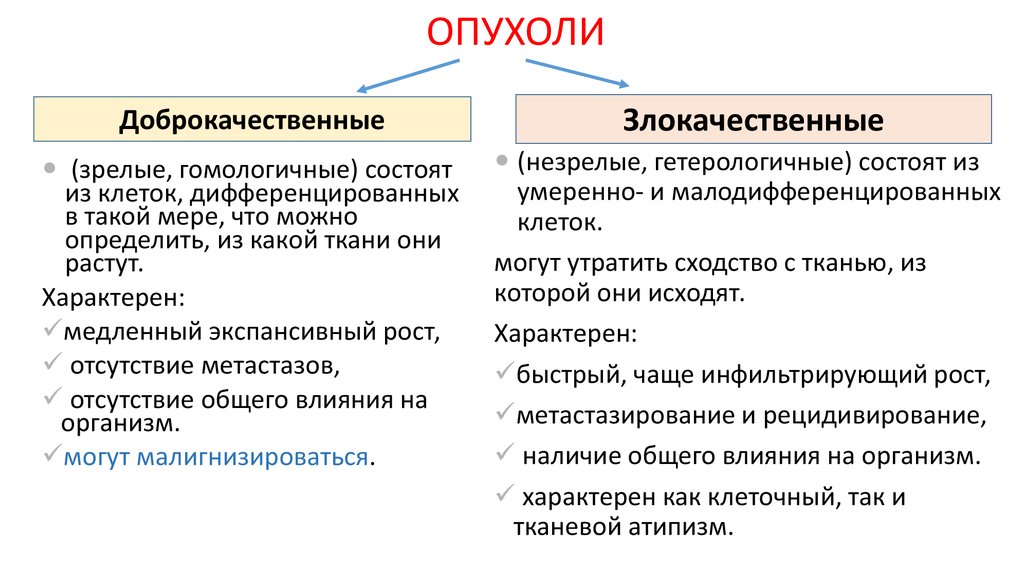
ОРГАНИЗМЫ
10. ВРОЖДЕННЫЙ ИММУНИТЕТ ПРИ ВНЕКЛЕТОЧНЫХ ИНФЕКЦИЯХ
Фагоциты (НГ, МФ), комплемент, БОВ , местная воспалительнаяреакция, в меньшей степени NK-клетки.
Фагоциты
в начале этапа их эффективность невелика:
• число клеток в месте внедрения недостаточно, они не активированы, их возможности
в отношении распознавания и разрушения микробов ограничены,
• при наличии в организме естественных АТ к м/о, эффективность фагоцитоза
значительно повышается.
Комплемент.
Активируется по альтернативному пути:
• на поверхности микробных клеток отсутствуют DAF (мембранный белок (Decay–Accelerating Factor —
фактор), ускоряющий деградацию –ингибитор комплемента), пропердин стабилизирует образующиеся
комплексы СЗb—Вb.
• Повышение количества фиксированных на поверхности микробной клетки
фрагментов СЗb способствует распознаванию их фагоцитами.
11. Индукция воспалительного ответа.
дегрануляция тучных клеток, выделение хемотаксических , провоспалительныхфакторов
активация НГ,МФ факторами инфекционных агентов,
активация эндотелиальных клеток продуктами МФ, повышение проницаемости
сосудов LTB4 и гистамином, экспрессия молекул адгезии и синтез цитокинов,
,миграция в очаг поражения большого числа - НГ,МОН, NK, а затем и ЛФ
активация мигрировавших клеток и выделение ИФН -1 и ИЛ-6, ФНО и хемокинов
усиление синтеза гепатоцитами БОФ(СРБ, амилоида, МБЛ, др.),
активация комплемента по классическому и лектиновому пути
12. РАННИЙ ОТВЕТ ПРИ ВНЕКЛЕТОЧНЫХ ИНФЕКЦИЯХ
Осуществляются в первые 4 суток, локально.участники: Ig, вырабатываемые B1-лф(CD5+), тимуснезависимые В-л и +Тл.
• на общие РАМР разных бактерий вырабатываются низкоафинные АТ- Ig классов A, M,
G2 ( В-л, без помощи Т-л).
• Тимуснезависимый ответ В-л осуществляется в региональных ЛУ и групповых
лимфатических фолликулах.
из-за неучастия Т-клеток:
• отсутствует переключение изотипов
• низкий аффинитет АТ ограничивает их защитную активность
• отсутствует формирование иммунологической памяти.
• IgA блокирует прикрепление бактерий к эпителиальным клеткам, но не способны
активировать комплемент.
• +-Т-клетки в слизистых распознают ограниченный круг АГ (стрессорные белки
микобактерий , пораженных клеток хозяина), путем связывания рецептором TCR без участия
АПК. Механизм действия +-клеток состоит в цитолизе инфицированных клеток
13. ФОРМИРОВАНИЕ ПОЛНОЦЕННОГО АДАПТИВНОГО ИММУННОГО ОТВЕТА ПРИ ВНЕКЛЕТОЧНЫХ ИНФЕКЦИЯХ.
Первый этап: Гуморальныйиммунный ответ (не менее 4 дней).
Перемещение клеток между первичным
инфекционным очагом и региональным
лимфоидным органом.
• В слизистых оболочках АПК – ДК, В-л,( не
классические ТК) поэтому выбор ИО
«решается» в пользу гуморального Th2зaвисимого.
• образуются IgG1 и IgG3-АТв региональных
ЛУ и особенно в селезенке,
опсонизируя клетки-мишени Ig вызывают
активацию NK-клеток и МФ, комплемента,
нейтрализацию экзотоксинов.
Направленность действия АТ:
• блокируют прикрепление бактерийсвязывая компоненты фимбрий и капсул,
липотейхоевые кислоты
• инициируют комплемент
зависимые реакции . АТ против
липопротеинов капсул грам(-)
бактерий и приводят к нарушению их
целостности.
• подавляют размножениеблокируют рецепторы для
поглощения питательных веществ.
• восстанавливают фагоцитоз
связывая бактериальные
иммунорепелленты.
• препятствуют повреждению тканей.
АТ против токсинов и гиалуронидазы
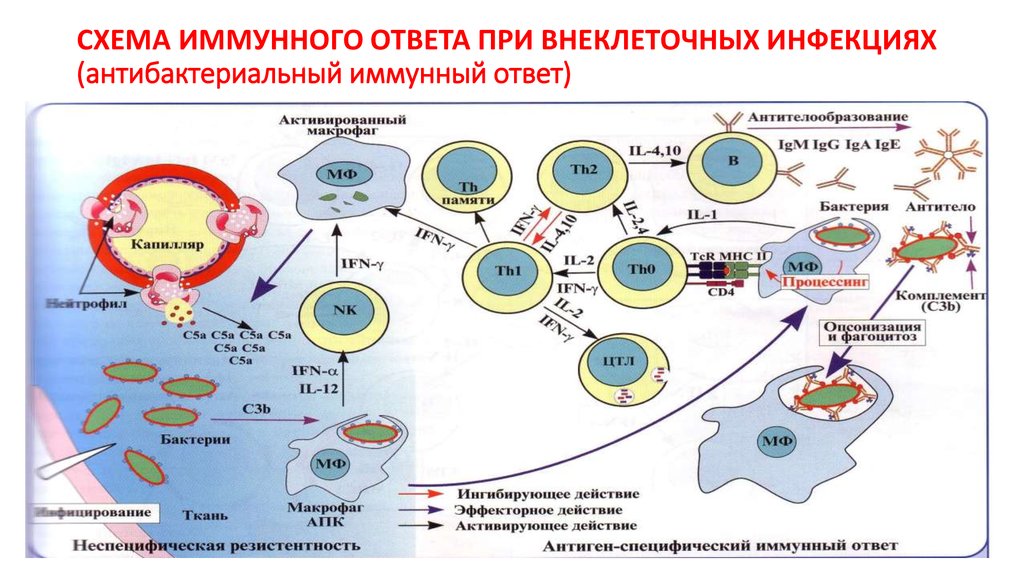
14. СХЕМА ИММУННОГО ОТВЕТА ПРИ ВНЕКЛЕТОЧНЫХ ИНФЕКЦИЯХ (антибактериальный иммунный ответ)
15. Второй этап: Th1-зависимый клеточный ответ.
При внеклеточной инфекции – макрофагальный.• на 8-9 сутки в процесс вовлекаются TCR-Т-лф при контакте с АПК в региональных
ЛУ.
• Th1- выделяют ИФН- , который, активируя МФ, в очаге поражения, способствует
уничтожению фагоцитированных и цитолизу инфицированных клеток.
• патоген первоначально перемещается лимфогенным путем.
Регионарный ЛУ- место формирования первичного (регионального) ИО и барьер
на пути распространения инфекции.
Преодоление этого барьера приводит:
• к гематогенному распространению инфекции, септицемии и генерализации
распространения микроорганизма,
• формированию вторичных очагов в тканях,
• расселению активированных иммунных клеток по организму, системной
активации лимфоидной ткани, вовлечению в ИО селезенки и других лимфоидных
образований;
• иногда к ареактивности вследствие интоксикации и избытка АГ.
16. Особенности патогенов микроорганизмов.
ОСОБЕННОСТИ ПАТОГЕНОВ МИКРООРГАНИЗМОВ.Патогенные свойства м/о во многом
зависят от типа оболочки.
бактерии можно поделить на:
• Грамположительные
• Грамотрицательные
• Микобактерии
• Спирохеты
• В клеточной стенке бактерий
присутствует пептидогликановый слой
• у грам(-) бактерий он дополнительно
покрыт внешним слоем, содержащим
липополисахариды.
Поверхностные молекулы патогенов – выступают в роли «образов
патогенности» - РАМР и распознаются ТLR рецепторами
17. ЭНДОТОКСИНЫ ЛИПОПОЛИСАХАРИДНОЙ ПРИРОДЫ ГРАМ(-):
• активируют комплемент, к которому у грам(-) бактерий нет резистентности.• вызывают образование фибрина, что нарушает подвижность бактерий.
• распознают CD14, экспрессируемые НГ, ДК, МФ и В-л.
При этом увеличивается:
• эффективность презентации АГ, активируется кооперация Т- и В-л.
• продукция провоспалительных – ИЛ-1, ФНО- , ИЛ-6, хемокинов
• В малых дозах липопротеин работает как ко-стимулятор - адъювант и полезен для
раннего ответа
Высокая его концентрация может привести к поликлональной стимуляции.
Иммунный ответ при этом:
• «распыляется» на синтез АТ разнообразной специфичности (поликлональная
стимуляция конкурирует с клоноспецифическим ответом),
• чреват опасностью развития аутоиммунного процесса.
• поликлональная стимуляция – важный фактор антимикробной защиты, поскольку
проявляется в первые 4 суток (до того, как сформируется полноценный адаптивный
ответ).
18. ПЕПТИДОГЛИКАНЫ БАКТЕРИАЛЬНОЙ СТЕНКИ - МУРАМИЛДИПЕПТИДЫ (ГРАМ +).
• Активно влияют на МФ: индуцируют выработку провоспалительных ИЛ иповышают их бактерицидную активность. Активированные МФ
стимулируют иммунные реакции, реализуемые Т-, В- и NK-клетками,
возможно прямое действие на Т-л.
• Пептидогликаны слабо активируют комплемент.
• Мурамилдипептиды лишены токсического компонента, препараты на
их основе используют в клинической практике в качестве
имунномодуляторов (Ликопид,гликопин).
• Полисахариды с повторяющимися эпитопами- являются
тимуснезависимыми АГ( например, оболочки пневмококков). Однако
некоторые бактериальные полисахариды способны индуцировать
анергию В-л.
• Гликолипиды оболочки микобактерий обладают адьювантным
эффектом, стимулируют фагоцитоз.
19. Пути защиты микроорганизмов от иммунного ответа
ПУТИ ЗАЩИТЫ МИКРООРГАНИЗМОВ ОТ ИММУННОГО ОТВЕТА1.Вариабельность.
• За счет мутаций внутри вида возникают различные серологические варианты (типы и
субтипы). При инфицировании формируется иммунитет только к линии возбудителя, но
не ко всем его разновидностям. Характерна для стрептококка, м/о кишечной группы.
• Если специфичность АГ изменяется в инфицированном организме – происходит
обострение заболевания после временного ослабления симптоматики.
2.Способность избегать разрушающего действия комплемента
Особенности капсулы грам(+) бактерии.
С3b связывается в отдалении от чувствительной к комплементу оболочки.
E.Coli, Salmonella, Pseudomonas способны «сбрасывать» комплекс С5b-С9,
Конфигурация наружной поверхности препятствует контакту фагоцита с С3b.
Бактерии выделяют «белки-ловушки», связывающие комплемент.
20.
3.Компоненты микроорганизмов влияют на фагоцитоз.• подавляют хемотаксис (репелленты)
• препятствуют связыванию с фагоцитом ( гиалуроновая кислота грам(+), белки шипов
нейссерий, фимбрий стрептококков)
• препятствуют слиянию фагосом с лизосомами, могут размножаться внутриклеточно,
блокируют способность фагоцита активироваться ИФН (Микобактерии)
• способны инактивировать свободные радикалы (Мycobacterium leprae).
4.Белки бактерий могут связывать иммуноглобулины.
• Белок-А клеточной стенки Staphylococcus aureus связываясь с Fc-фрагментом к IgG,
препятствует взаимодействию IgG с эффекторными клетками.
5.Экзотоксины (суперантигены ) вызвают поликлональную
гиперактивацию Т-л, а затем их массовую гибель.
СРЕДИ ФАКТОРОВ, ПОЗВОЛЯЮЩИХ М/О ИЗБЕЖАТЬ ЗАЩИТНЫХ МЕХАНИЗМОВ,
ВЕЩЕСТВА, ИЗМЕНЯЮЩИЕ НАПРАВЛЕНИЕ ИО, И СОВСЕМ НЕМНОГО ЧИСТЫХ
ИММУНОСУПРЕССАНТОВ.
21. ИММУННЫЙ ОТВЕТ ПРИ ВНУТРИКЛЕТОЧНОЙ ИНФЕКЦИИ
Вирусы – облигатные внутриклеточные паразиты,использующие для воспроизводства ресурсы клетки хозяина.
Вирусы прикрепляются к клеткам, связываясь со
специфическими рецепторами, что определяет тропизм
вируса к определенным тканям.
Пути проникновения вирусов в клетки.
Вирус
Рецептор
Клетка-мишень
ВИЧ
Вирус Эпштейна-Барр
CD4
CR2 (рецептор для комплемента)
Т-хелпер, МФ
В-клетки
Вирус гриппа А-типа
Гликофорин А
Многие типы клеток
Риновирус
ICAM-1
Многие типы клеток
Вирус полиомиелита
Рецептор вируса полиомиелита?
Нейроны
22. ВРОЖДЕННЫЙ ИММУНИТЕТ ПРИ ВНУТРИКЛЕТОЧНЫХ ИНФЕКЦИЯХ
Первые часы после внедрения (внеклеточная фаза) защиту обеспечиваютфагоциты и NK-клетки.
• Их мало , эффективность невелика, повышается при наличии в организме естественных
АТ к вирусам.
• Некоторые вирусы могут активировать комплемент, но он не играет роли в
противовирусной защите.
Клетки, инфицированные вирусом, синтезируют ИФН и ИФН
Интерфероны делают соседние клетки устойчивыми к вирусу:
• активируя протеинкиназу, которая блокирует синтез вирусного белка,
• активируя эндонуклеазу, которая способна разрушить вирусную РНК.
Через 2-е суток появляются активные NK-клетки.
При герпесвирусной (в частности цитамегаловирусной) инфекции это главный
эффекторный механизм, так указанные вирусы подавляют экспрессию MHC-1.
23. Индукция воспалительного ответа.
• На 2-4 сутки, запускается воспалительный ответ.При этом происходит:
• активация эндотелиальных клеток продуктами МФ,
• повышение проницаемости сосудов,
• экспрессия молекул адгезии и синтез цитокинов,
• миграция в очаг поражения большого числа — НГ, МОН, а затем и ЛФ,
• активация мигрировавших клеток и выделение ИЛ-1 и ИЛ-6, ФНОα,
хемокинов.
• усиление синтеза гепатоцитами БОФ(С-реактивного белка, сывороточного
амилоида, маннозосвязывающего белка),
• выработка инфицированными клетками ИФН и ͢ =>
активация NK-клеток.
24. АДАПТИВНЫЙ ИММУННЫЙ ОТВЕТ ПРИ ВНУТРИКЛЕТОЧНЫХ ИНФЕКЦИЯХ Th1- ЗАВИСИМЫЙ КЛЕТОЧНЫЙ
Начинает формироваться в первые дни, пик достигается через 3-4 недели.• протекает с преобладанием цитотоксического варианта:
Th1 синтезируют ИЛ-2,ИФН- активируя CD8+ -клетки (ТЦЛ).
• CD8+Т-лф покидают ЛУ и мигрируют в воспаленные участки.
• В очаге Т-киллеры убивают инфицированные клетки, несущие на своей
поверхности вирусные АГ, ассоциированные с MHC-1.
• Th1-клетки выделяют ИФН- , который:
• активирует NK-клеток и МФ, для цитолиза инфицированных клеток
уничтожения фагоцитированных клеток (основной механизм защиты от
ВПГ1-типа),
• препятствует инфицированию клеток,
• ингибирует размножение вируса в клетке,
• усиливает экспрессию MHC-1 и MHC-2 типа.
25. Противовирусный иммунитет
26. ГУМОРАЛЬНЫЙ АДАПТИВНЫЙ ИММУННЫЙ ОТВЕТ ПРИ ВНУТРИКЛЕТОЧНЫХ ИНФЕКЦИЯХ
• АТ при вирусной инфекции вырабатываются на белки и гликопротеиныоболочки (тимусзависимые АГ).
• развивается медленно, но вследствие участия Тh обеспечивается:
• высокий аффинитет АТ (за счет усиления мутагенеза),
• формирование иммунологической памяти.
Функции специфических АТ при вирусной инфекции:
главное препятствие внеклеточного распространения вируса,
участие в реакциях антителозависимой цитотоксичности (АЗКЦ) против
инфицированных клеток,
активации комплемента для разрушения инфицированных клеток.
27. Стратегия обхода вирусами иммунологического контроля
СТРАТЕГИЯ ОБХОДА ВИРУСАМИ ИММУНОЛОГИЧЕСКОГОКОНТРОЛЯ
1.Вариабельность - делает невозможным формирование защитного
иммунитета и очень затрудняет вакцинопрофилактику.
Типы вариабельности:
• Антигенный дрейф (drift). Вследствие серии точечных мутаций накапливаются
изменения специфичности АГ. Сформировавшийся протективный механизм
срабатывает лишь частично.
• Антигенный сдвиг (shift) – следствие обмена генетическим материалом между
разными линиями. Изменения специфичности АГ происходят скачкообразно.
Сформировавшийся иммунитет не распространяется на измененные варианты.
Пример: Вариабельность гемагглютинина вируса гриппа А
Время, требующееся для изменения типа АГ у вирусов гриппа:
• для гемагглютинина — от одной эпидемии к следующей,
• для нейраминидазы — через 2—3 эпидемии;
• При этом спустя некоторое время (десятки лет, 3—5 эпидемий) наблюдается
возвращение ранее уже зарегистрированного серотипа гемагглютинина.
28. 2.Модификация вирусами активности иммунной системы
а)Блокада активации комплемента, связывание АТ.Гликопротеин ЦМВ,ВПГ, связывает Fc-фрагмент IgG тем самым:
• связываются противовирусные АТ, не происходит антителозависимый цитолиз
• блокируется активация комплемента (не развивается МАК-зависимый цитолиз )
б)Торможение экспрессии МНС-1. ЦМВ, аденовирусы, блокируя экспрессию МНС-1,
подавляют распознавание инфицированной клетки CD8+ лимфоцитами.
в)Синтез вирусами факторов взаимодействующих с цитокинами.
• блокада эффекта ИФН( ВЭБ, аденовирусы)
• вирус Миксомы вырабатывает гомолог рецептора ИФН , связывающий ИФН и
препятствующий реализации его функции,
• белок, секретируемый ВЭБ, гомологичен ИЛ-10 и воспроизводит его эффекты
(подавление активности Th1 и переключение и.о. на гуморальный).
• Вирусная двуспиральная РНК - мощный интерфероноген, повышает активность МФ
и NK. Синтетические аналоги вирусной двуспиральной РНК (поли-I/поли-С, полиА/поли-U) широко используются в качестве иммуномодуляторов.
29. 3.Отклонения от «классического» варианта иммунного ответа при инфекциях
3.ОТКЛОНЕНИЯ ОТ «КЛАССИЧЕСКОГО» ВАРИАНТА ИММУННОГООТВЕТА ПРИ ИНФЕКЦИЯХ
Особенности патогенов или ИС могут приводить:
• к повреждению собственных тканей
• длительному персистированию возбудителя
• хронизации процесса.
Повреждение собственных тканей
• При персистировании инфекции избыток количества АГ относительно количества АТ
приводит к образованию слабо растворимых иммунных комплексов (ЦИК) – в результате
иммунокомплексные заболевания.(Вирус гепатита В, вирус лимфоцитарного
хориоменингита)
• Клетки ЦНС, инфицированные вирусом лимфоцитарного хориоменингита, поражаются
собственными цитотоксическими лимфоцитами.
• быстрое и обильное высвобождение цитокинов индуцируемое суперантигенами, вызывает
потенциально смертельное повреждение – эндотоксический шок. Чаще развивается при
инфицировании грам(-) бактериями и стафилококком.
30. 4.Неадекватная тактика иммунного ответа
Th1-зависимые клеточные механизмыэффективны при внутриклеточных
инфекциях: туберкулезе, листериозе,
лейшманиозе, проказе, столбняке, вирусных
инфекциях (грипп, ВИЧ), кандидозе.
Пример: при инфицировании М. Leprae если ответ
развивается
по Тh1- типу – развивается туберкулоидная
форма лепры, имеющая благоприятный прогноз
По Тh2- пути – проказа проявляется в
лепроматозной форме, не поддающейся
излечению
Th2-зависимый гуморальный путь
эффективен при внеклеточных инфекциях:
бореллиозе, гельминтозах, нейссериями,
стафилококками, микоплазмами,
кишечными палочками, частично
вирусных инфекциях.
Пример: при инфицировании Leishmania
maior ответ развивается
по Тh1-зависимому типу – полная защита
по Тh2-зависимому пути – болезнь со
смертельным исходом,.
Механизмы формирования неадекватного ответа неясны
за редкими исключениями:
Вирус Эпштейна-Барр продуцирует фактор BCR F-1 с активностью подобной ИЛ-10,
направляющий ответ по Th2-пути неадекватному для защиты от вирусной инфекции.
31. 5.Переход вируса в латентную фазу.
При этом происходит:• Прекращение репликации вируса и формирования новых вирусных частиц=>>
вирусный АГ перестает экспрессироваться на поверхности клеток.
• Патоген становится недосягаемым для иммунных факторов.
• Иммунный процесс затухает до следующей фазы активации вируса.
• Вирус гепатита В и Эпштейна-Барр, вируса ветряной оспы, опоясывающего
лишая, простого герпеса персистируют с постоянным или периодическим
выделением активного вируса.
• Прионы особый класс инфекционных агентов- белки с аномальной третичной
структурой и не содержащих нуклеиновых кислот. Прионы увеличивают свою
численность, используя функции живых клеток (в этом схожи с вирусами).
• Прион -способен катализировать превращение гомологичного ему
нормального клеточного белка в себе подобный (болезнь Скрейпи и
Крейцфельда-Якоба), персистируют, не вызывая иммунного ответа.
32. 6.Непосредственное инфицирование ЛФ и МФ
Некоторые вирусы, поражая ИКК, приводят к иммунным дефектам.Инфекции, при которых вирус размножается в пролиферирующих лимфоцитах, к
АГ вируса формируется иммунологическая толерантность.
В-лимфоциты
Т-лимфоциты
Макрофаги
Вирус Эпштейна-Барр
ВИЧ, вирус кори, герпесвирус 6, Т-лимфоцитарный вирус
ВИЧ, цитомегаловирус, лактатдегидрогеназный вирус
Формирование гранулемы
Гранулемы (при туберкулезе, проказе) – скопления активированных МФ, содержащих
неубитые и размножающиеся микобактерии, окруженные активированными Т-л.
Туберкулезные вирусные и некоторые другие инфекционные агенты могут вызывать
повреждения мембран с последующей их «неправильной» репарацией, в результате
происходит слияние клеток – формируется симпласт. Развитие гранулемы, как правило,
служит показателем неэффективности иммунной защиты.
33. 7.Перекрестная реактивность АГ микро- и макроорганизма
• При инфицировании стрептококком типа А появляются АТ против -DN-ацетилглюкозамина – эпитопа, общего для стрептококка и клетокчеловека.
• АТ реагируют с тканями хозяина, экспрессирующими этот полисахарид –
миокардом, клапанами сердца, синовиальной оболочкой суставов,
эпителиальными клетками – развитие ревматизма.
• При инфицировании Treponema pallidum появляются АТ к кардиолипину,
патогенетически значимые для формирования волчаночного синдрома.
• При инфицировании Treponema cruzis имеет место перекрестная
реакция с белками ЦНС. Вследствие развития аутоагрессии возникает
поздняя нервная симптоматика.
34. Серологическое тестирование стадий инфекционного заболевания
СтадияДиагностический титр АТ
Динамика
Острая
IgM – очень высокий
IgG – очень высокий
IgA – высокий
Быстрое угасание ИО:
IgM , IgG, IgA
Хроническая
Высокие титры специфических
IgG, IgA
Титры не меняются длительное
время
Реактивация инфекции
Очень высокие титры
специфических IgM , IgG, IgA
Возможно достаточно быстрое
угасание ИО
Бессимптомное течение
Повышенные титры IgA
Сохраняются длительное время
Состояние постинфекции
Повышенные и высокие титры
IgG
Сохраняются длительное
время, медленно снижаются
!!!
2-3-х кратное снижение специфических IgG, IgA в процессе лечения –
эффективность терапии!!
35.
36. ПРОТИВОПРОТОЗОЙНЫЙ ИММУНИТЕТ
• инвазия сопровождается формированием гуморального и клеточногоиммунитета.
Характер противопаразитарного иммунитета определяется биологическими особенностями
паразита.
• Антитела (IgМ, IgG) против простейших действуют на внеклеточные формы паразитов:
активируют АЗКЦ с участием МФ,
• в случае внутриклеточного паразитирования участвуют – NK,NKTи γδT лимфоциты.
• Паразитарные инвазии сопровождаются аллергизацией организма по механизму ГЗТ.
Многие паразиты обладают высокой АГ-изменчивостью, что позволяет им избегать действия
факторов иммунитета.
• Такие паразиты (малярийный плазмодий) как бы «ускользает» от ранее образовавшихся АТ
• Фагоцитоз часто незавершенный (при лейшманиозах)
• Выявление ГЗТ используют при диагностике токсоплазмоза, лейшманиоза и др. протозойных
инфекций
37. ИММУННАЯ ЗАЩИТА ПРОТИВ ГЕЛЬМИНТОВ
• компоненты гельминтов (PAMP) распознаются РРR рецепторами клеток
врожденного иммунитета (МФ, ДК, энтероцитами слизистых оболочек
кишечника).
лизофосфатидилсерин (распознается TLR2), липопротеины, обогащенные
фосфорилхолином (распознаются TLR4), гликаны- распознаются лектиновыми
рецепторами
• активация ДК приводит к дифференцировке Th0 в Th2.
• Th2-ответ- преобладающая форма протективного иммунного ответа
против гельминтов.
• ИЛ-4, ИЛ-13, ИЛ-5 обеспечивают переключение изотипов антител на IgE,
• привлекают эозинофилы и базофилы.
• IgE – взаимодействуют с сенсебилизированными тучными клетками,
стимулируют выброс факторов с антигельминтной активностью и
хемоатрактантами для ЭОЗ.
38. ОСОБЕННОСТИ ПРОТИВОГЛИСТНОГО ИММУНИТЕТА
• Ведущая роль - ЭОЗ, которые осуществляют АЗКЦ.• ЭОЗ распознают паразитов, отмеченных специфическими IgE или IgA.
• ЭОЗ и БАЗ образуют вал вокруг гельминтов и выделеляют молекулы и вещества
обладающие антигельминтными свойствами:
• белок ЭОЗ- МВР (главный щелочной белок)
гибель гельминтов
• белок ЭОЗ-ЕСР (эозинофильный катионный белок)
• АГ гельминта, связываясь с рецепторами ТК слизистой оболочки, вызывают их
дегрануляцию.
• Экскретированные биологически активные соединения вызывают интенсивную
перистальтику, удаляющую паразита или его останки из просвета кишки.
• ЭОЗ и ТК синтезируют цитокины и липидные медиаторы, потенцирующие
воспалительную реакцию в месте внедрения гельминта.
Глистная инвазия сопровождается аллергизацией в основном по механизму ГЗТ.
Против гельминтов формируется относительно слабая и кратковременная
иммунологическая память.
39.
Противогрибковыйиммунитет
Основой противогрибкового иммунитета является клеточный
иммунитет:
фагоцитоз эпителиоидная гранулематозная реакция ГЗТ Аллергия
IgE-антитела против антигенов грибов ГЗТ и ГНТ.
Антитела (IgM, IgG) при микозах выявляются в низких титрах.
Факторы противогрибковой неспецифической резистентности кожи,
слизистых оболочек рта и слюны
Микозы, особенно, оппортунистические, часто развиваются после
длительной антибиотикотерапии и при ИДС
40. Часть 2 АУТОИММУННЫЕ ПРОЦЕССЫ.
41. Аутоиммунные заболевания:
- это заболевания, в патогенезе которыхАутоиммунные
заболевания поражают
5-7 % населения Земли.
ведущую роль играют аутореактивные
лимфоциты, которые распознают АГ
собственного организма как чужеродные
и запускают патологические процессы,
характеризующиеся деструкцией • клеток-мишеней
• тканей-мишеней
• нарушением их функций (как снижением,
так и усилением)
• развитием хронического воспаления.
42. Аутоиммунные заболевания:
Эффекторные процессы аутоиммунных заболеваний реализуютсячерез гуморальные (ауто-АТ) и/или клеточные (аутореактивные
клоны лимфоцитов) иммунные реакции.
Гиперпродукция провоспалительных цитокинов
сопровождает практически все аутоиммунные
заболевания.
43. Естественные (нормальные) ауто-АТ
В норме АТ обновляютсяежедневно из них:
70-80% - АТ к инфекционным АГ
20-30% - ауто-АТ
вырабатываются в норме в небольших количествах
синтез ауто-АТ начинается во внутриутробном периоде – раньше синтеза АТ к
чужеродным АГ.
• CD5+-В1-лф - вырабатывают «естественные» АТ- IgM ,не индуцированные
иммунизацией, без Тh поддержки, в том числе к некоторым ауто-АГ.
• присутствуют нормальные ауто-АТ, реагирующие с ДНК, компонентами цитоскелета,
миелином, сывороточным альбумином, тиреоглобулином, цитохромом, коллагеном,
трансферрином, с компонентами клеток сердца, почек, эритроцитами, фибробластами,
а также органоспецифические IgG-ауто-АТ. С возрастом титр этих АТ нарастает.
Если продукция ауто-АТ к ауто-АГ выходит за физиологические пределы
и изменения сохраняются месяцами- это может стать причиной развития
аутоиммунных заболеваний (АИЗ).
44. Естественные ауто -АТ, наряду с гормонами ,нейромедиаторами, регулируют множество физиологических функций.
Способствуют освобождению организма от отмирающих клеток идругих отживших свой срок биологических структур.
Взаимодействуя со специализированными ауто-АГ: рецепторами,
гормонами, ферментативными комплексами естественные АТ служат:
• стимуляторами роста и функции щитовидной железы, коры
надпочечников,
• агентами апоптоза,
• регуляторами дифференцировки, стимуляторами регенерации,
• являются факторами естественной радиопротекции.
Эффекты ауто-АТ не замещают и не превосходят действие нормальных
эндокринных или нервных регуляторов (гормонов, медиаторов и прочих
биоактивных веществ), а только дополняют их.
45. АУТОРЕАКТИВНЫЕ КЛОНЫ ЛИМФОЦИТОВ.
АУТОРЕАКТИВНЫЕ КЛОНЫ ЛИМФОЦИТОВ.В норме у каждого здорового организма в периферических лимфоидных
тканях есть и T-л, и B-л с АГ-распознающими рецепторами для «своего»,
т.е. манифестация аутоиммунных заболеваний не является результатом
возникновения аномальных аутореактивных клонов лимфоцитов - они
всегда присутствуют.
В норме аутореактивные клоны находятся в состоянии
иммунологической толерантности, и срыв этого состояния приводит к
запуску аутоиммунного процесса, переходящего в заболевание.
Чаще всего манифестация аутоиммунного деструктивного
процесса инициируется патогенным внешним фактором.
46. ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ -
ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ это отсутствие активации лимфоцитов (и, следовательно продукции имиэффекторных молекул) при наличии специфического АГ.
Толерантность Лф (как отсутствие ответа на АГ) нужна только по отношению к
АГ собственных неповрежденных тканей.
Супрессия
Продуктивная активация клона ЛФ
начинается, реализуется, затем
подавляется
Толерантность
Продуктивной активации
антигенспецифического клона ЛФ не
происходит
Механизмы:
апоптоз
подавление внутриклеточного метаболизма
сигналами с ингибирующих рецепторов
47. Факторы, обеспечивающие предрасположенность к аутоиммунным процессам
Присутствие ауто-АТ или аутоспецифических клеток недостаточно для развитияаутоиммунного процесса.
• Наследственный фактор. У ближайших родственников больных, даже в случаях
отсутствия заболевания, обнаруживаются повышенный уровень ауто-АТ. Семейные
заболевания чаще органоспецифические, наследуется не только
предрасположенность, но и мишень (орган).
• Генетическая предрасположенность сцеплена с генами МНС.
Пример: предрасположенность или резистентность к развитию инсулинзависимого
диабета определяет различие по 1 остатку в позиции 57 молекулы HLA-DQ
(резистентность обусловлена присутствием остатка аспарагиновой кислоты,
предрасположенность – остатков валина, серина или аланина).
• Среди негенетических факторов - пол (у женщин развиваются чаще) и
возраст (с возрастом увеличивается вероятность развития заболевания).
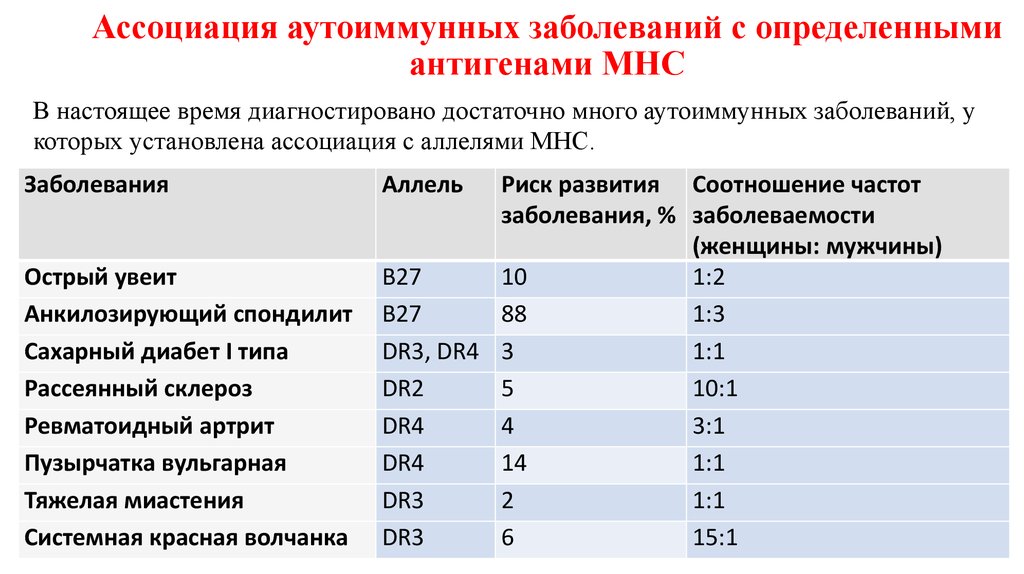
48. Ассоциация аутоиммунных заболеваний с определенными антигенами МНС
В настоящее время диагностировано достаточно много аутоиммунных заболеваний, укоторых установлена ассоциация с аллелями МНС.
Заболевания
Острый увеит
Анкилозирующий спондилит
Сахарный диабет I типа
Рассеянный склероз
Ревматоидный артрит
Пузырчатка вульгарная
Тяжелая миастения
Системная красная волчанка
Аллель
Риск развития Соотношение частот
заболевания, % заболеваемости
(женщины: мужчины)
В27
10
1:2
В27
88
1:3
DR3, DR4 3
1:1
DR2
5
10:1
DR4
4
3:1
DR4
14
1:1
DR3
2
1:1
DR3
6
15:1
49. МЕХАНИЗМЫ ЗАПУСКА АУТОИММУННОЙ ПАТОЛОГИИ.
Нарушение функции регуляторных Т-лимфоцитов-Тreg (CD3+CD4+CD25+Foxp3+).Срыв толерантности к ауто-АТ (аутотолерантность) и возникновение аутоиммунного конфликта
происходят из-за нарушения взаимодействия ИКК и механизмов регуляции их активности.
Иммунная регуляция
Тreg
Поддержание самозащиты
(self-tolerans)
Сохранение способности
адекватного ИО против
патогенов
Нарушение образования (развития) и
функции Тreg
Запуск аутоиммунной патологии
В 2001 г. описан наследственный синдром - IPEX (Immunodysregulation, Polyendocrinopathy, Enteropathy X-linked - сцепленная с
Х-хромосомой иммунная дисрегуляция, полиэндокринопатия, энтеропатия), обусловленный мутацией
гена Foxp3, приводящей к глубокому дефициту регуляторных Т-клеток (CD3+CD4+CD25+Foxp3+). Заболевание выявляют в
перинатальном и младенческом возрастах. Оно сопровождается развитием множественных тяжёлых аутоиммунных и
аллергических патологий и вскоре заканчивается летальным исходом.
50. МЕХАНИЗМЫ ЗАПУСКА АУТОИММУННОЙ ПАТОЛОГИИ.
Микробные суперантигены вызывают поликлональную активациюлимфоцитов. Какие-то из клонов лимфоцитов, специфичные к собственным АГ,
могут войти в режим эффекторного иммунного ответа (ИО).
Деструкция тканей патогеном (цитопатогенное действие вирусов, бактерий и
др.) приводит к попаданию тканевых АГ в активированные (тем же
патогеном) ДК, которые транспортируют все АГ в периферические
лимфоидные органы для инициирования ИО. В этих условиях ДК могут
утратить способность к толерантности к собственным АГ и вместо этого
запускать ИО, реализуемый, как правило, с участием Тh1-лимфоцитов.
Два TCR на одном лимфоците. Примерно 30% периферических Т-л несут, по
крайней мере, 2 разных по специфичности TCR .
Есть вероятность, что один из TCR может иметь специфичность к патогену, а
второй - к ауто-АГ. Активация иммуногенеза патогеном приведёт к созданию
клона лимфоцитов, которые будут работать в качестве эффекторов против обоих
АГ - чужеродного и своего.
51. СОМАТИЧЕСКИЕ КЛЕТКИ СТАНОВЯТСЯ АПК
• В норме клетки организма (за исключением АПК) не экспрессируютмолекулы МНС II класса и не распознаются Тh.
• Если клетки тех или иных органов начинают экспрессировать МНС II, они
становятся мишенью для собственной иммунной системы.
примеры заболеваний с этим механизмом: инсулинзависимый
сахарный диабет, тиреотоксикоз, аутоиммунный гепатит.
• Причины необычной экспрессии молекул МНС II класса неизвестны.
Усиление экспрессии этих молекул и их появление в необычных местах
может вызвать ИФН .
• ИФН -основной продукт Th1-клеток, возможно, этим объясняется
способность полного адъюванта Фрейда индуцировать аутоиммунные
процессы.
• Во всех случаях такого рода заболеваний индуцируется
аутоиммунный процесс клеточного типа.
52.
Нарушение изоляции «иммунологически привилегированных» органови тканей: ЦНС, внутренние среды глаза, внутренние части семенников, фолликулы
щитовидной железы и др.
В норме в эти органы не поступают иммунологически значимые сигналы.
При поступлении соответствующих АГ (основной белок миелина, тиреоглобулин,
кристаллин и т.д.) может развиться аутоиммунный процесс.
Пример: аутоиммунное поражение парных органов при первоначальном повреждении
(обычно при травме) одного из них:
• «симпатическая офтальмия» (вовлечение в патологию здорового глаза при развитии
воспалительного процесса в травмированном глазу),
• поражения обоих яичек при аутоиммунном орхите, инициируемом травмой одного из
них.
Для индукции аутоиммунного процесса требуется сочетание:
• иммунизация «за барьерным» АГ,
• воздействие на иммунную систему, вызывающее гиперактивацию Th1-клеток.
• После преодоления барьеров гуморальное звено иммунной реакции срабатывает
беспрепятственно: ауто-АТ, индуцированные в результате травмы одного глаза,
«находят» второй глаз, не встречая преград.
53. АНТИГЕННАЯ МИМИКРИЯ.
У бактерий имеются АГ-детерминанты, перекрестно реагирующие снормальными АГ.
• В норме ауто-реактивные клоны не активируются, т.к. на
профессиональных АПК ауто-АГ присутствует в низких концентрациях, а на
непрофессиональных АПК нет ко-стимулирующих молекул.
Появление перекрестно-реагирующего бактериального антигена (БАГ)–
приведет аутореактивные клоны в активное состояние.
• Другой механизм: в норме ауто-реактивные В-л не продуцируют АТ, так как
лишены Тh помощи.
Но в качестве АПК, В-л захватывает перекрестно-реагирующий БАГ,
презентирует фрагменты БАГ Тh .
В результате не аутореактивные Т-х начинают помогать аутореактивным В-л
54. МИМИКРИЯ: МИКРОБНЫЕ И АУТО-АГ В РАЗВИТИЕ АЗ
Микробный АГАуто-АГ со сходной структурой
Аутоиммунные заболевания, в
развитии которых выявленная
мимикрия может играть роль
М-белок стрептококка А АГ, обнаруженный в мышце сердца
Ревматическая лихорадка
Бактеральные белки
теплового шока
Собственные белки теплового шока
Прослеживается взаимосвязь с
несколькими аутоиммунными
заболеваниями, но она не доказана
Ядерный белок вируса
Коксаки В4
Глутамат декарбоксилаза
островковых клеток ПЖ
Диабет 1 типа
Гликопротеин
Campilobakter jejuni
Миелин-ассоциированные
гликолипиды и ганглиозиды
Синдром Гийена-Барре
Белки теплового шока
Субтипы HLA-DR β цепи, содержащие Ревматоидный артрит
«частный эпитоп» ревматоидного
артрита
55. МОДИФИКАЦИЯ СТРУКТУРЫ СОБСТВЕННЫХ БЕЛКОВ ОРГАНИЗМА.
• Присоединение гаптенов приводит к формированию эпитопов,включающих, кроме гаптена, часть белковой молекулы. В случае
перекрестного распознавания рецепторами Т- и В-клеток нормальных
аутологичных эпитопов развивается аутоиммунная реакция.
• -метил-ДОФА индуцирует аутоиммунную гемолитическую анемию, при
которой мишенью АТ становятся молекулы D (Rh) АГ.
• Пенициллинамид и прокаинамид вызывают системную аутоагрессию
вплоть до волчаночного синдрома.
• Изониазид может вызвать образование антиядерных антител с
клиническими проявлениями в виде полиартрита.
• -адреномиметики – астматический статус.
• Однако строгие доказательства прямой связи индукции
аутоиммунного процесса с модификацией ауто-АГ отсутствуют.
56. Иммунологические механизмы аутоиммунных поражений
• гуморального типа накопление ауто-АТ IgG их участие в :• АТ зависимой цитотоксичности –
ГНТ II типа (гемолитическая анемия и др.
поражения клеток крови)
• иммунокомплексной –
ГНТ III типа (системная красная волчанка)
• стимулирующей (ауто-АТ к рецепторам TSH
при тиреотоксикозе)
клеточного типа- более тяжелые и менее
чувствительные к лечебным воздействиям.
варианты клеточных механизмов
цитотоксический – цитолиз, опосредованный CD8+
(инсулинзависимый сахарный диабет)
ГЗТ – разрушение макрофагами
(активированными Th1) и их продуктами с
последующим формированием очага хронического
иммунного воспаления (рассеянный склероз и
ревматоидный артрит).
• путем подключения комплемента
(комплемент зависимый цитолиз), МФ
(опсонизация), NK (АТ зависимый клеточноопосредованный цитолиз),
При цитотоксическом механизме поражения
более локализованные, менее деструктивные,
последствия связаны с уникальностью
поражаемых клеток (сахарный диабет)
• запуска активирующих сигналов через
рецептор—мишень ауто-АТ.
При развитии ГЗТ в патологию вовлекаются
значительные массивы тканей, повреждения
более выраженные.
57. Классификация аутоиммунных заболеваний
В настоящее время нет единой классификации аутоиммунных заболеванийСИСТЕМННЫЕ
ОРГАНОСПЕЦИФИЧЕСКИЕ
• Повреждаются различные органы и ткани в результате
атаки на «общий» для них тип АГ.
• Неуклонно прогрессирующие заболевания, при этом
отмечается постепенное вовлечение новых тканей и
органов в аутоиммунный процесс.
• При атаке на органоспецифические АГ происходит
повреждение только определенных типов тканей
(крови, органов пищеварения, желез внутренней
секреции и др.)
• Почти всегда самолимитирующиеся заболевания
(сахарный диабет I типа , аутоиммунная реакция
протекает около 3-4-х мес. и завершается при
полном разрушении панкреатических островков).
58.
Системныеаутоиммунные
заболевания
- когда поражаются
различные органы либо ткани , причем поражаются органы в разной степени и тогда
лечение проходит у того врача симптомы болезни которой наиболее ярко выражены
или у нескольких специалистов.
• Системный склероз (склеродермия)
• Системная красная волчанка
• Антифосфолипидный синдром
• Полимиозит и дермаполимиозит
• Синдром Шегрена
• Ревматоидный артрит
• Болезнь Бехчета
• Системные васкулиты - это группа разных отдельных болезней,
объединенных на основании воспаления сосудов
59. Диффузный токсический зоб характеризуется триадой — гипертиреоидизм, зоб экзофтальм (выпученные глаза).
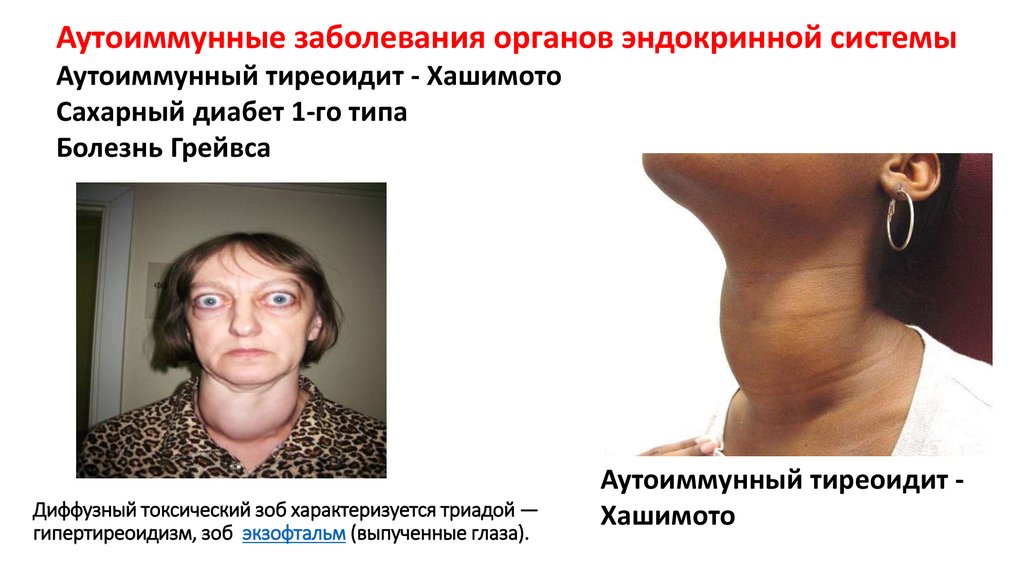
Аутоиммунные заболевания органов эндокринной системыАутоиммунный тиреоидит - Хашимото
Сахарный диабет 1-го типа
Болезнь Грейвса
Диффузный токсический зоб характеризуется триадой —
гипертиреоидизм, зоб экзофтальм (выпученные глаза).
Аутоиммунный тиреоидит Хашимото
60.
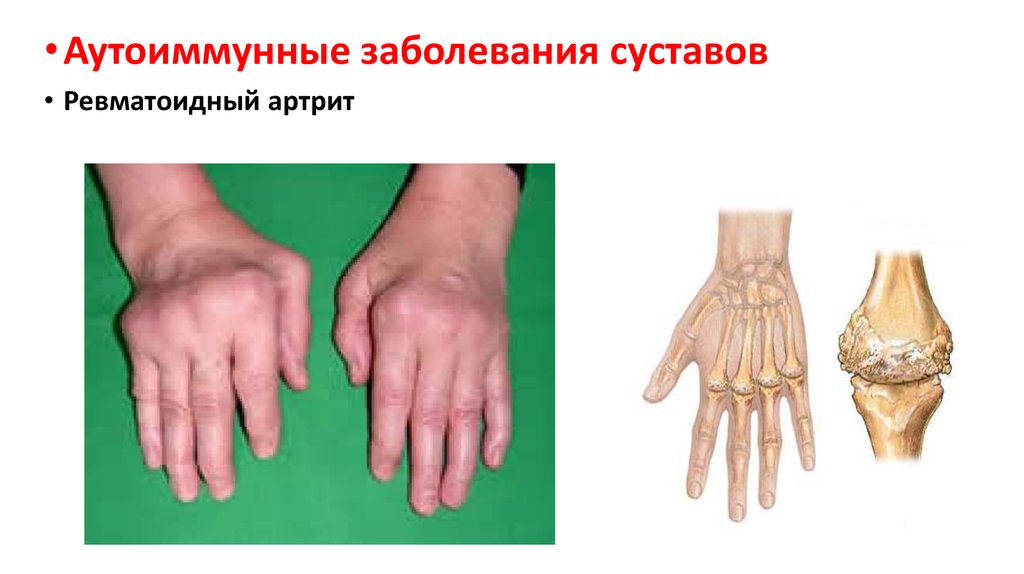
• Аутоиммунные заболевания суставов• Ревматоидный артрит
61.
Аутоиммунные заболевания крови• Аутоиммунная гемолитическая анемия
• Аутоиммунная нейтропения
• Аутоиммунная тромбоцитопения
Тромбоцитопеническая пурпура
Аутоиммунная тромбоцитопения
62.
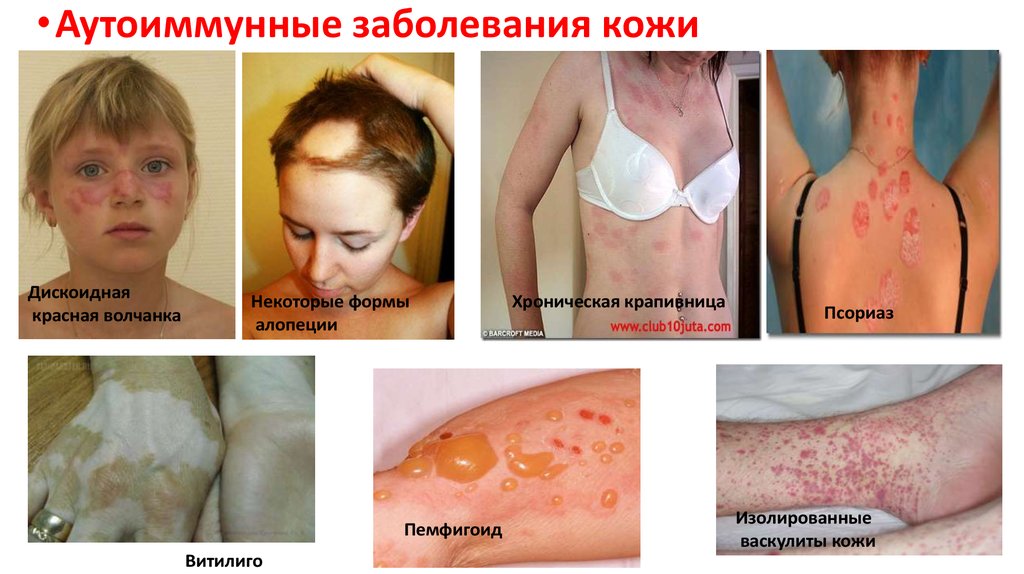
• Аутоиммунные заболевания кожиДискоидная
красная волчанка
Некоторые формы
алопеции
Пемфигоид
Витилиго
Хроническая крапивница
Псориаз
Изолированные
васкулиты кожи
63.
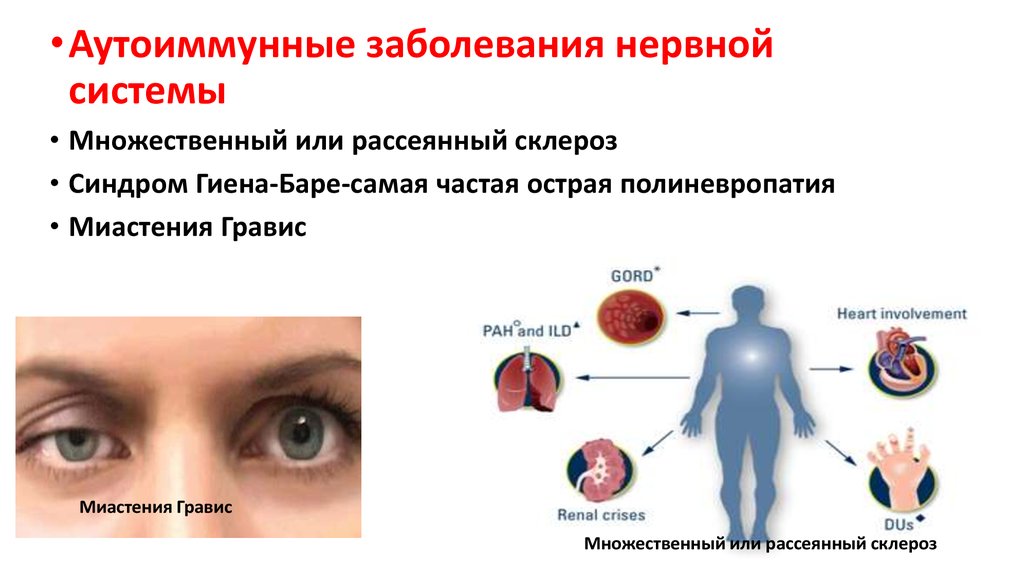
• Аутоиммунные заболевания нервнойсистемы
• Множественный или рассеянный склероз
• Синдром Гиена-Баре-самая частая острая полиневропатия
• Миастения Гравис
Миастения Гравис
Множественный или рассеянный склероз
64. Классификация аутоиммунных заболеваний (по механизму иммунопатологического процесса) - в основе патогенеза тип реакции
гиперчувствительности по Джеллу и КумбсуЗаболевание
Аутоантиген
Основные симптомы
Тип II повреждения тканей – АТ к клеточным или матриксным АГ
Гемолитическая анемия
Rh-АГ Эр
Разрушение Эр комплементом и фагоцитозом
Тромбоцитопеническая
пурпура
Интегрин тромбоцитов GpIIb/IIIa
Разрушение тромбоцитов
Синдром Гудпасчера
Коллаген типа IV
Гломерулонефрит, геморрагии в легких
Вульгарная пузырчатка
Кадгерин эпидермиса
Отслойка эпидермиса в виде пузырей
Острая ревматическая
лихорадка
АГ миокарда, перекрестно
реагирующие с АГ стрептококка
Миокардит, артриты
Пернициозная анемия
Париетальные клетки
Гастрит и В12 – дефицитная анемия
Гипертиреоидизм
Рецептор тиреотропного гормона
Гиперстимуляция АТ к рецептору
тиреотропного гормона
Первичная микседема
(болезнь Хасимото)
Тиреопероксидаза
Деструктивное воспаление щитовидной
железы и зоб
65. Классификация аутоиммунных заболеваний (по механизму иммунопатологического процесса) - продолжение
Классификация аутоиммунных заболеваний (по механизму иммунопатологического процесса) продолжениеЗаболевание
Аутоантиген
Основные симптомы
Тип II повреждения тканей – АТ к клеточным или матриксным АГ
Сахарный диабет II
типа
Rp инсулина (АТ – антогонисты
инсулина)
Гипергликемия, кетоацидоз
Синдром гипогликемии
Rp инсулина (АТ – антогонисты
инсулина)
Гипогликемия
Тяжелая миастения
Никотиновый Rp ацетилхолина
Мышечная слабость
Гранулематоз Вегенера
Протеиназа-3 гранул НГ
Некротизирующий васкулит
Хроническая
крапивница
Высокоаффинный рецептор для IgE
(FcεRI)
Крапивница, не связанная с конкретными
аллергенами (IgG к этому Rp)
Тип III повреждения тканей – иммунными комплексами
Идиопатическая
криоглобулинемия
IgG (комплексы IgG с
ревматоидным фактором)
Разрушение β-клеток CD8+Т-л и/или
опосредованное цитокинами Th1 - л
Системная красная
волчанка
ДНК, гистоны, рибосомы
Гломерулонефриты, васкулиты, артриты
66. Классификация аутоиммунных заболеваний (по механизму иммунопатологического процесса) - продолжение
Классификация аутоиммунных заболеваний (по механизму иммунопатологического процесса) продолжениеЗаболевание
Аутоантиген
Основные симптомы
Тип IV повреждения тканей (ГЧЗТ, клеточный) – Т-эффекторы (Th1, цитотоксические Т-л)
Сахарный диабет I типа
АГ (?) β-клеток островков Лангерганса
Разрушение β-клеток CD8+Т-л и/или
опосредованное цитокинами Th1 - л
Рассеянный склероз
Основной белок миелина
Th1 – опосредованное воспаление мозга
Синдром Шегрена
Неизвестный АГ экзокринных желез
Кератоконъюнктивит, ксеростома,
разрушение экзокринных желез
Тип V повреждения тканей – аллергические реакции ауто-АТ, аутосенсибилизация
Сахарный диабет I тип
Инсулин
Инсулиновые рецепторы β-клеток
островков Лангерганса
Связывание инсулина ауто-АТ
Блокада инсулиновых рецепторов
(инсулинолитическое действие) АИАТ или
их активация АИАТ (инсулиномиметическое действие)
Болезнь Грейвса (Базедова
болезнь)
Тиреотропный рецептор тиреоцитов
Стимуляция тиреоцитов и увеличение
продукции тиреоидных гормонов тиреотоксикоз
67. Отличия между системными и органоспецифическими аутоиммунными заболеваниями.
ХарактеристикиЗаболевания
Органоспецифические
Системные
Доступные концентрации ауто -АГ
Обычно низкие
Высокие
Аутоантитела
Органоспецифичные
Неорганоспецифичные
Тип иммунопатологии
IV (наряду со II)
III (наряду со II)
Органы-мишени
Щитовидная железа, желудок,
надпочечники, поджелудочная
железа (сочетания)
Основы терапии
Воздействие на метаболизм
Злокачественное перерождение
Клеток органа-мишени
Экспериментальное моделирование
Введение аутоантигена в
полном адъюванте Фрейнда
Сочетанные поражения кожи,
почек, суставов и мышц.
Подавление воспаления и
синтеза антител
Лимфоцитов
Спонтанно у животных
определенных генотипов.
68. Противоопухолевый иммунитет
Часть 3Онкопатология занимает 2 место после сердечно-сосудистых заболеваний среди
причин смерти в цивилизованных странах.
Опухоли (новообразования) возникают, когда по каким-либо причинам наблюдается
неконтролируемая избыточная пролиферация клеток.
Обычно во всех органах и тканях поддерживается баланс между процессами гибели
клеток и их новообразованием. Это обеспечивается механизмами контроля и
регуляции гомеостаза тканей.
69.
70. ОПУХОЛИ
ДоброкачественныеЗлокачественные
(зрелые, гомологичные) состоят
из клеток, дифференцированных
в такой мере, что можно
определить, из какой ткани они
растут.
Характерен:
медленный экспансивный рост,
отсутствие метастазов,
отсутствие общего влияния на
организм.
могут малигнизироваться.
(незрелые, гетерологичные) состоят из
умеренно- и малодифференцированных
клеток.
могут утратить сходство с тканью, из
которой они исходят.
Характерен:
быстрый, чаще инфильтрирующий рост,
метастазирование и рецидивирование,
наличие общего влияния на организм.
характерен как клеточный, так и
тканевой атипизм.
71. Опухоли способны
• возникать спонтанно, без видимых на то причин• могут быть индуцированы.
Индуцировать канцерогенез способны
• различные химические вещества (метилхолантрен, бензпирен,
афлатоксин В1),
• физические факторы (ультрафиолетовый свет, ионизирующая
радиация)
• вирусы ( герпес-, адено- и ретровирусы).
У человека 3 типа вирусов тесно связаны с опухолями:
• вирус Эпштейна-Барр (лимфома Беркита),
• цитомегаловирус (саркома Капоши)
• вирус папилломы.
72. Противоопухолевые иммунные факторы
I.Клеточные:
1) NK-клетки
2) Т-лимфоциты-киллеры;
3) активированные МФ;НГ
II. Гуморальные:
1) специфические АТ к АГ опухоли
приемущественно IgM и IgG;
АТ не разрушают опухоли, адсорбируясь
усиливают цитолиз
2) ИЛ-1 и ИЛ-2;
3) фактор некроза опухолей (ФНО);
4) интерфероны.
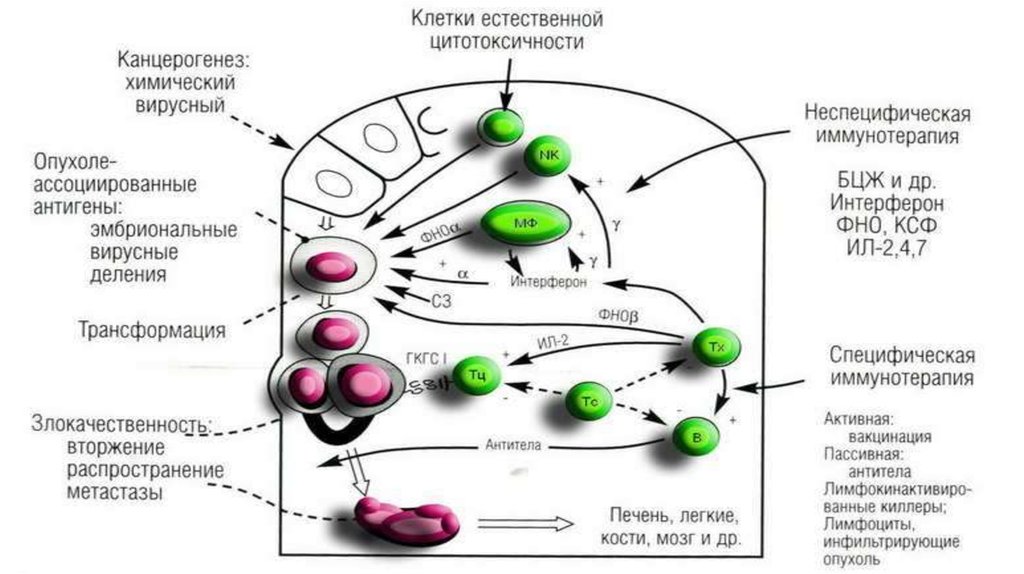
73. ИММУННЫЙ НАДЗОР ОПУХОЛЕВОГО РОСТА
• Концепция была предложена Ф.М. Бернетом в 70-е годы.• У человека за сутки возникает > 1000 000 мутантных клеток, значительная часть которых подвергается опухолевой
трансформации.
Причина низкой частоты реализации этой опасности - наличие иммунного надзора.
• ИС осуществляет контроль элиминируя любые клетки, несущие чужеродную генетическую
информацию.
• немногие клетки, маскирующие проявления своей чужеродности обходят этот контроль и дают
начало опухолям.
• приведенные факты объясняются вирусной этиологией опухолей.
• У здоровых людей многие вирусы циркулируют всю жизнь, но репликация их подавлена ИО.
Доказана этиологическая роль:
• вируса гепатита В - рак печени,
• вируса папилломы человека - рак шейки матки,
• вируса Эпштейна-Барр -лимфомы и рак носоглотки,
• вируса HTLV-1( T-лимфотропный вирус человека типа 1) -Т-клеточный лейкоз.
• На большинство опухолей ИО или вообще не развивается или он поздний и неэффективный.
• Причина -отсутствие иммуногенности злокачественных опухолей, иначе отсутствие
опухолеспецифических АГ
74. Антигены, ассоциированные с опухолями
Опухолеспецифические АГ(трансплантационные АГ)
присутствуют только на
опухолевых клетках
Имеют вирусное происхождение
Опухолеассоциированные АГ –
гетероорганные АГ
нельзя отнести к чужеродным
типичные АГ для нормальной
ткани
АГ с упрощенным строением
Исследование АГ необходимо для расшифровки механизма ИО и создания новых
способов диагностики и лечения.
• Доказательств существования АГ, специфичных только для опухолей мало.
• Далеко не все опухоли содержат маркерные АГ
• Все эти АГ распознаются с МНС I класса, чаще всего HLA-A2 и индуцируют
дифференцировку цитотоксических Т-клеток.
75. АНТИГЕНЫ, АССОЦИИРОВАННЫЕ С ОПУХОЛЯМИ
• раково-эмбриональный антиген (РЭА)- ассоциирующий с раком толстойкишки,
• хорионический гонадотропин (ХГЧ) (гормон, в норме продуцируемый в
плаценте)- выделяемый хориокарциномой, семиномой и рядом опухолей,
происходящих из эмбриональных тканей.
• Большинство этих АГ – результат экспрессии генов, которые в норме
«работают» в эмбриональном периоде.
• мембранные АГ опухолевых клеток – опухолеспецифические
трансплантационные АГ (Tumour-specific transplantation antigen, TSTA).
• К опухолеассоциированным АГ также относят муцины. Описано 7
представителей этой группы (MUC1, MUC2 и т.д.). Их гены образуют кластер в
хромосоме 11.
• В нормальных эпителиальных клетках они участвуют в распознавании
молекул адгезии. Муцины особенно характерны для карцином кишечника.
Полагают, что муцины опухолевых клеток имеют значение в процессе
метастазирования.
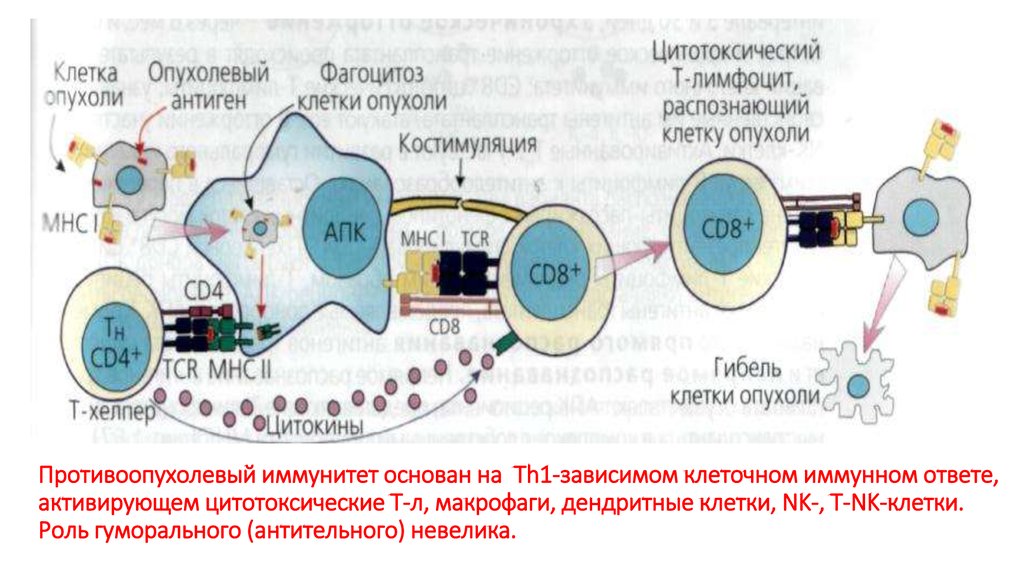
76. Противоопухолевый иммунитет основан на Тh1-зависимом клеточном иммунном ответе, активирующем цитотоксические Т-л, макрофаги,
дендритные клетки, NK-, T-NK-клетки.Роль гуморального (антительного) невелика.
77.
78. Механизмы избегания опухолями иммунного надзора
МЕХАНИЗМЫ ИЗБЕГАНИЯ ОПУХОЛЯМИ ИММУННОГО НАДЗОРА1. Слабая экспрессия молекул МНС I класса.
• опухоли слабо экспрессируют МНС I, необходимые для распознавания АГ CD8+-Т-л.
• Но полная утрата мембранных МНС-I делает опухолевые клетки чувствительными к NKклеток.
• Оптимальным для опухолевых клеток является промежуточное «решение»: утрата
молекул МНС I класса некоторых типов (например, HLA-A) при сохранности других типов
этих молекул. (при раке толстой кишки).
2. Нарушение адгезии и корецепции.
• опухолевые клетки лишены молекул адгезии( LFA-1, LFA-3, ICAM-1),и могут экспрессировать
антиадгезивные молекулы (муцин).
• Нарушение адгезии снижает эффективность фагоцитоза и килинга.
• Эффективный механизм защиты опухолей – отсутствие экспрессии молекул CD80 и CD86,
распознаваемых ко-рецептором CD28.
• Без сигнала, поступающего с ко-рецептора, развивается анергия Т-клетки.
• Возможно, именно этот механизм является главным способом самозащиты опухолевых
клеток.
• разрушаются клетки опухоли, лишенные молекулы CD80 (адаптивный иммунитет за счет
цитотоксических CD8+-клеток, не нуждающихся в костимуляции).
79. Механизмы избегания опухолями иммунного надзора
МЕХАНИЗМЫ ИЗБЕГАНИЯ ОПУХОЛЯМИ ИММУННОГО НАДЗОРА3.Гены опухолевых АГ мутируют.
• в ходе естественной селекции отбираются варианты опухолевых клеток,
несущие мутантные АГ с которыми АТ и ЦТЛ( CD8+-лимфоциты) не реагируютрезко снижают эффективность иммунной защиты
4.Формирование иммунологической толерантности к опухолевому антигену.
• может формироваться под действием низкодозных растворимых форм
опухолевого АГ. Индуцирует развитие толерантности Т-л, отсутствие на
опухолевых клетках ко-стимулирующих молекул.
5. Опухолевые клетки подавляют иммунный ответ.
• выделяют цитокины, которые подавляют иммунный ответ (TFR и , ИЛ-10,
простагландин Е2).
• Способствуют выживанию опухолевых клеток ( фактор, активирующий ростовую
активность меланоцитов, а также факторы роста фибробластов и тромбоцитов).
80. Механизмы избегания опухолями иммунного надзора
МЕХАНИЗМЫ ИЗБЕГАНИЯ ОПУХОЛЯМИ ИММУННОГО НАДЗОРА6.Противоопухолевые антитела защищают опухоль.
• АТ, индуцируемые к опухолевым АГ, защищают опухоли от действия Т-л.
( феномен был описан в 50-е годы и назван феноменом усиления (enhancing) опухолевого роста)
• Данный факт свидетельствует о ведущей роли клеточных механизмов противоопухолевой защиты.
• Переключение на гуморальный тип ИО свидетельствует о низкой эффективности клеточного типа.
• Защитный эффект обусловлен тем, что АТ неспособны вызвать комплементзависимый цитолиз, так
как на опухолевых клетках (как и соматических) экспрессируются CR1 и DAF.
• АТ ( изотипов IgG1 и IgG3) не опсонизируют клетки-мишени, и поэтому, не способствуют их фагоцитозу
или киллингу NK-клетками.
• Отсутствие опсонизации можно объяснить двумя причинами:
• АТ связываются с мембранным АГ и образующийся комплекс не погружается внутрь клетки, ресинтез
мембранного АГ не происходит
• опухолевые клетки могут синтезировать секреторный вариант АГ , либо растворимые формы
мембранных АГ смываются с клеток.
• Растворимый антиген связывает противоопухолевые антитела, не позволяя им взаимодействовать с
опухолевой клеткой.
7 Растворимый антиген блокирует цитотоксические клетки.
81. Пробластомные факторы
на определенном этапе развития опухоли иммунная система хозяинаначинает выделять пробластомные (способствующие росту опухоли)
факторы, которые:
подавляют иммунитет
1. Супресcивные вещества, продуцируемые ЛФ и МФ
2. Блокирующие АТ
3. Циркулирующие иммунные комплексы
4. Простагландины ПГЕ2
5. ИЛ-10
6. Трансформирующий фактор роста (TGFβ),
подавляющий:
а) продукцию цитокинов (ИЛ-12);
б) созревание Т-киллеров;
в) экспрессию рецепторов к цитокинам.
• усиливают рост опухоли:
1. Фактор роста опухоли,
продуцируемый МФ
2. ИЛ-2 и ИЛ- 6.
3.ИФН y.
4. Фактор роста сосудистого
эндотелия.
5. Иммунодефицитное
состояние:
а) нарушение созревания Т-к;
б) нарушение функции АПК
82. ЦИТОКИНСИНТЕТИЧЕСКАЯ АКТИВНОСТЬ ОПУХОЛЕЙ. ДЕЙСТВИЕ ЦИТОКИНОВ НА ОПУХОЛИ.
ЦитокинИФ ,
ИФ
ИФ
ИЛ-1
ФНО
ФНО
ИЛ-2
ИЛ-7
ИЛ-6
Прямое действие на опухолевые клетки
Цитостатическое Усиление экспрессии МНС I класса
Повышение активности М, NK
Цитостатическое и литическое Усиление экспрессии МНС I и
II класса, молекул адгезии
Ростовой эффект Усиление экспрессии молекул адгезии
Повышение активности М, NK, Тк
Цитостатическое Усиление экспрессии молекул адгезии
Цитостатическое и литическое
Возможен ростовой эффект
—
Ростовой эффект (аутокринный при множественной миеломе)
Активация Тк, модуляция ангиогенеза
Участие в действии Тк
Пролиферация Тк и NK
То же (слабее)
Участие в образовании Тк
ИЛ-4
—
ИЛ-10
—
ИЛ-5
—
—
ИЛ-12
Опосредованное влияние на опухоль
ГМ-КСФ Возможен ростовой эффект
Участие в активации Тк, NK
Подавление Тh1, участие в образовании
Тк и антител
Подавление противоопухолевого Тh1ответа
Активация Эо, М, ЛАК
Усиление Th1- опосредованной защиты,
образования ЛАК
Активация М, Эо, Тк, Н
Возможность синтеза
опухолью
+
Грибовидный микоз, Тлимфомы и лейкозы
Миелоидные, Т-кл. и
моноцитарн.лейкозы
—
—
Т-лимфомы, лейкозы
—
Множественная миелома
Синдром Сезари
—
Синдром Сезари
—
—
Г-КСФ
То же
Усиление активности Н
—
ТФР
Ингибирование роста (?)
Подавление Тh1-ответа
+
83.
84.
85. Иммунодиагностика рака-МЕТОД ИФА
.основана на выявлении в сыворотке и жидкостях больного опухолеспецифических
АГ или маркеров опухолевого роста (опухолеассоциированных белков).
тест-системы:
– СЕА; используется для выявления РЭА, положительный тест при карциноме
толстой кишки и поджелудочной железы.
– AFP; для выявления альфа-фетопротеина, положительный тест при
первичном раке печени.
– СА-125 маркер рака яичника.
– СА-15-3 маркер рака молочной железы.
– СА-19-9 маркер рака ЖКТ.
– СА-242 маркер рака поджелудочной железы, толстой и прямой кишки.
– PSA EIA специфический антиген простаты.
– PSA Free; специфический АГ простаты, определение свободного PSA.
– NSE; маркер мелкоклеточного рака легких.
– UBC; маркер рака мочевого пузыря.
– CASA маркер рака яичника.
– MSA; маркер рака молочной железы.
– Chromogranin A маркеры опухолей эндокринного происхождения.
– CD30 (Ki-1 Antigen); опухолилимфопролиферативного происхождения
86. Иммунотерапия больных с онкопатологией
ведется по двум направлениям1) коррекция иммунных расстройств, развивающихся в процессе проведения
химио- и радиотерапии;
2) активация противоопухолевых иммунных механизмов.
• Для лечения гемо- и иммунодепрессий, развивающихся в результате
токсического действия опухолей на гемопоэз и иммуногенез, а также как
следствия применения высоких доз радио- и химиотерапии, в соответствии с
показаниями, могут быть использованы:
• трансфузия совместимого костного мозга
• трансфузия лейкомассы и тромбоцитарной взвеси (в том числе и аутологичной);
• иммунотропные препараты, влияющие на Т-В-л и МФ.
Иммунотропные препараты оказывают лечебное и иммунокоррегирующее
действие только в случае наличия клеточной базы компенсации дефектов гемо- и
лимфопоэза.
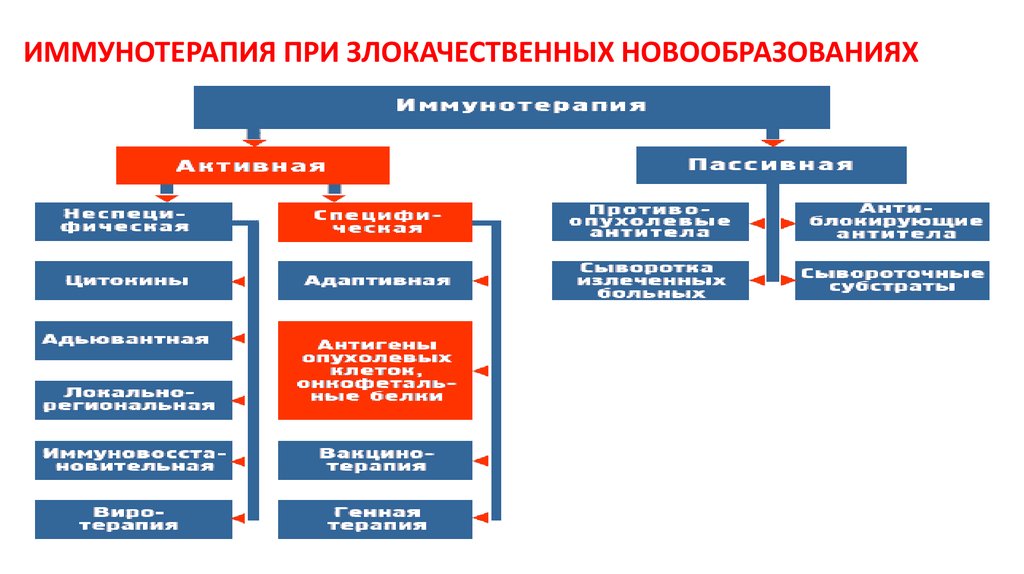
87. ИММУНОТЕРАПИЯ ПРИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЯХ
88.
89.
ДЕЙСТВИЕ ОНКОВАКЦИНЫ НА ОСНОВЕ DCзаключается в стимуляции ЦТЛ (СD8+лф) пациента против определённой опухоли:
1. активация дендритных клеток (ДК) in vitro опухолевыми АГ,
2. активированные ДК, презентирующие опухолевый АГ на своей поверхности
взаимодействуют с наивными Т-лимфоцитами,
3. последние дифференцируются в "профессиональные цитотоксические лимфоцитыкиллеры (ЦТЛ)", мигрируют и лизируют определённую опухоль в организме.
90.
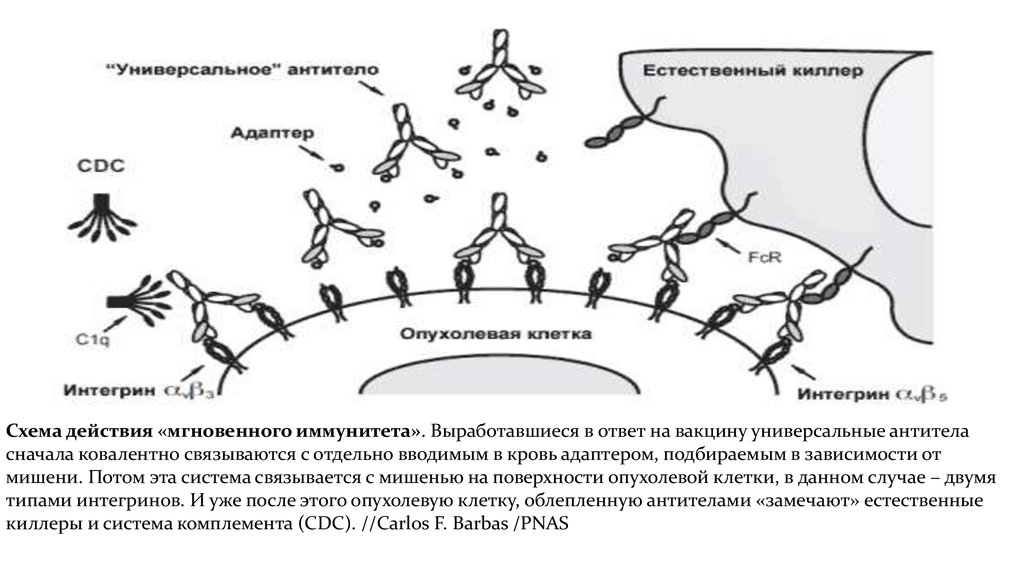
Схема действия «мгновенного иммунитета». Выработавшиеся в ответ на вакцину универсальные антителасначала ковалентно связываются с отдельно вводимым в кровь адаптером, подбираемым в зависимости от
мишени. Потом эта система связывается с мишенью на поверхности опухолевой клетки, в данном случае – двумя
типами интегринов. И уже после этого опухолевую клетку, облепленную антителами «замечают» естественные
киллеры и система комплемента (CDC). //Carlos F. Barbas /PNAS









































































 medicine
medicine








