Similar presentations:
Болезни экспансии некодирующих повторов (синдром Мартина-Белл, атаксия Фридрейха). Методы молекулярно-генетической диагностики
1.
Семинар 5Немцова М.В.
Медицинская генетика
Фармация Курс 3 ЦИОП «Медицина
будущего»
Болезни экспансии некодирующих повторов
(синдром Мартина-Белл, атаксия Фридрейха).
Методы молекулярно-генетической
диагностики.
2. Общие методы
Выделение ДНКПолимеразная цепная реакция
Рестрикционный анализ
Электрофорез в полиакриламидном и
агарозном геле
Блотинг по Саузерну
3. Оборудование для ДНК-диагностики
Оборудование для ДНКдиагностикиАмплификаторы
Термостаты настольные для
пробирок (от 25-95С)
Центрифуга для микропробирок
Трансилюминатор
4. Источники геномной ДНК
Цельная кровьКультура клеток
Букальный эпителий
Пятна высушенной крови
Другие источники
Сыворотка, плазма крови, образцы
мочи, образцы тканей
При делециях мтДНК
предпочтительный материал –
образец мышечной ткани
Блоки фиксированной ткани
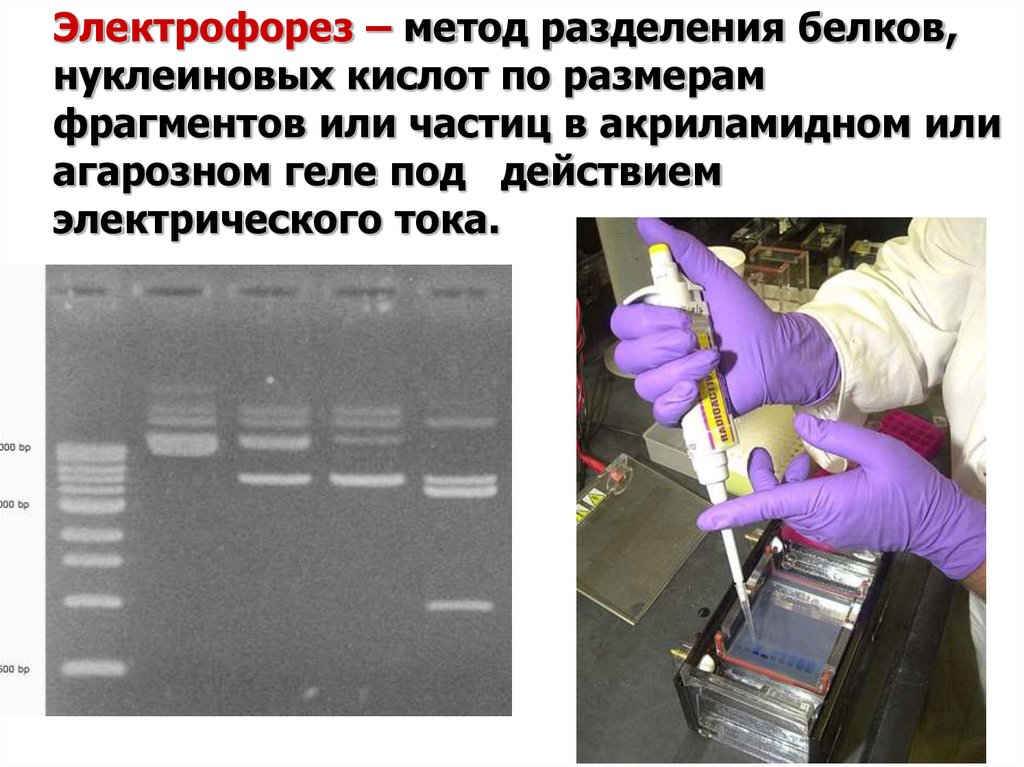
5. Электрофорез – метод разделения белков, нуклеиновых кислот по размерам фрагментов или частиц в акриламидном или агарозном геле
под действиемэлектрического тока.
6. Горизонтальный электрофорез в агарозном геле
БуферФрагменты ДНК
Агарозный гель
Чем меньше фрагменты ДНК, тем
быстрее они передвигаются в геле
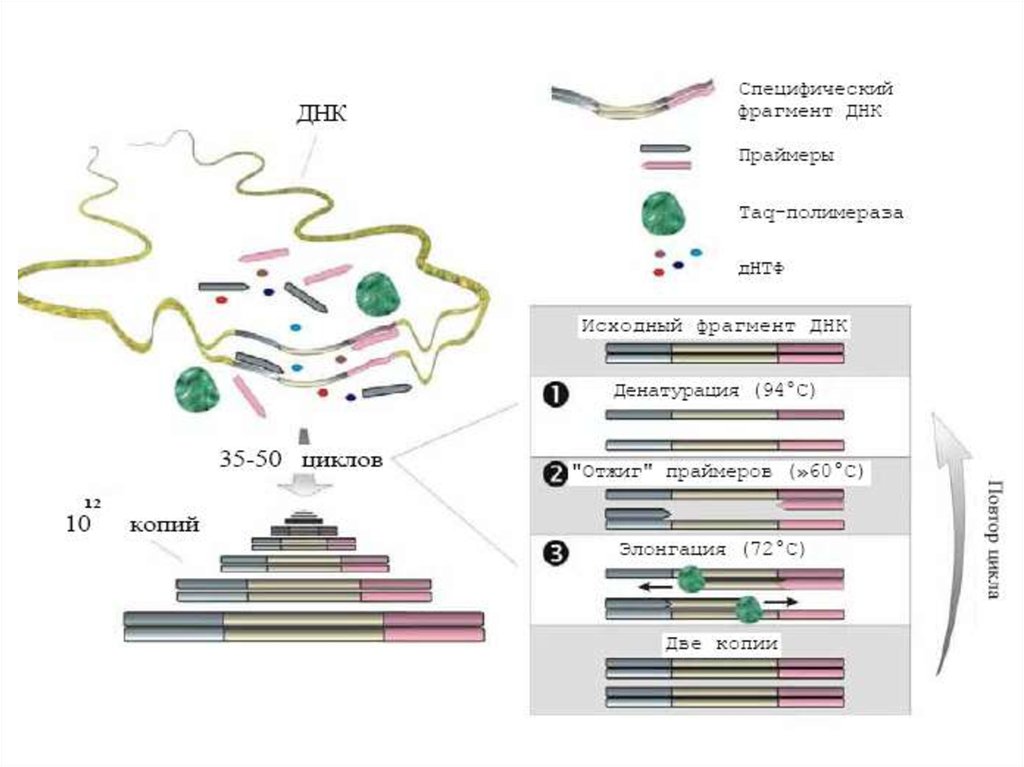
7. ПЦР
Состав реакционной смеси:Исследуемый образец
Буфер, содержащий ионы магния
Смесь АТФ, ТТФ, ГТФ,СТФ
Taq-полимераза
Специфические олигонуклеотидные
праймеры
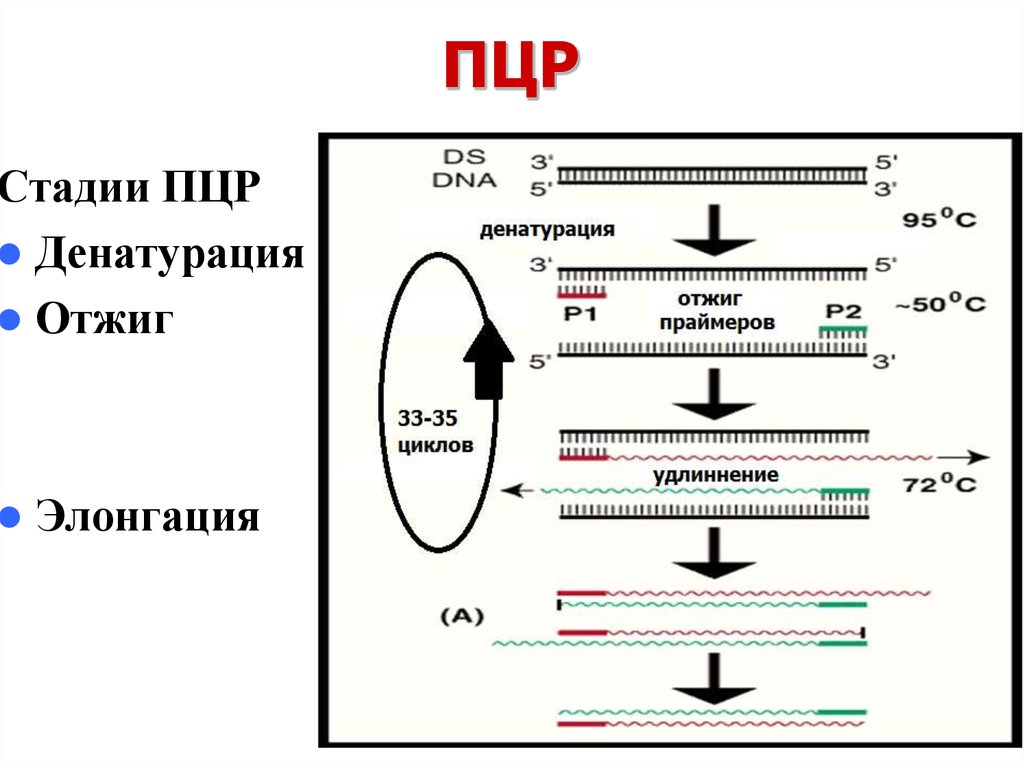
8. ПЦР
Стадии ПЦРДенатурация
Отжиг
Элонгация
9.
ДенатурацияОтжиг
Полимеризация
Tag-полимераза
10.
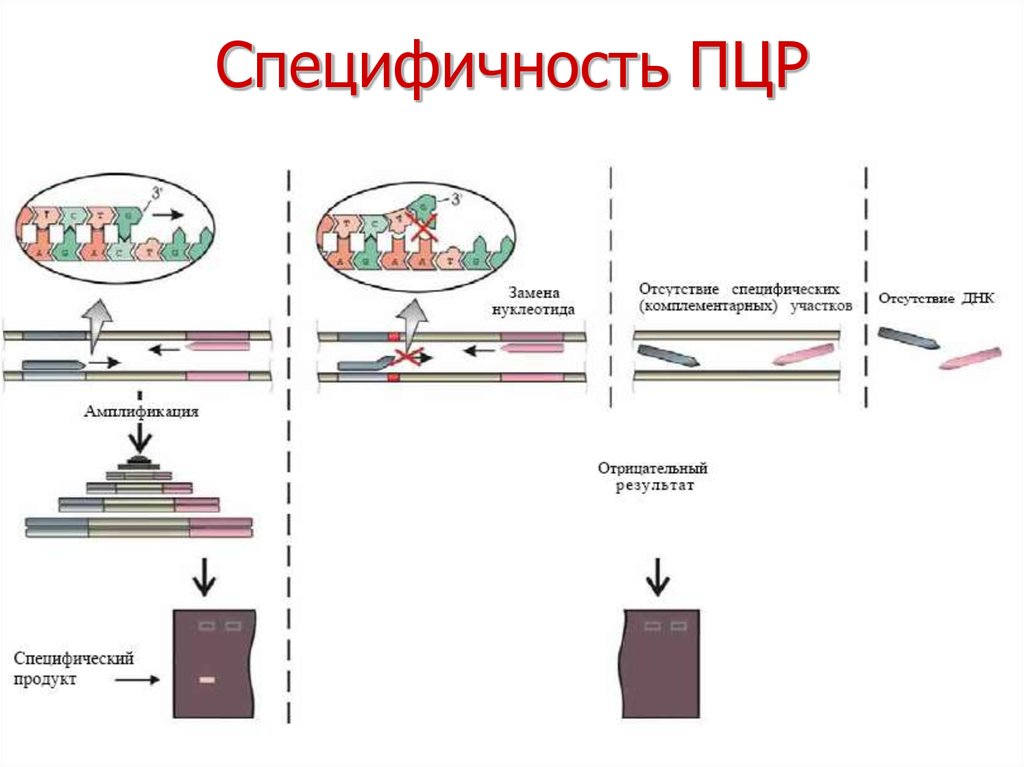
11. Специфичность ПЦР
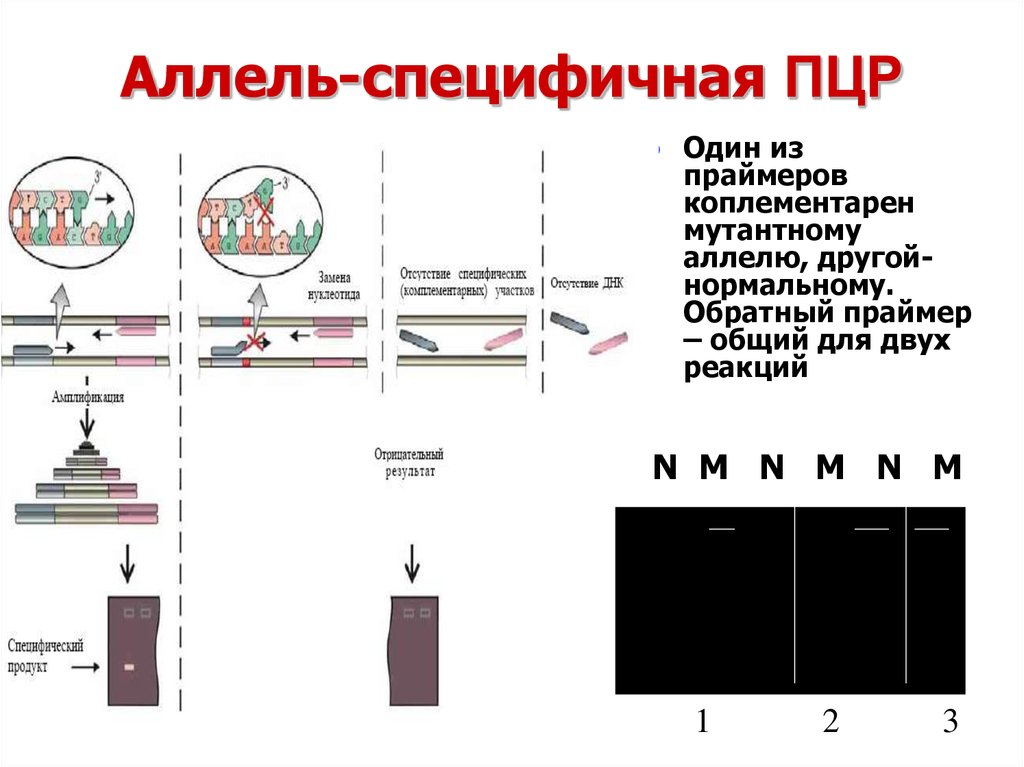
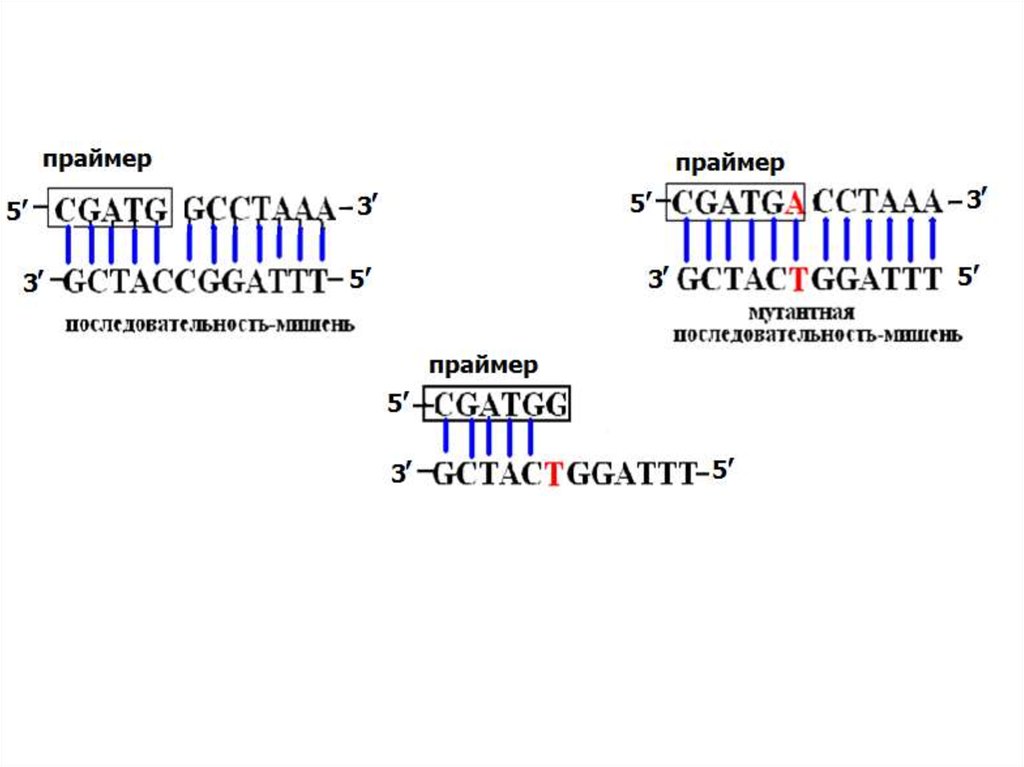
12. Аллель-специфичная ПЦР
Один изпраймеров
коплементарен
мутантному
аллелю, другойнормальному.
Обратный праймер
– общий для двух
реакций
N M N M N M
1
2
3
13.
14. Аллель-специфичная амплификация
15. Мультилокусная ПЦР
ПЦР с несколькими парами праймеров,соответствующих разным участкам гена
Пример –ДНК-диагностика делеций при
миодистрофии Дюшена
16.
Многолокусная ПЦР с флуоресцентно меченнымипраймерами
17.
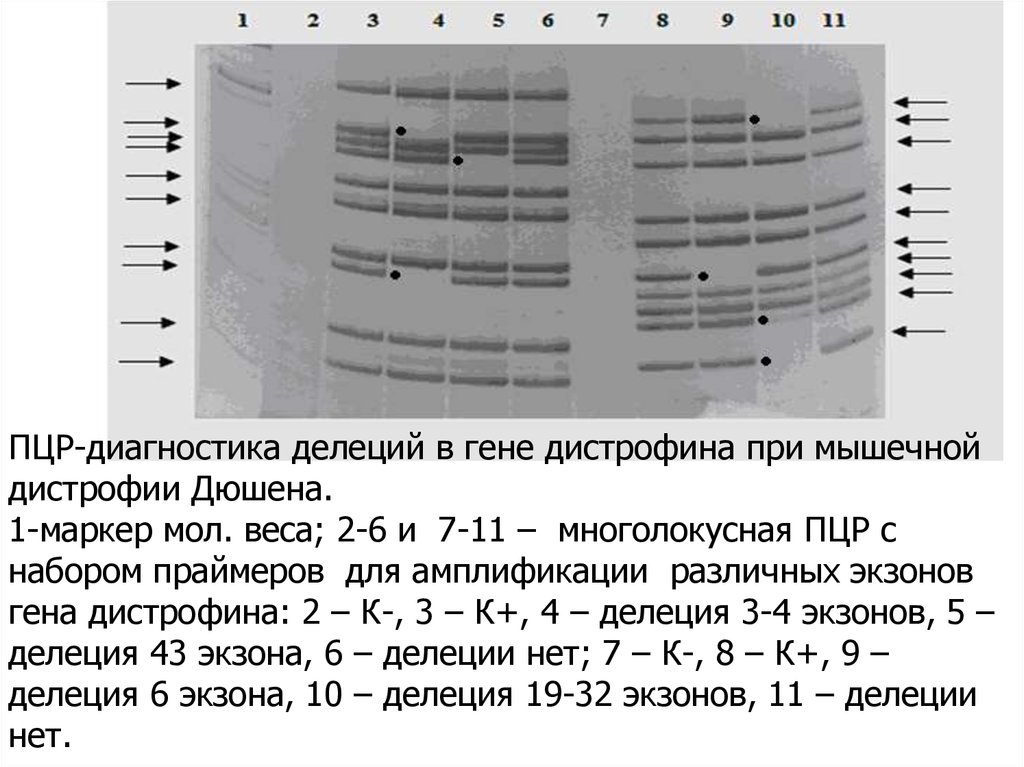
ПЦР-диагностика делеций в гене дистрофина при мышечнойдистрофии Дюшена.
1-маркер мол. веса; 2-6 и 7-11 – многолокусная ПЦР с
набором праймеров для амплификации различных экзонов
гена дистрофина: 2 – К-, 3 – К+, 4 – делеция 3-4 экзонов, 5 –
делеция 43 экзона, 6 – делеции нет; 7 – К-, 8 – К+, 9 –
делеция 6 экзона, 10 – делеция 19-32 экзонов, 11 – делеции
нет.
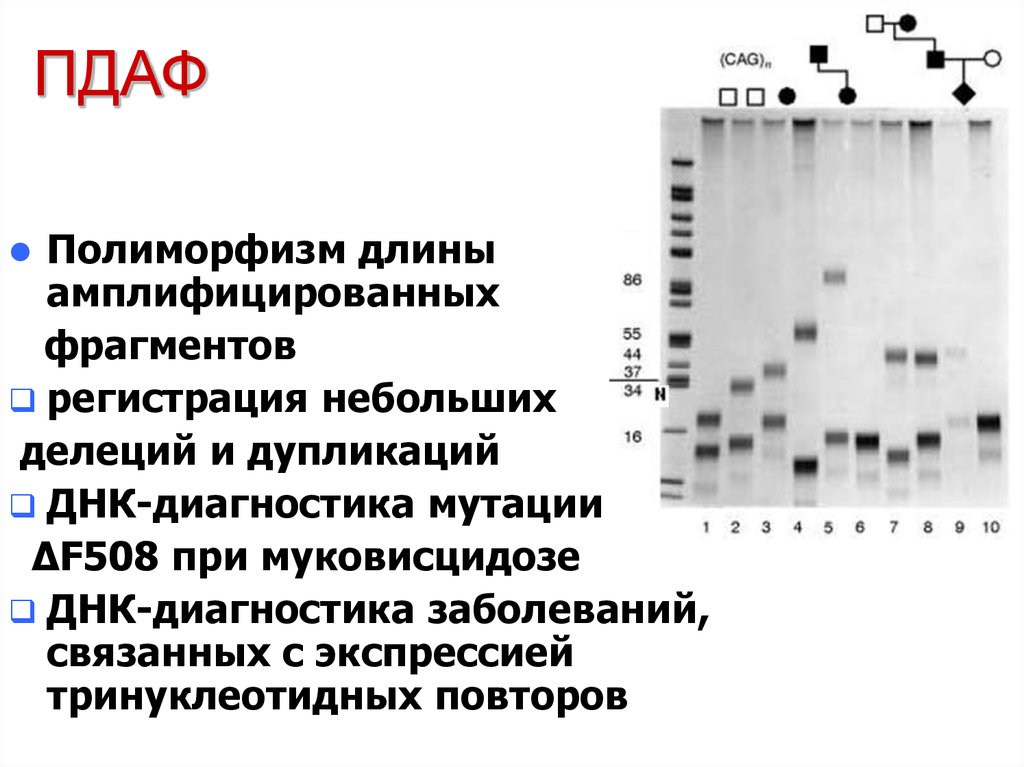
18. ПДАФ
Полиморфизм длиныамплифицированных
фрагментов
регистрация небольших
делеций и дупликаций
ДНК-диагностика мутации
ΔF508 при муковисцидозе
ДНК-диагностика заболеваний,
связанных с экспрессией
тринуклеотидных повторов
19. Эндонуклеазы рестрикции
Ферменты, узнающиеопределенные короткие (4-8 пн)
последовательности в ДНК
(сайты) и разрезающие
двухцепочечную ДНК
- Пример: MspI (CCGG)
GCTGATCCGGGGCATGGTTCCGGAT
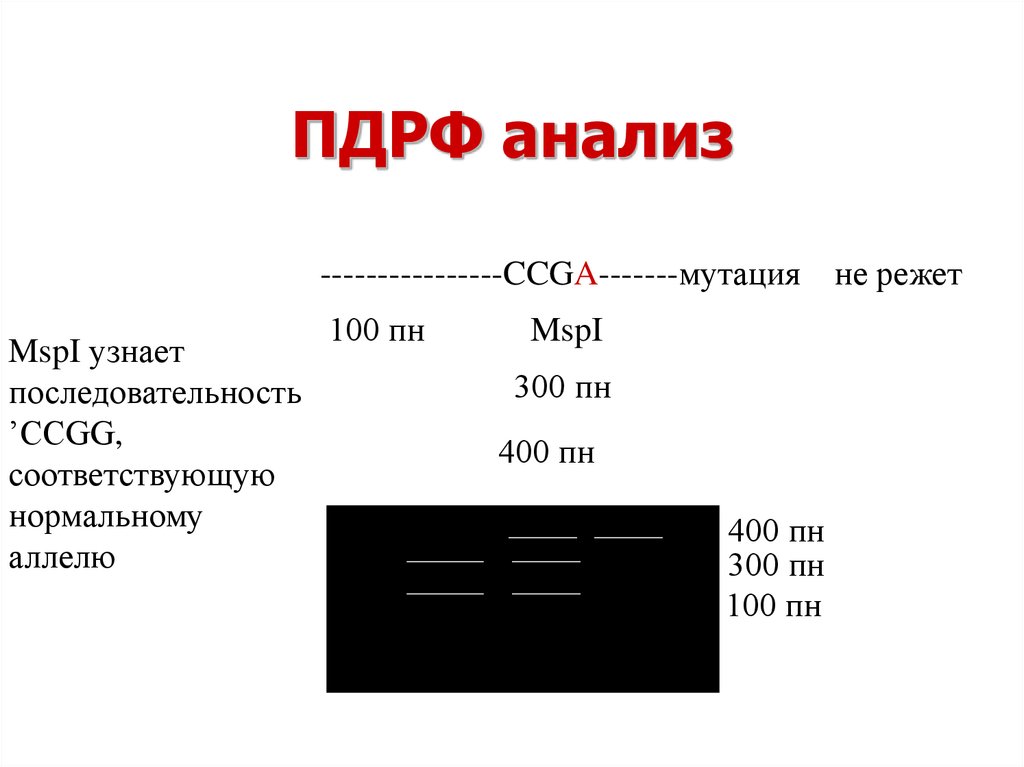
20. ПДРФ анализ
----------------CCGG-------нормарежет
----------------CCGA-------мутация не режет
MspI узнает
последовательность
’CCGG,
соответствующую
нормальному
аллелю
100 пн
MspI
300 пн
400 пн
400 пн
300 пн
100 пн
21. Полиморфизм длин рестрикционных фрагментов
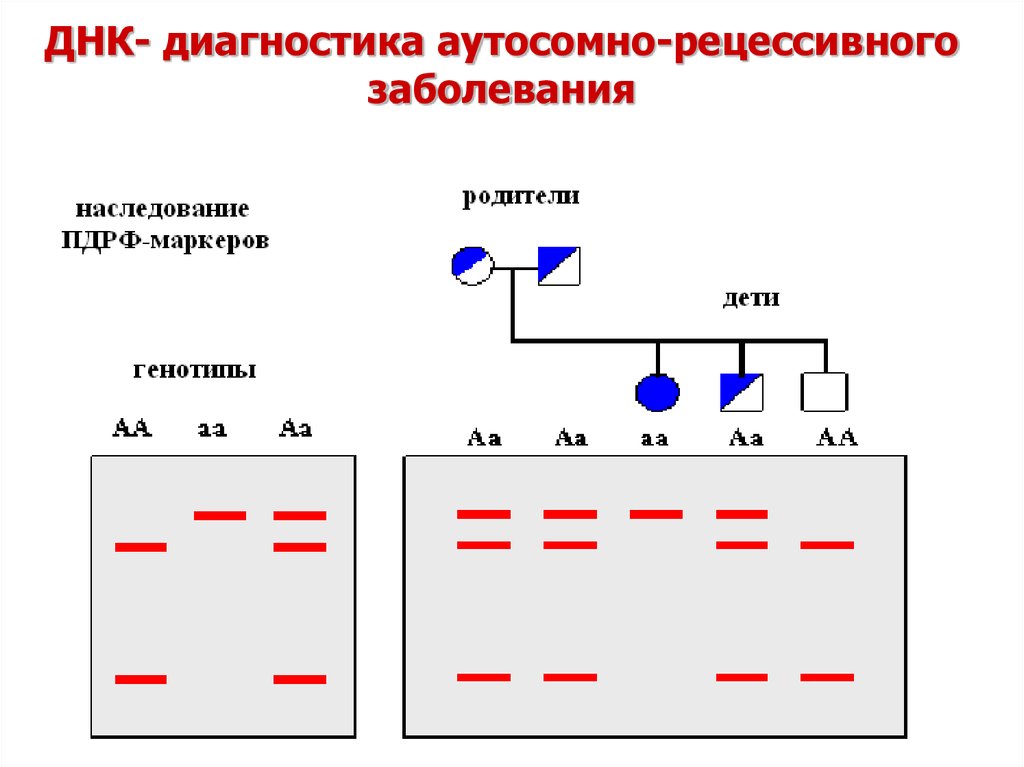
22. ДНК- диагностика аутосомно-рецессивного заболевания
23. КЛАССИЧЕСКАЯ ГАЛАКТОЗЕМИЯ
Характеристика гена GALT-локализация гена 9p13
-11 экзонов
5’
экзоны:
1
2
3 4
5 6 7
8
9
10
11
Характеристика мутации
- Описано более 160 различных мутаций
- Мутации Q188R, K285N обуславливают тяжелый
фенотип (самые частые мутации 70-80%
аллелей)
- N314D обуславливает, т.н. вариант Дуарте
- S135L обуславливает легкий фенотип (62 %
аллелей, Африка)
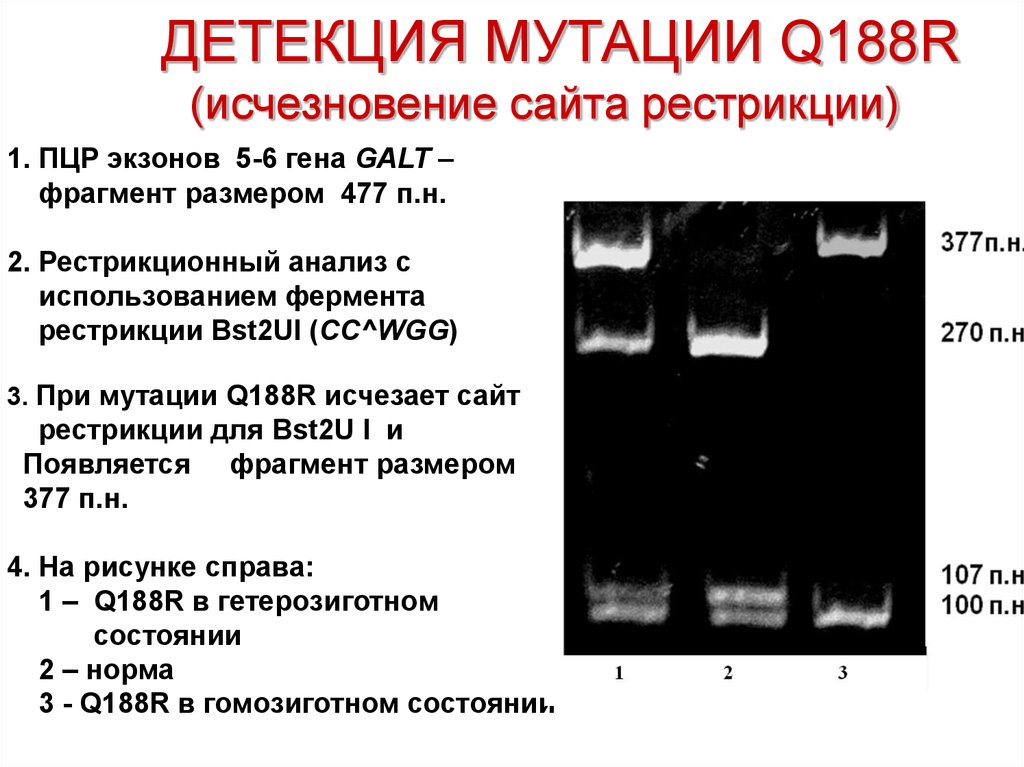
24. ДЕТЕКЦИЯ МУТАЦИИ Q188R (исчезновение сайта рестрикции)
1. ПЦР экзонов 5-6 гена GALT –фрагмент размером 477 п.н.
2. Рестрикционный анализ с
использованием фермента
рестрикции Bst2UI (CC^WGG)
3. При мутации Q188R исчезает сайт
рестрикции для Bst2U I и
Появляется фрагмент размером
377 п.н.
4. На рисунке справа:
1 – Q188R в гетерозиготном
состоянии
2 – норма
3 - Q188R в гомозиготном состоянии
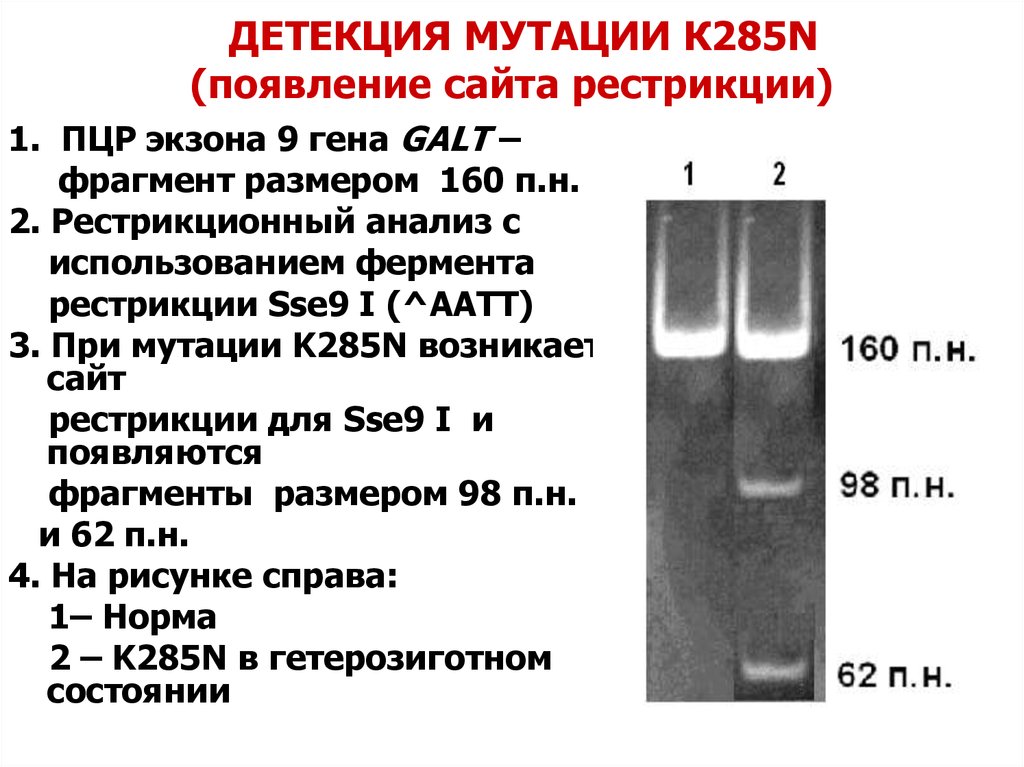
25. ДЕТЕКЦИЯ МУТАЦИИ К285N (появление сайта рестрикции)
1. ПЦР экзона 9 гена GALT –фрагмент размером 160 п.н.
2. Рестрикционный анализ с
использованием фермента
рестрикции Sse9 I (^AATT)
3. При мутации K285N возникает
сайт
рестрикции для Sse9 I и
появляются
фрагменты размером 98 п.н.
и 62 п.н.
4. На рисунке справа:
1– Норма
2 – K285N в гетерозиготном
состоянии
160 п.н.
98 п.н.
62 п.н.
26. ДНК-диагностика
Подтверждение диагнозаДиагностика носительства
Пресимптоматическая диагностика
Пренатальная (дородовая)
диагностика
Предимплантационная диагностика
27. Прямая ДНК-диагностика
Определение мутации,являющейся непосредственной
причиной заболевания
Косвенная ДНК-диагностика
Определение хромосомы, несущей
поврежденный ген при семейном
анализе
28. ДНК-ДИАГНОСТИКА
ПРЯМАЯ ДНКДИАГНОСТИКАВозможна только когда
известна структура гена
Возможна и без
больного члена семьи
(анализ ДНК родителей
пробанда)
Высокая точность
Возможна при
полилокусном
заболевании
КОСВЕННАЯ
ДНК-ДИАГНОСТИ КА
Возможна когда известно
положение гена, а
мутация или
последовательность
неизвестны
обязательно проведение
семейного анализа и
анализ образца больного
члена семьи
Точность зависит от
расположения маркеров
Обязательно наличие
одного локуса
заболевания
29. Прямая ДНК-диагностика
ПЦР ( мультиплексная ПЦР, аллельспецифическая амплификация,ПДАФ)
ПЦР-ПДРФ анализ ( анализ
полиморфизма длины
рестрикционных фрагментов)
Секвенирование (определение
последовательности) гена
Блотинг по Саузерну
Биочипы
30. Методы поиска мутаций в генах
SSCP-анализДенатурирующий
гель
электрофорез или
денатурирующая ВЭЖХ
Секвенирование
Биочипы
Блотинг по Саузерну
(детекция крупных
перестроек)
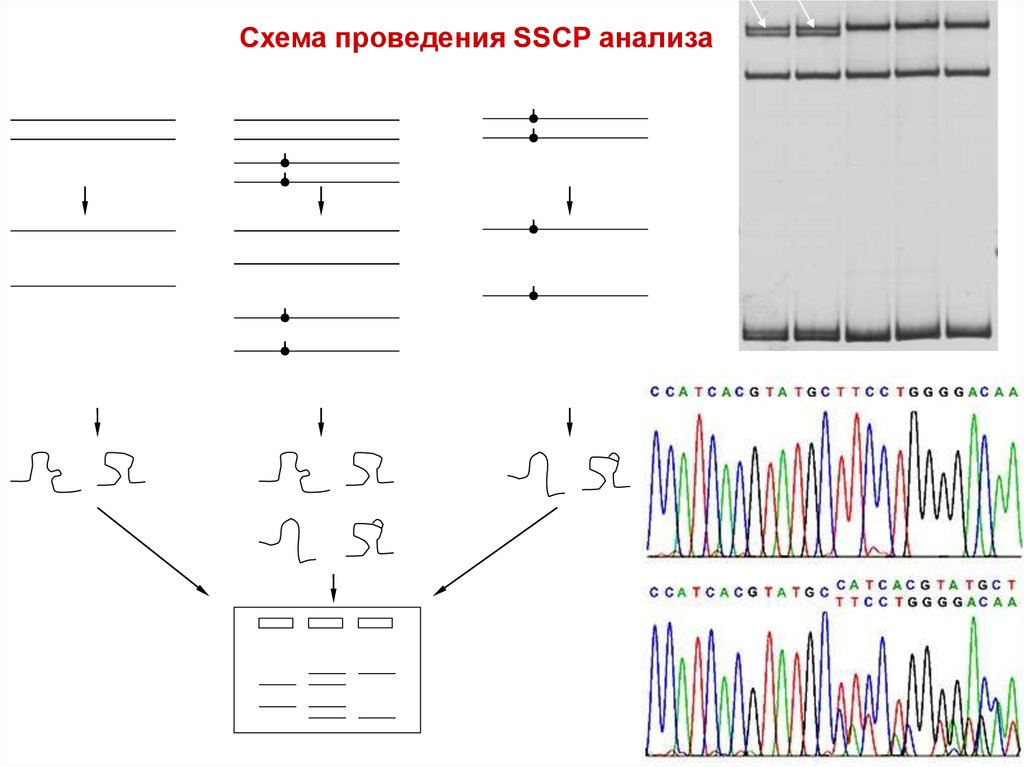
31. SSCP-анализ
Анализ конформационногополиморфизма однонитевой ДНК
Замена даже одного нуклеотида
приводит к измененим конформации
цепей, что изменяет их
электрофоретическую подвижность
Чувствительность 70-80%
32.
Схема проведения SSCP анализаНормальная ДНК (Н)
Мутантная ДНК (М)
денатурация
ренатурация однонитевой ДНК
н/н
н/м
м/м
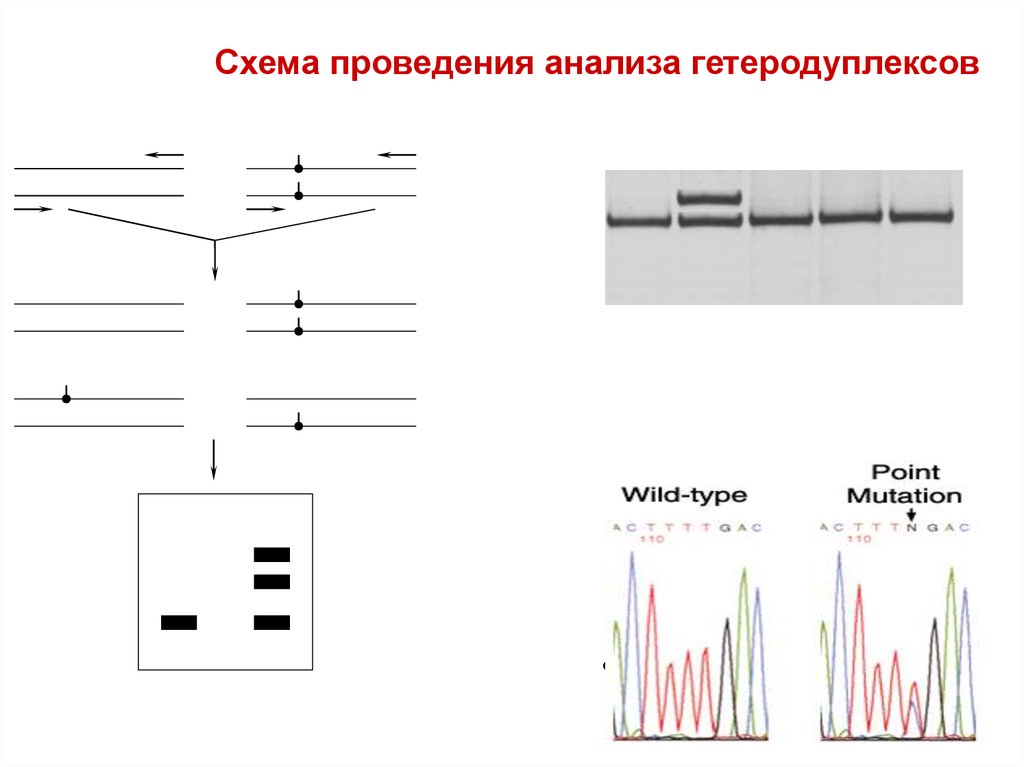
33.
Схема проведения анализа гетеродуплексов (ННормальная ДНК (Н)
Мутантная ДНК(М)
смешивание и
денатурация
гомодуплексы
гетеродуплексы
Н/Н
М/М
34. Диагностика нейрофиброматоза 1 типа (определение мутаций гена NF1 методом SSCP)
12 3
4
5
1
6
2
3
4
5
6
1
экзон 2
1
2
3
4
экзон 26
5
2
3
4
экзон 42
6
1
2
3
4
экзон 40
5
5
6
экзон 8
6
1
2
3
4
5
экзон 13
6
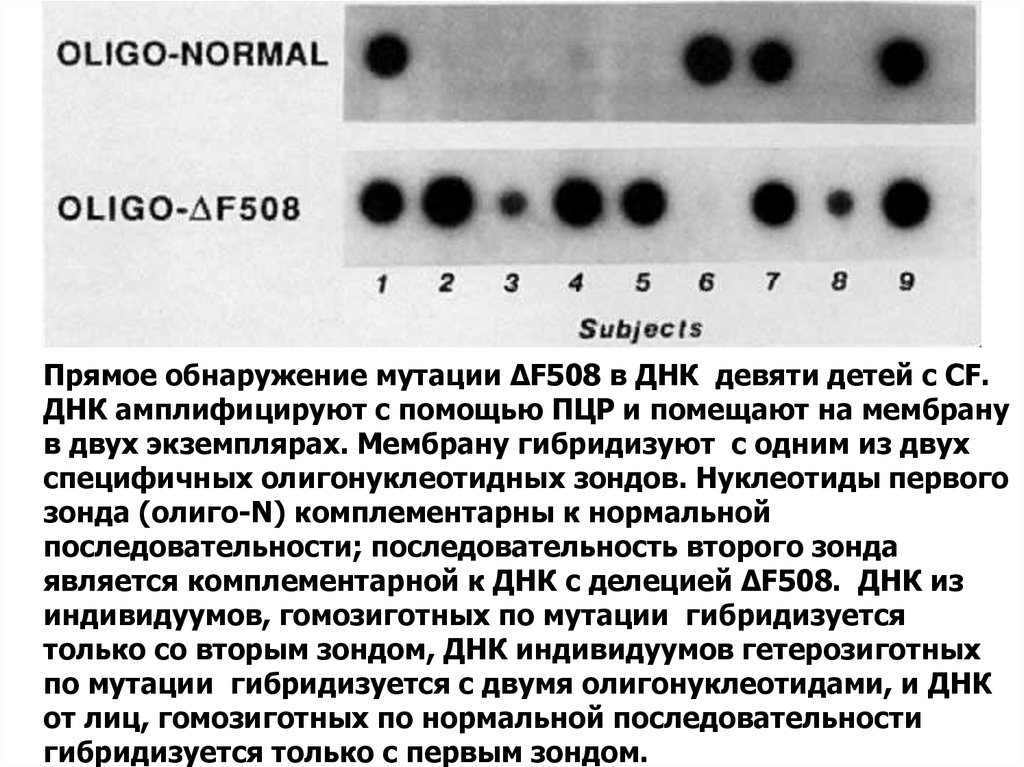
35. Гибридизация ДНК-ДНК - комплементарное взаимодействие между одноцепочечными полинуклеотидами из разных источников (ДНК-зонд и
ДНК-мишень)36.
Прямое обнаружение мутации ΔF508 в ДНК девяти детей с CF.ДНК амплифицируют с помощью ПЦР и помещают на мембрану
в двух экземплярах. Мембрану гибридизуют с одним из двух
специфичных олигонуклеотидных зондов. Нуклеотиды первого
зонда (олиго-N) комплементарны к нормальной
последовательности; последовательность второго зонда
является комплементарной к ДНК с делецией ΔF508. ДНК из
индивидуумов, гомозиготных по мутации гибридизуется
только со вторым зондом, ДНК индивидуумов гетерозиготных
по мутации гибридизуется с двумя олигонуклеотидами, и ДНК
от лиц, гомозиготных по нормальной последовательности
гибридизуется только с первым зондом.
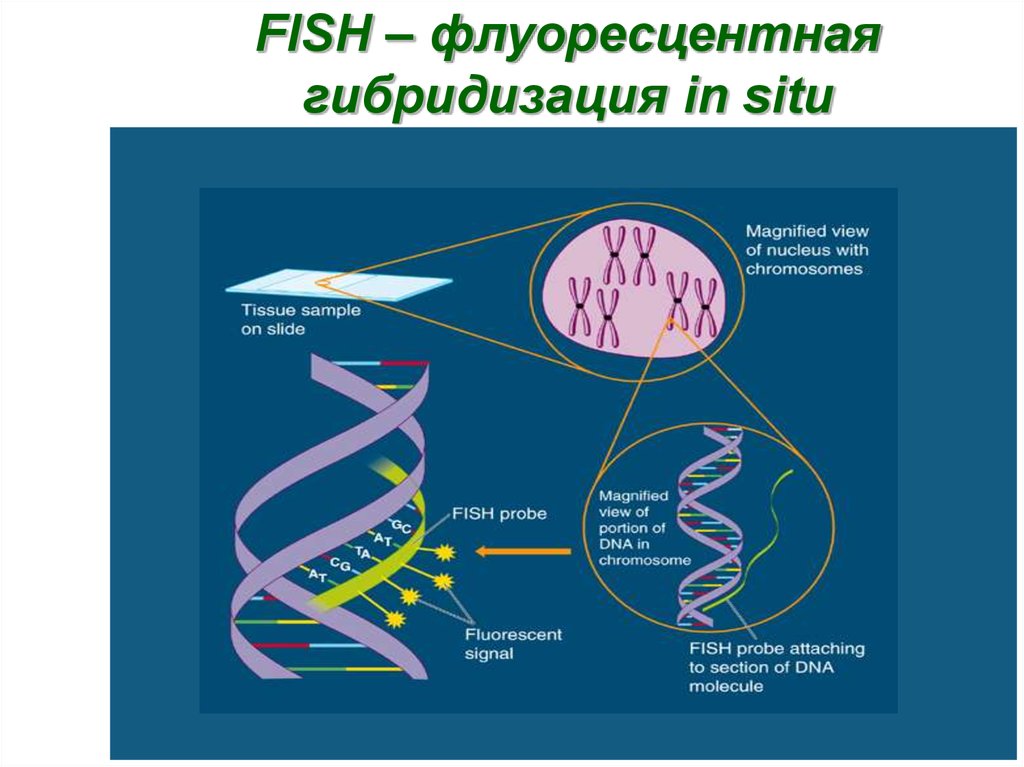
37. FISH – флуоресцентная гибридизация in situ
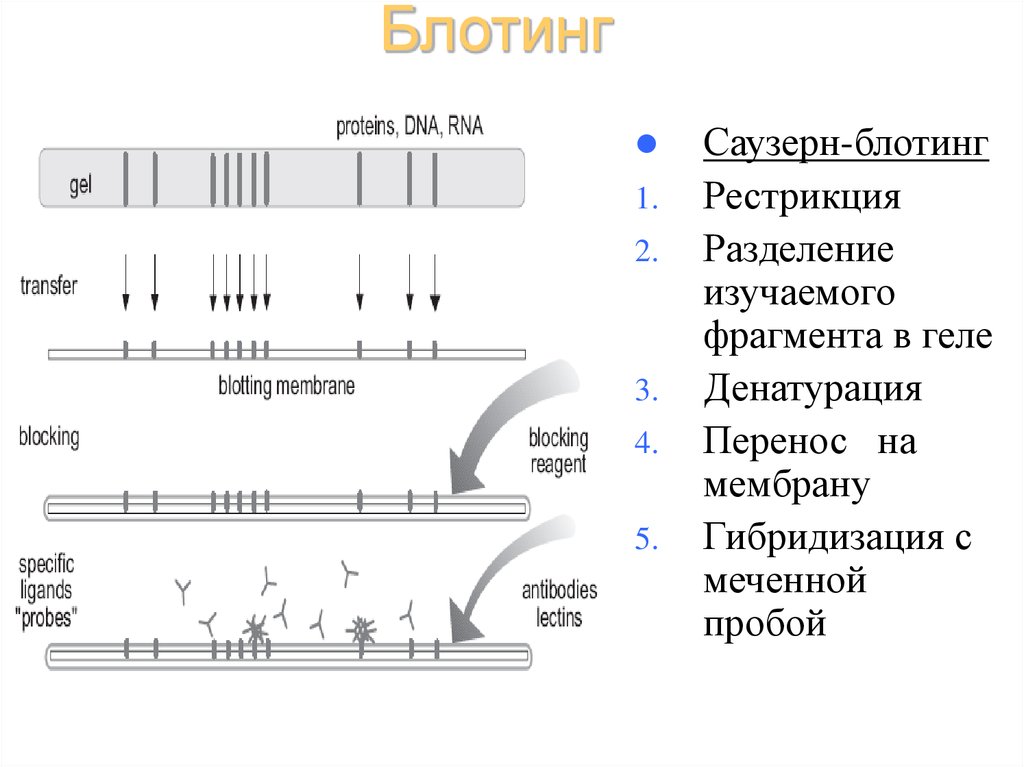
38. Блотинг
1.2.
3.
4.
5.
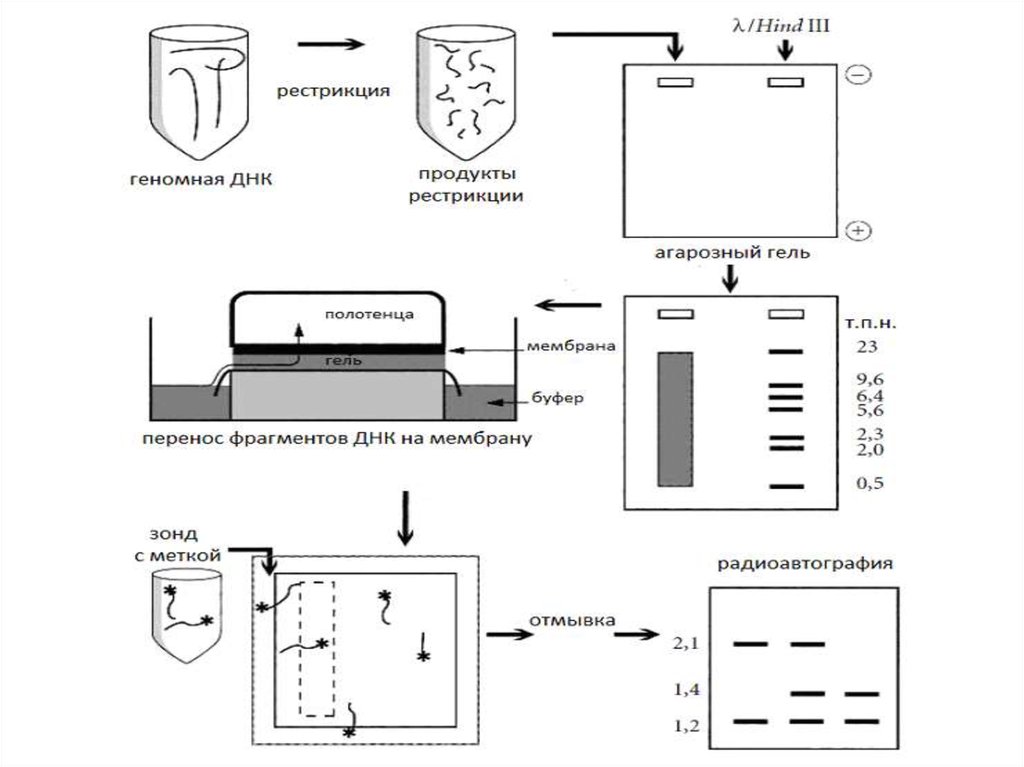
Саузерн-блотинг
Рестрикция
Разделение
изучаемого
фрагмента в геле
Денатурация
Перенос на
мембрану
Гибридизация с
меченной
пробой
39.
40.
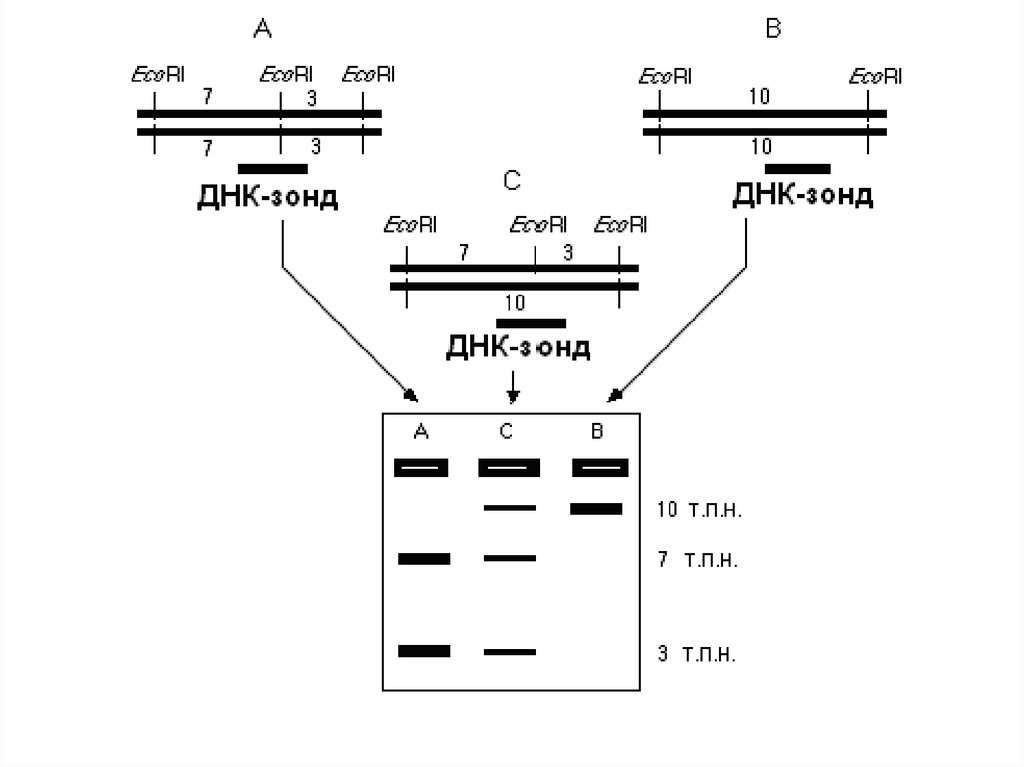
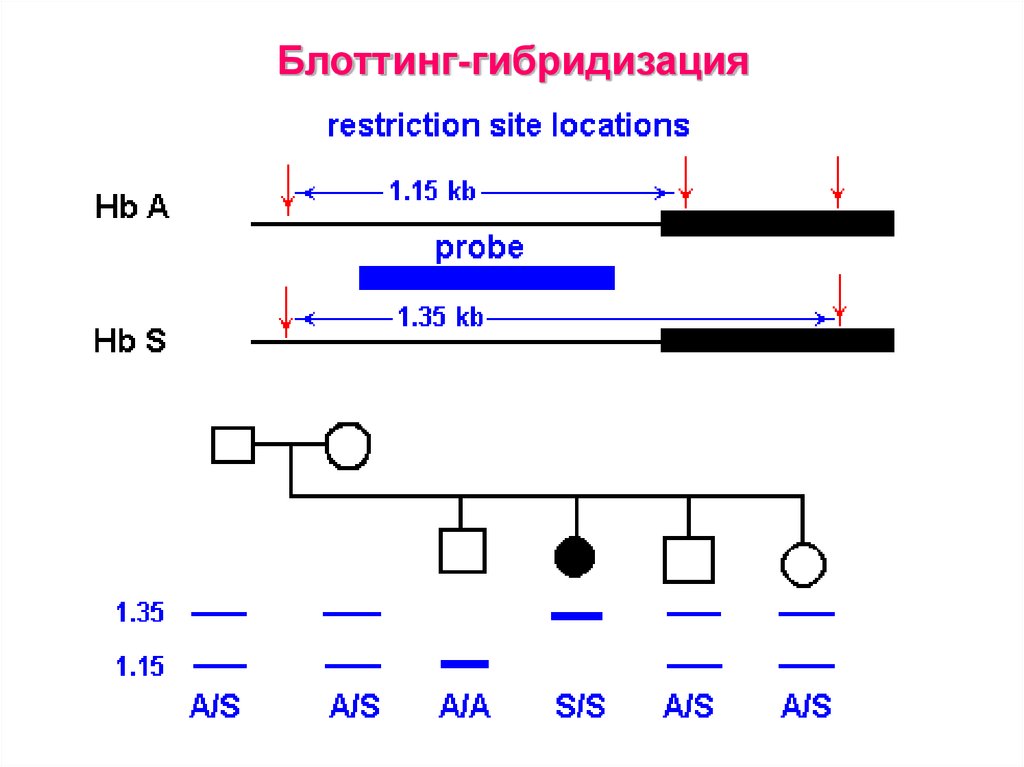
41. Блоттинг-гибридизация
42. Секвенирование ДНК
43. Биочипы
Матрица на которуюнанесены тысячи
олигонуклеотидов
Олигонуклеотиды
специфично
гибридизуются с
меченными молекулами
ДНК
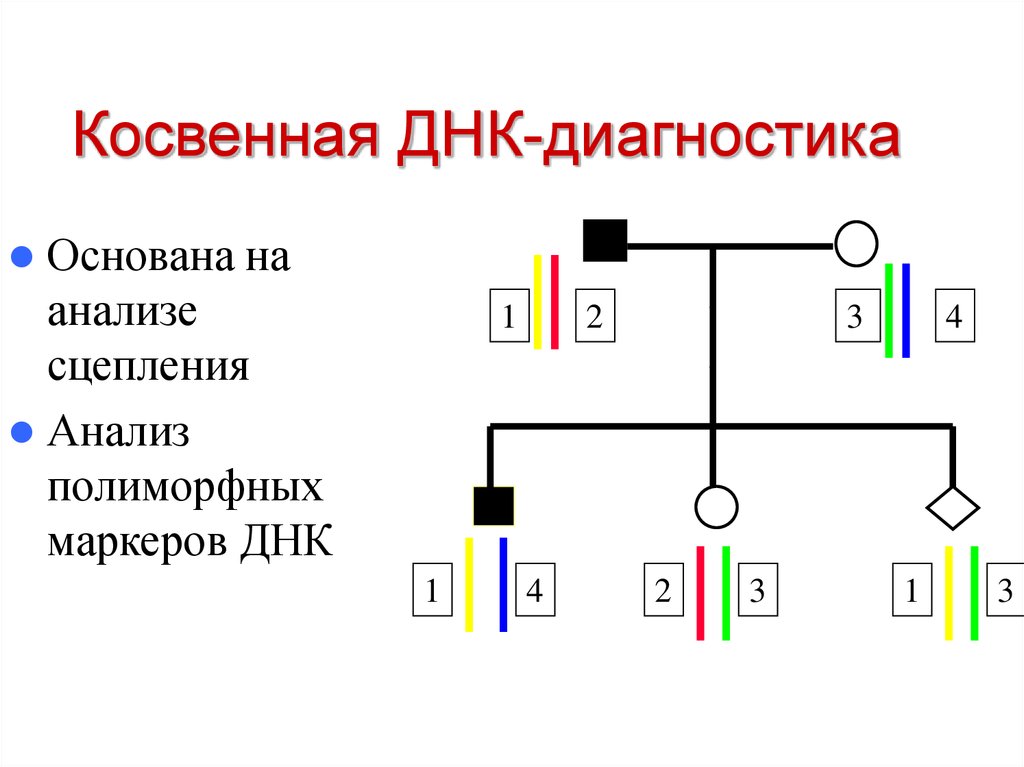
44. Косвенная ДНК-диагностика
Основана наанализе
сцепления
Анализ
полиморфных
маркеров ДНК
1
1
2
4
3
2
3
4
1
3
45. Полиморфные варианты ДНК
Различия в последовательности ДНК(Однонуклеотидные полиморфизмы –
SNP)
-----------AGGCTG-----------------------AAGCTG------------ Различия в длине последовательностей
----------AATG AATG-------------------------AATG AATG AATG------
46. Вариабельность ДНК
Около 99,7% ДНК-последовательности увсех людей идентичны
Около 0,3% (примерно 10 000 000
нуклеотидов) различаются между
отдельными индивидами.
47. Повторяющиеся последовательности
Сателлитная ДНК – размер повторяющегосяэлемента от нескольких сотен до нескольких
тысяч пн
Минисательтная ДНК (VNTR – variant number
tandem repeats) размер повторяющегося элемента
10-100пн
Микросательтная ДНК (STR – short tandem
repeats) размер повторяющегося элемента 2-6 пн
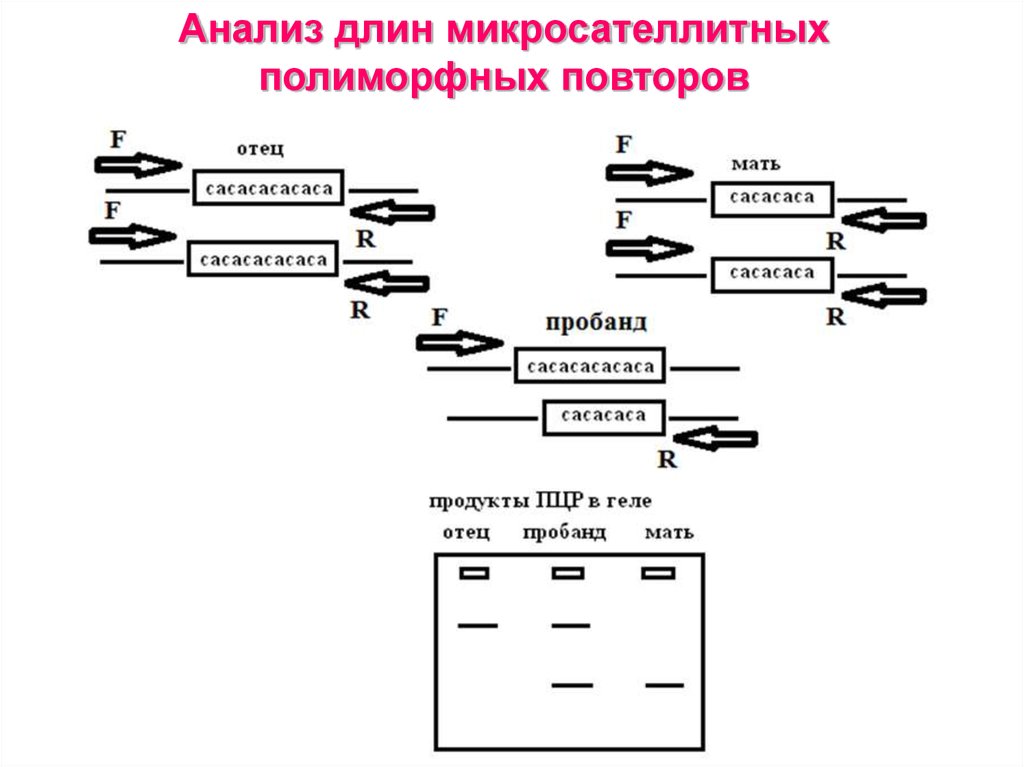
48. Анализ длин микросателлитных полиморфных повторов
49. Номенклатура ДНК-маркеров
ДНК-маркеры, расположенные за пределамигена обозначаются согласно их положению на
хромосоме.
D16S539
D – ДНК
16- хромосома
S – единичная копия последовательности
539- 539 локус описанный на хромосоме 16
50. Выбор ДНК-маркеров
Внутригенные ДНК-маркеры(полиморфизмы в генах )
Расположенные близко к исследуемому
гену. Фланкирующие ген с теломерной и
центромерной сторон
51.
Чемближе расположены маркеры к гену,
тем теснее они сцеплены, тем ниже
процент ошибки
A4
A3
М
A2
Н
A1
Расстояние
A4
A3
A4
М
A2
М
A2
Н
A1
оценивают в сантиморганидах
(1СМ –1%- 1000 000 пн)
52.
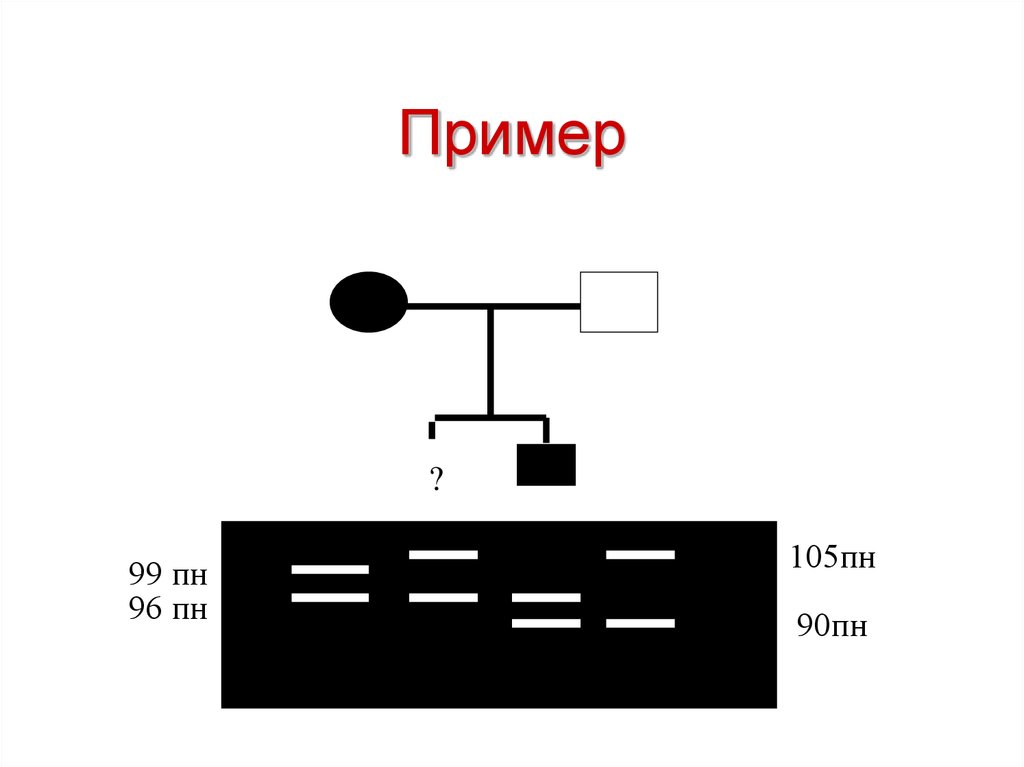
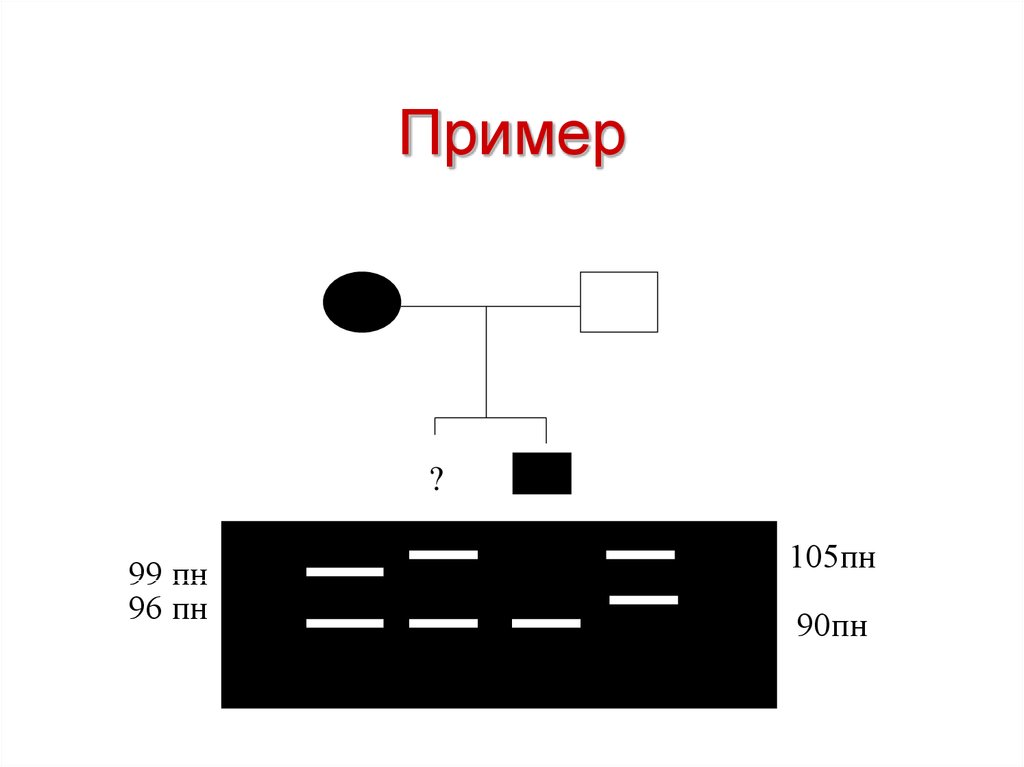
?53. Пример
?99 пн
96 пн
105пн
90пн
54. Пример
?99 пн
96 пн
105пн
90пн
55. ДНК-диагностика
по возможности использоватьнесколько подходов к диагностике
(например, прямые и косвенные)
анализ семейного материала даже в
случае прямой диагностики
Контроль воспроизводимости
результатов
Контроль на загрязнение плодного
материала материнским
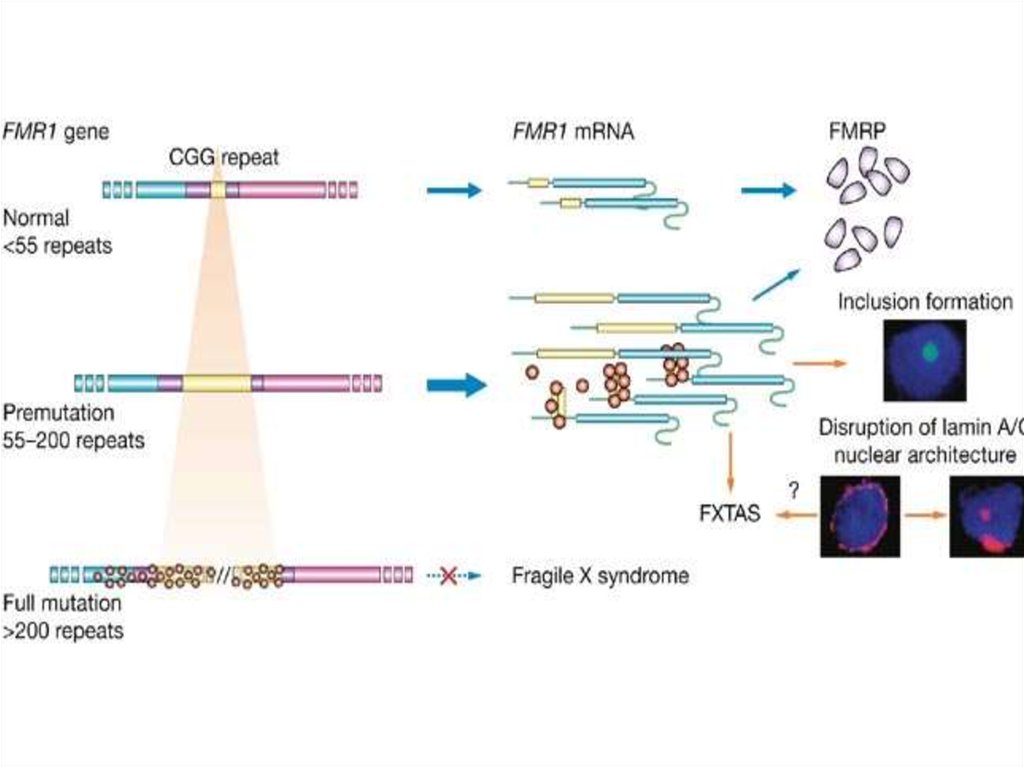
56. Болезни экспансии тринуклеотидных повторов
Экспансия кодирующихтринуклеотидных
повторов
CAG-повторы –
полиглутаминовые
тракты
Хорея Гентингтона
GCG,GCA,GCT,GCCповторыполиаланиновые тракты
1. Небольшое количество
повторений при
патологии
2. Новыя функция белка
3. Цитотоксический
эффект
Экспансия не
кодирующих
тринуклеотидных
повторов
Различные триплеты
Синдром Мартина-Белл
(УО FRAXA, FRAXE, FRAXF)
1. Большое количество
повторений
2. Расположены в
регуляторных областях
57. Синдром Мартина-Белл
- Нормальное телосложение- Широкий лоб
- Удлинненное лицо
- Крупные оттопыренные уши
- Страбизм (косоглазие)
- Высокое арочное нёбо
Гиперэластичность суставов
- Мозоли (аутоагрессия)
- Пролапс митрального клапана
-
Макроорхизм
- Гипотония
- Мягкая эластичная кожа
-
Плоскостопие
- Судороги (~10%)
- Аутизм
-
-
Умственная отсталость
58.
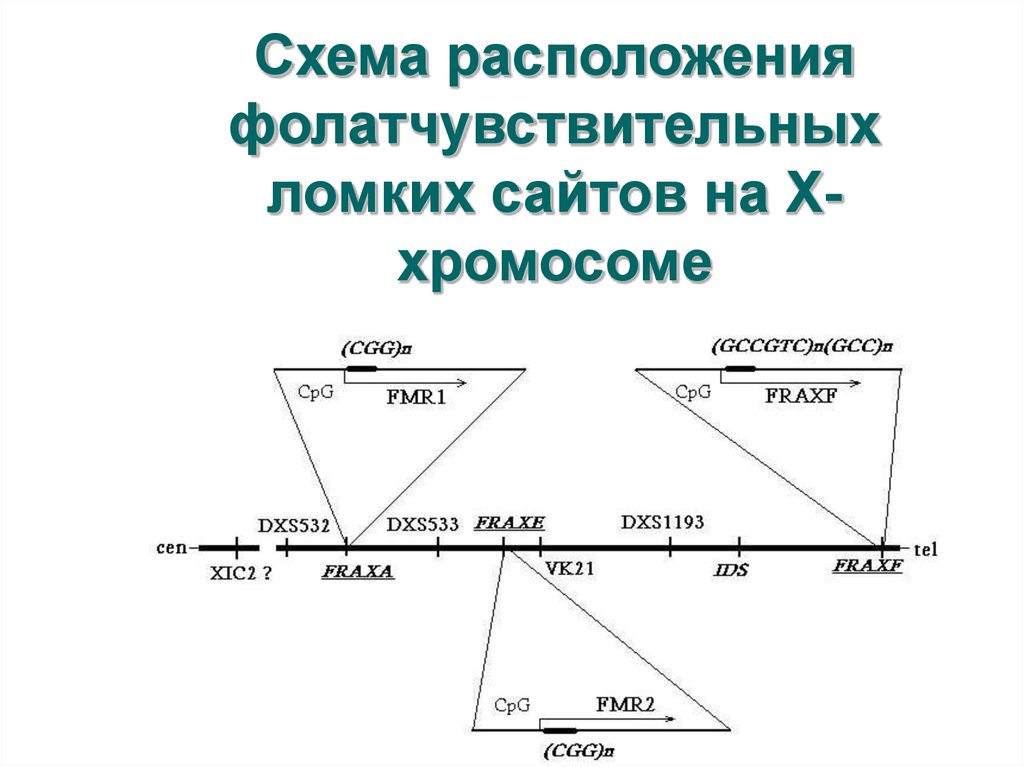
59. Схема расположения фолатчувствительных ломких сайтов на Х-хромосоме
Схема расположенияфолатчувствительных
ломких сайтов на Ххромосоме
60.
61.
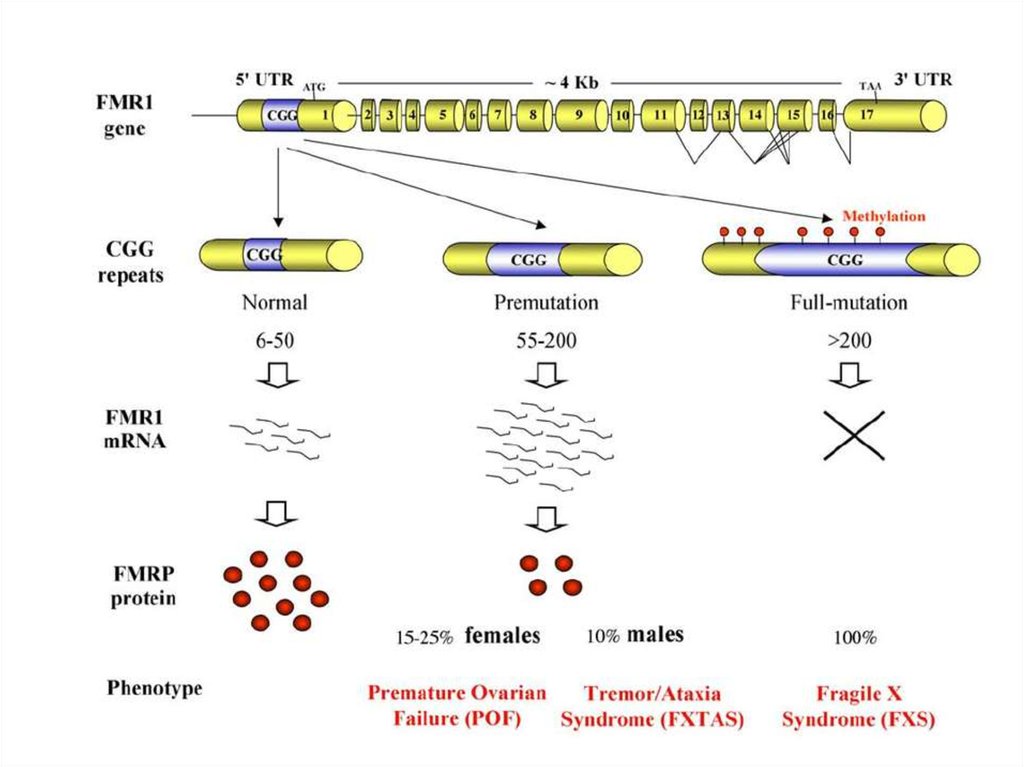
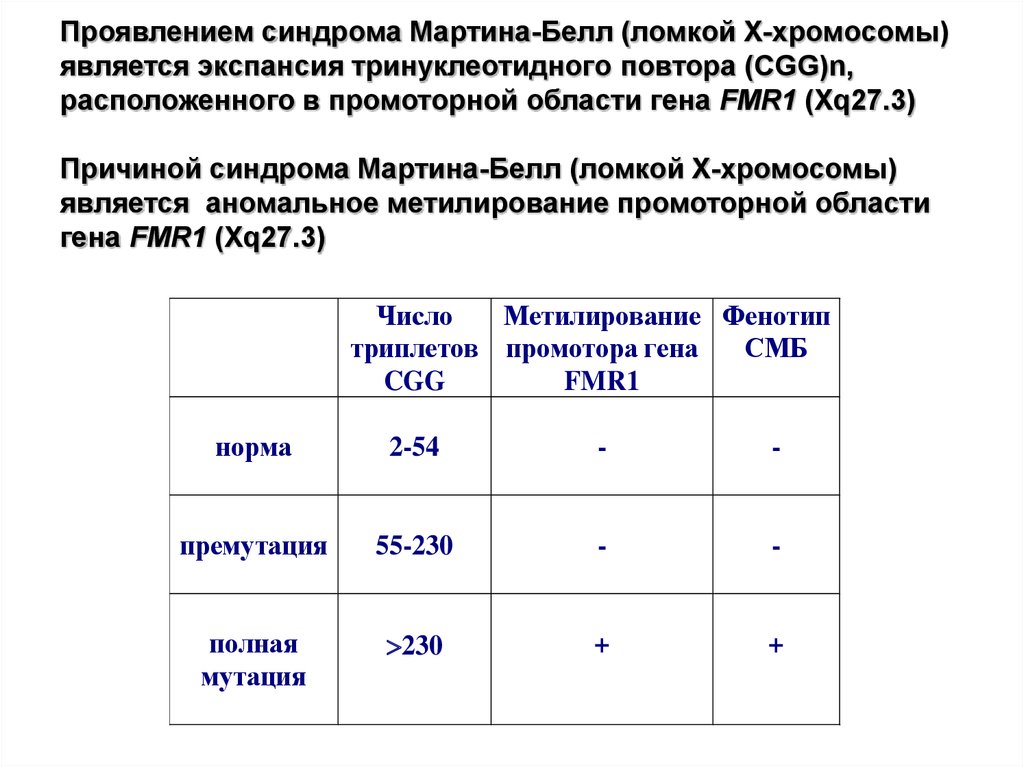
62. Проявлением синдрома Мартина-Белл (ломкой Х-хромосомы) является экспансия тринуклеотидного повтора (CGG)n, расположенного в
промоторной области гена FMR1 (Xq27.3)Причиной синдрома Мартина-Белл (ломкой Х-хромосомы)
является аномальное метилирование промоторной области
гена FMR1 (Xq27.3)
Число
Метилирование Фенотип
триплетов промотора гена
СМБ
CGG
FMR1
норма
2-54
-
-
премутация
55-230
-
-
полная
мутация
230
+
+
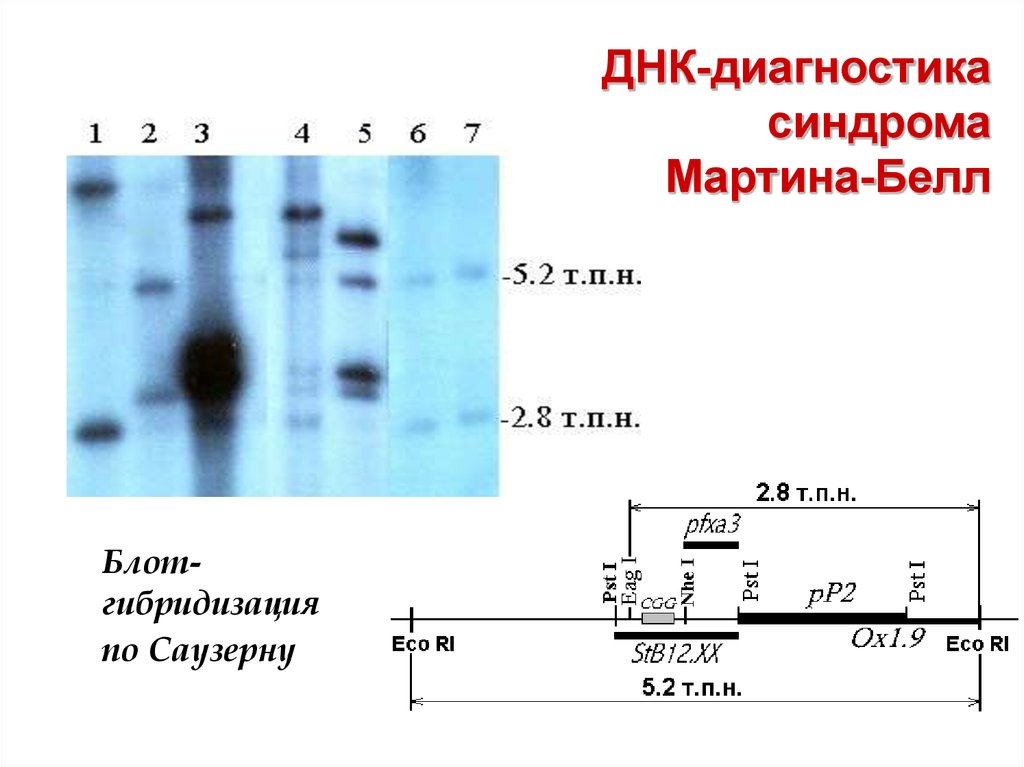
63. ДНК-диагностика синдрома Мартина-Белл
Блотгибридизацияпо Саузерну
64.
Молекулярно-генетическая диагностикасиндрома Мартина-Белл
М
1- ДНК нат., 2 –ДНК HpaII
1,2 – пациент FRAX; 3,4 – нормальный
мужчина; 5,6 - пациент FRAX; 7,8 –
нормальный мужчина
1
2
3
4
5
6
7
8
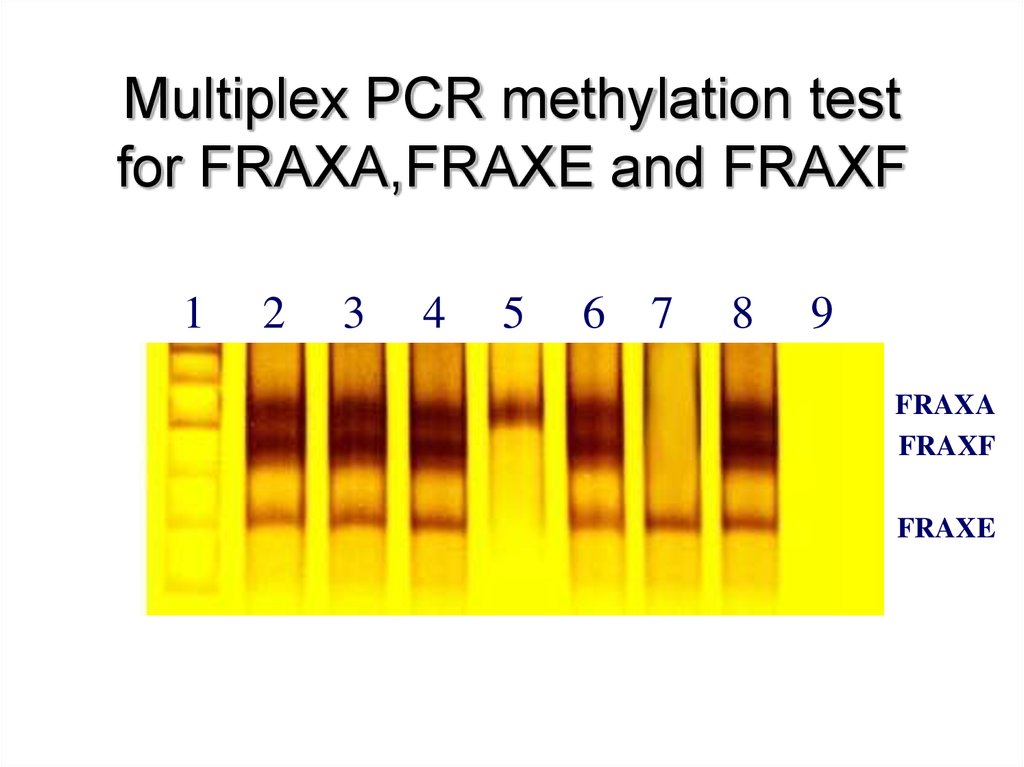
65. Multiplex PCR methylation test for FRAXA,FRAXE and FRAXF
12
3
4
5
6
7
8
9
FRAXA
FRAXF
FRAXE
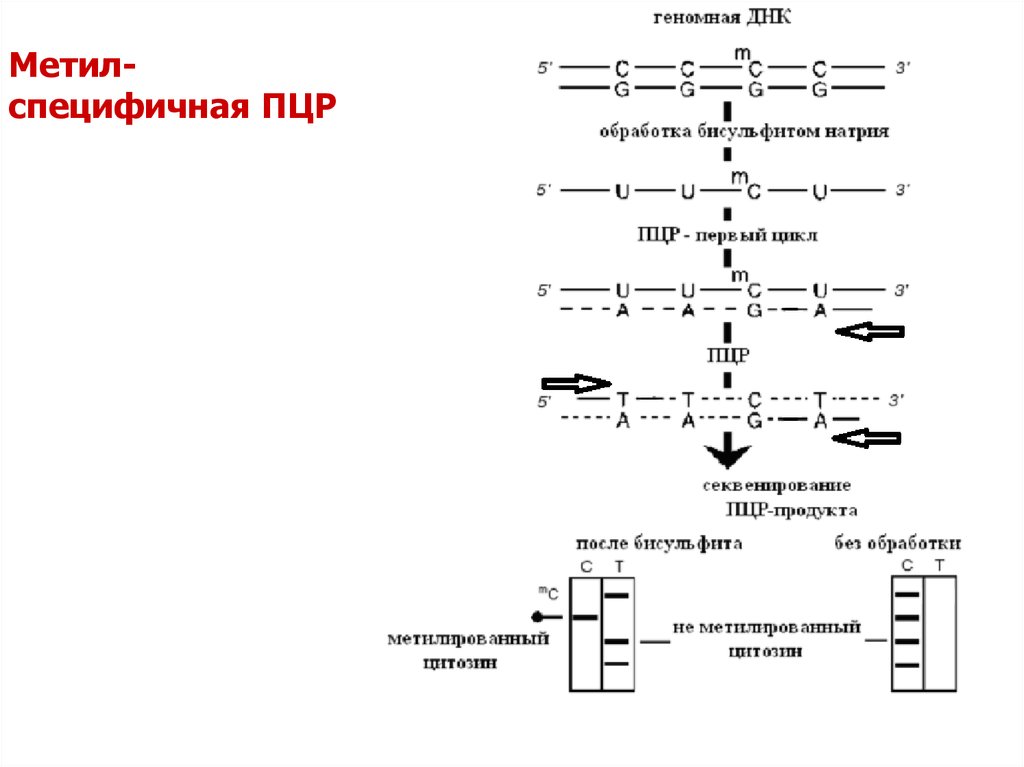
66. Метил- специфичная ПЦР
Метилспецифичная ПЦР67.
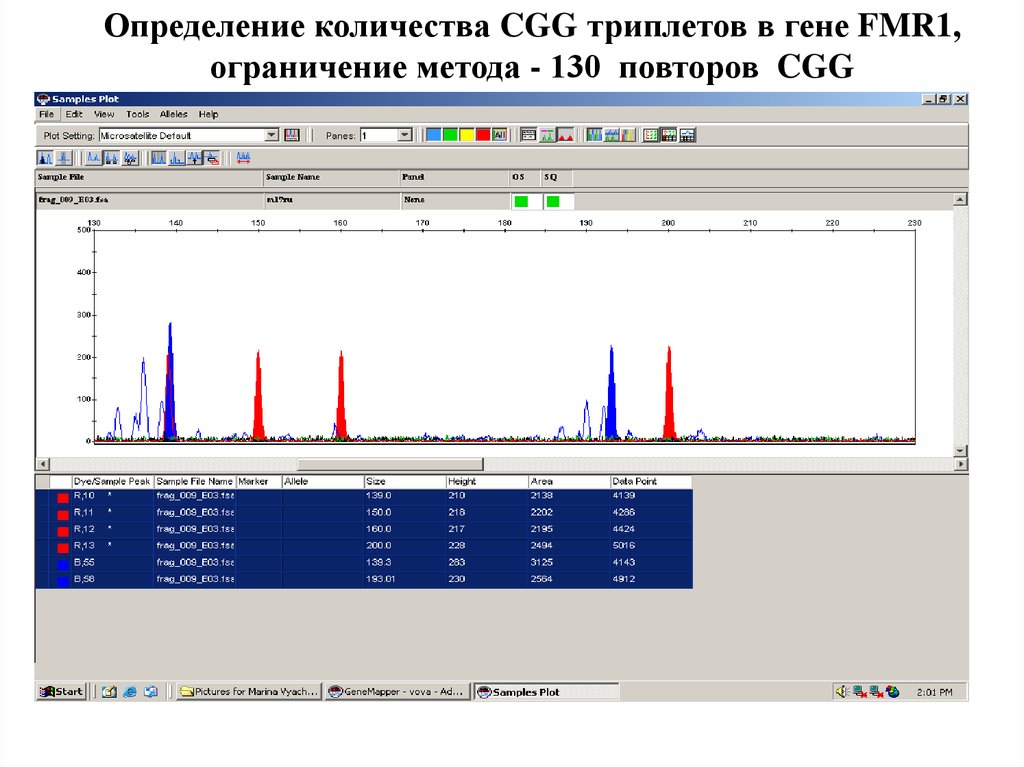
Определение количества CGG триплетов в гене FMR1,ограничение метода - 130 повторов CGG
68.
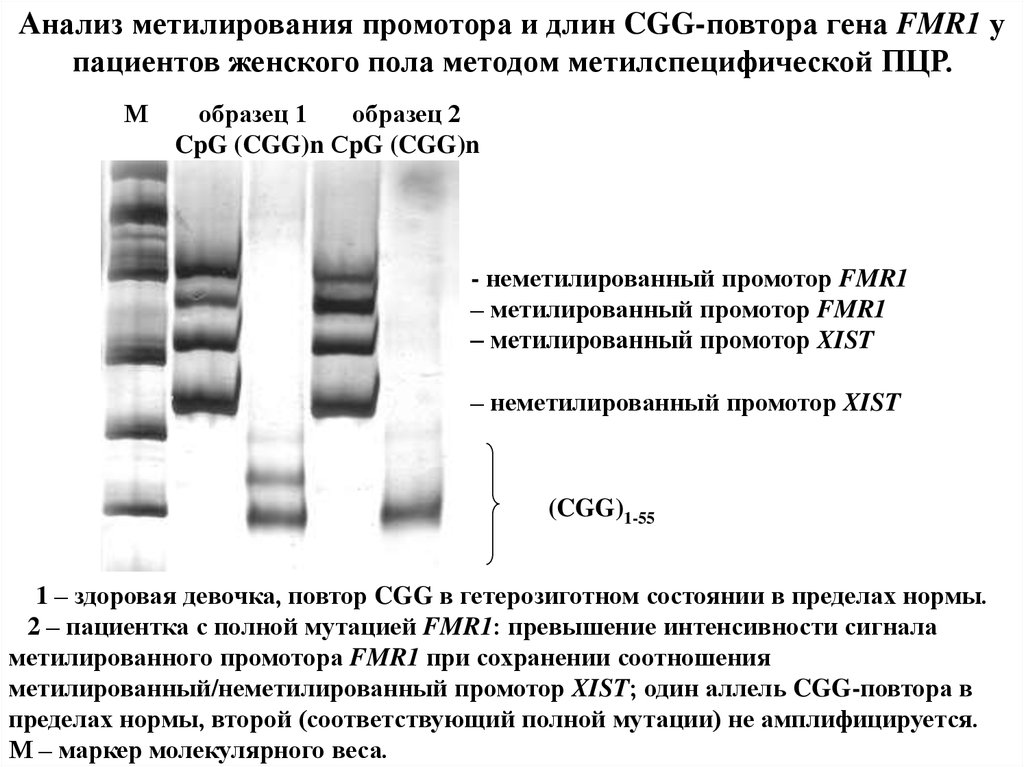
Анализ метилирования промотора и длин CGG-повтора гена FMR1 упациентов женского пола методом метилспецифической ПЦР.
М
образец 1
образец 2
CpG (CGG)n СpG (CGG)n
- неметилированный промотор FMR1
– метилированный промотор FMR1
– метилированный промотор XIST
– неметилированный промотор XIST
(CGG)1-55
1 – здоровая девочка, повтор CGG в гетерозиготном состоянии в пределах нормы.
2 – пациентка с полной мутацией FMR1: превышение интенсивности сигнала
метилированного промотора FMR1 при сохранении соотношения
метилированный/неметилированный промотор XIST; один аллель CGG-повтора в
пределах нормы, второй (соответствующий полной мутации) не амплифицируется.
М – маркер молекулярного веса.
69. Диагностика синдрома Мартина-Бепп
1п м
п
2
м
п
3
м
4
п м
п
5
м
п
6
м
п
7
м
п
8
м
п
9
м
М
н/м FMR1
м FMR1
м XIST
н/мXIST
1,2,4,9 – нормальные женщины
3 – женщина с полной мутацией FMR1 и аномальным метилированием
промотора
5,6,7,8 – семья с FRAX, 5 – мать с премутацией, 6 – больной сын с
полной мутацией FMR1 и аномальным метелированием промотора, 7 –
здоровая сестра пробанда без носительства, 8 - отец
70.
Диагностика синдрома Мартина-Белл1. Исследование кариотипа пробанда для исключения
хромосомной патологии, не имеющей отношения к
СМБ
2. Анализ состояния метилирования промоторной
области FMR1 у больных без выраженной
хромосомной патологии: методом МЧ-ПЦР для
больных мужского пола и методом блотгибридизации по Саузерну для больных женского
пола
3. Анализ ДНК родственников выявленных больных с
СМБ для определения носителей премутаций и
полных мутаций. Метод выбора – анализ сцепления
по фланкирующим STR-маркерам.
4. Пренатальная диагностика по STR-маркерам на



































 biology
biology








