Similar presentations:
Эпигенетика. Эпигенетическая регуляция генной экспрессии. Механизмы эпигенетической регуляции. Гистоновый код. Рнк-интерференция
1.
Семинар 6Немцова М.В.
Медицинская генетика
Фармация Курс 3 ЦИОП «Медицина
будущего»
Эпигенетика. Эпигенетическая регуляция
генной экспрессии. Механизмы
эпигенетической регуляции. Гистоновый код.
РНК-интерференция.
Метилирование/деметилирование ДНК.
2.
1. В одноклеточных организмах каждая клеткаиспользует почти всю геномную информацию
и располагает практически идентичным
фенотипом.
2. У млекопитающих имеется несколько сотен,
различных типов клеток. Все эти типы клеток
происходят из одной клетки - зиготы.
3. Дифференцировка каждого типа проходит
без изменения последовательности ДНК, на за
счет скоординированного использования
субнаборов генов.
Для этого используется ряд
эпигенетических механизмов.
3. "epigenetic landscape" (Waddington 1957)
"epigenetic landscape" (Waddington 1957)В 1942 году Уоддингтон создал свой самый знаменитый
рисунок «эпигенетический ландшафт».
Этот рисунок наглядно показывает влияние генов и
окружающей среды на развитие организма.
Эпигенетические программы изображены в виде долин, по
которым, словно шар, скатывается организм. Внешние
воздействия отклоняют шар от намеченной траектории, а
если они достаточно сильны или приходятся на развилку,
могут привести к перемещению в другую долину. Тогда
организм меняется.
4.
Геном содержит информацию двух видов– генетическую и эпигенетическую.
Генетическая информация – руководство по созданию
живого организма.
Эпигенетическая информация – как, где и когда
должна быть реализована генетическая информация.
5.
В 1990 г. Робин Холлидей дал более конкретноеопределение эпигенетики. «Исследование механизмов
временного и пространственного контроля генной
активности в сложных организмах».
В 1992 г. Брайан Холл определил эпигенетику, как
«сумму генетических и негенетических факторов,
воздействующих на клетки в целях селективного
контроля экспрессии генов, которые позволяют
увеличить фенотипическое разнообразие в процессе
развития».
Еще более узкое определение эпигенетики было
предложено в 1996 г. Руссо и соавт.: «исследование
митотически и/или мейотически наследуемых
изменений в экспрессии генов, которые нельзя
объяснить изменениями в ДНК»
2006 г. Эндрю Файер и Крейг Мелло - первые
эпигенетики, получившие Нобелевскую премию
(РНК-интерференция).
6.
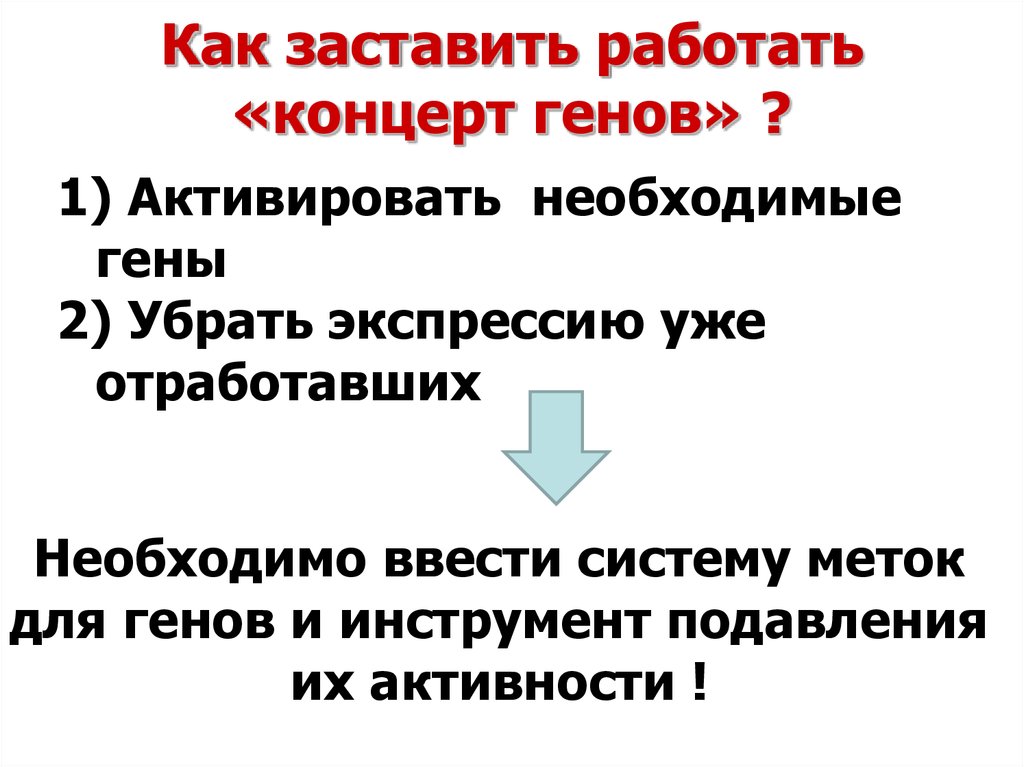
7. Как заставить работать «концерт генов» ?
1) Активировать необходимыегены
2) Убрать экспрессию уже
отработавших
Необходимо ввести систему меток
для генов и инструмент подавления
их активности !
8.
Эпигенетические изменения наследственные и ненаследственныеизменения в экспрессии гена без каких-либо
соответствующих структурных изменений в
его ДНК.
Проявление эпигенетической регуляции у
человека
•Структурно-функциональная организация
хроматина определенных хромосомных
локусов (ремоделлинг хроматина)
•Ковалентные модификация
(метилирование и ацетиллирование и др.)
гистонов (гистоновый код)
•РНК-интерференция
•Метилирование ДНК
9.
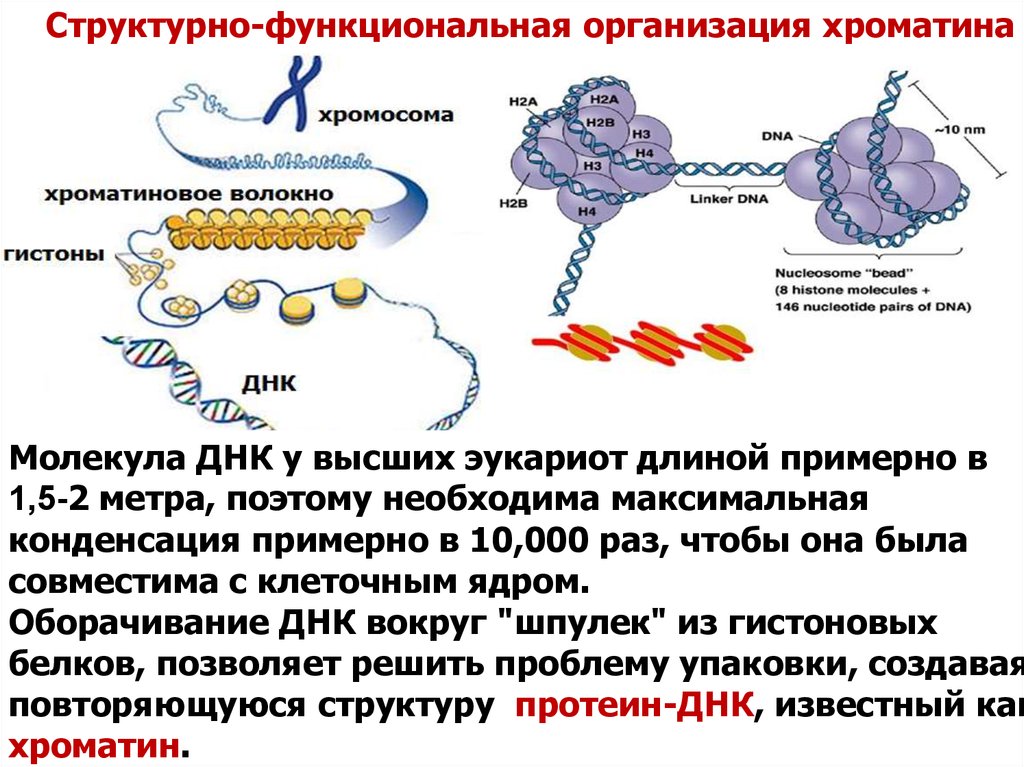
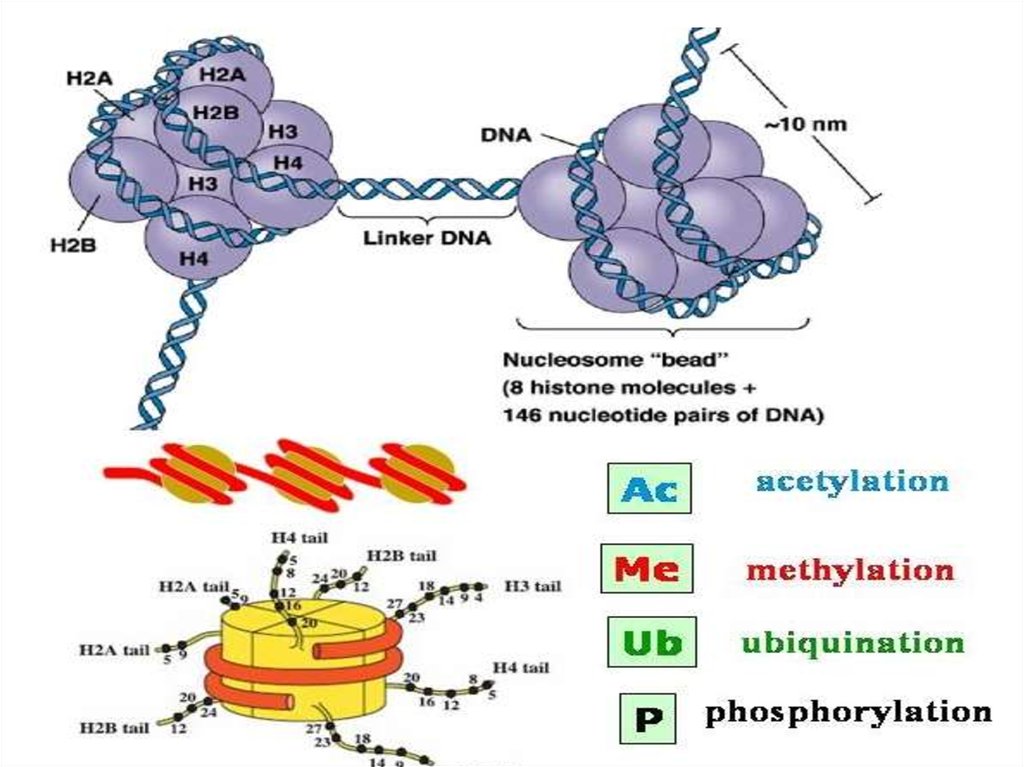
Структурно-функциональная организация хроматинаМолекула ДНК у высших эукариот длиной примерно в
1,5-2 метра, поэтому необходима максимальная
конденсация примерно в 10,000 раз, чтобы она была
совместима с клеточным ядром.
Оборачивание ДНК вокруг "шпулек" из гистоновых
белков, позволяет решить проблему упаковки, создавая
повторяющуюся структуру протеин-ДНК, известный как
хроматин.
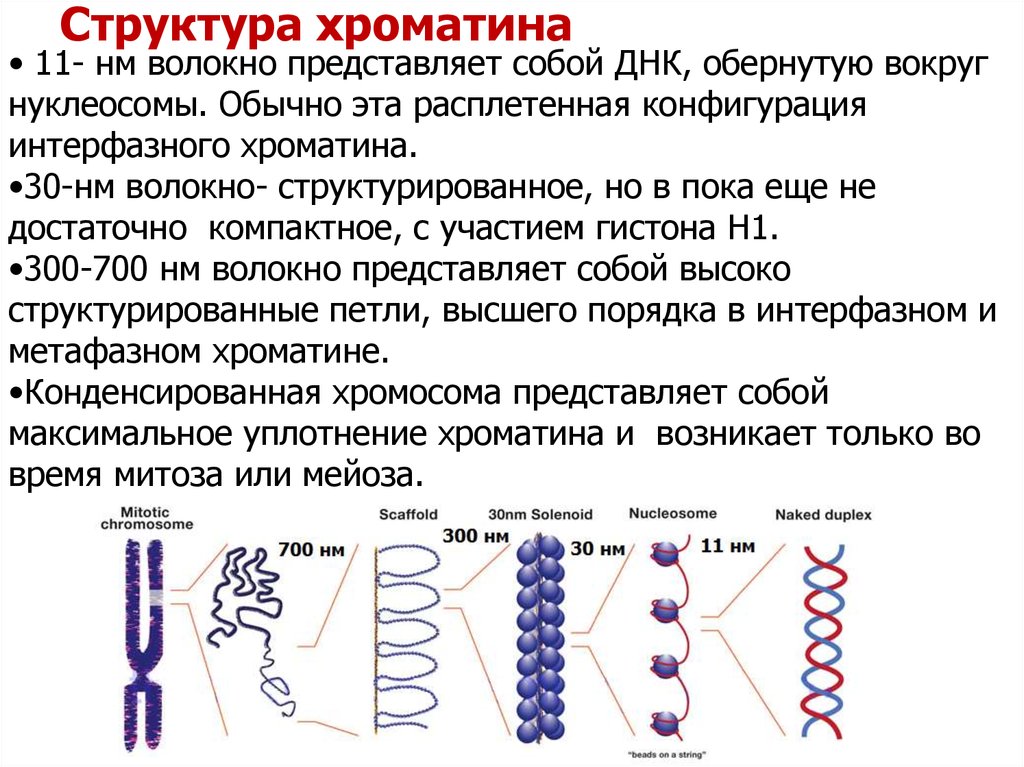
10. Структура хроматина
• 11- нм волокно представляет собой ДНК, обернутую вокругнуклеосомы. Обычно эта расплетенная конфигурация
интерфазного хроматина.
•30-нм волокно- структурированное, но в пока еще не
достаточно компактное, с участием гистона H1.
•300-700 нм волокно представляет собой высоко
структурированные петли, высшего порядка в интерфазном и
метафазном хроматине.
•Конденсированная хромосома представляет собой
максимальное уплотнение хроматина и возникает только во
время митоза или мейоза.
300 нм
11 нм
11.
Конститутивный (структурный)гетерохроматин
содержится в обеих гомологичных хромосомах и
локализован преимущественно в центромере
теломерах, ядрышковом организаторе.
ДНК конституивного гетерохроматина является
преимущественно сателлитной ДНК,
состоящей из тандемных повторов (к примеру, HS1
(Human Satellite 1), HS2, HS3, альфа-сателлит и
прочие сателлиты человека). В интерфазном ядре
конститутивный гетерохроматин образует
хромоцентры с внутренней стороны ядерной
мембраны, и в районах ядрышковых организаторов.
Конститутивный гетерохроматин можно найти в
районах, обогащенных дупликонами и псевдогенами
(в организме человека в основном на хромосомах
1,9,16 и X).
.
12.
Центромера13.
Факультативный гетерохроматинне постоянный, он может превращаться
в эухоматин в некоторых клетках или на
разных стадиях онтогенеза организма.
Обычно факультативные гетерохроматиновые
участки присутствуют только в одной из
гомологичных хромосом. Типичным примером
факультативного гетерохроматина является
неактивная половая хромосома при гомогаметном
кариотипе, к примеру, неактивная X-хромосома у
женских особей млекопитающих, которая
инактивирующаяся в конденсированное
гетерохроматиновое состояние; такая
гетерохроматиновая X-хромосома наблюдается в
интерфазе как тельце Барра. При гаметогенезе и на
ранних стадиях эмбриогенеза обе X-хромосомы
являются эухроматиновыми и транскрипционно
активными.
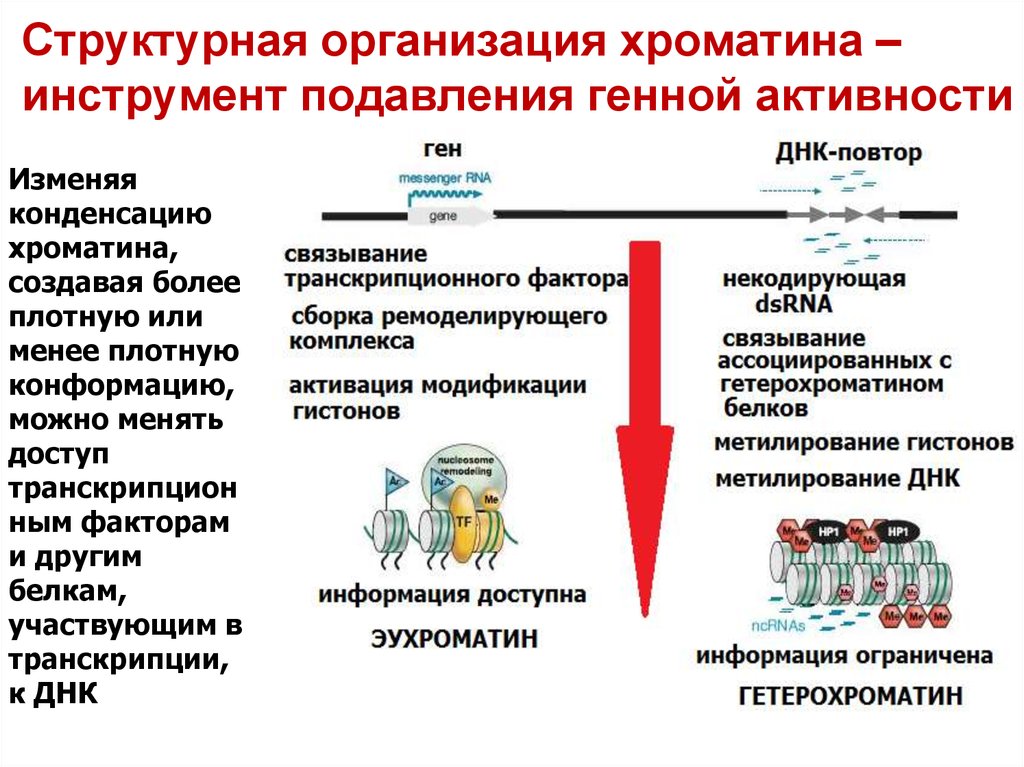
14. Структурная организация хроматина – инструмент подавления генной активности
Изменяяконденсацию
хроматина,
создавая более
плотную или
менее плотную
конформацию,
можно менять
доступ
транскрипцион
ным факторам
и другим
белкам,
участвующим в
транскрипции,
к ДНК
15.
16.
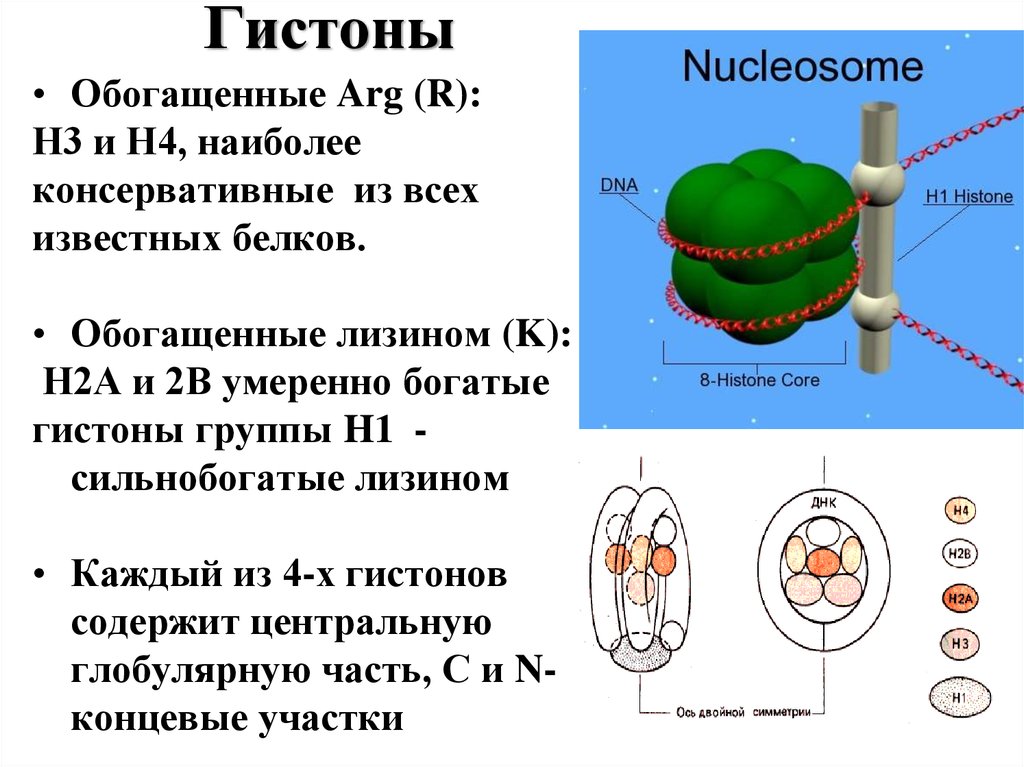
17. Гистоны
• Обогащенные Arg (R):Н3 и Н4, наиболее
консервативные из всех
известных белков.
• Обогащенные лизином (K):
Н2А и 2В умеренно богатые
гистоны группы H1 сильнобогатые лизином
• Каждый из 4-х гистонов
содержит центральную
глобулярную часть, С и Nконцевые участки
18.
19.
Метилирование ифосфорилирование
Ацетилирование и
метилирование
стрежневых гистонов,
особенно H3 и H4,
являются основными
среди описанных
ковалентных
модификаций и считается,
что они коррелируют с
позитивными и
негативными
изменениями
транскрипционной
активности.
20.
Ацетилирование гистоновГистон ацетилаза
Гистон деацетилаза
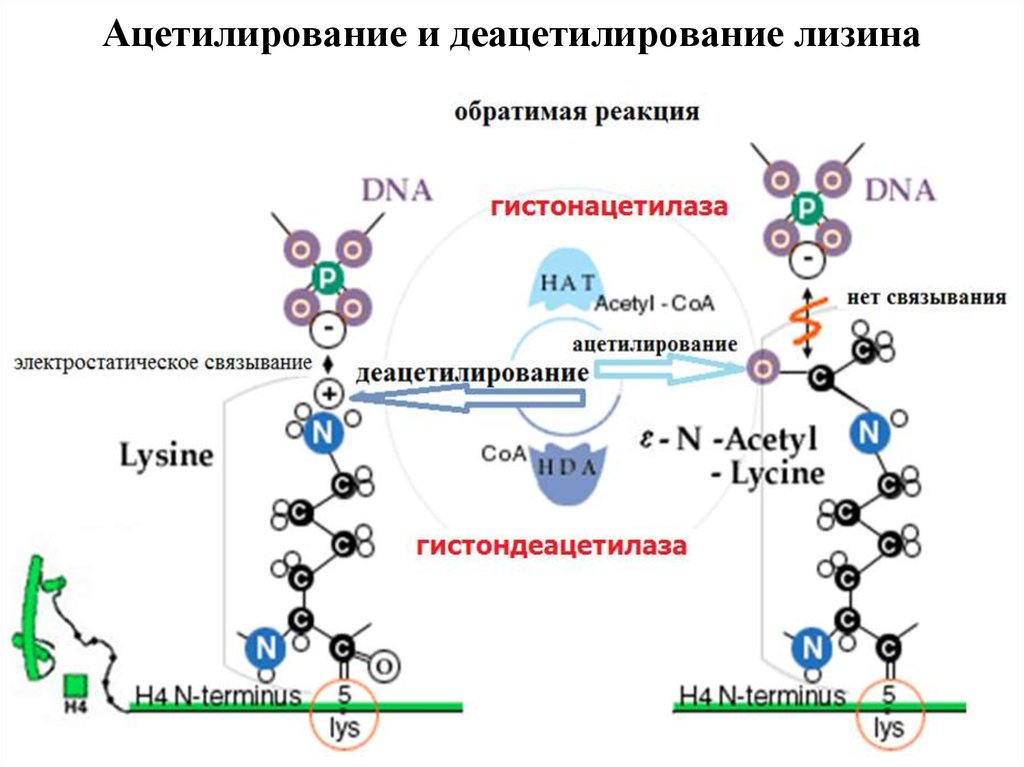
21. Ацетилирование и деацетилирование лизина
22. Ферменты модификации гистонов
• Гистоновая ацетилтрансфераза (HATs) ацетилируетспецифический лизиновый остаток в гистонах, а
обратная реакция происходит с помощью
гистоновой деацетилазы (HDACs).
• Семейство гистоновых киназ фосфорилирует
специфический сериновый или треониновый
остаток, а фосфатазы (PPTases) удаляют метки
фосфорилирования. Особенно хорошо изучены
митотические киназы, такие как cyclin-зависимая
киназа, которая катализирует фосфорилирование
стержневого (H3) и линкерного (H1) гистонов.
• Описаны два основных класса метилирующих
ферментов: PRMTs (аргинин метилтрансфераза ),
чьим субстратом является аргинин и HKMTs (лизин
метилтрансфераза), которая действует на
лизиновый остаток.
23.
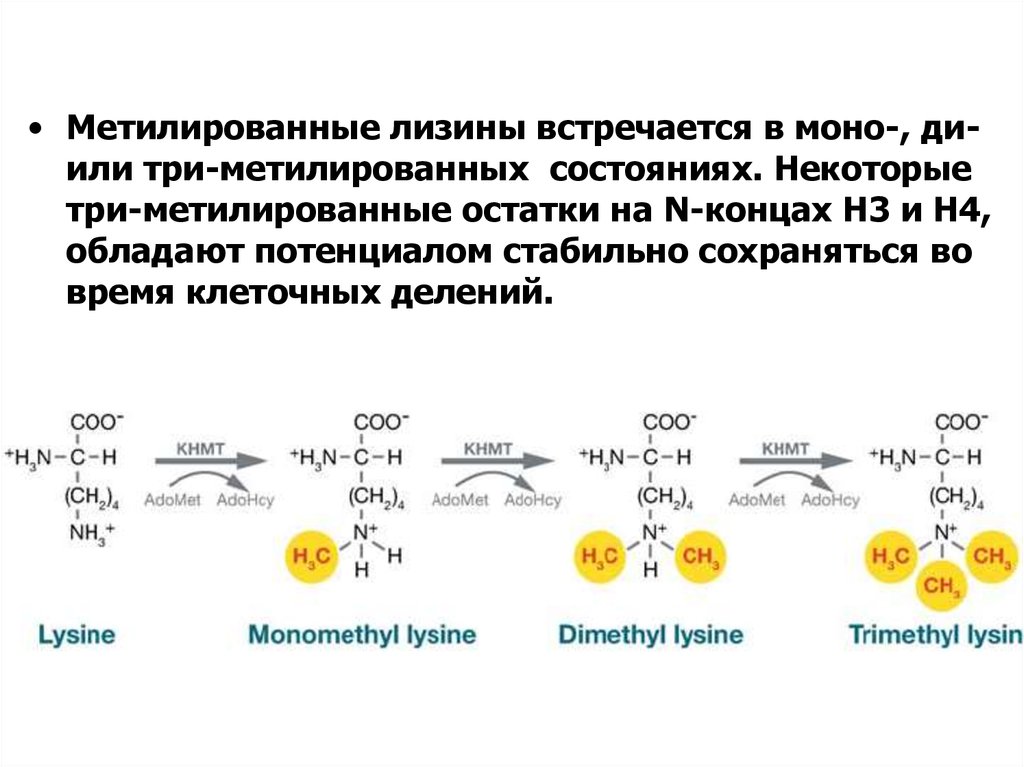
• Метилированные лизины встречается в моно-, диили три-метилированных состояниях. Некоторыетри-метилированные остатки на N-концах H3 и H4,
обладают потенциалом стабильно сохраняться во
время клеточных делений.
24.
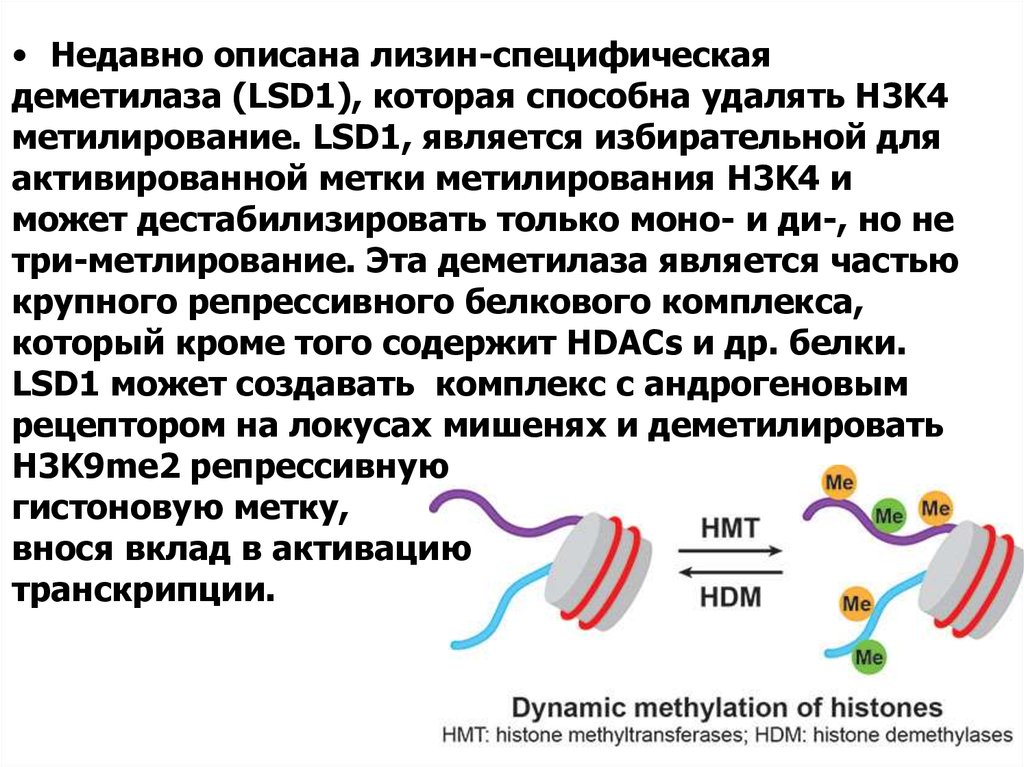
• Недавно описана лизин-специфическаядеметилаза (LSD1), которая способна удалять H3K4
метилирование. LSD1, является избирательной для
активированной метки метилирования H3K4 и
может дестабилизировать только моно- и ди-, но не
три-метлирование. Эта деметилаза является частью
крупного репрессивного белкового комплекса,
который кроме того содержит HDACs и др. белки.
LSD1 может создавать комплекс с андрогеновым
рецептором на локусах мишенях и деметилировать
H3K9me2 репрессивную
гистоновую метку,
внося вклад в активацию
транскрипции.
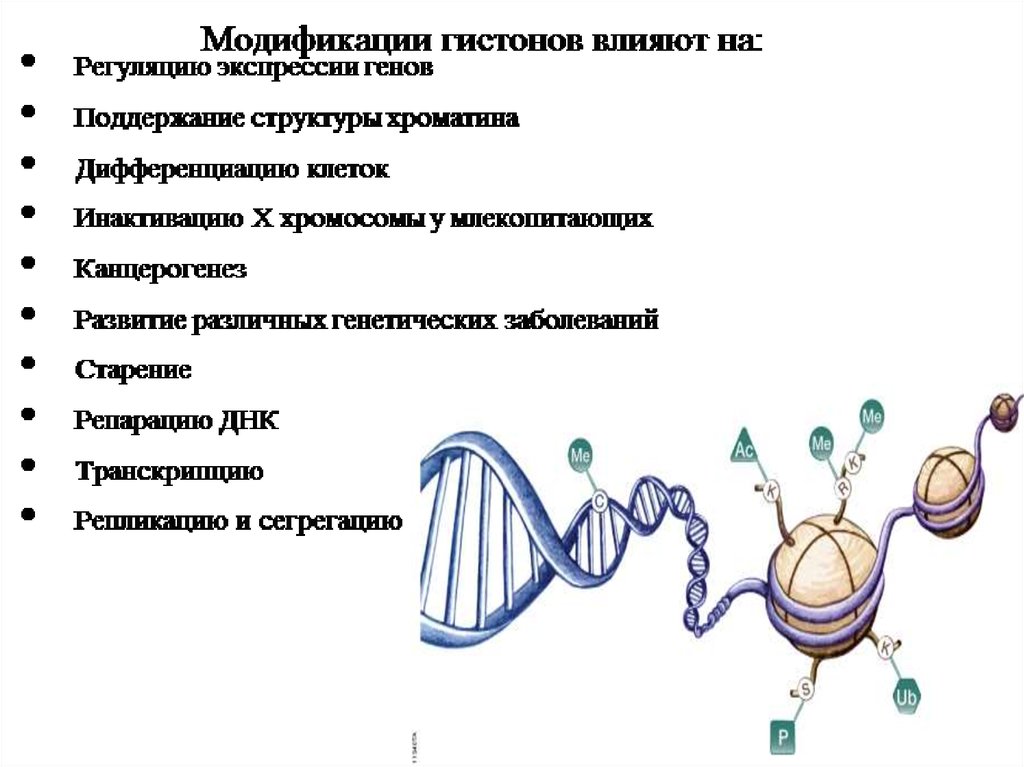
25. Гистоновый код
• Посттрансляционные модификации гистонов могут определятьдальнейшую судьбу клетки.
• Например, фосфорилирование остатков серина в положении 10 и 28
гистона НЗ является маркером низкой транскрипционной активности.
Комбинация фосфорилирования серина в положении 10 и
ацетилирования лизина в положении 14 гистона НЗ является признаком
активной транскрипции. Предполагается, что множественные
модификации, имеющие место в определенных гистонах
представляют собой код, который влияет на то, какие белки
способны взаимодействовать с комплексами гистонов и ДНК и,
следовательно, какие гены регулируются этими белками.
• Существует так называемая «эпигенетическая память». Это означает,
что клетка «запоминает» паттерн гистоновых модификаций и способна
сохранять его при делении. При нарушении передачи информации
гистонового кода или при сбое в его реализации могут возникать
тяжёлые нарушения не только на клеточном уровне, но и серьёзные
патологии на организменном уровне.
26.
Гистоновый код27.
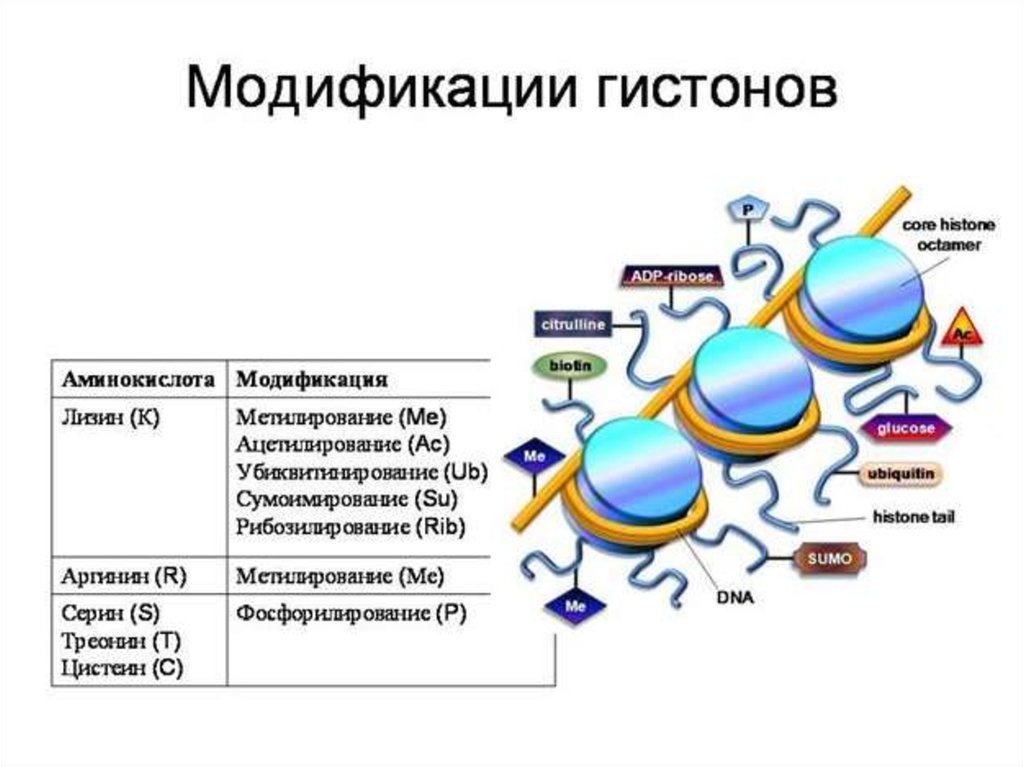
Типы ковалентных посттрансляционныхмодификаций гистонов
Группа
Роль в
траснкрипции
Модифицируемые сайты гистона
Ацетилирование
Активация
H3 (K9, K14, K18, K56); H4 (K5, K8,
K12, K16); H2A/H2B (K6, K7, K16,
K17)
Фосфорилирование
Активация
H3 (S10)
Метилирование
Активация
H3 (K4, K36, K79)
Репрессия
H3 (K9, K27)
I
II
Убиквитинилирование Активация
H2B (K123)
Репрессия
H2A (K119)
Репрессия
H4 (K5, K8, K12, K16), H2A (K126),
H2B (K6, K7, K16, K17)
Сумоилирование
Группа I – модификация малыми химическими
группами
28. Механизмы преобразования хроматина
1.2.
3.
ковалентная модификация гистонов
Ковалентные модификации гистонов создают
эпигенетические изменения, которые определяют
функциональное состояние различных участков
генома — гистоновый код.
АТФ-зависимое ремоделирование хроматина
АТФ-зависимые хроматин-ремоделирующие белки
модифицируют структуру хроматина, изменяя
контакты ДНК с гистонами. Такие изменения
приводят к перемещению или удалению нуклеосом,
что и определяет «молчание» или активность генов.
включение вариантных гистонов в хроматин.
Вариантные гистоны и факторы, вовлеченные в
доставку этих гистонов в хроматин, играют
существенную роль в контроле хромосомной
архитектуры, экспрессии генов, репарации и
формировании эпигенетической памяти
29.
Комбинации таких изменений рассматриваются вкачестве фундаментального эпигенетического
30.
• Ковалентная модификация гистонов может привестик замене основного гистона на вариантный гистон.
H3.3
нужен
для
активизации транскрипции,
не участвует в репликации
ДНК
H2A.Z также коррелирует с
транскрипционной
активностью, индексирует
5’-конец
свободных
от
нуклеосом промоторов
CENP-A
(вариант
Н3)
существенен
для
построения центромеры
H2A.X
ассоциирован
с
поврежденной
ДНК,
возможно,
участвует
в
рекрутировании ферментов
репарации
макроН2А ассоциирован с
неактивной Х-хромосомой у
млекопитающих
31.
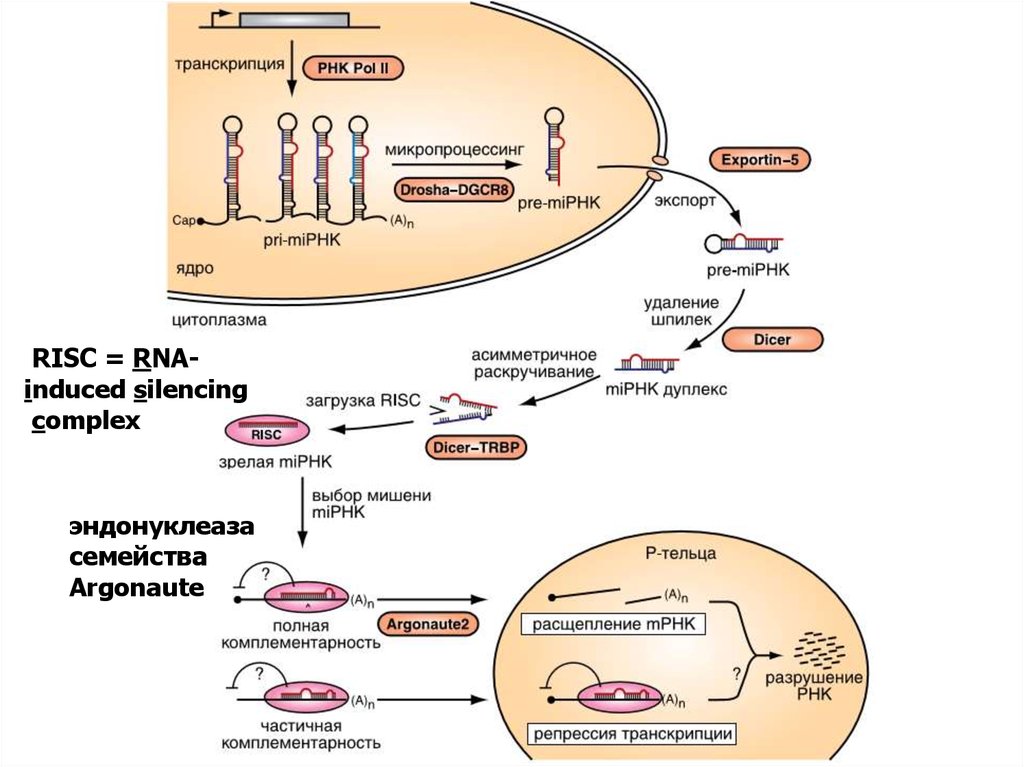
32. РНК-интерференция
33.
Чтобы получить сорт петуний сБолее яркими бардовыми лепестками,
генетики ввели в ее клетки ген,
отвечающий за синтез красного
пигмента. Однако, многие
цветы, вместо того, чтобы усилить
окраску, вовсе теряли пигмент и получались белыми.
С этого и других похожих наблюдений, сделанных в
начале 90-х годов, и началась история малых РНК.
В другом эксперименте биологи, изучавшие
генетическую регуляцию у одного из самых
популярных в последнее время модельных
организмов - червя Caenorhabditis elegans (C. elegans),
пытались усилить работу определенных генов путем
введения в клетки червя дополнительных копий
таких генов (в виде ДНК). И снова, вместо усиления
экспрессии данного гена, наблюдали
противоположный эффект: его полное "замолкание".
34.
МикроРНК (miRNA) — малые некодирующие молекулыРНК длиной 18—25 нуклеотидов (в среднем 22),
обнаруженные у растений, животных и некоторых
вирусов, принимающие участие в транскрипционной
и посттранскипционной регуляции экспрессии генов
путём РНК-интерференции.
• Эффект "гашения" экспрессии определенных
генов малыми РНК получил название
РНК - интерференции, а молекулы,
вызывающие его,
назвали siRNA (small interfering RiboNucleic Aci
ds - малые интерферирующие
рибонуклеиновые кислоты
35.
• miРНК активно участвуют в процессах онтогенеза,метаболизма жира, секреции инсулина, гемопоэзе,
развитии мышц, самообновлении и
дифференцировке стволовых клеток, в
канцерогенезе.
• Около 50% их локализуется внутри интронов генов
и транскрибируется совместно с того же промотора.
• Большинство miРНК кластерировано в геноме
человека и экспрессируется совместно, что
свидетельствует о необходимости более чем одной
miРНК для регуляции экспрессии конкретного гена.
• Большинство miРНК консервативны и
располагаются в районах, чаще всего вовлеченных
в структурные перестройки хромосом, или в ломких
сайтах. Установлено, что это имеет значение в
развитии ряда генетических заболеваний и
опухолей у человека.
36.
RISC = RNAinduced silencingcomplex
эндонуклеаза
семейства
Argonaute
37.
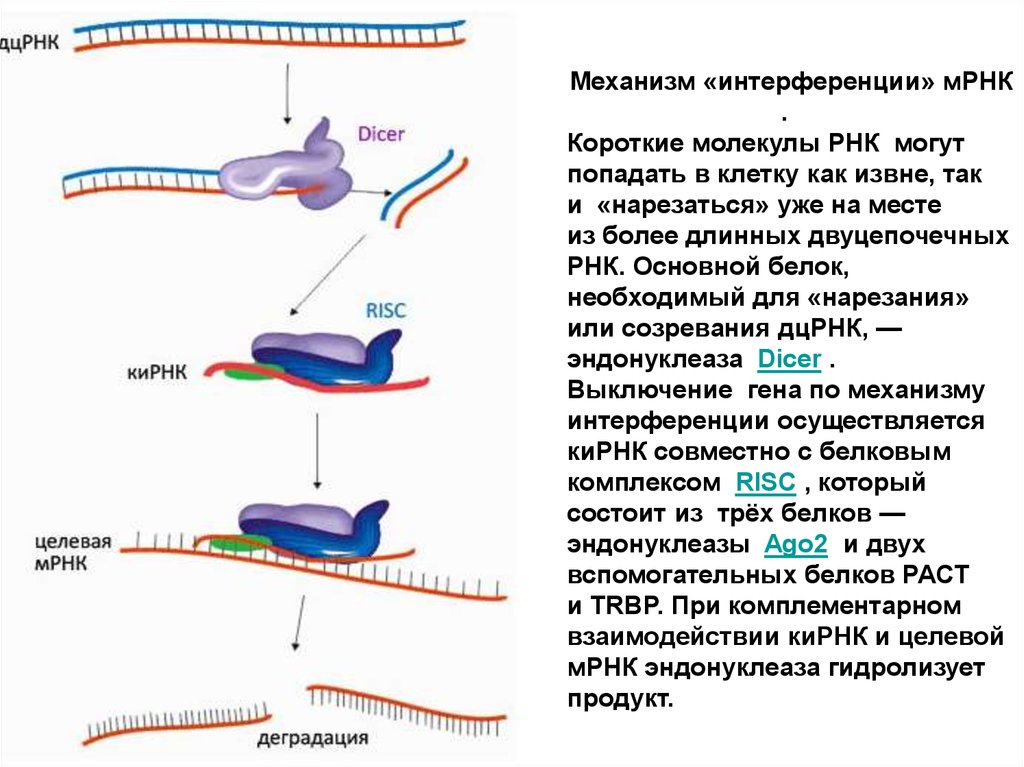
Механизм «интерференции» мРНК.
Короткие молекулы РНК могут
попадать в клетку как извне, так
и «нарезаться» уже на месте
из более длинных двуцепочечных
РНК. Основной белок,
необходимый для «нарезания»
или созревания дцРНК, —
эндонуклеаза Dicer .
Выключение гена по механизму
интерференции осуществляется
киРНК совместно с белковым
комплексом RISC , который
состоит из трёх белков —
эндонуклеазы Ago2 и двух
вспомогательных белков PACT
и TRBP. При комплементарном
взаимодействии киРНК и целевой
мРНК эндонуклеаза гидролизует
продукт.
38. Метилирование ДНК у млекопитающих
1. Поддержание структуры хроматинаи стабильности хромосом
2. Инактивация повторов и
интегрированной чужеродной ДНК
3. Формирование тканеспецифичного
паттерна экспрессии генов
4. Тканеспецифичное подавление
генной экспрессии
Гиперметилированы:
- Сателлиты и рассеянные
повторы
- Провирусные копии и
транспозоны
- Транскрипционно
неактивные гены
Гипометилированы:
- Транскрипционно активные
гены
39.
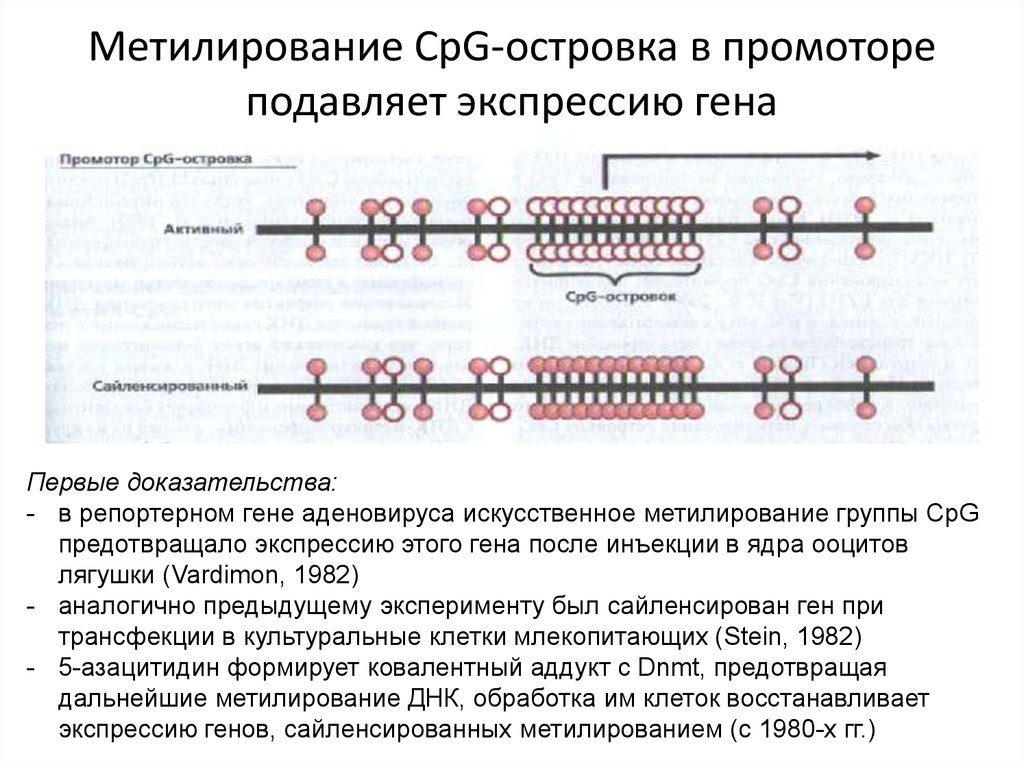
Метилирование CpG-островка в промотореподавляет экспрессию гена
Первые доказательства:
- в репортерном гене аденовируса искусственное метилирование группы CpG
предотвращало экспрессию этого гена после инъекции в ядра ооцитов
лягушки (Vardimon, 1982)
- аналогично предыдущему эксперименту был сайленсирован ген при
трансфекции в культуральные клетки млекопитающих (Stein, 1982)
- 5-азацитидин формирует ковалентный аддукт с Dnmt, предотвращая
дальнейшие метилирование ДНК, обработка им клеток восстанавливает
экспрессию генов, сайленсированных метилированием (с 1980-х гг.)
40.
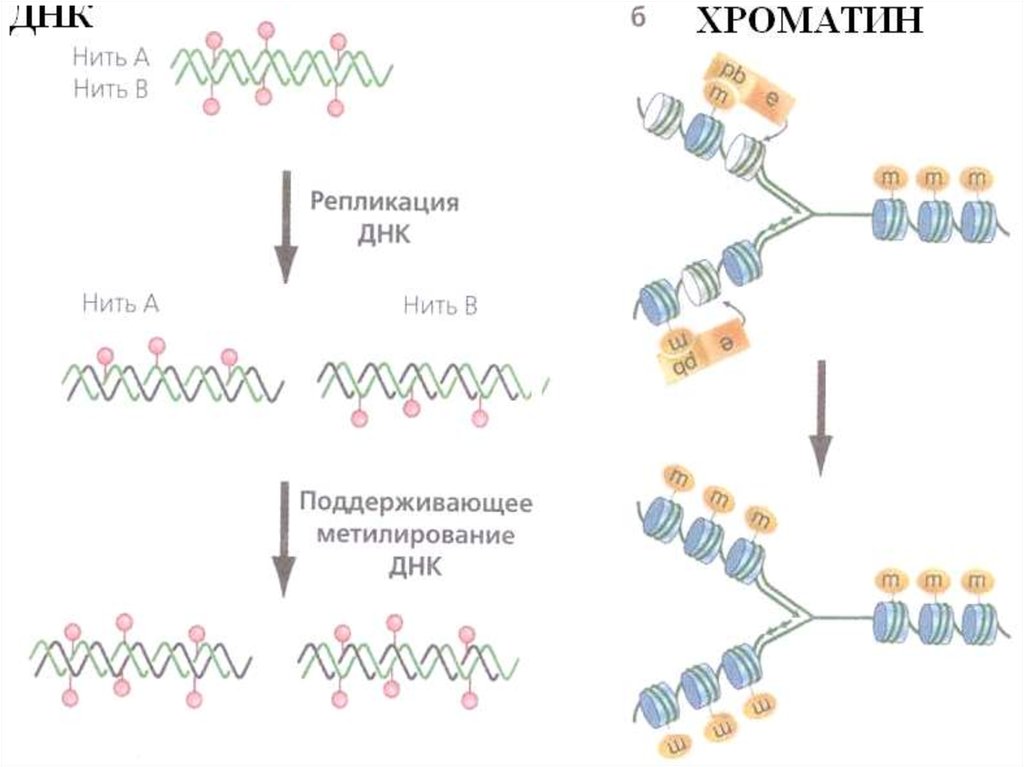
Ферменты метилирования у млекопитающихУ млекопитающих существуют три функциональные DNA –
метилтрансферазы (Dnmts): Dnmt1, Dnmt3a Dnmt3b.
Dnmt1
- метилирует дочернюю нить во время репликации, чтобы
сохранить родительский паттерн метилирования ДНК.
- добавляет метильную группу к полуметилированной ДНК
- локализуется в фокусах репликации во время S фазы и
взаимодействует с methyl-CpG-binding protein 2 (MeCP2),
который распознает полуметилированную ДНК
- вносит вклад в наследование меток метилирования ДНК в
поколениях.
Dnmt3a и Dnmt3b – «de novo» метилтрансферазы
Мутации в гене Dnmt3b приводят к развитию IFC-синдром
Модельные мыши, имеющие нок-аут этих генов не
выживают.
41.
42.
Синдром Ретта ( RTT, OMIM312750)
описано в 1966 году, встречается
преимущественно у девочек,
приводит к регрессии развития,
аутизму, характерны
стереотипные движения рук и
тяжелая умственная отсталость
•Основная причина – мутации
МеСР2 (главный компонент
метилцитозин связывающего
комплекса)
синдром ICF (иммунодефицит,
хромосомная нестабильность,
аномалии лицевого черепа)
(ICF, OMIM 242860)
Причина - мутации в гене
DMNT3B (метилтрансфераза de
novo). Гетерохроматиновые
районы хромосом 1, 9 и 16
неметелированны, вследствие
чего растянуты и имеют
ветвистую структуру
43.
Клеточная дифференцировка основана намассивных изменениях эпигенетического статуса по
всему геному в различных генных локусах.
Существуют многочисленные тканезависимые, дифференциально
метилированные регионы ДНК (T-DMRs) в уникальных
последовательностях, включая гены и их регуляторные элементы в
геноме млекопитающих.
Каждый тип клеток/ткани обладает специфическим профилем
метилирования T-DMRs, и эти профили могут быть использованы для
различения типов клеток/тканей
Профиль метилирования ДНК специфичен для типов клеток и тканей,
подобно отличиям отпечатков пальцев, и может быть использован как
идентификационная метка для клеток
ES – эмбриональные стволовые
клетки мыши, EG- эмбриональные
герминальные клетки, TS – клетки
трофобласта
44.
45. Механизмы инактивации гена в результате метилирования промоторной области
1. Метильные группы нарушают ДНКбелковые взаимодействия, выступая вбольшую бороздку ДНК и препятствуя
связыванию специфических
транскрипционных факторов.
2. Метилированные районы ДНК
специфически связывают транскрипционные
репрессоры.
3. Метилирование ДНК влияет на структуру
хроматина.
46.
47. Распределение метилирования на хромосомах
48.
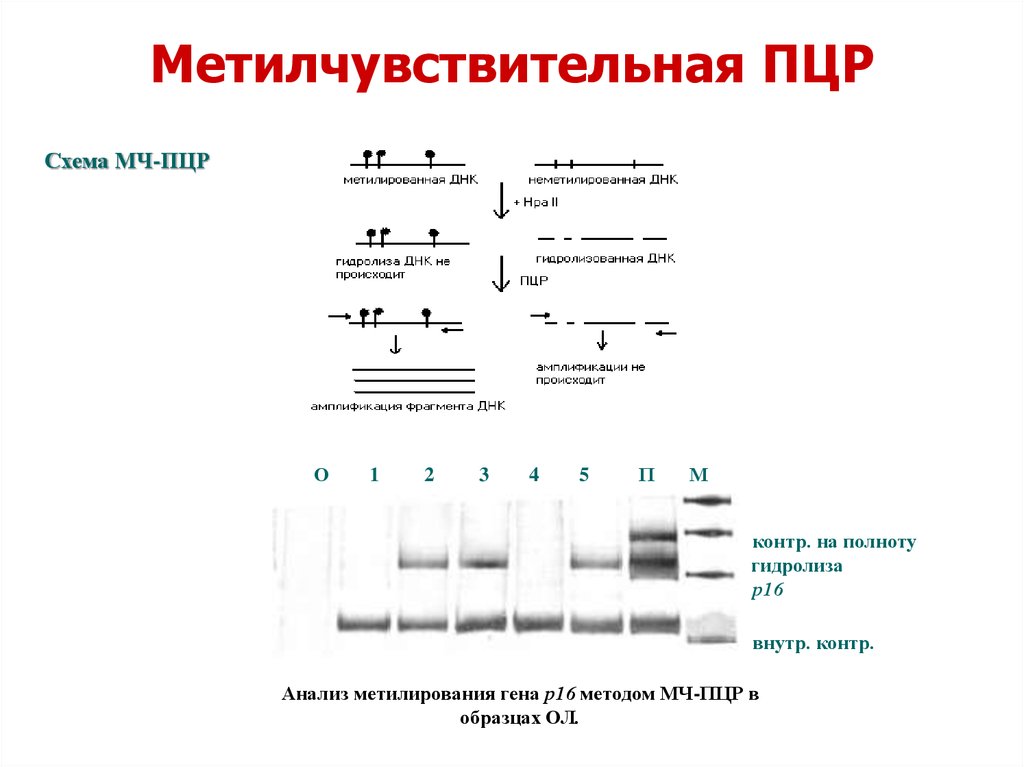
Методы анализа метилирования1. Метилчувствительная ПЦР (Not1, Eag1, SacII, HpaII,
HhaI)
аналитическая чувствительность - 1: 2000
2. Метилспецифическая ПЦР
Трансформация цитозина в урацил бисульфитом Na
аналитическая чувствительность - 1: 1000
3. MethylLight – метилспецифическая ПЦР в реальном
времени
аналитическая чувствительность - 1: 10000
4. Метилспецифическое секвенирование
5. Биологические микрочипы
49.
Метилчувствительная ПЦРСхема МЧ-ПЦР
О
1
2
3
4
5
П
М
- контр. на полноту
гидролиза
- р16
- внутр. контр.
Анализ метилирования гена р16 методом МЧ-ПЦР в
образцах ОЛ.
50.
Метил-специфическаяПЦР
51.
COBRACombined Bisulfite Restriction Analysis (or COBRA):
1. Бисульфитная конверсия геномной ДНК
2. ПЦР участка, содержащего интересующие CpG (с
метилспецифических праймеров; CpG должны попадать в
сайты узнавания рестриктазы)
3. ПДРФ-анализ
52.
Метилирование ДНК вовлечено вширокий круг биологических процессов,
которые включают регуляцию
экспрессии тканеспецифичных генов,
клеточную дифференцировку, геномный
импринтинг, инактивацию Х-хромосомы,
регуляцию структуры хроматина,
репликацию ДНК, канцерогенез,
латентный период у вирусов.
53.
Уровни эпигенетической регуляции1. Геномный
2. Хромосомный
3. Генный
Эпигенетические нарушения
1) Однородительская дисомия
2) аномалии метилирования промоторных и регуляторных
областей гена;
3) инактивирующее влияние крупных блоков структурного
гетерохроматина.
54.
Для нормального развития организма необходимравный вклад обоих родителей.
1. Трансплантация пронуклеусов.
2. Патология у человека.
Пузырный занос – хорошо развиваются плацентарные
структуры, нет эмбриональных структур - два набора
отцовских хромосом
Тератома - эмбриональная опухоль, включающая все три
эмбриональных слоя и отсутствие плацентарной ткани - два
набора материнских хромосом.
3. Триплоидия.
2n - отец + n - мать -> андроид: большая кистозная плацента,
у плода: большая голова, маленькое веретенообразное тело,
синдактилия, отставание в росте и развитии. Если плод
рождается, то, как правило, есть мозаицизм.
2n - мать + n - отец -> гиноид: недоразвитая плацента,
клеточная масса, эмбрион и плод не развивается.
55.
Эпигенетические изменения на геномном уровне56. Проявление эпигенетической патологии на хромосомном уровне – это однородительская дисомия (ОРД)
• Однородительская дисомия, то естьнаследование обеих копий целой хромосомы
или ее части от одного родителя, при
отсутствии соответствующего генетического
материала от другого родителя.
- изодисомия
- гетеродисомия
Исследования на мышах:
Разные хромосомы вносят различный вклад в нормальное
развитие плода. Дисомии по 1,3,4,8,9,10,13.15,16,18 и 19
не вызывали отклонений от нормального развития
мышиных эмбрионов, а по 2,6,7,11,17 сопровождались
отклонениями от нормального развития и гибелью плода
57. Эпигенетические изменения на хромосомном уровне – это однородительская дисомия (ОРД)
• Однородительская дисомия - наследование обеих копий целойхромосомы или ее части от одного родителя, при отсутствии
соответствующего генетического материала от другого родителя.
58.
Эпигенотип (импринт) - совокупность модификаций, которыепо-разному маркируют родительские аллели и обеспечивают
моноаллельный характер экспрессии импринтированных генов
на хромосомах отцовского или материнского происхождения.
Геномный импринтинг - эпигенетический механизм регуляции
экспрессии гомологичных генов в процессе развития организма
в зависимости от родительского происхождения гена,
хромосомы или генома.
Импринтированный ген - ген, который дифференциально
экспрессируется в зависимости от материнского или отцовского
происхождения. Импринтированные гены в диплоидной клетке
млекопитающих обычно экспрессируются только с одного
аллеля.
59.
Эпигенетическая патология1) Однородительская дисомия
2) аномалии метилирования промоторных и регуляторных
областей гена;
3) динамические мутации
(амплификация микросателлитных повторов);
4) точковые мутации в отдаленных регуляторных
областях генов;
5) транспозиции повторяющихся элементов генома;
6) инактивирующее влияние крупных блоков структурного
гетерохроматина.












































 biology
biology