Similar presentations:
Періодична система Менделєєва. Елементи 6 групи
1.
ТЕМА: VI ГРУПА.ПЕРІОДИЧНА СИСТЕМА МЕНДЕЛЄЄВА
1. Загальна характеристика елементів.
2. Оксиген. Характеристика, одержання, властивості, застосування.
3. Озон. Характеристика, одержання, властивості, застосування.
4. Сульфур. Характеристика, властивості, застосування.
5. Сірководень і сульфідна кислота. Фізичні та хімічні властивості,
одержання.
6. Солі сульфідної кислоти (сульфіди). Хімічні властивості сульфідів.
7. Оксид сульфуру (IV). Властивості, застосування.
8. Сульфітна кислота. Властивості, застосування.
9. Солі сульфітної кислоти (сульфіти). Властивості, застосування.
10. Оксид сульфуру (VI). Властивості, застосування, одержання.
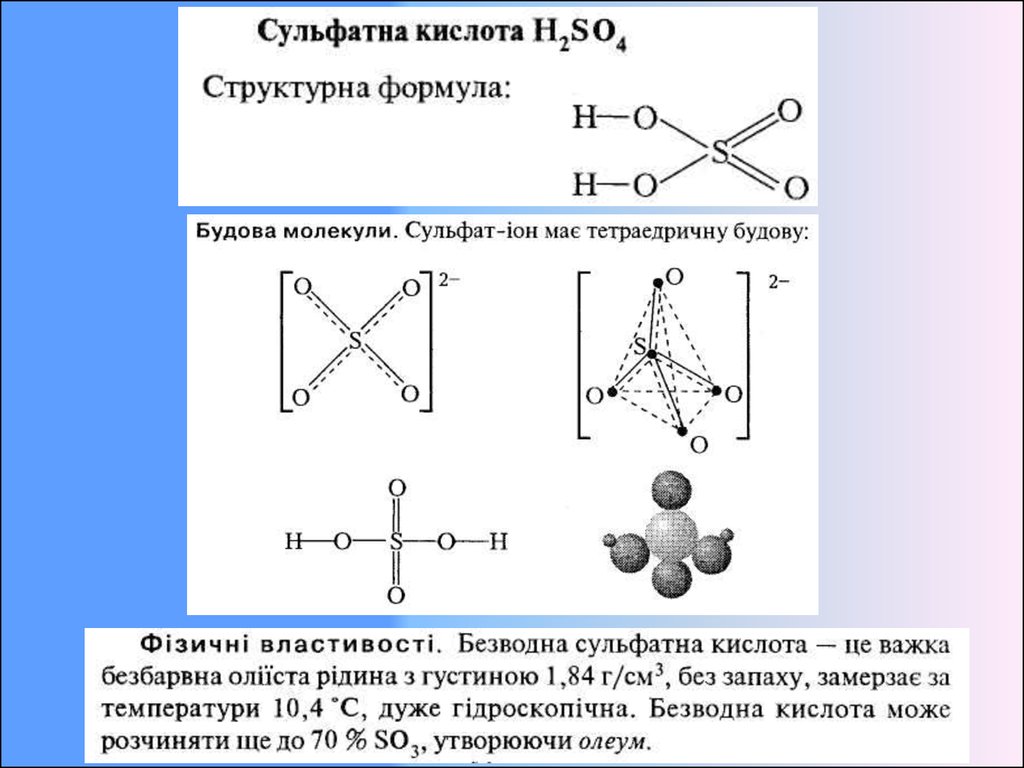
11. Сульфатна кислота. Властивості, одержання, застосування.
12. Солі сульфатної кислоти (сульфати). Властивості, застосування.
2.
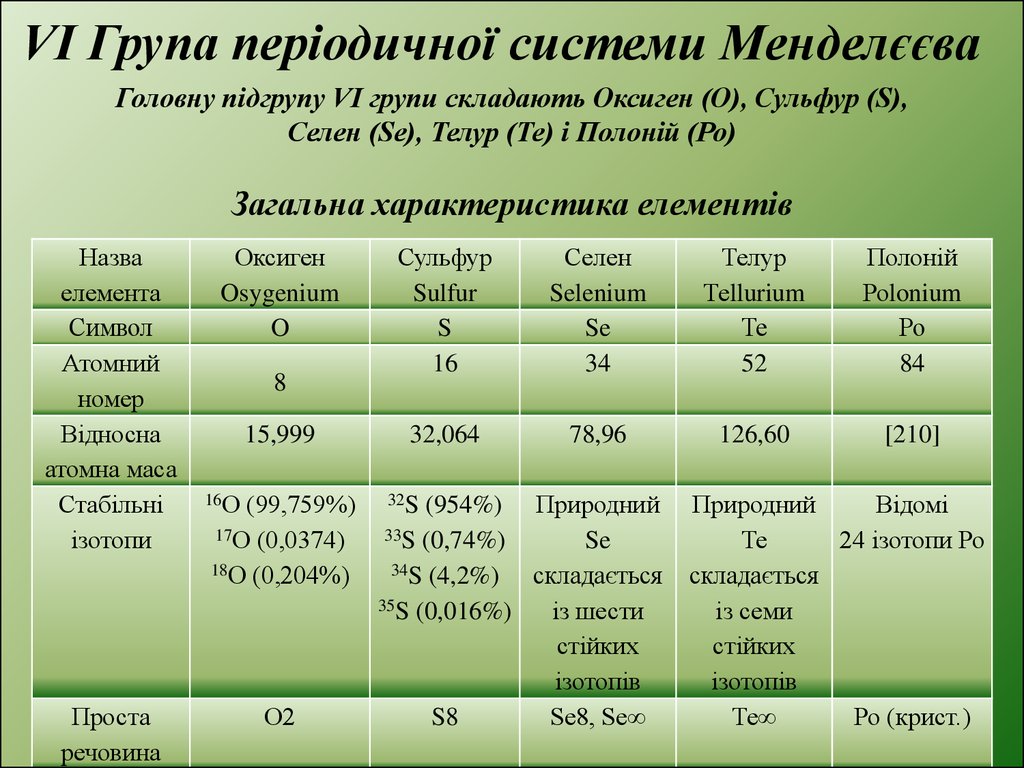
VІ Група періодичної системи МенделєєваГоловну підгрупу VI групи складають Оксиген (О), Сульфур (S),
Селен (Se), Телур (Те) і Полоній (Ро)
Загальна характеристика елементів
Назва
елемента
Символ
Атомний
номер
Відносна
атомна маса
Стабільні
ізотопи
Проста
речовина
Оксиген
Osygenium
O
8
15,999
16О
(99,759%)
17О (0,0374)
18О (0,204%)
О2
Сульфур
Sulfur
S
16
Селен
Selenium
Se
34
Телур
Теllurium
Те
52
Полоній
Роlonium
Ро
84
32,064
78,96
126,60
[210]
(954%) Природний
33S (0,74%)
Se
34S (4,2%)
складається
35S (0,016%)
із шести
стійких
ізотопів
S8
Se8, Se∞
32S
Природний
Відомі
Те
24 ізотопи Ро
складається
із семи
стійких
ізотопів
Те∞
Ро (крист.)
3.
Електронна будова елементівЕлемент
Електронна конфігурація
Елемент
Ступінь окиснення
Радіус атома, нм
Електронегативність
О
S
Se [Hе]
[Ne]
[Ar]
2s22p4
3s23p4
3d104s24p4
О
S
Se
-2,-1,+1,+2 -2,+2,+3, +4,+5,+6 -2,+4,+6
0,074
0,104
0,117
3,5
2,5
2,4
Потенціал іонізації, еВ
13,6
10,4
Те
[Кr]
4dl05s25p4
Те
-2,+4,+6
0,134
2,1
Ро
[Хе]
4fl45dl06s26p4
Ро
-2,+4
0,152
2,0
9,0
8,4
9,8
Фізичні властивості
Елемент
Атомний номер
Агрегатний стан
Колір
Температура
кипіння, 0С
Температура
плавління, 0С
О
8
газ
безбарвний
-183
-219
S
Se
Те
Ро
16
34
52
84
кристалічна
кристалічна
кристалічна
кристалічна
речовина
речовина
речовина
речовина
жовтий
сірий, червоний сріблясто-білий сріблясто-білий
445
685
990
962
119
217
450
254
4.
Знаходження в природіОксиген — найпоширеніший на Землі елемент (52,3%).
У чистому вигляді не зустрічається. Входить до складу більшості
природних сполук.
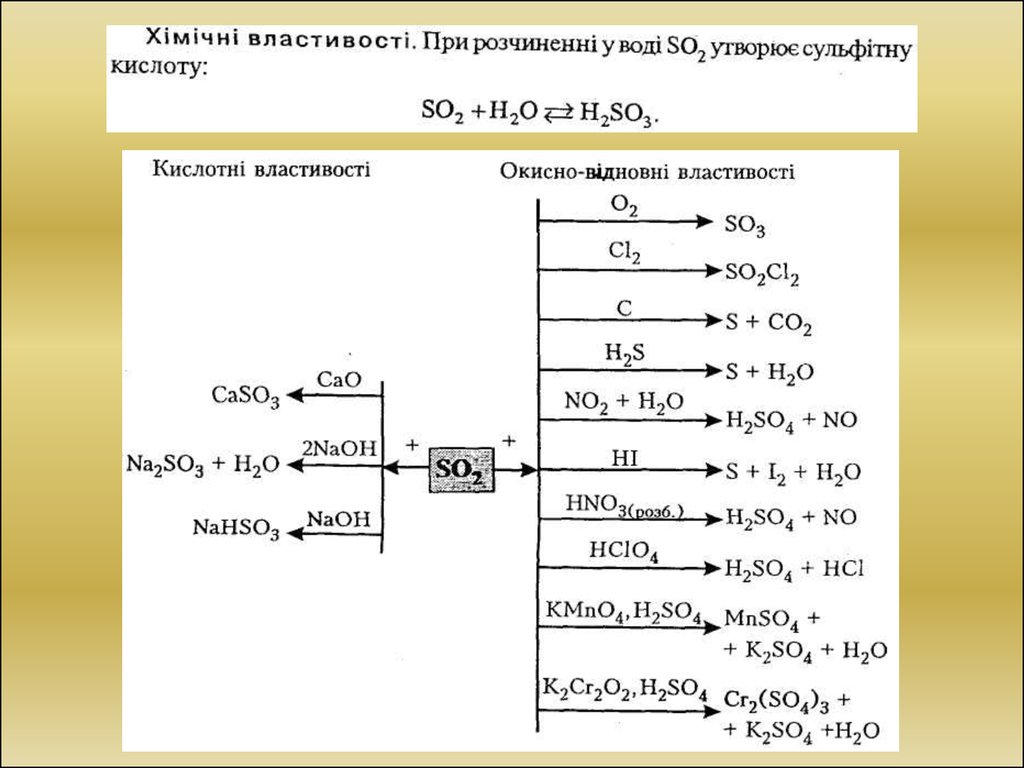
Хімічні властивості
Всі елементи утворюють сполуки з Гідрогеном із загальною формулюю
H2E. Водні розчини цих сполук є слабкими кислотами. Сила кислоти у ряді
Н2О — Н2Se — H2Те збільшується. Зі збільшенням заряду ядра окисні
властивості елементів у ряді О-S-Se-Te-Po зменшуються, а відновні
зростають: О; S; Se — типові неметали, Те — проміжний елемент,
Ро — типовий метал.
Всі елементи утворюють сполуки з Оксигеном:
— оксиди із загальною формулою EO2 і EO3;
— кислоти із загальною формулою H2EO3 і H2EO4.
Кислоти H2EO3 і H2EO4 є окисниками, однак у деяких випадках
(наприклад, у присутності сильного окисника) кислоти H2EO3 можуть
проявляти відновні властивості. Зі збільшенням атомного радіуса сила
кислот H2EO3 і H2EO4 зменшується й зростає окисна здатність.
5.
6.
Тест на виявлення киснюОдержання кисню
Каталітичний розклад
гідроген пероксиду
Розклад Н2О2 на кисень і воду
відбувається дуже повільно.
Додаючи каталізатор
MnО2 – реакція відбувається
набагато швидше.
Молекулярна картина
В кожній молекулі Н2О2 по 2 атоми Оксигену та
Гідрогену. З двох молекул цієї сполуки одержують
1 молекулу кисню та 2 молекули Н2О.
7.
ЗастосуванняУ промисловості: для активізації процесів окиснювання,
одержання високих температур при зварюванні та різанні металів
(суміш кисню з ацетиленом).
У медицині: для лікування хворих з утрудненим диханням.
8.
9.
10.
11.
12.
13.
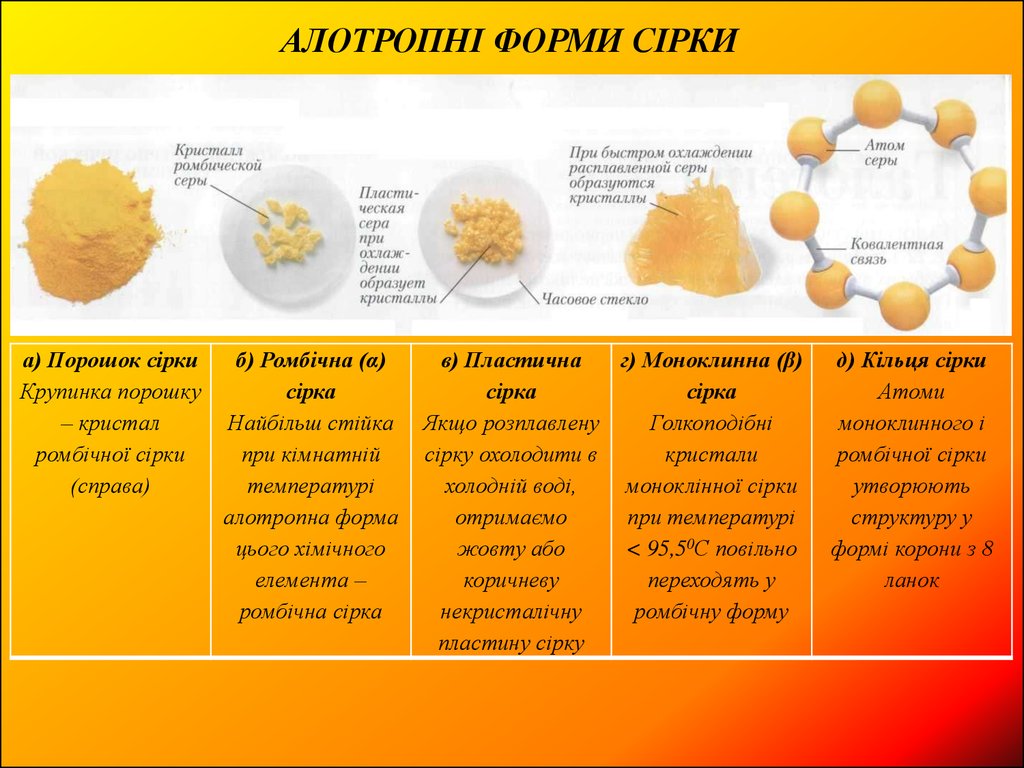
АЛОТРОПНІ ФОРМИ СІРКИа) Порошок сірки
Крупинка порошку
– кристал
ромбічної сірки
(справа)
б) Ромбічна (α)
сірка
Найбільш стійка
при кімнатній
температурі
алотропна форма
цього хімічного
елемента –
ромбічна сірка
в) Пластична
г) Моноклинна (β)
сірка
сірка
Якщо розплавлену
Голкоподібні
сірку охолодити в
кристали
холодній воді,
моноклінної сірки
отримаємо
при температурі
жовту або
< 95,50С повільно
коричневу
переходять у
некристалічну
ромбічну форму
пластину сірку
д) Кільця сірки
Атоми
моноклинного і
ромбічної сірки
утворюють
структуру у
формі корони з 8
ланок
14.
Як ромбічна так імоноклинна сірка
складаються з
складчастих кілець
з 8 атомів сірки
Ромбічна сірка
Називається також
α- сірки або орторомбічної сірки.
Блідо-жовта кристалічна алотропна
модифікація сірки,
найбільш стабільна форма при
кімнатній температурі
Моноклинна сірка або бета-сірка (β-сірка)
Жовта кристалічна алотропна
модифікація сірки.
Вона біль стабільна, ніж ромбічна сірка,
при температурі > 96 0С
15.
Фізичні властивості. Сірка — тверда, крихка кристалічна речовинажовтого кольору, практично нерозчинна у воді. Розчинна в сірковуглеці
CS2, аніліні та інших органічних сполуках. За звичайних умов
найстійкішою є ромбічна сірка. Моноклінна сірка утворюється при
нагріванні останньої вище 96 °С. Якщо сірку, що кипить за
температури 444,6 °С, вилити в холодну воду, то утвориться
пластична сірка — коричнева в'язка маса.
За звичайних умов молекула сірки складається з восьми атомів, які
замикаються у цикли, як показано вище. Для спрощення
стехіометричних коефіцієнтів у хімічних рівняннях формулу сірки
записують переважно як одноатомну.
Застосування сірки:
- для одержання сірчаної кислоти;
- у боротьбі зі шкідниками сільськогосподарських культур;
- для вулканізації каучуків у гумовій промисловості;
- для виготовлення штучних волокон, вибухових речовин;
- у промисловому органічному синтезі;
- у медицині (сірка пригнічує життєдіяльність гельмінтів
і сприяє виведенню їх з організму, її використовують для лікування
деяких захворювань шкіри).
16.
Хімічні властивості.Сірка належить до неметалів середньої активності.
За звичайних умов реагує тільки з ртуттю, з іншими металами і
неметалами — при нагріванні.
17.
Приклади реакцій:а) реакції міжмолекулярного окиснення-відновлення:
б) реакція диспропорціонування
18.
19.
20.
21.
22.
23.
СОЛІ СУЛЬФІДНОЇ КИСЛОТИ (СУЛЬФІДИ)Сульфідна кислота є двохосновною, тому утворює два типи солей
— середні (сульфіди) і кислі (гідрогенсульфіди), наприклад
K2S — сульфід калію, KHS — гідрогенсульфід калію.
Майже всі гідрогенсульфіди добре розчинні у воді, а більшість
сульфідів (крім сульфідів лужних, лужноземельних металів і амонію)
практично нерозчинні або малорозчинні у воді.
Деякі сульфіди мають характерне забарвлення, наприклад:
PbS, CuS, HgS, FeS — чорні, ZnS — білий, CdS — жовтий, Fe2S3 —
темно-коричневий, що використовують в аналітичній хімії.
Малорозчинні у воді сульфіди можна розчинити у сильних
кислотах, кислотах-окисниках або в „царській горілці".
Застосування.
Сульфіди важких металів промислово важливі і знаходяться в
рудах, з яких добувають метали. У вигляді сульфідів осаджують з
розчинів йони багатьох d-елементів.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
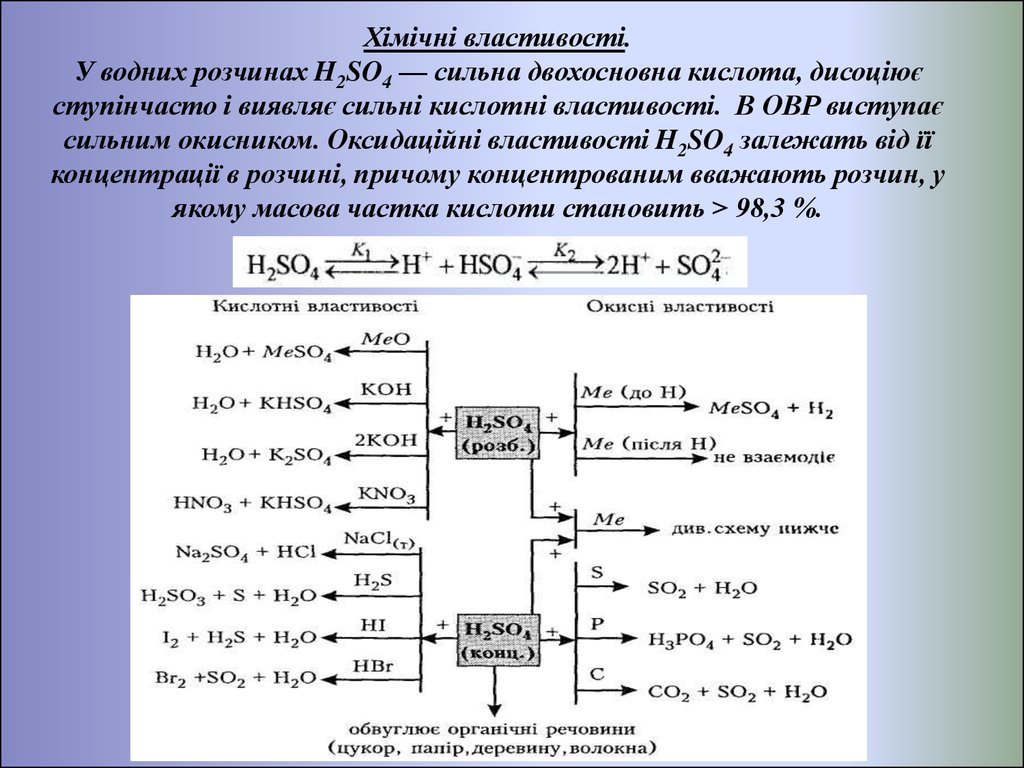
Хімічні властивості.У водних розчинах H2SO4 — сильна двохосновна кислота, дисоціює
ступінчасто і виявляє сильні кислотні властивості. В ОВР виступає
сильним окисником. Оксидаційні властивості H2SO4 залежать від її
концентрації в розчині, причому концентрованим вважають розчин, у
якому масова частка кислоти становить > 98,3 %.
38.
39.
40.
41.
42.
43.
44.
ЛІТЕРАТУРА1.Романова Н.В. Загальна та неорганічна
хімія: підручник для студентів вищ. Навч.
закладів. – Київ; Ірпінь: ВТФ «Перун»,
1998. – 480 с.
2. Карнаухов О.І., Мельничук Д.О. та ін.
Загальна та біонеорганічна хімія:
Підручник для студентів
сільськогосподарських спеціальностей
вищих аграрних навчальних закладів. –
Вінниця: Нова книга, 2003. – 544 с.






































 chemistry
chemistry








