Similar presentations:
Общая химическая технология
1.
Каралин Эрнест АлександровичПрофессор кафедры общей химической технологии КНИТУ
Рабочий телефон:
2-31-95-02
E-mail:
karalin@kstu.ru
2.
3.
1Слово «технология» греческого происхождения и имеет дословный перевод «наука
о ремесле». В широком смысле под технологией подразумевается научное
описание методов и средств производства в какой-либо отрасли промышленности.
Химическая технология возникла в конце 18 века и на начало 20 века состояла из
описания конкретных химических производств, их основного оборудования,
материальных и энергетических балансов. По мере развития химической
промышленности возникла необходимость выявления общих закономерностей
построения химико-технологических процессов, их промышленной реализации
и рациональной эксплуатации.
Общая химическая технология – наука, изучающая теоретические основы
разработки технологий для различных классов химических реакций.
Задачи ОХТ
1) отыскание общих закономерностей протекания химико-технологических
процессов;
2) определение оптимальных условий проведения химико-технологических
процессов;
3) изучение химических превращений с учетом массо- и теплообменных
процессов;
4) повышение эффективности использования сырья, энергии, снижение
количества отходов и выбросов в окружающую среду; повышение качества
выпускаемой продукции.
4.
2Основные понятия химической технологии
Химико-технологический процесс – совокупность взаимосвязанных
физических и химических процессов, которые проходит сырье до превращения в
целевой продукт.
К физическим процессам относятся –
1. Механические процессы (например, измельчение твердых материалов при
подготовке сырья, гранулирование порошков при изготовлении катализаторов
неподвижного слоя);
2.
Гидродинамические
процессы
(движение
жидкостей
и
газов,
перемешивание, получение и разделение суспензий и эмульсий, фильтрование
жидкостей и газов, центрифугирование и т.д.);
3. Тепловые процессы (нагрев и охлаждение без изменения агрегатного
состояния, испарение, конденсация, кристаллизация);
4. Массообменные процессы (растворение, адсорбция – концентрирование
вещества из газовой или жидкой фазы на поверхности твердого тела, абсорбция –
переход вещества из газовой фазы в жидкую, ректификация).
Все физические процессы рассматриваются в курсе «Процессов и аппаратов»,
в курсе ОХТ изучаются теоретические основы химических процессов, протекающих
в аппаратах большого размера (химических реакторах).
5. Химический процесс – как подсистема сложного, многостадийного
химико-технологического процесса – это одна или несколько химических реакций,
скорость которых определяется законами химической кинетики.
5.
3В общем случае любой Химико-технологический процесс можно представить
тремя последовательными этапами:
Первый этап - подготовка сырья
Второй – химическое превращение сырья
Третий – разделение реакционной смеси
сырье
(реагенты
и примеси)
Подготовка
сырья
исходная
смесь
Химическое
превращение
целевой
продукт
реакционная смесь
побочные
продукты
Разделение
реакционной
смеси
непревращенные
реагенты
примеси
6.
4Сырье – это исходный многокомпонентный материал, поступающий на
массовую переработку (и обладающий стоимостью).
В состав сырья входит реагент – индивидуальное химическое соединение,
принимающее участие в основной химической реакции химико-технологического
процесса и переходящее в результате в целевой продукт.
Остальные компоненты сырья называются примесями. В идеальном случае в
химическом превращении должен принимать участие только реагент, на практике
встречаются системы, в которых происходит и превращение примесей.
Образующиеся в ходе химических реакций вещества называются продуктами,
продукт, ради которого организовано производство называется целевым, все
остальные продукты называются побочными.
Реакция, в которой образуется целевой продукт, называется целевой, все
другие реакции - побочными реакциями.
Очевидно, что мы должны максимально полно выделить из реакционной смеси все продукты
реакции, а также не превращенные реагенты, которые возвращаются на стадию подготовки сырья.
7.
8.
9.
5В качестве примера:
Процесс газофазной каталитической дегидратации этилового спирта до
этилена.
Сырье – водный раствор этанола (азеотроп)
В системе протекают две химических реакции:
1. Внутримолекулярная дегидратация:
этанол этилен + вода
2. Межмолекулярная дегидратация:
этанол + этанол диэтиловый эфир +
вода
В самом общем виде схема процесса включает три стадии:
Первая стадия - подготовка сырья (испарение воды и этанола, перегрев паров
этанола и воды до рабочей температуры), на этой стадии химических превращений
не происходит.
Вторая стадия - химическое превращение, образуются новые вещества –
продукты реакции (этилен, эфир и вода); так как обычно химическая реакция
протекает не до конца,отметим, что часть этанола остается без изменения.
Третья стадия – разделение реакционной смеси (выделение продуктов
реакций и не превращенного этанола, который возвращается в начало процесса.
В этом примере:
Сырье – смесь этанол + вода, Реагент – этанол; Целевой продукт - этилен,
Целевая реакция - мономолекулярная дегидратация; Побочный продукт –
диэтиловый эфир; Побочная реакция - межмолекулярная дегидратация;
Вода одновременно Примесь и Побочный продукт, выделяющийся как в
целевой, так и в побочной реакциях
10.
6Технологический режим - это совокупность технологических параметров,
определяющих работу аппарата или нескольких аппаратов в которых единичный
(отдельный) процесс протекает как стадия химико-технологического процесса.
Аппаратом является ректификационная колонна на стадии разделения,
теплообменник на стадии подогрева или охлаждения, емкость с мешалкой на
стадии смешения и т.д.
В качестве специфического термина, характеризующего аппарат в котором
протекает химическая реакция, используется термин Химический реактор, чаще
всего без прилагательного «химический».
Совокупность отдельных аппаратов, связанных между собой материальными,
тепловыми и энергетическими потоками, называется Технологической схемой
процесса.
Технологические параметры – это измеряемые величины, позволяющие по
возможности полно охарактеризовать состояние процесса (расход материальных
потоков, температура, давление, концентрация компонентов, концентрация
катализатора).
11.
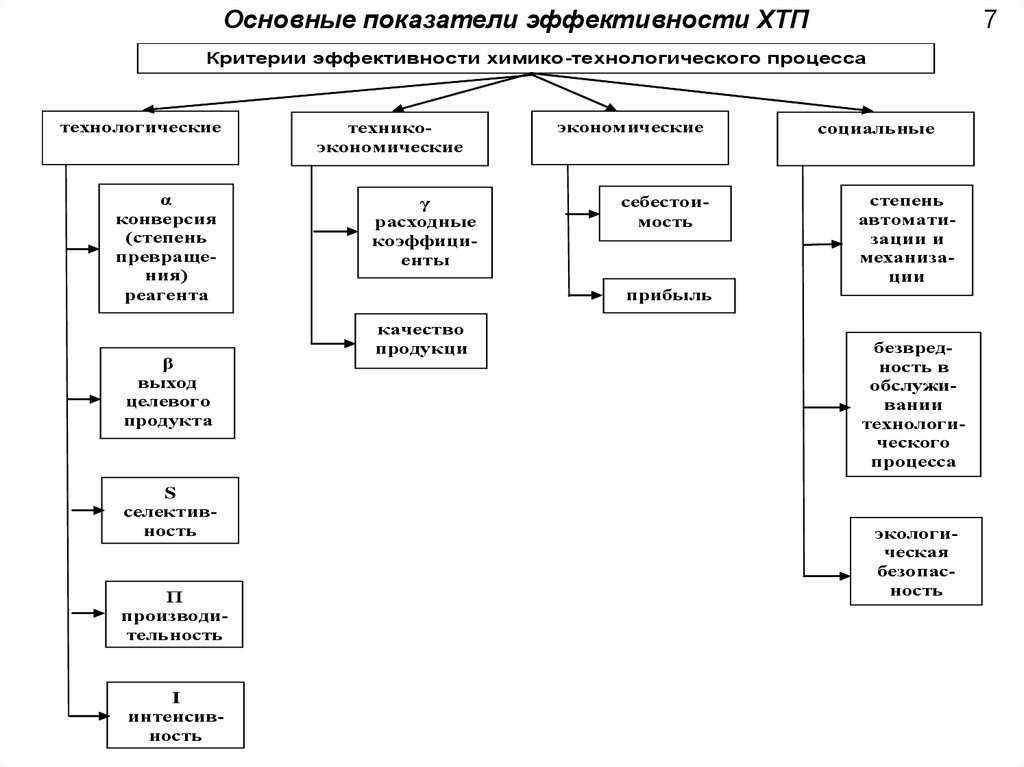
Основные показатели эффективности ХТП7
Критерии эффективности химико-технологического процесса
технологические
α
конверсия
(степень
превращения)
реагента
β
выход
целевого
продукта
S
селективность
П
производительность
I
интенсивность
техникоэкономические
γ
расходные
коэффициенты
экономические
себестоимость
прибыль
качество
продукци
и
социальные
степень
автоматизации и
механизации
безвредность в
обслуживании
технологического
процесса
экологическая
безопасность
12.
8Степень превращения (конверсия) реагента.
Характеризует все химические превращения данного вещества, протекающие в
системе. Рассчитывается как доля вступившего в химические реакции вещества, от
его исходного (начального) количества.
Обозначается греческой строчной буквой альфа, в качестве подстрочного индекса
может быть указан реагент (брутто формулой, названием).
Например, для системы с двумя химическими реакциями:
aА bВ (целевой продукт)
a/A dD (побочный продукт)
А рассчитывается как разница между количеством реагента (вещества A) на входе
в реактор и количеством реагента на выходе из реактора, отнесенная к количеству
реагента на входе в реактор.
А
nA,вход nА,выход
nА,вход
mA,вход mА,выход
mА,вход
С А,вход С А,выход
С А,вход
где: n и m - количество вещества в моль и масса вещества в кг (для
периодического реактора); для проточного реактора удобнее использовать
мольный поток F (размерность моль/время) или массовый расход (размерность
кг/время); С – молярная концентрация (размерность моль/объем), расчеты по
молярной концентрации корректно проводит только в том случае, если объем
жидкого потока остается постоянной величиной.
13.
9При известной концентрации реагента на входе в аппарат, концентрация на
выходе из аппарата выражается через степень превращения как:
С А С А, 0 1 А
Степень превращения может выражаться не только в долях 1, но и в
процентах (вышеприведенные выражения умноженные на 100%).
Если в реакции участвует несколько веществ, степень превращения может быть
рассчитана по любому из реагентов.
Для обратимой реакции aА bВ, предельным состоянием в конкретных условиях
проведения является состояние химического равновесия.
Для таких реакций дополнительно используется понятие равновесная степень
превращения:
А, равн. А,е
С А, 0 С А, равн
С А, 0
С А, 0 С А, е
С А, 0
Здесь САравн или СА,е (индекс «е» от английского слова equilibrium) - концентрация
реагента к моменту наступления химического равновесия).
14.
Выберите правильный ответ:Степень превращения (конверсия) реагента при условии, что
из 100 кг поданного на вход в реактор реагента, 45 кг
превратилось в целевой продукт, а 10 кг осталось не
превращенным:
1. 0,90
2 . 45 %
3. 10 %
4. 0,45
15.
10Выход продукта – отношение реально (фактически) полученного количества
продукта к максимально возможному количеству, которое можно получить в
данных условиях осуществления химической реакции.
Для простой необратимой реакции aA bB
Выход продукта на поданное сырье (на поданный реагент) равен степени
превращения:
b
n A, 0 A
nB
a
В
A
b
b
n A, 0
n A, 0
a
a
Для обратимой реакции aA bB
Выход продукта на поданное сырье (на поданный реагент) равен отношению
фактической степени превращения к равновесной (максимальной в данных
условиях):
b
nB
a A
В
b
b A,e
n A,0 A,e
n A,0 A,e
a
a
n A, 0 A
16.
11Для сложных реакций (параллельных, последовательных, комбинированных),
где помимо целевой реакции протекают побочные реакции, выход по целевому
продукту рассчитывается при допущении, что все количество реагента расходуется
в целевой реакции.
В целом для сложных реакций выход по данному продукту рассчитывается как
произведение конверсии реагента на селективность по этому продукту.
Селективность – доля превращенного реагента, израсходованная на
образование данного продукта (не обязательно целевого), при расчете
селективности учитываются только химические реакции - основная и побочные.
17.
12Полная или интегральная селективность – это отношение количества реагента,
израсходованное в данной реакции, к общему количеству превращенного
реагента. По другому интегральную селективность можно называть избирательной
конверсией так как она отражает долю реагента израсходованного на образование
данного продукта в общем количестве реагента, израсходованного на образование
всех продуктов.
Например, для последовательной реакции
aА (реагент) bВ (целевой продукт) cС (побочный продукт)
селективность целевого продукта B по реагенту А:
SB / A
nВ nB ,0
b
n A, 0 A
a
селективность побочного продукта С по реагенту А
nС nС ,0
SC / A
c
n A, 0 A
a
18.
13Для параллельных реакций дополнительно используется понятие
дифференциальной селективности равной отношению скорости целевого
превращения к суммарной скорости расходования реагента:
А В (целевой продукт)
А С (побочный продукт)
rA B
rB
sB / A
rA B rA C rA,
Производительность:
количество продукта произведенного (выработанного) в единицу времени:
П
В
где В – количество продукта (кг, тонн), - время, для выражения которого может
быть использована любая единица – час, сутки, месяц, год)
19.
14Интенсивность – понятие, которое используют для сравнения эффективности
работы аппаратов, используемых для осуществления одной и той же химической
реакции.
Интенсивность равна производительности, отнесенной например, к единице
объема аппарата:
П
В
И
Vапп Vапп
Пример размерности для интенсивности - [кг/(м3 ч)].
Для каталитических реакторов производительность аппарата удобно относить к
массе (или объему) загруженного катализатора:
И
В
mкатализатора
20.
15Расходные коэффициенты по сырью (по реагенту):
Теоретический расходный коэффициент рассчитывается по стехиометрии
химической реакции.
Например для реакции
aА bВ (целевой продукт) + cС (побочный продукт)
a МА
Т
b МВ
где Мi – молекулярная масса
Практический или фактический расходный коэффициент – отношение массы
реагента, поданного в систему за данный временной интервал, к массе продукта,
произведенного в течение этого временного интервала.
mA
П Ф
mB
21.
16Себестоимость продукции.
Разделяется на фабрично-заводскую себестоимость, а именно денежное
выражение затрат данного предприятия на изготовление единицы продукта и
полную себестоимость, которая включает еще и затраты предприятия на сбыт
готового продукта.
Фабрично-заводская себестоимость складывается из следующих статей
расхода:
1. Сырье, доля затрат на сырье составляет основную долю расходов (60 – 70
и более %);
2. Затраты на топливо и энергию;
3. Амортизационные отчисления, идущие на возмещение износа основного
оборудования, коммуникаций, зданий;
4. Зарплата основных рабочих;
5. Цеховые расходы – зарплата вспомогательных рабочих, администрации
цеха, вспомогательных служб, текущий ремонт оборудования;
6. Общезаводские расходы – расходы на администрацию завода, охрану,
пожарную службу, очистные сооружения).
Если из сырья помимо основного продукта получают побочные продукты, их
стоимость вычитается из себестоимости основного продукта.
Прибыль - в бухгалтерском учете - превышение доходов от продажи товаров
и услуг над затратами на производство и продажу этих товаров.

















 chemistry
chemistry








