Similar presentations:
Клеточные технологии и современная медицина
1. Клеточные технологии и современная медицина Н.А. Онищенко (лекция)
НИИ ТРАНСПЛАНТОЛОГИИ И ИСКУССТВЕННЫХ ОРГАНОВ2. Механизмы реализации лечебного действия клеточной терапии
1. Возмещается дефицит отсутствующих клоновспециализированных клеток в органах.
2. Стимулируется резерв внутриклеточной
регенерации и пролиферации в сохранившихся
клетках органа.
3. ПУТИ КОМПЕНСАЦИИ НЕДОСТАТОЧНОСТИ ФУНКЦИИ ПОРАЖЕННОГО ОРГАНА ДОНОРСКИМИ КЛЕТКАМИ
При трансплантации - за счет суммации эффектовфункционирования донорских клеток и
индуцированного увеличения функциональной
активности клеток пораженного органа.
При экстракорпоральном подключении - за счет
увеличения мощности импульсных регуляторных
сигналов донорских клеток и реализации их системного
воздействия на восстановительные процессы в
пораженном органе.
4. ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ЭФФЕКТИВНОСТЬ КЛЕТОЧНОЙ ТЕРАПИИ ПОРАЖЕННОГО ОРГАНА
Масса жизнеспособной ткани в пораженном органедолжна быть достаточной для восприятия сигнала к
повышению ее функциональной активности и
восстановлению органного гомеостаза в организме.
Масса биологической активности донорских клеток
должна быть достаточной для индукции регуляторной
перестройки в клетках пораженного органа.
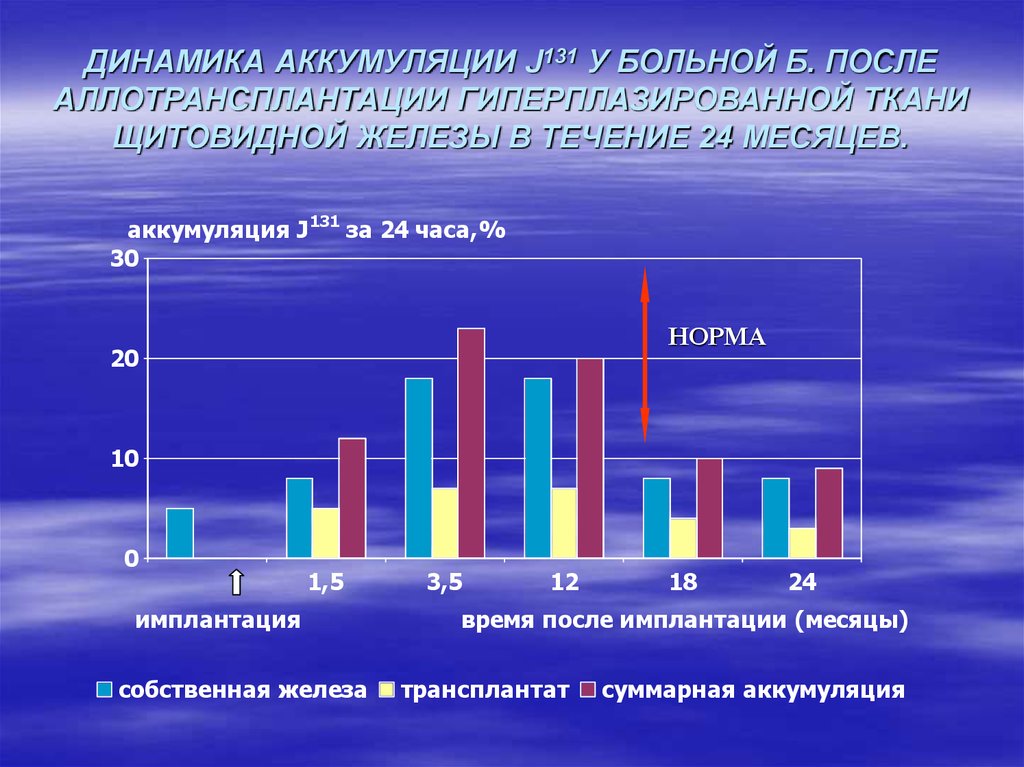
5. ДИНАМИКА АККУМУЛЯЦИИ J131 У БОЛЬНОЙ Б. ПОСЛЕ АЛЛОТРАНСПЛАНТАЦИИ ГИПЕРПЛАЗИРОВАННОЙ ТКАНИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ В ТЕЧЕНИЕ 24
МЕСЯЦЕВ.аккумуляция J 131 за 24 часа,%
30
НОРМА
20
10
0
1,5
имплантация
собственная железа
3,5
12
18
24
время после имплантации (месяцы)
трансплантат
суммарная аккумуляция
6.
ПРЕИМУЩЕСТВА ФЕТАЛЬНЫХ ОРГАНОВПЕРЕД ОРГАНАМИ ВЗРОСЛЫХ
ДОНОРОВ
Клетки фетальных органов имеют слабо
экспрессированные комплексы главных антигенов
гистросовместимости (МНС-I, МНС-II).
Преобладает содержание стволовых и бластных
клеток, обладающих мощным потенциалом
пролиферации.
Стволовые и бластные клетки продуцируют
уникальный комплекс цитокинов и ростовых
факторов.
7. Свойства стволовых клеток
способность к многократному делению;способность при делении воспроизводить
себе подобные клетки;
способность дифференцироваться в
один или более тип клеток.
8.
Факторы препятствующие использованию эмбриональныхстволовых клеток в клеточной терапии
1. Технические трудности в получении чистой линии
человеческих ЭСК;
2. Недостаток информации об индукции их
дифференцировки in vitro;
3. Наличие ряда биоэтических вопросов,
возникающих при использовании ЭСК,
выделенной из эмбриональной ткани с
применением технологии переноса ядра;
4. Опасность индукции канцирогенеза при
использовании ЭСК;
5. Иммунологические проблемы отторжения.
9. Сравнительная характеристика ЭСК и Взрослых СК
Хорошо размножаютсяТоти-, плюрипотентны
Сложная техника получения и
культивирования
Получение порождает
этические проблемы
Аутологичная трансплантация
возможна только в случае
реализации терапевтического
клонирования
Высокий риск канцерогенеза
Пролиферативный потенциал
ниже, чем у ЭСК
Уни-, би-, мультипотентны,
редко – плюрипотентны
Более доступный процессинг
Нет этических проблем
Возможность аутологичной
трансплантации
Онкогенность минимальна
10. Источники взрослых стволовых клеток для клинического применения
Фетальная печень (гемопоэтические СК)Мозг фетуса (нейральные СК)
Пуповинная кровь (гемопоэтические СК)
Костный мозг взрослого человека
(гемопоэтические и стромальные СК)
Слизистая оболочка носоглотки в районе
обонятельной луковицы (нейральные СК)
Жировая ткань(мезенхимальные СК)
Пульпа молочных зубов
11. Достоинства костного мозга как источника СК
Относительно большое количество СК впунктате КМ
Несколько видов СК в пунктате (высокая
пластичность СК костного мозга)
Возможность аутологичной трансплантации
Доступность
Относительно низкая стоимость получения и
культивирования
Отсутствие онкогенности
Отсутствие этических проблем
12. СК костного мозга
Пунктат костного мозгаМононуклеарная фракция
Гемопоэтические СК
CD34+, 1–2%
Стромальные СК
CD34-, CD45-,
CD14-, < 0.05%
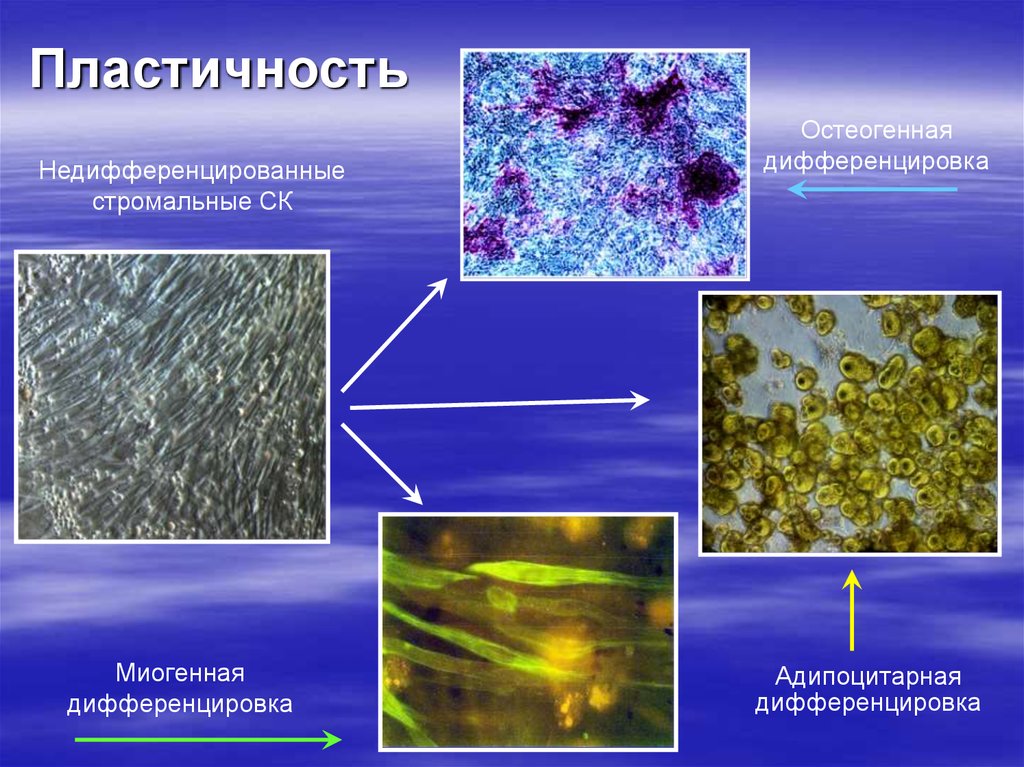
13. Пластичность
Недифференцированныестромальные СК
Миогенная
дифференцировка
Остеогенная
дифференцировка
Адипоцитарная
дифференцировка
14.
Кардиомиоцитоподобная клетка из костногомозга in vitro.
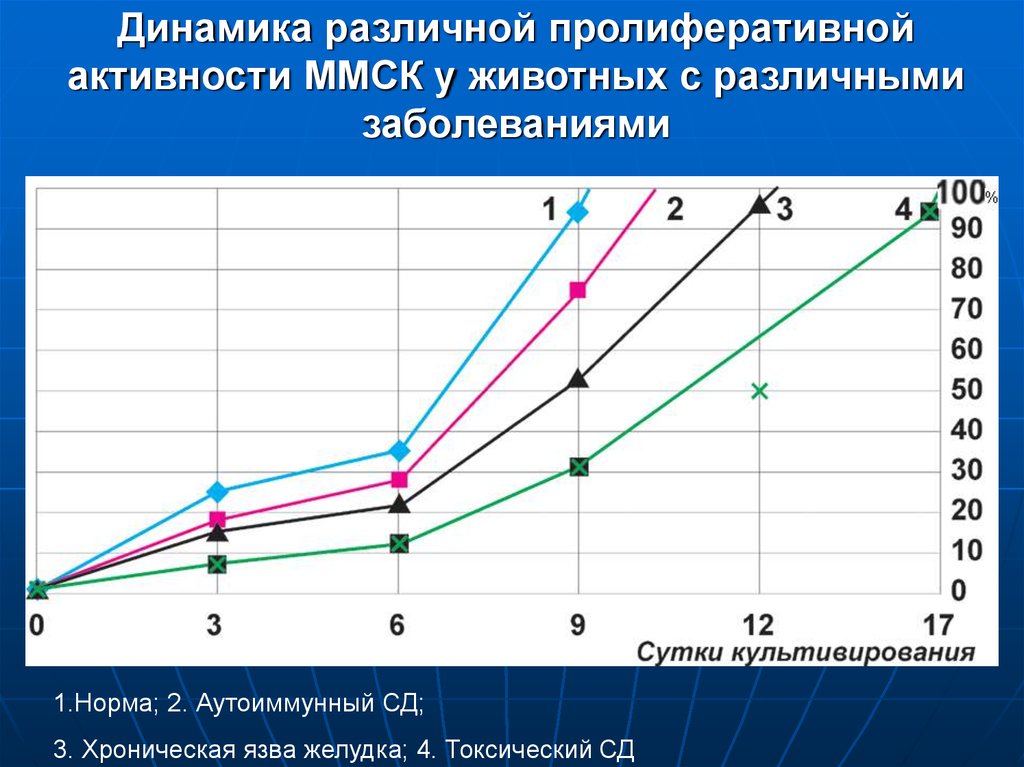
15. Динамика различной пролиферативной активности ММСК у животных с различными заболеваниями
1.Норма; 2. Аутоиммунный СД;3. Хроническая язва желудка; 4. Токсический СД
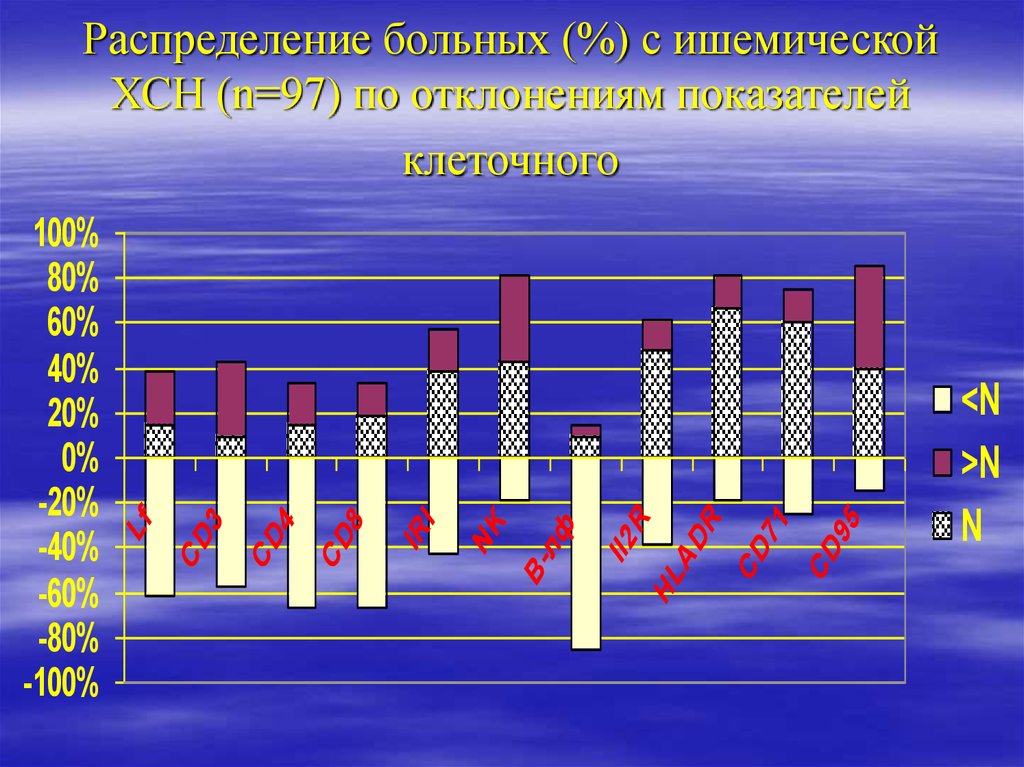
16. Распределение больных (%) с ишемической ХСН (n=97) по отклонениям показателей клеточного
95CD
71
CD
R
HL
AD
Il2
R
лф
В-
NK
IR
I
8
CD
4
CD
3
CD
100%
80%
60%
40%
20%
0%
-20%
-40%
-60%
-80%
-100%
Lf
Распределение больных (%) с ишемической
ХСН (n=97) по отклонениям показателей
клеточного
<N
>N
N
17. Взаимосвязь между содержанием CD25+ лимфоцитов в крови и количеством колониеформирующих единиц мононуклеарными клетками
костного мозга у больных ХСН.Scatterplot: CFU vs. CD25+ клетки (Casew ise MD deletion)
CD25+ клетки = -1,554 + ,00981 * CFU
Correlation: r = ,72542
9
8
CD25+ клетки
7
6
5
4
3
2
1
0
-1
0
100
200
300
400
500
CFU
600
700
800
95% confidence
900
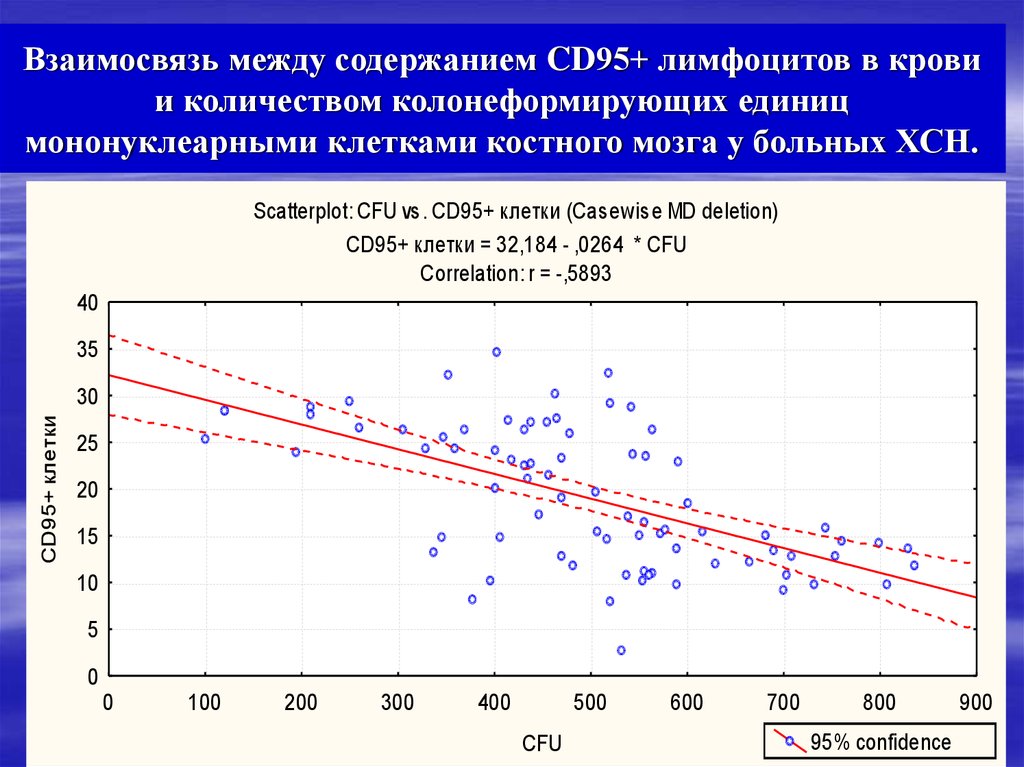
18. Взаимосвязь между содержанием CD95+ лимфоцитов в крови и количеством колонеформирующих единиц мононуклеарными клетками костного
мозга у больных ХСН.Scatterplot: CFU vs. CD95+ клетки (Casewise MD deletion)
CD95+ клетки = 32,184 - ,0264 * CFU
Correlation: r = -,5893
40
35
CD95+ клетки
30
25
20
15
10
5
0
0
100
200
300
400
500
CFU
600
700
800
95% confidence
900
19. Содержание про- и противовоспалительных цитокинов в культуральной среде в процессе культивирования ММСК
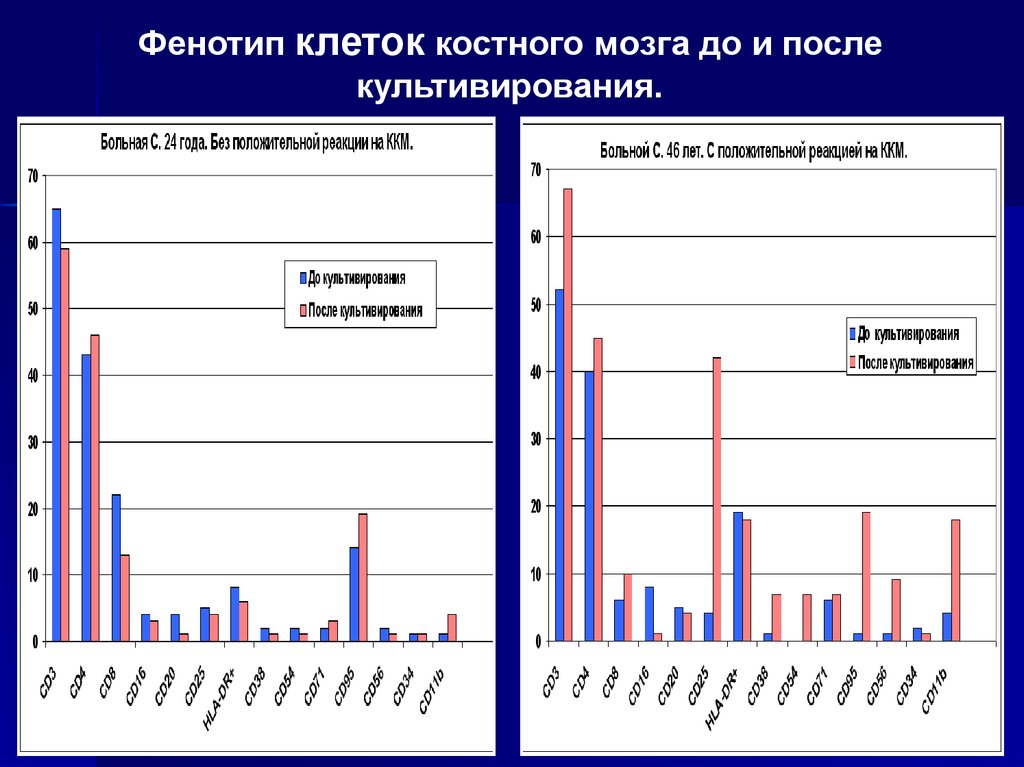
20.
Фенотип клеток костного мозга до и послекультивирования.
21.
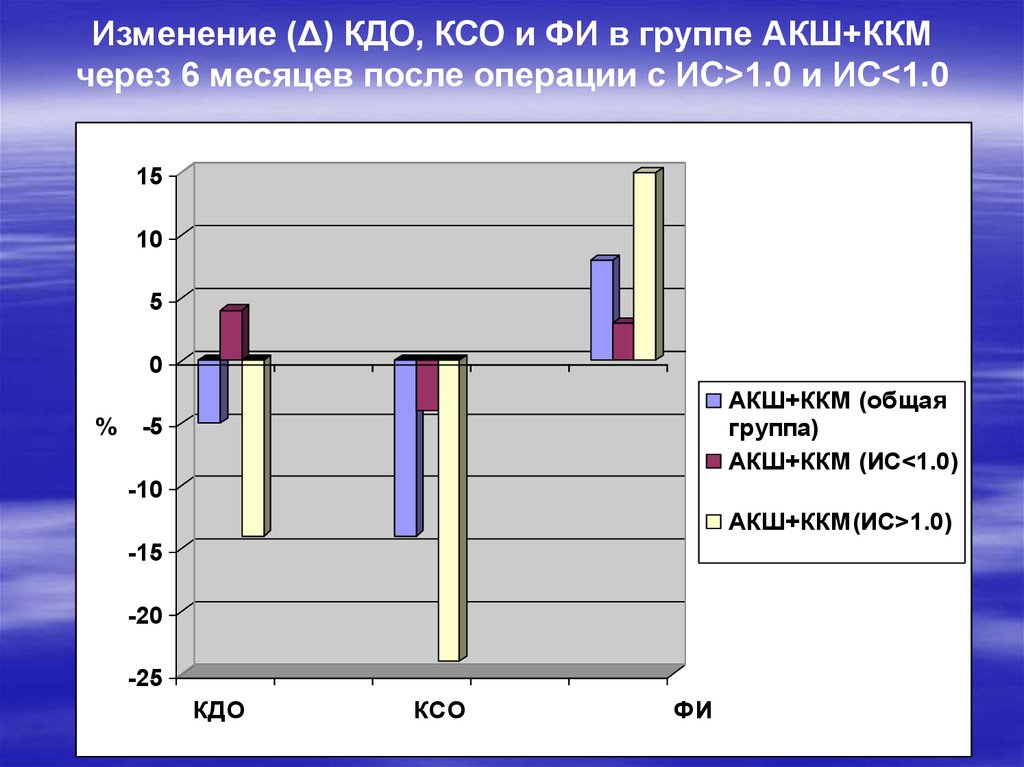
22.
Изменение (Δ) КДО, КСО и ФИ в группе АКШ+ККМчерез 6 месяцев после операции с ИС>1.0 и ИС<1.0
15
10
5
0
%
АКШ+ККМ (общая
группа)
АКШ+ККМ (ИС<1.0)
-5
-10
АКШ+ККМ(ИС>1.0)
-15
-20
-25
1
КДО
2
3
КСО
4
5
ФИ
23. Микрососуды брыжейки тонкой кишки у интактной крысы.
Импрегнация азотнокислым серебром по КуприяновуУв. 200
ув. 400
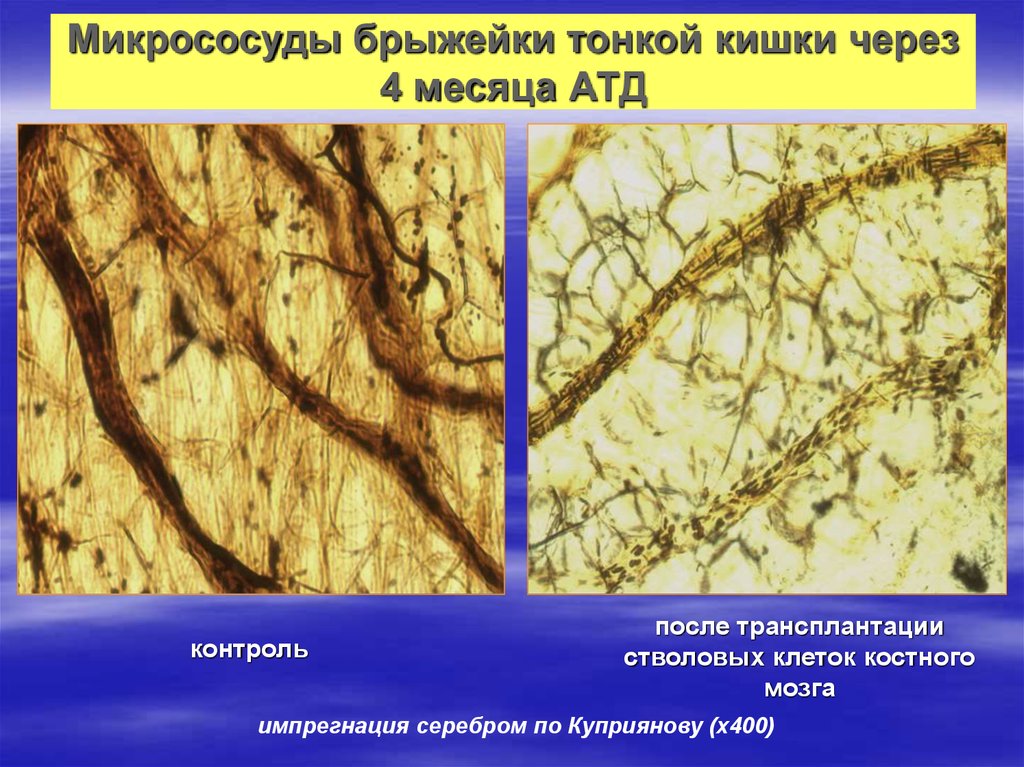
24. Микрососуды брыжейки тонкой кишки через 4 месяца АТД
контрольпосле трансплантации
стволовых клеток костного
мозга
импрегнация серебром по Куприянову (х400)
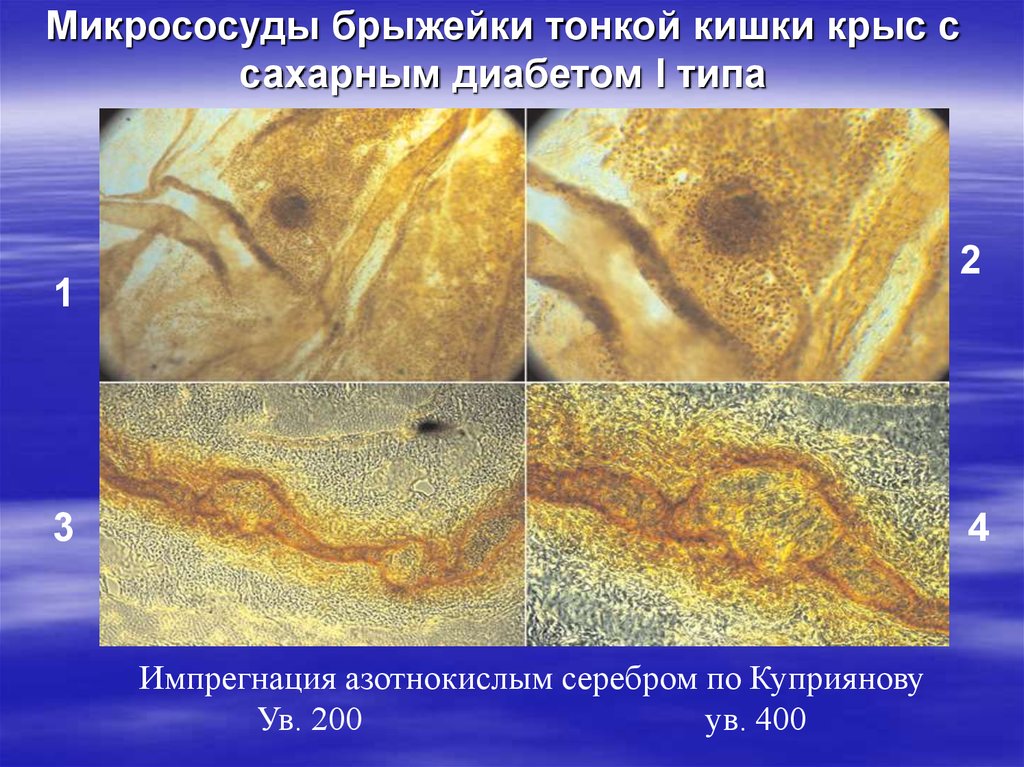
25. Микрососуды брыжейки тонкой кишки крыс с сахарным диабетом I типа
21
3
4
Импрегнация азотнокислым серебром по Куприянову
Ув. 200
ув. 400
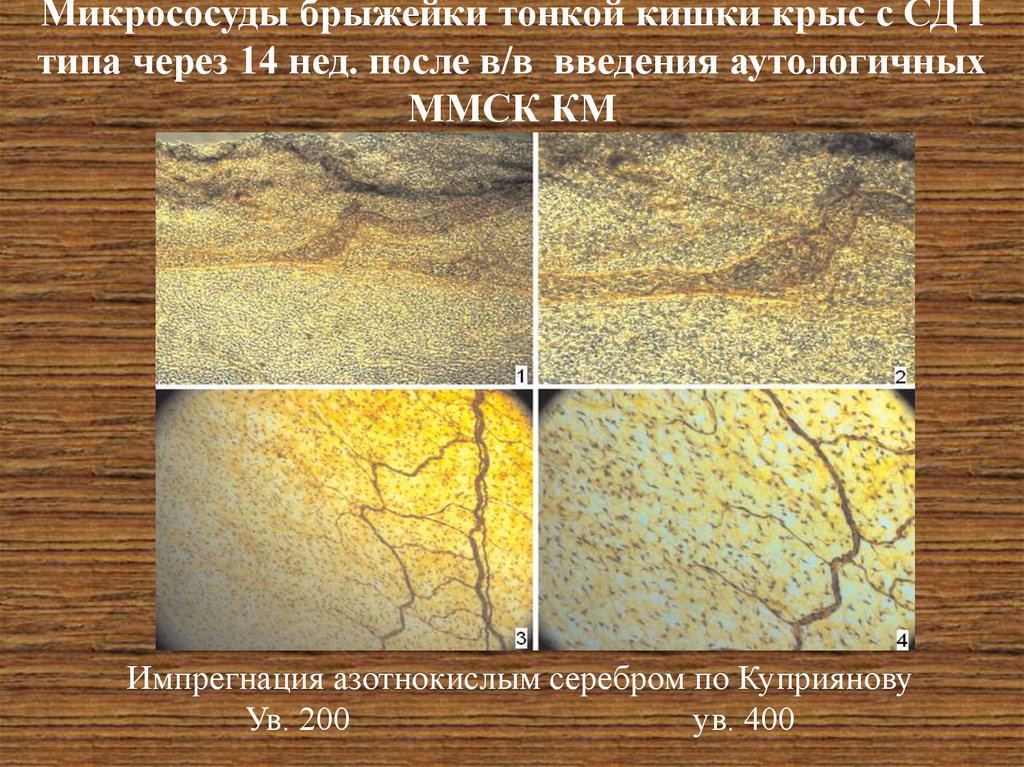
26. Микрососуды брыжейки тонкой кишки крыс с СД I типа через 14 нед. после в/в введения аутологичных ММСК КМ
Импрегнация азотнокислым серебром по КуприяновуУв. 200
ув. 400
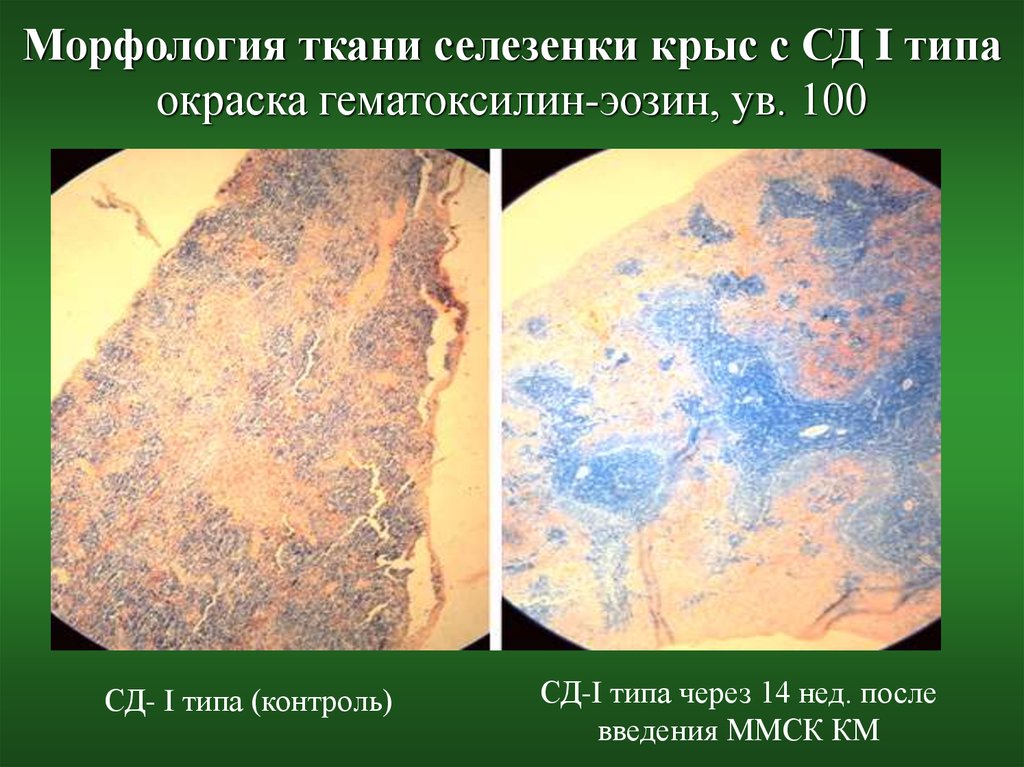
27. Морфология ткани селезенки крыс с СД I типа окраска гематоксилин-эозин, ув. 100
СД- I типа (контроль)СД-I типа через 14 нед. после
введения ММСК КМ
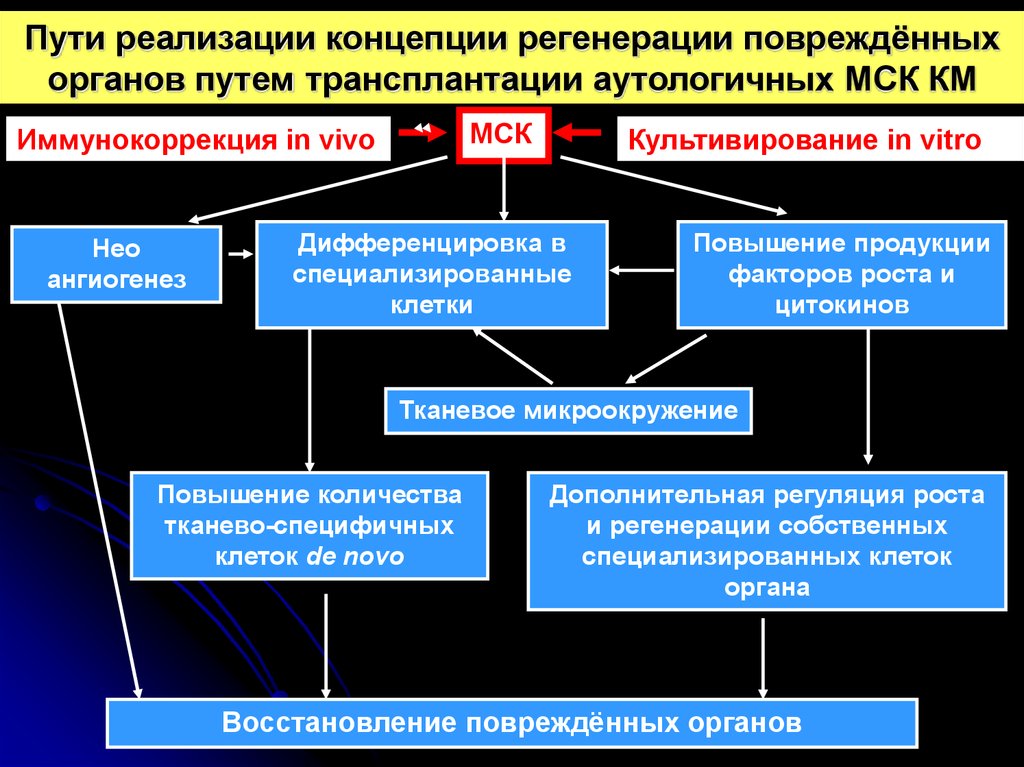
28.
Пути реализации концепции регенерации повреждённыхорганов путем трансплантации аутологичных МСК КМ
МСК
Иммунокоррекция in vivo
Нео
ангиогенез
Культивирование in vitro
Дифференцировка в
специализированные
клетки
Повышение продукции
факторов роста и
цитокинов
Тканевое микроокружение
Повышение количества
тканево-специфичных
клеток de novo
Дополнительная регуляция роста
и регенерации собственных
специализированных клеток
органа
Восстановление повреждённых органов
















 medicine
medicine








