Similar presentations:
Растворы электролитов
1.
РАСТВОРЫ2.
Растворы электролитовЭлектролиты – вещества с ионной
проводимостью.
Это
растворы
солей,
кислоты,
оснований, расплавы солей.
I – закон Рауля для электролитов:
(P P)
iN 2
0
P
0
3.
II закон Рауля∆Tкип =iEm
∆Tзам=iKm
Закон Вант-Гоффа
∆Pосм=icRT
4.
i – поправочный коэффициентизотонический
число всех частиц в растворе
i
число исходных частиц
Δt опыт
ΔPопыт
i
Δt расчёт ΔPрасчёт
i – зависит от:
- природы раствора
- концентрации раствора
i>1 для растворов солей, кислот и
оснований
5.
Теория электролитическойдиссоциации Аррениуса
Распад молекул электролитов на ионы
в среде растворителя под действием
молекул растворителя.
NaCl → Na+ + ClКоличество частиц при диссоциации
увеличивается.
6.
Количественнаяхарактеристика
процесса
диссоциации
выражается
степенью
электролитической
диссоциации – α.
Счисло молекул распавшихс я на ионы
α
Собщее число молекул электролита
7.
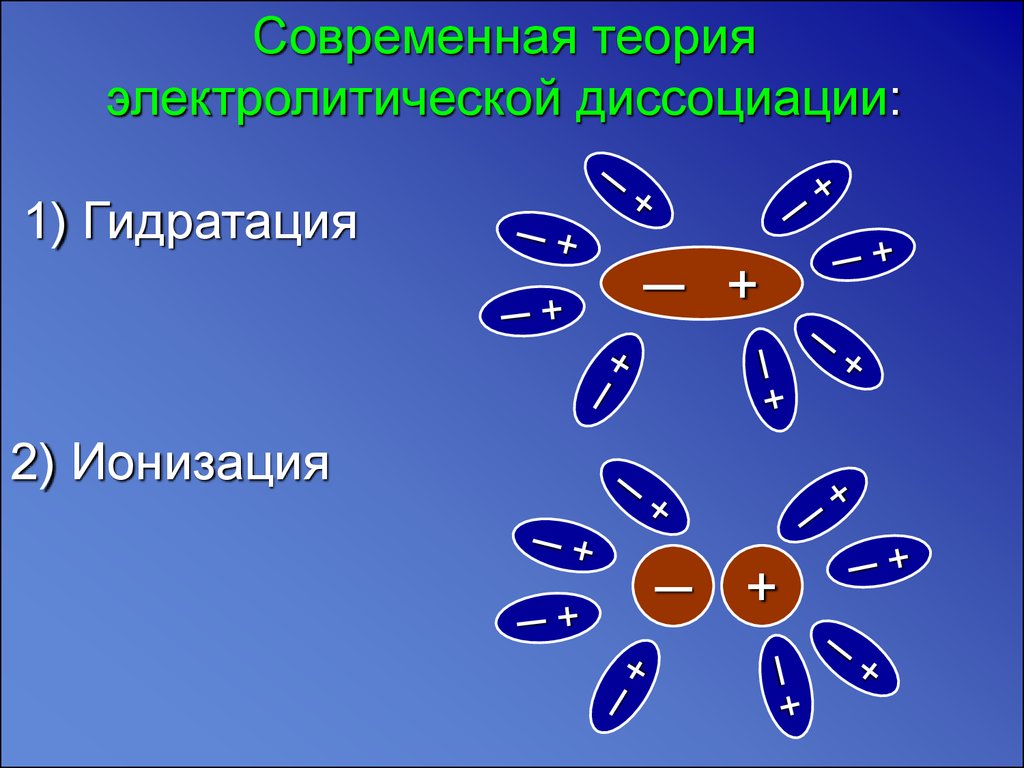
Современная теорияэлектролитической диссоциации:
1) Гидратация
─ +
2) Ионизация
─
+
8.
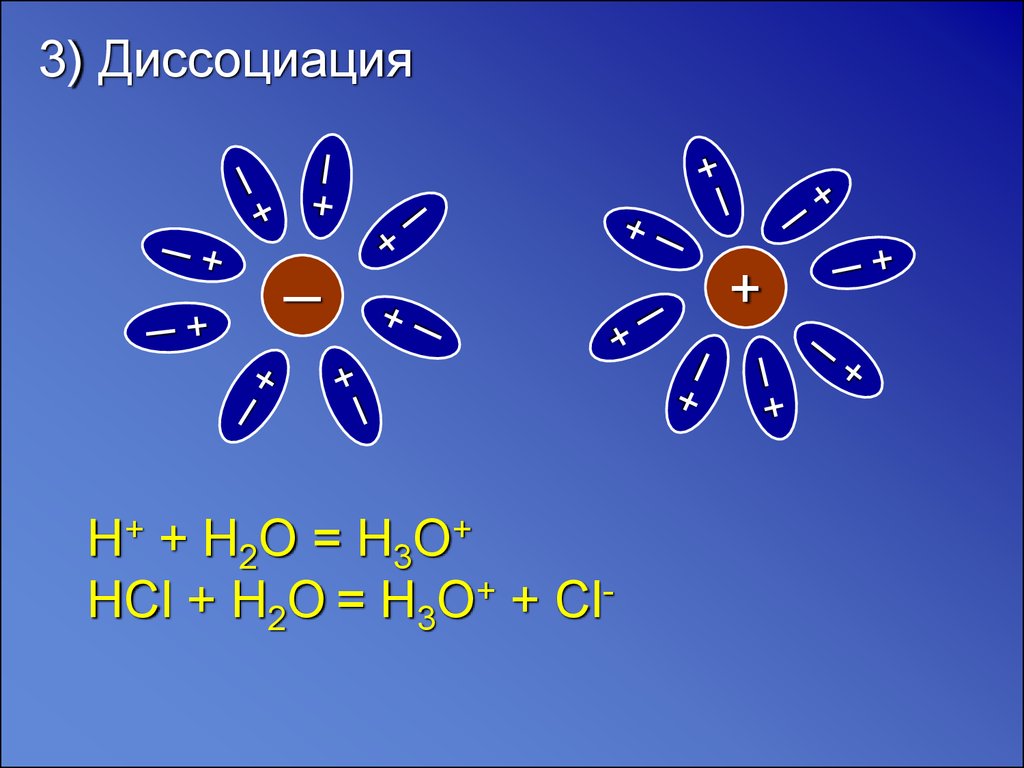
3) Диссоциация─
H+ + H2O = H3O+
HCl + H2O = H3O+ + Cl-
+
9.
Способность гидратироваться зависит:- от природы ионов
- от заряда иона
- от размера иона
- от строения электронной оболочки
Al3+ > Cr3+ > Zn2+ > Na+
Энтальпия гидратации ионов:
∆Hгид.соли = ∆H+гид+ ∆Н-гид
∆S>0 Гидратация сопровождается
значительным разрушением структуры
∆S<0 если структура растворителя
упорядочивается
10.
По степени диссоциации:Сильные электролиты – α > 50% все
соли,
неорганические
кислоты,
гидроксиды
щёлочных
и
щелочноземельных металлов: HCl,
H2SO4, HNO3
Слабые электролиты – α < 50% Н2S,
H2SiO3, H2CO3, CH3COOH, гидрооксиды
d – элементов (нерастворимые
вещества), NH4OH.
11.
Растворы слабых электролитовдиссоциация
AB
ассоциация
A+ + B
[A ][B ]
Кд
[AB]
Чем
больше
Кд
тем
диссоциирует электролит.
NH4OH = NH4+ + OH-
Кд
[NH4 ][OH ]
[NH4OH]
сильнее
12.
Закон разбавления Освальда1
α<<1, то α К д
С
С – разбавлением раствора степень
диссоциации увеличивается.
с – молярная концентрация электролита
сα – концентрация каждого из ионов
с(1-α) – концентрация
недиссоциирующих частиц.
13.
Растворы сильных электролитовNaCl i≈2
NaCl → Na+ + Cl- от наличия одноимённых ионов
I. СН3COOH ↔ H+ + CH3COOII. СН3COONa → CH3COO- + Na+
- от температуры, увеличение t°
вызывает ассоциацию ионов.
14.
1907 Льюис → активность (а) →эффективная концентрация ионов.
а = f·c;
f=1 a=c
Активность отражает:
1. Неполную диссоциацию молекул
2. Взаимное притяжение
разноименных ионов
3. Влияние гидратации ионов
4. Взаимодействия между молекулами
растворителя.
15.
lg f A JКоэффициент активности зависит от
ионной силы раствора (J).
А – коэффициент пропор., зависит от
вида растворителя.
Кислоты – диссоциируют на катионы H+
и анион кислотного остатка
HCl → H+ + ClН3РО4 ↔ [H+][H2PO4]
[H ][Н2РО 4 ]
К1
[Н3РO 4 ]
16.
(H2PO4)- ↔ H+ + (HPO4)2К2
2[H ][HPO 4 ]
[Н2РO 4 ]
(HPO4)2- ↔ H+ + PO43
3
[H ][HPO 4 ]
K3
2
[HPO4 ]
K1 > K2 > K3
17.
Ионное произведение воды.pH – растворов.
Н2О ↔ H+ + ОН
[H ][OH ]
16
Kg
1,2 10
[H2O]
K´воды = [H+][OH-] – ионное произведение
воды
Kводы = [H+][OH-] = 1,1 10-14 г-ион/л –
увеличивается с ростом температуры.
[H+][OH-] = 1 10-14 тогда
[H+] = [OH-] = 10 14 = 10-7 г-ион/л
18.
Нейтральный раствор[H+] = 10-7 г-ион/л
[OH-] = 10-7 г-ион/л
Кислый раствор
[H+] > 10-7 г-ион/л
[OH-] < 10-7 г-ион/л
Щелочной раствор
[H+] < 10-7 г-ион/л
[OH-] > 10-7 г-ион/л
Водородный показатель
-Lg[H+] = pH
19.
В нейтральной среде:[H+] = 10-7
-Lg[10-7] = 7 → pH = 7
В кислой среде:
[H+] = 10-5
-Lg[10-5] = 5 → pH = 5
pH < 7 ([Н+] < 10-7)
В щелочной среде:
[H+] = 10-9
-Lg[10-9] = 9 → pH = 9
pH > 7 ([Н+] > 10-7)
20.
Пример 1:[OH-] = 10-11
pH = ?
[H+][OH-] = 10-14
x 10-11 = 10-14
14
10
3
x 11 10
10
[H+] = 10-3 г-ион/л
-Lg[10-3] = 3
pH = 3 (кислая среда)
21.
Пример 2:pH = 2
[OH-] = ?
[H+] = 10-2
10-2 x = 10-14
14
10
12
x 2 10
10
[OH-] = 10-12 г-ион/л













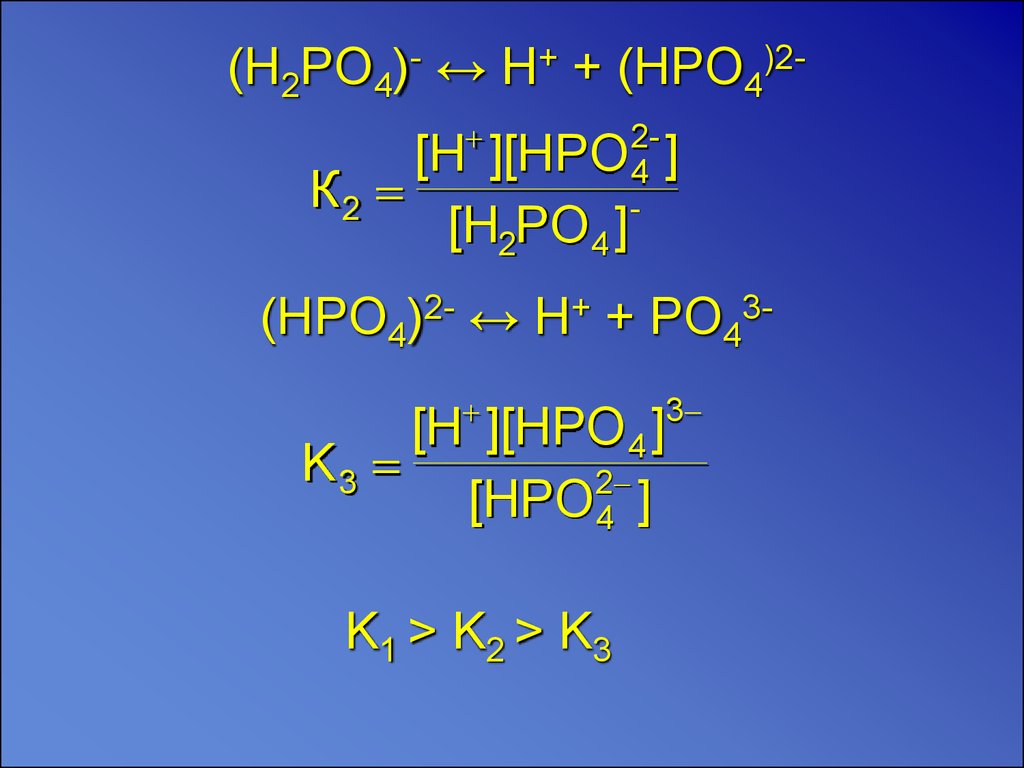




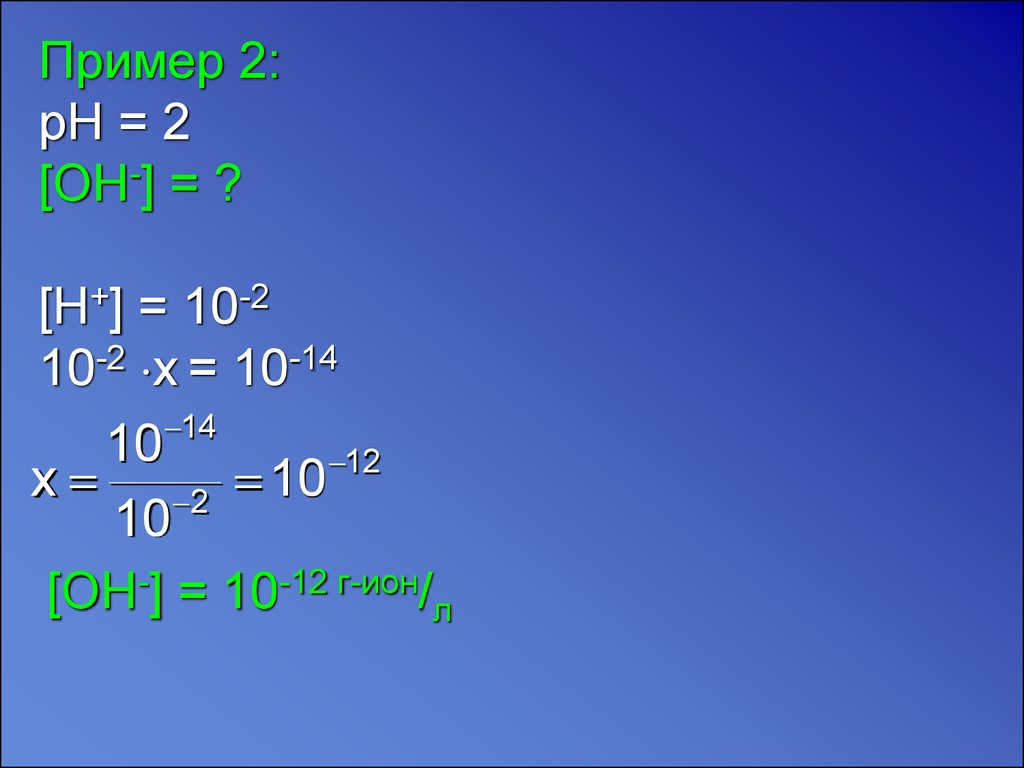
 chemistry
chemistry








