Similar presentations:
Количественный масс-спектрометрический анализ
1. Количественный масс-спектрометрический анализ
A bundanc eT IC : P 5 6 5 0 C 3 .D \ d a ta .m s
7500000
7000000
6500000
6000000
5500000
5000000
4500000
4000000
3500000
3000000
2500000
2000000
1500000
1000000
500000
6 .5 0
T im e - - >
7 .0 0
7 .5 0
8 .0 0
8 .5 0
9 .0 0
9 .5 0
2. Обработка масс-спектров
Важнейшие области применения массспектрометрии Важнейшие области применениямасс-спектрометрии :
-определение относительных молекулярных масс;
-оценка содержания изотопов с использованием
изотопных пиков;
- установление качественного состава образцов;
- проведение количественного анализа.
3. Определение молекулярных масс
Как правило, пики с самым большимсоотношением м I z (молекулярные) дают
информацию о молекулярных массах
компонентов исследуемых проб.
Однако бывают и исключения. Например,
если после ионизации электронным ударом
первоначальная молекула разрушается при
протекании многочисленных реакций
фрагментации, молекулярные ионы могут
отсутствовать.
Если молекулярный пик отсутствует в
спектре, необходимо использовать «мягкие»
методы ионизации, например ХИ.
При этом следует учитывать, что пик с самым
большим соотношением м/ z необязательно
должен соответствовать молекулярной массе
компонента образца. При определенных
обстоятельствах другие атомы или группы
атомов связаны с молекулой, вследствие чего
будут получены сигналы с большими массами.
4. Реакции фрагментации
Если для ионизации применяется «жесткий» метод ионизации (ИЭУ), то, какправило, молекула разрушается под действием высокой энергии ионизирующих
электронов.
Наличие осколков определенных соединений в молекуле является
положительным явлением, если образующиеся фрагментные ионы достаточно
устойчивы.
При расщеплении простой углерод-углеродной связи С-С стабильность
фрагмента возрастает по мере стабилизации образующихся карбониевых
ионов, т. е. по мере увеличении степени их замещения (рис. 3.59). Поэтому
расщепление связей С-С происходит преимущественно в местах разветвления
углеродной цепи.
Стабилизация положительного заряда радикал-катиона на рис. 3.59 возрастает
слева направо.
5. Реакции фрагментации
Существует множество других процессов, приводящих к фрагментации молекулы.В табл. 3.19 приведены некоторые «ключевые» осколки молекул. При этом речь идет о
стабильных молекулярных фрагментах, вследствие чего они часто появляются в массспектрах при определенных значениях а. е. м. (массовых чисел).
Например, при фрагментации cпиртов и простых эфиров образуются ионы СН 2=ОН +, с
отношением m / z = 31. Пик с таким показателем свидетельствует о том, что
анализируемое соединение является, скорее всего, спиртом или простым эфиром
6. Реакции фрагментации
На основании различий масс между сигналами молекулярных иближайших к ним осколочных ионов можно сделать некоторые
выводы о структуре анализируемого вещества.
В табл. 3.20 приводятся варианты интерпретации некоторых таких
дифференциаций
7. Реакции фрагментации
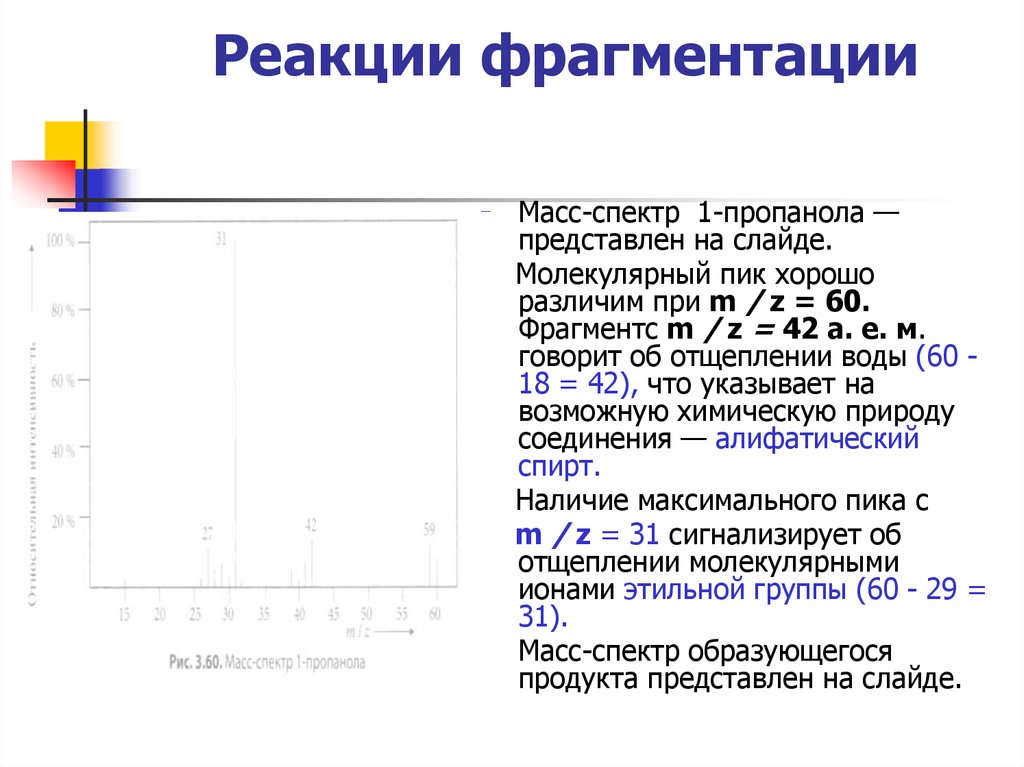
Масс-спектр 1-пропанола —представлен на слайде.
Молекулярный пик хорошо
различим при m / z = 60.
Фрагментс m / z = 42 а. е. м.
говорит об отщеплении воды (60 18 = 42), что указывает на
возможную химическую природу
соединения — алифатический
спирт.
Наличие максимального пика с
m / z = 31 сигнализирует об
отщеплении молекулярными
ионами этильной группы (60 - 29 =
31).
Масс-спектр образующегося
продукта представлен на слайде.
8. Количественный масс-спектрометрический анализ
С момента возникновения МС былапризнана методом количественного
анализа.
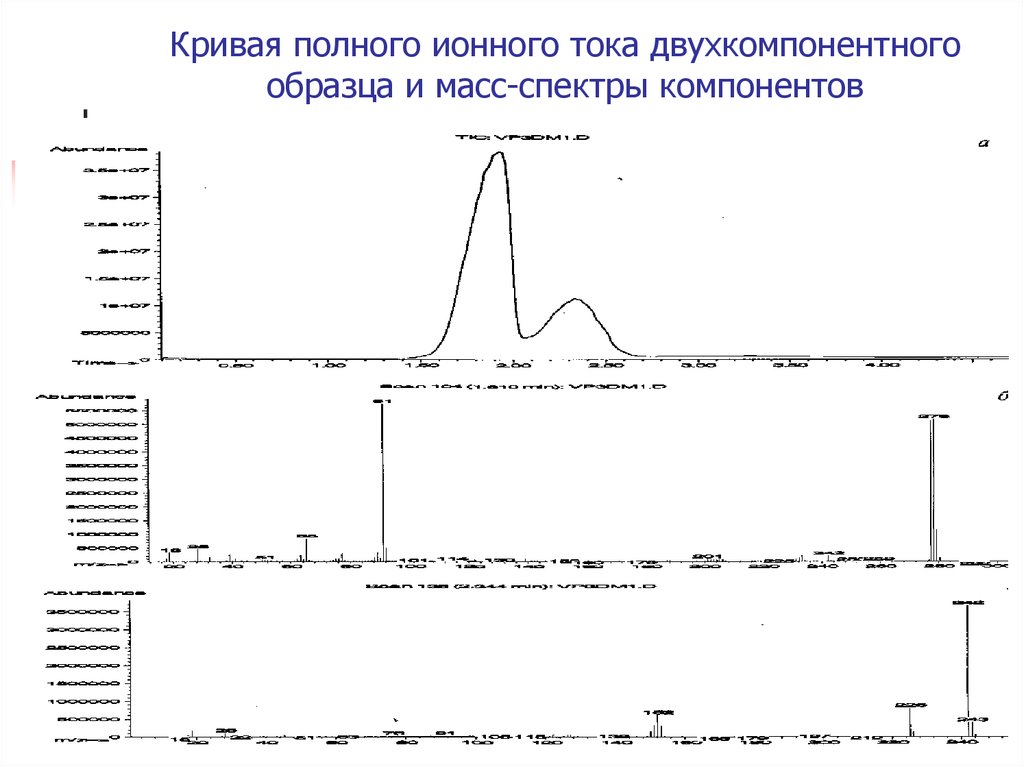
Для грубой количественной оценки
можно использовать площадь под кривой
полного ионного тока, полученной при
полном испарении образца.
Важно, чтобы кривая испарения вещества
не перекрывалась кривой испарения
другого компонента образца
9. Кривая полного ионного тока двухкомпонентного образца и масс-спектры компонентов
10. Количественный масс-спектрометрический анализ
Наилучшим инструментом для проведенияколичественного анализа смесей органических
соединений является ХМС.
В этом случае на входе мы имеем неизвестную
смесь органических соединений, а на выходе –
полную информацию о ее качественном и
количественном составе.
Масс-спектр позволяет идентифицировать
соединение, а площадь хроматографического
пика – оценить содержание этого соединения в
пробе.
11. Количественный масс-спектрометрический анализ
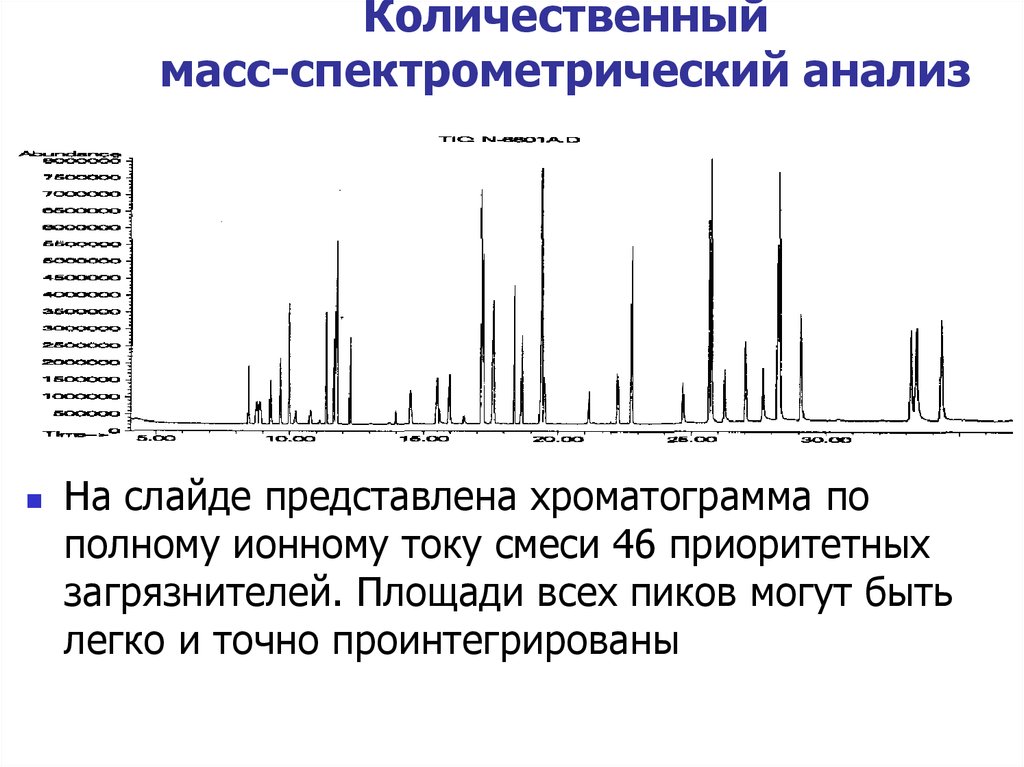
На слайде представлена хроматограмма пополному ионному току смеси 46 приоритетных
загрязнителей. Площади всех пиков могут быть
легко и точно проинтегрированы
12. Количественный масс-спектрометрический анализ
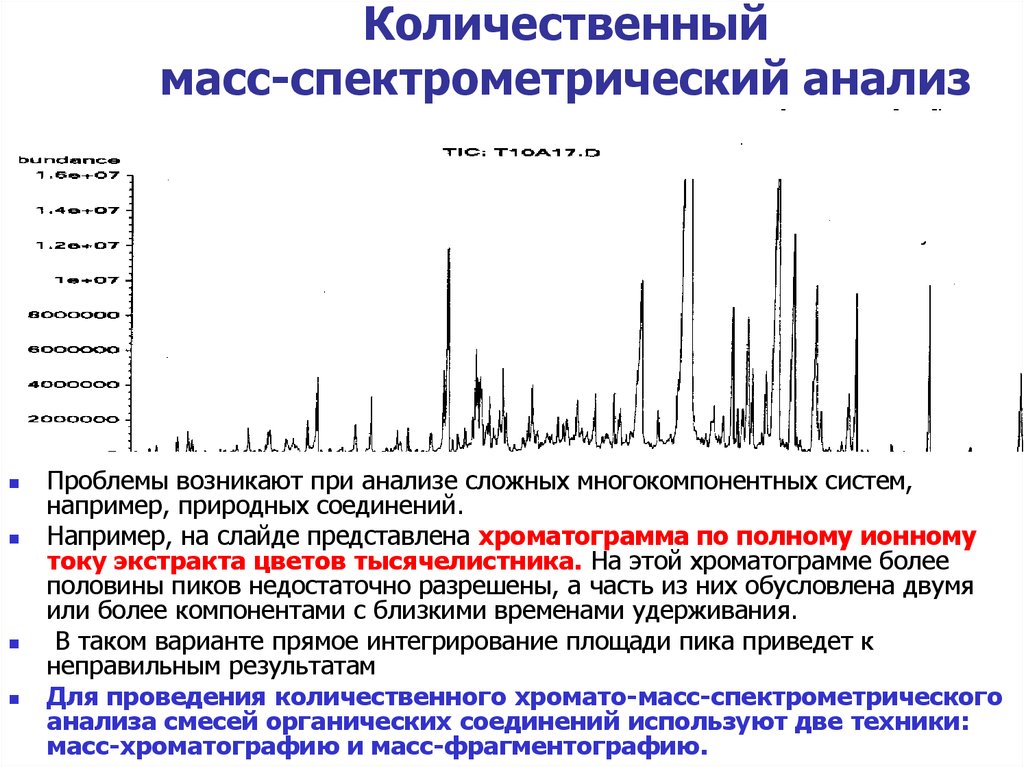
Проблемы возникают при анализе сложных многокомпонентных систем,например, природных соединений.
Например, на слайде представлена хроматограмма по полному ионному
току экстракта цветов тысячелистника. На этой хроматограмме более
половины пиков недостаточно разрешены, а часть из них обусловлена двумя
или более компонентами с близкими временами удерживания.
В таком варианте прямое интегрирование площади пика приведет к
неправильным результатам
Для проведения количественного хромато-масс-спектрометрического
анализа смесей органических соединений используют две техники:
масс-хроматографию и масс-фрагментографию.
13. Масс-хроматография
Данный метод не связан ни с каким особым проведениемэксперимента.
Ведется обычный хромато-масс-спектрометрический
анализ с полным сканированием масс-спектра в заданном
диапазоне масс.
Качественное определение ингредиентов
осуществляется по их масс-спектрам и временам
удерживания.
Однако для количественного анализа компьютер
строит хроматограммы по току характеристических
ионов для каждого соединения.
Внешний вид хроматограммы в данном случае
может полностью измениться по сравнению с
исходной хроматограммой, построенной по полному
ионному току, т.к. все ионы, за исключением
заданных, игнорируются.
14. Масс-хроматография
Ab u n d a n c
e
T
7 5 0 0 0 0 0
I C :
P
5 6 5 0 C 3 . D
\
d a t a . m
s
7 0 0 0 0 0 0
6 5 0 0 0 0 0
6 0 0 0 0 0 0
5 5 0 0 0 0 0
5 0 0 0 0 0 0
4 5 0 0 0 0 0
4 0 0 0 0 0 0
3 5 0 0 0 0 0
3 0 0 0 0 0 0
2 5 0 0 0 0 0
2 0 0 0 0 0 0
1 5 0 0 0 0 0
1 0 0 0 0 0 0
5 0 0 0 0 0
6 . 5 0
T
A
b
im
u
n
7 . 0 0
d
a
n
c
2
5
0
0
2
0
0
0
1
5
0
0
1
0
0
0
5
0
0
0
i m
b
u
e
n
d
a
n
c
e
n
6
.
5
0
7
.
d
o
0
e
-
9 . 5 0
-
2
1
7
.
0
0
n
1
8
7
.
0
0
(
7
.
2
1
5
6
.
7
0
t
o
2
6
.
7
0
t
o
1
0
1
8
.
7
0
.
7
0
) :
P
5
6
7
0
) :
P
5
6
0
5
8
0
.
5
C
3
.
D
\
d
a
t
3
.
D
\
d
a
t
0
a
.
m
9
.
0
a
.
m
9
.
0
s
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
6
.
5
0
7
.
0
0
(
7
.
1
8
5
0
8
8
.
7
0
.
0
5
0
8
.
0
C
8
.
5
C
0
9
.
5
0
0
0
9
.
5
0
0
9
.
5
0
s
>
a
n
c
e
1
1
1
1
i m
n
0
o
I
T
9 . 0 0
e
9
8
7
6
5
4
3
2
1
i m
b
u
8 . 5 0
>
I
T
A
8 . 0 0
e
I
T
A
7 . 5 0
e -->
>
6
4
2
0
8
6
4
2
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
6
.
5
0
7
.
0
0
o
n
5
8
.
0
0
7
(
.
5
5
7
0
.
7
0
t
o
5
8
8
.
.
0
7
0
0
)
:
P
5
6
5
3
5
0
.
D
\
d
a
t
a
.
m
9
s
.
0
15. Масс-хроматография
На рисунке 4 представлена хроматограмма по полному ионному токутюленьего жира и масс-хроматограмма по току ионов 326, 360 и 394,
характерных для пентахлор-, гексахлор- и гептахлорбифенилов
соответственно.
Все пики хорошо разрешены, их площади могут быть легко вычислены.
Нужно обратить внимание, что ни один из этих пиков не может быть
надежно зарегистрирован на хроматограмме по полному ионному току.
Здесь речь не идет о повышении чувствительности, а меняется лишь
форма представления результатов.
Такая форма характеризуется повышенной селективностью
Масс-хроматография позволяет во многих случаях проводить
качественный и количественный анализ компонентов, которые
не разделяются хроматографически.
16. Масс-хроматография
Если есть подозрение о наложении масс-спектров двух соединений сблизкими временами удерживания, имеет смысл построить массхроматограммы по характеристичным ионам.
Как правило, компоненты не выходят абсолютно одновременно. Пик
на хроматограмме кажется уширенным, но на масс-хроматограммах
отчетливо видно, что вершины пиков характеристичных ионов,
принадлежащих разным компонентам, сдвинуты друг относительно
друга.
Для увеличения надежности качественного и
количественного анализа имеет смысл построить массхроматограммы не по одному, а по 2-3 характеристическим
ионам.
Достоинством масс-хроматографии является сохранение всей
информации, получаемой при использовании классической хроматомасс-спектрометрии.
Тем не менее, существуют варианты проведения ХМС-анализа, когда
чувствительность эксперимента увеличивается на 2-3 порядка.
17. Масс-фрагментография
Иногда задачей анализа является количественное определениеконкретных ультрамикрокомпонентов смеси.
Для повышения чувствительности метода можно использовать
технику масс-фрагментографии – или мониторинга заданных
ионов (SIM).
В этом случае масс-спектрометр не сканирует весь диапазон масс,
а жестко настраивается на регистрацию ионов с заданными
значениями m/z.
В чем причина улучшения пределов обнаружения в таком
эксперимента?
Представим себе, что в обычном сканирующем режиме скорость
развертки от m/z 50 до 550 составляет 1 с.
Даже без учета времени, которое требуется для возвращения с
верхней границы масс на нижнюю для начала нового
сканирования, прибор фиксирует конкретную целочисленную
массу за 1/500 долю секунды.
18. Масс-фрагментография
Поскольку ионы генерируются непрерывно, это означает, чтодетектора достигнет 0,2 % ионов каждого типа.
Подавляющую часть ионов сканирующий масс-спектрометр просто
не сможет зарегистрировать, поскольку занят определением других
ионов.
Если вместо сканирования настроить прибор на регистрацию ионов
только с определенным значением m/z, все 100 % ионов этого типа
будут достигать детектора.
Это равносильно увеличению чувствительности в 500 раз.
Попеременное пропускание через анализатор ионов с двумя
разными величинами m/z увеличит чувствительность в 250 раз,
пяти ионов – в 100 раз.
В любом случае метод масс-фрагментографии дает по сравнению с
классическим вариантом выигрыш в чувствительности по крайней
мере на два порядка.
19. Масс-фрагментография
Как правило, в одной пробе требуется определитьнесколько соединений.
Однако одновременный мониторинг большого числа
характеристических ионов приводит к закономерному
уменьшению чувствительности.
Поэтому одновременно регистрируются не более 2-4
ионов, причем, поскольку время выхода искомых
соединений уже известно, можно вести мониторинг в
течение узкого интервала времени, а затем
переключаться на регистрацию другого набора из 2-4
ионов, характерных для соединений, выходящих из
колонки позже.
Такой последовательный процесс регистрации
соединений легко программируется и осуществляется в
автоматическом режиме
20. Масс-фрагментография
Выигрыш в чувствительности сопровождаетсязначительным проигрышем в информативности и
надежности метода.
Во-первых, полностью теряется информация о других
компонентах смеси. Конечно, если исследователя
интересует исключительно одно конкретное соединение,
этим можно пренебречь.
Во-вторых, существует определенная вероятность
неправильно измерить концентрацию или вообще неверно
определить присутствие в смеси какого-либо вещества.
Поскольку весь диапазон масс не сканируется, полный
масс-спектр соединения не регистрируется, а именно массспектр является уникальной характеристикой вещества.
В режиме масс-фрагментографии исследователь имеет
время удерживания соединения и интенсивность пиков
характеристических ионов данного соединения.
21. Масс-фрагментография
Однако в реальной смеси близкие времена выходамогут иметь несколько соединений, причем с
меньшей (но не равной нулю) вероятностью эти
соединения могут иметь характеристические пики
с одной и той же величиной m/z. В этом случае
мы получаем искаженный пик искомого иона.
Вариантами масс-фрагментографии являются
анализы с использованием тандемной МС.
Методы связанных сканирований с регистрацией
спектров дочерних ионов, родительских ионов и
выбросов идентичных нейтральных частиц
фактически представляют собой методы
мониторинга заданных ионов.
22. Метод внешнего стандарта
Метод заключается в приготовлении стандартного раствора соединения,которое требуется проанализировать.
Известный объем этого раствора вводится в прибор.
Измеряется интенсивность сигнала, т.е. устанавливается зависимость между
количеством введенного соединения и интенсивностью его сигнала.
Затем, не изменяя никаких условий эксперимента, в прибор вводится такой
же объем анализируемой пробы, и вновь измеряется интенсивность сигнала
анализируемого соединения.
В диапазоне линейности зависимости количества образца – интенсивность
регистрируемого сигнала рассчитать количество анализируемого вещества в
пробе можно, используя простейшую формулу:
М = kS
где М – количество определяемого соединения в объеме, введенном в
прибор,
S – интенсивность сигнала определяемого соединения,
k – фактор отклика, равный отношению количества соединения, введенного
в прибор из стандартного раствора к интенсивности его сигнала (Мст / Sст.).
23. Метод внешнего стандарта
Для ЭУ данная зависимость сохраняет линейность в широком диапазоне (до6 порядков).
В случаях других методик ионизации диапазон линейности уже в связи с
протеканием в источнике ионов побочных процессов.
Поэтому для проведения количественного анализа требуется построение
калибровочного графика. Для этого в прибор вводятся одинаковые объемы
стандартных растворов, содержащих разные известные количества
анализируемого соединения. На основании интенсивностей полученных
сигналов строится график. В идеале, это должна быть прямая, продолжение
которой должно проходить через начало координат.
Метод внешнего стандарта зачастую приводит к значительным ошибкам. Это
связано с невозможностью абсолютного совпадения объемов пробы,
вводимой в прибор, а также с изменениями работы масс-спектрометра в
течение проведения калибровок и анализа.
Небольшие изменения, связанные с величиной напряжения на различных
линзах, с изменением потока газа-носителя или делением потока, с
давлением в источнике ионов делают два последовательных анализа не
абсолютно идентичными. Эти различия возрастают при проведении анализа
большой серии образцов в течение дня.
В связи с этим предпочтительнее является использование метода
внутреннего стандарта.
24. Метод внутреннего стандарта.
В этом случае интенсивности сигналов анализируемых соединенийсравниваются с сигналом стандартного вещества, которое добавляется
непосредственно в образец, вводимый в прибор.
Такой стандарт может использоваться для одновременного определения
многих соединений, присутствующих в анализируемом образце.
Поскольку внутренний стандарт добавляется непосредственно в
анализируемую пробу, все перечисленные выше недостатки метода
внешнего стандарта устраняются.
В качестве внутреннего стандарта может использоваться любое вещество,
важно только, чтобы оно было чистым, не реагировало с растворителем и
другими компонентами смеси и изначально отсутствовало в анализируемом
образце.
Широкое распространение получили соединения с меченными атомами –
дейтерий, 13С, 15N и т.д.
Анализ начинается с последовательного введения в прибор серии
стандартных растворов с точно известным содержанием внутреннего
стандарта и соединений, которые планируется анализировать.
25. Метод внутреннего стандарта.
Количество внутреннего стандарта в этих растворах, как правило, одно и тоже, хотя это и необязательно. Его концентрация должна попадать в середину
диапазона потенциальных концентраций анализируемых соединений в пробе.
Фактор отклика, т.е. зависимость регистрируемого отклика от концентрации,
должен быть постоянным во всем диапазоне концентраций. Величина
фактора отклика может изменяться в широком диапазоне в зависимости от
природы определяемого соединения и внутреннего стандарта. Для получения
достоверных результатов фактор отклика должен быть как можно ближе к
единице.
После завершения работ со стандартными растворами приступают к анализу
образцов. Для этого в образец добавляется точная навеска внутреннего
стандарта. Концентрация внутреннего стандарта должна примерно
соответствовать величине, использованной для определения фактора
отклика.
Расчет количества анализируемого вещества в пробе осуществляется по
формуле:
М = RF S Mis / Sis
М – количество анализируемого соединения в пробе, S – площадь пика
анализируемого соединения, RF – фактор отклика, Mis – количество
введенного внутреннего стандарта, Sis – площадь пика внутреннего
стандарта.
26. Метод внутреннего стандарта.
Существуют разные варианты того, в какой момент лучшедобавлять внутренний стандарт к пробе.
Эту процедуру можно осуществлять в любой момент от отбора
пробы до введения ее в прибор.
Если внутренний стандарт по своей природе очень близок
определяемым соединениям, лучше добавлять его как можно
раньше.
В этом случае на всех стадиях пробоподготовки его потери будут
адекватными потерям анализируемых соединений, и конечный
результат будет точнее соответствовать реальной концентрации
вещества в пробе.
Однако если свойства внутреннего стандарта (например, если он
хуже экстрагируется используемым растворителем), лучше его
добавлять на поздних стадиях пробоподготовки.
27. Метод добавок
Количественный ХМС-анализ можно проводить, используяклассический метод аналитической химии.
Для осуществления метода добавок используют добавление к
пробе известного количества анализируемого вещества.
Вновь, как в случае метода внутреннего стандарта, эту прцедуру
можно осуществлять на любой стадии пробоподготовки.
Однако предпочтительнее является добавление этих веществ
сразу после пробоотбора, поскольку потери вещества во время
хранения пробы и пробоподготовки можно будет оценить по
результатам анализа.
Простейшим вариантом метода является деление пробы на две
части и добавление в одну из них известного количества
анализируемых соединений. Добавляется в 2-5 раз больше (по
массе), чем их ожидаемое количество в пробе.
28. Метод добавок
Поскольку часто нельзя заранее оценить уровни анализируемыхсоединений в реальной пробе, во втором варианте проводят
пробоподготовку, и анализ первой порции.
Затем, грубо оценив концентрации искомых компонентов,
добавляют во вторую порцию нужные соединения в нужных
количествах (в 2-5 раз больше, чем было определено в первой
порции).
После анализа второй порции имеется два набора результатов.
Обозначим концентрацию в пробе за Х. Пусть площадь пика
вещества S. Тогда, для второй порции пробы содержание искомого
компонента будет Х + А, а площадь пика S1. Решая пропорцию,
получим уравнение:
Х = SA / (S1 – S)
























 physics
physics chemistry
chemistry








