Similar presentations:
Типы химических связей
1. Типы химических связей
Санкт-Петербургское государственное бюджетноепрофессиональное образовательное учреждение
«Фельдшерский колледж»
Типы химических
связей
Презентацию составил
преподаватель по химии
Зинатулина Маргарита Римовна
Санкт-Петербург
2017 г.
2. Задачи:
познакомиться с типами химических связей ;научиться определять по молекулярной
формуле соединения тип связей в нём;
научиться составлять механизм образования
химической связи.
3.
• Что такоехимическая связь?
Это взаимодействие
атомов, которое связывает
их в молекулы, ионы,
радикалы, кристаллы.
4. Различают четыре типа химических связей:
1.Ионная связь.2.Ковалентная связь.
3.Металлическая связь.
4.Водородная связь.
Рис.1
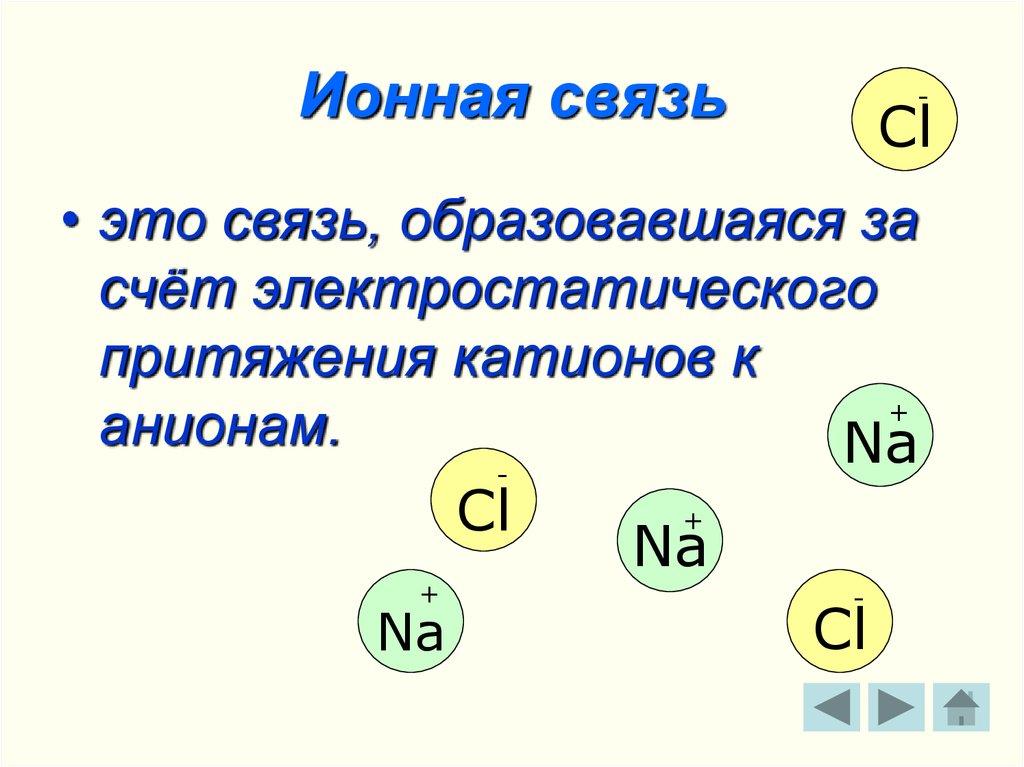
5. Ионная связь
-Cl
• это связь, образовавшаяся за
счёт электростатического
притяжения катионов к
+
анионам.
Na
-
Cl
+
Na
+
Na
-
Cl
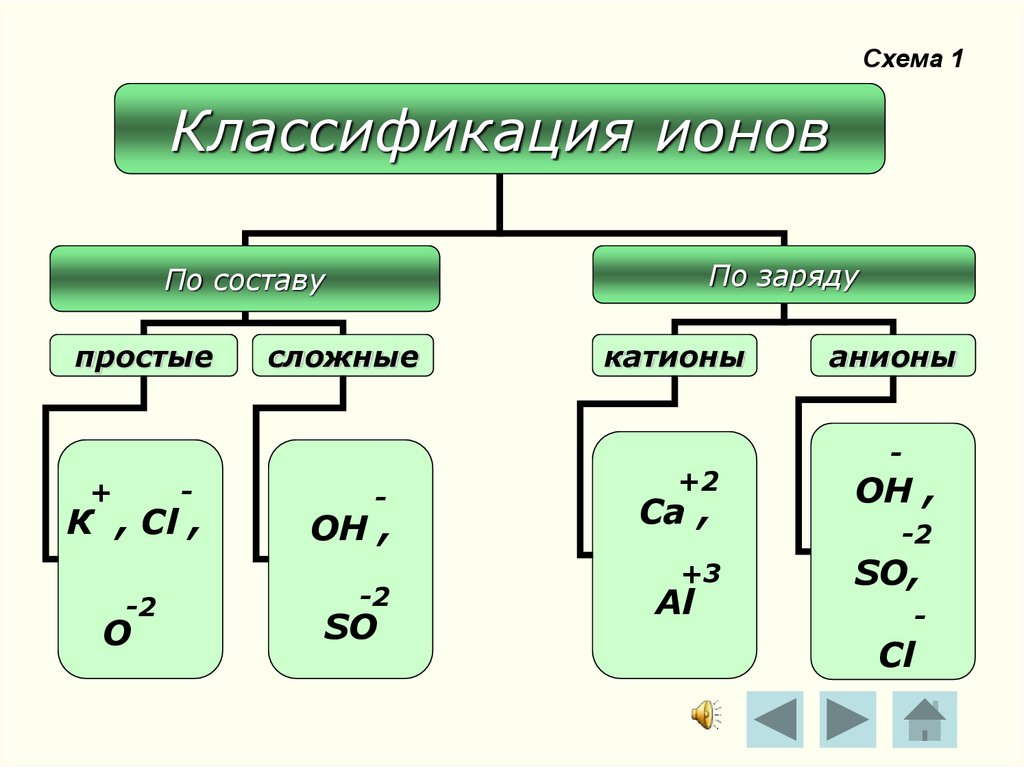
6. Схема 1
Классификация ионовПо заряду
По составу
простые
+
-
К , Сl ,
-2
О
сложные
-
ОН ,
-2
SO
катионы
+2
Ca ,
+3
Al
анионы
-
ОН ,
-2
SO,
-
Cl
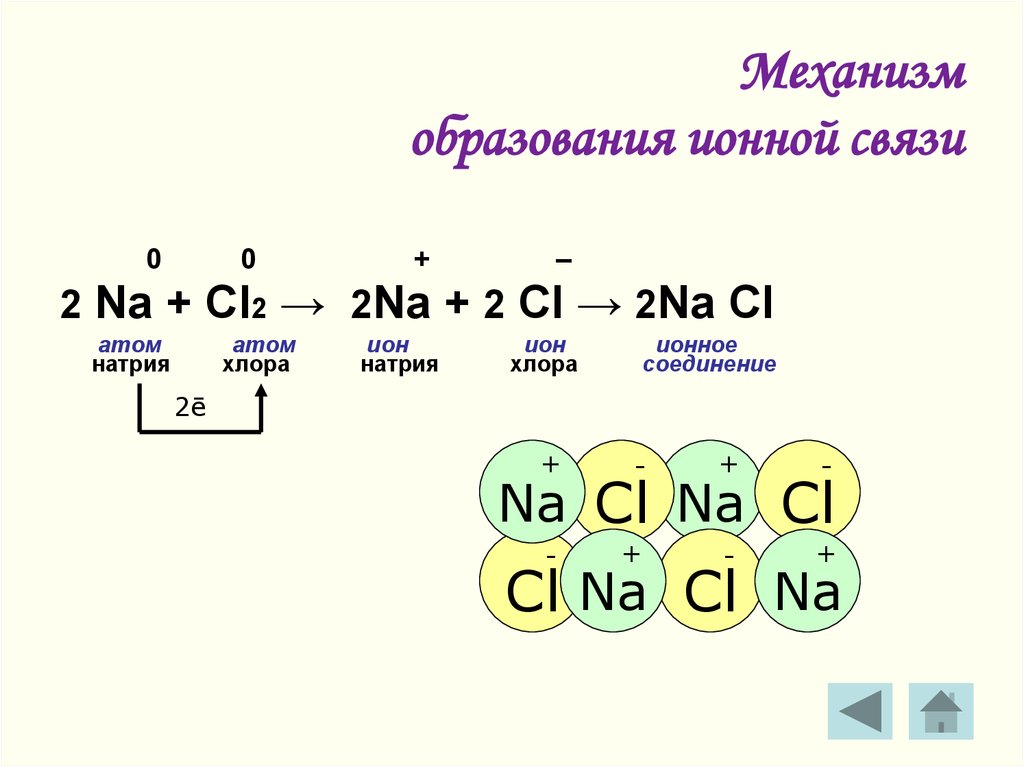
7. Механизм образования ионной связи
00
+
–
2 Na + Cl2 → 2Na + 2 Cl → 2Na Cl
атом
натрия
атом
хлора
ион
натрия
ион
хлора
ионное
соединение
2ē
+
-
+
-
-
+
-
+
Na Cl Na Cl
Cl Na Cl Na
8. Ковалентная связь
• это связь, возникает междуатомами за счёт
образования общих
ē
электронных пар.
ē
ē
ē
ē
ē
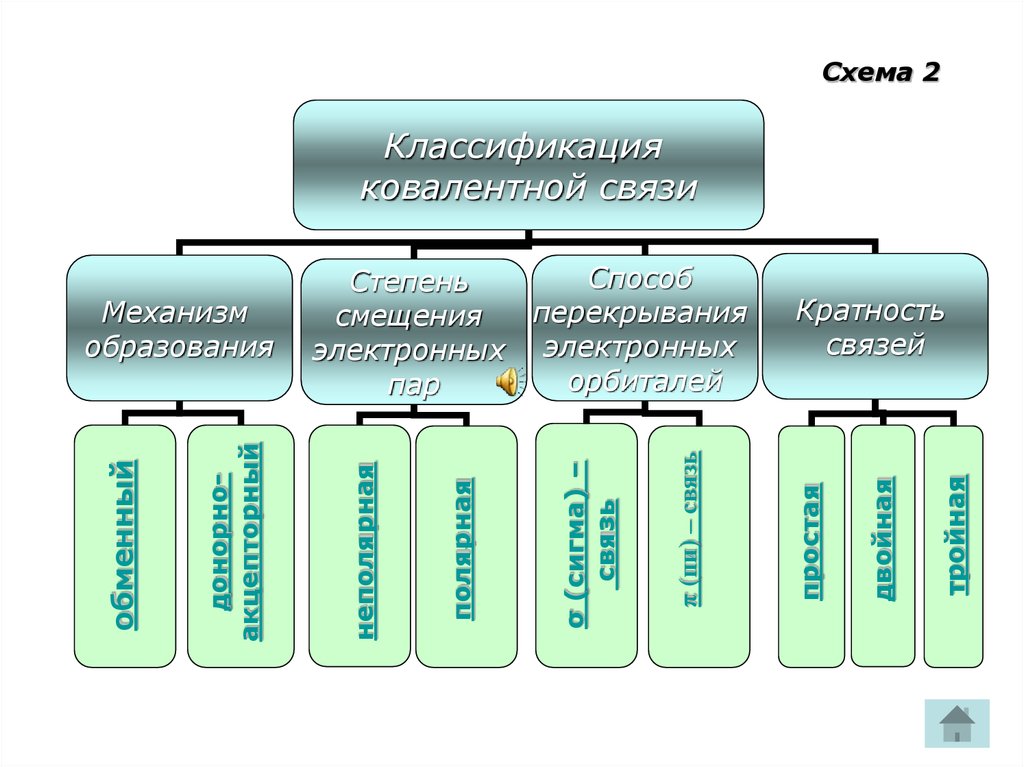
9. Схема 2
СхемаСхема
22
Классификация
ковалентной связи
тройная
двойная
Кратность
связей
простая
π (пи) – связь
р
σ (сигма) –
связь
полярная
неполярная
донорноакцепторный
обменный
Механизм
образования
Способ
Степень
перекрывания
смещения
электронных электронных
орбиталей
пар
10. Обменный механизм образования ковалентной связи
☼ Действует, когда атомы образуют общие электронныепары за счёт объединения неспаренных электронов.
Например:
1. Н2 – водород
Н• + •Н → Н ׃Н или Н - Н ;
2. НCl – хлороводород или соляная кислота
N
•
•
N • +•N →
•
•
••
••
или H – Cl ;
•
3. N2 – азот
•
•
→ Н Cl
•
•
Н• + • Cl
•
•
N
или N
N.
11. Степень смещения электронных пар
☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ элементов.Ряд электроотрицательности:
F, O, N, C l, Br, S, C, P, Si
ІІІ
НЕПОЛЯРНАЯ ковалентная связь – это связь, образованная
между атомами с одинаковой электроотрицательностью.
Например : H – H; Cl – Cl; N N.
ПОЛЯРНАЯ ковалентная связь – это связь, образованная между
атомами с разной электроотрицательностью.
Например: H – Cl; H – S – H.
12. Кратность ковалентной связи
☼Зависит от числа общих электронных пар, связывающихатомы.
ІІ
Бывает:
1. ПРОСТАЯ « - » - это одна σ-связь;
2. ДВОЙНАЯ « » - это одна σ-связь и одна
π-связь;
3. ТРОЙНАЯ « » - это одна σ-связь и две
π- связи.
ІІІ
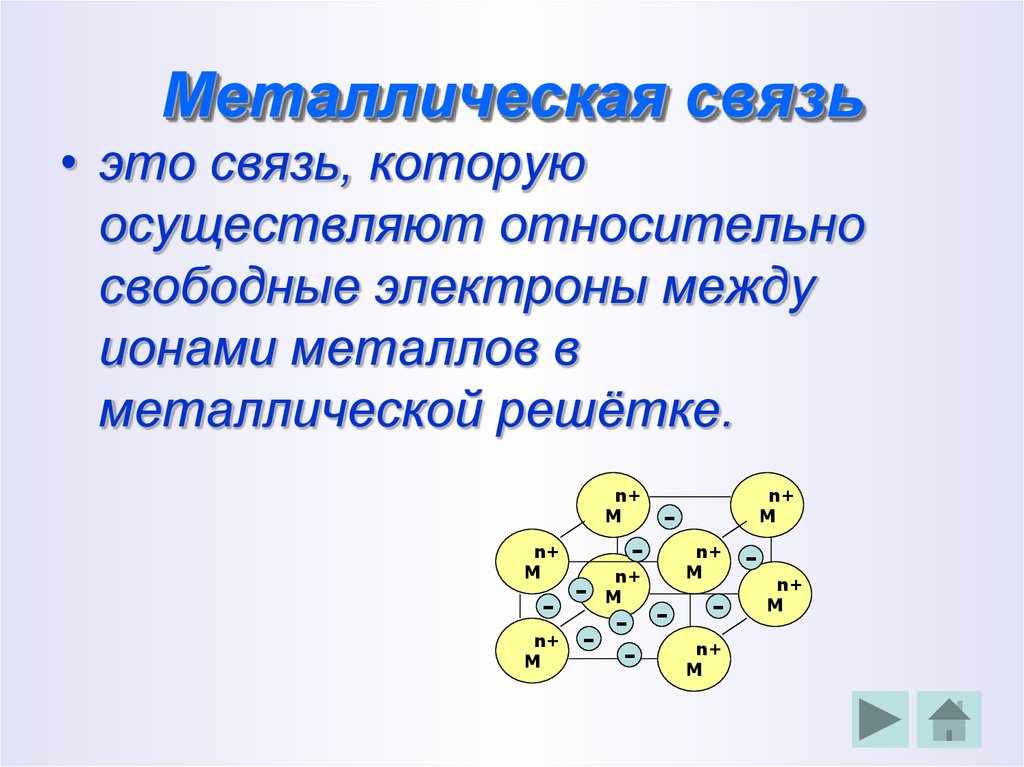
13. Металлическая связь
• это связь, которуюосуществляют относительно
свободные электроны между
ионами металлов в
металлической решётке.
n+
M
n+
M
n+
M
-
-
n+
M
n+
M
- -
n+
M
n+
M
n+
M
14. Механизм образования металлической связи:
0n+
М - nē = М
Например:
• для элементов (металлов) Ι группы главной
0
1+
подгруппы М - 1ē = М ;
• для элементов (металлов) Ι Ι группы главной
0
2+
подгруппы М - 2ē = М .
15. Водородная связь
Межмолекулярная водородная связь – этосвязь между атомами водорода одной
молекулы и сильноотрицательными
элементами(O, N, F) другой молекулы.
Н
Н----О
|
|
|
Н----О
Н
|
О
|
|
Н
|
|
Н О---- Н
Н
16. Водородная связь
Внутримолекулярная водородная связь –эта связь возможна при наличии в одной
молекуле и электроноакцепторной
группы и электронодонорного атома.
Например в молекуле
ДНК: І І
А-Т
Г-Ц
Г-Ц
Т-А
І І
Рис.4
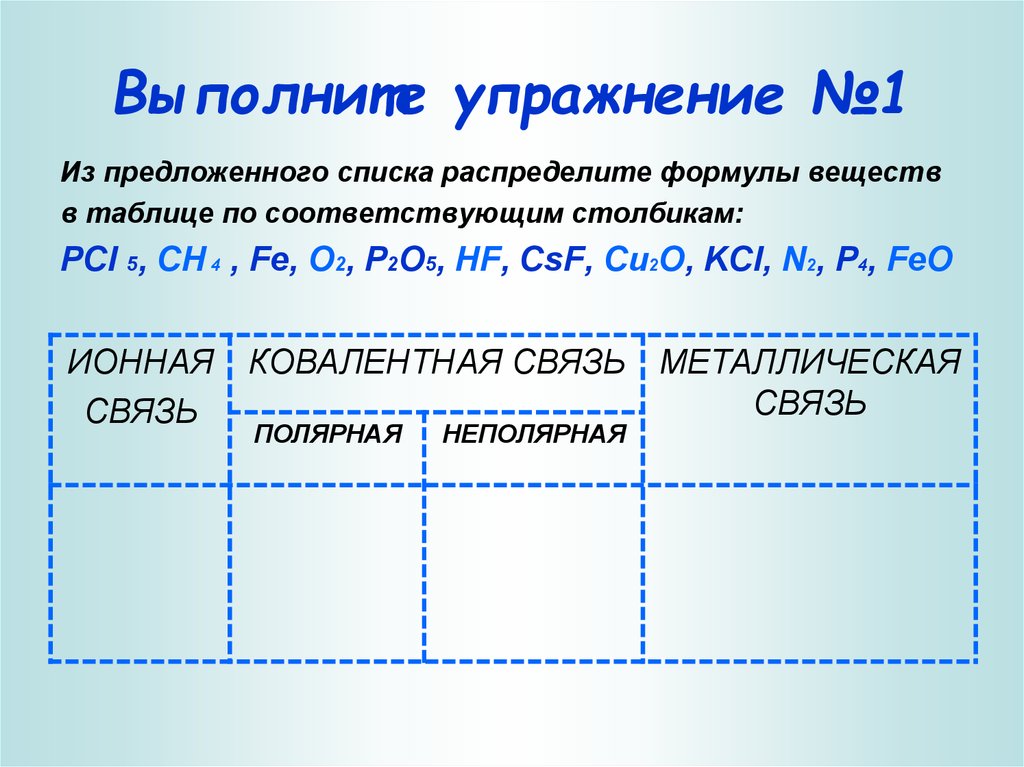
17. Выполните упражнение №1
Из предложенного списка распределите формулы веществв таблице по соответствующим столбикам:
PCl 5, CH 4 , Fe, O2, P2O5, HF, CsF, Cu2O, KCl, N2, P4, FeO
ИОННАЯ
СВЯЗЬ
КОВАЛЕНТНАЯ СВЯЗЬ МЕТАЛЛИЧЕСКАЯ
СВЯЗЬ
ПОЛЯРНАЯ
НЕПОЛЯРНАЯ
18. Выполните упражнение №2
Как меняется полярность связив ряду:
HCl – H2Se – AsH3
19. Выполните упражнение №3
Покажите образование ионнойсвязи в соединениях:
Cu2O, KCl.
20. Выполните упражнение №4
Покажите образованиековалентных связей и укажите
их тип в соединениях:
PCl 5, CH 4 ,O2, P2O5, N2.
21. Источники:
1.Литература: Учебник для общеобразовательных
учреждений Химия. 11 класс Габриелян О.С,
Лысова Г. Г. М.: 2-е изд. Дрофа, 2002
2.
Рисунки:
Рис.1 «Атом» - http://office.microsoft.com/ruru/clipart/results.aspx?qu=%D0%B0%D1%82%D0%B
E%D0%BC%D1%8B&sc=20
Рис.2,3«σ- и π- связи» http://www.chemistry.ssu.samara.ru/chem1/index1.ht
m
Рис.4«ДНК» - http://office.microsoft.com/ruru/clipart/results.aspx?qu=%D0%94%D0%9D%D0%9
A&sc=20&AxInstalled=copy&DownloadAssetId=MCj0
1494830000&DownloadExtension=wmf&c=0















 chemistry
chemistry








