Similar presentations:
Бензофураны и бензотиофены. Общие методы синтеза
1.
Бензофураны и бензотиофеныОбщие методы синтеза
Me
+
X
Na+
Cl
O
Me
O
Me
ZnCl2
X
X
X = O, S
MeO
OMe
ПФК
S
S
2.
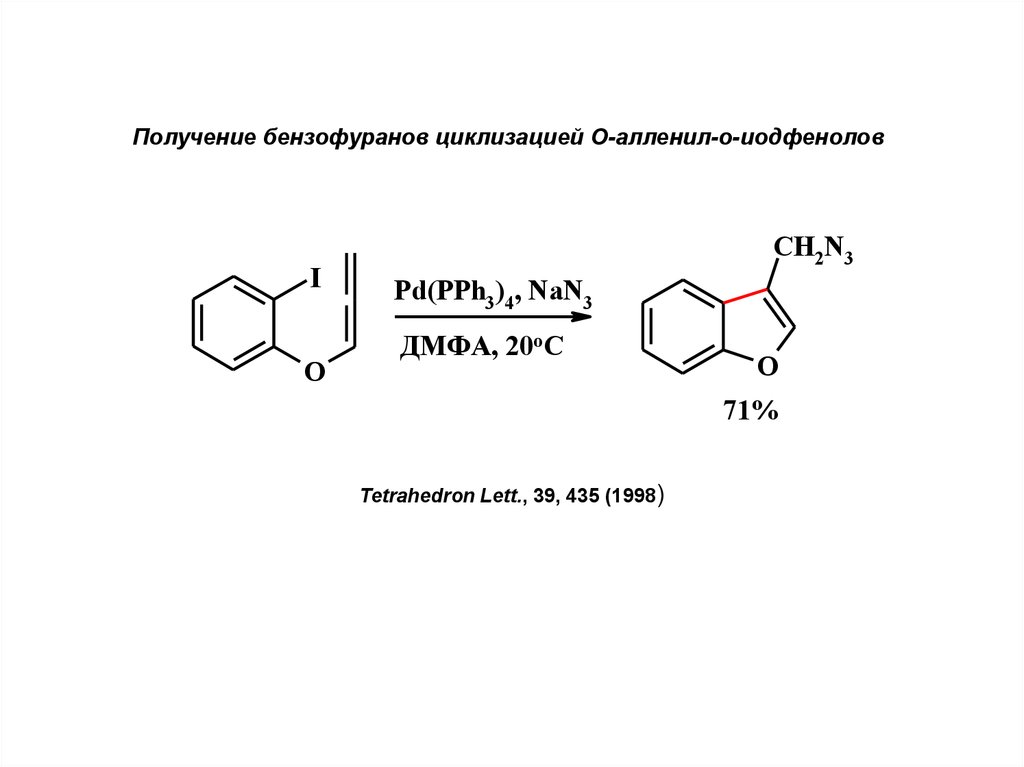
Получение бензофуранов циклизацией О-алленил-о-иодфеноловI
O
CH2N3
Pd(PPh3 )4, NaN3
ДМФА, 20оС
O
71%
Tetrahedron Lett., 39, 435 (1998)
3.
Образование связи С(2)-С(3)CHO
+
Cl
OH
Me
CHO
KOH
O
Me
Me
O
O
O
CHO
+
S- Na+
Cl
Me
Me
O
S
O
O
4.
Специфические методы синтезаBr
Br
Br
Br2
O
O
O
Br
OHO
O
O
O
Br
COO-
COO- – HBr
O
H+
CO2 H
O
H
O
CaO
O
H2S
FeS, Al2 O3
S
5.
Химические свойства бензофурановMe2NCHO, POCl3
O
CHO
O
Реакция Вильсмайера
Hal2
Hal
Hal
Hal
Hal
E+
BuLi
Li
O
Hal
O
O
O
O
+
E
O
Li
BuLi
O
O
OLi
6.
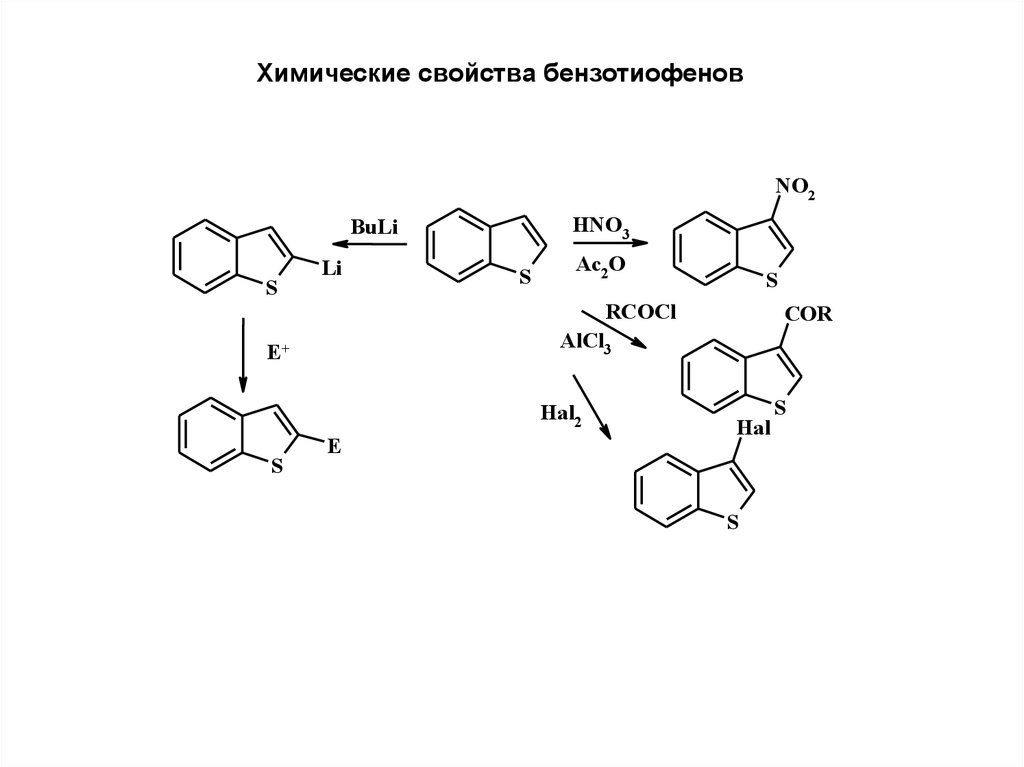
Химические свойства бензотиофеновNO2
HNO3
BuLi
S
Li
S
Ac2 O
RCOCl
COR
AlCl3
E+
Hal2
S
S
E
Hal
S
S
7.
ClCl
Cl
Cl
S
S
O
PhCN+O-
Ph
N
N
+
Ph
S
MeO2 C
- N2
N
N
CO2Me
N
N
N
N
CO2Me
S
CO2Me
O
S
8.
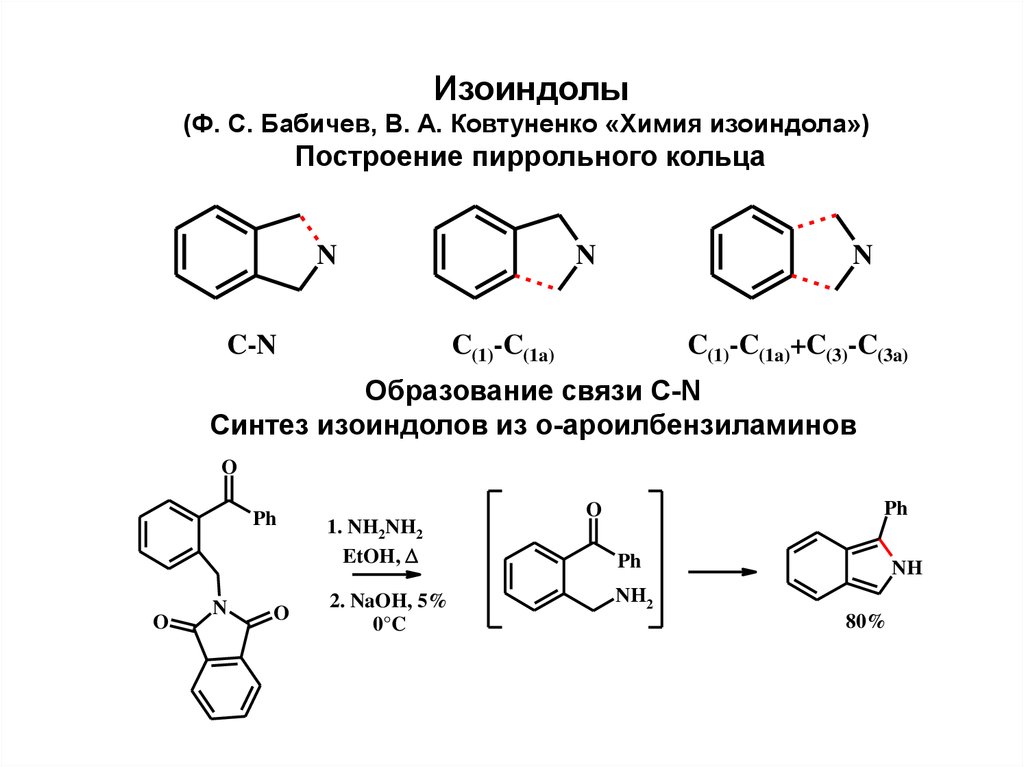
Изоиндолы(Ф. С. Бабичев, В. А. Ковтуненко «Химия изоиндола»)
Построение пиррольного кольца
N
C-N
N
N
C(1)-C(1a)
C(1)-C(1a)+C(3)-C(3a)
Образование связи С-N
Синтез изоиндолов из о-ароилбензиламинов
O
Ph
O
N
O
1. NH2NH2
EtOH,
2. NaOH, 5%
0°C
Ph
O
Ph
NH
NH2
80%
9.
Синтез из о-хлорметилбензонитрилаCH2 Cl
RNH2
CN
CH2NHR
N R
CN
N R
NH2
NH
Восстановительная конденсация о-фталодинитрила
N
CN
-
CN
LiAlH4
N
N
CN
B
A
NH2
CN
H2
CH2N3
NH
NH
Ni-Ra
56% NH2
10.
Образование связей С(1)-С(1а) и С(3)-С(3а)Внутримолекулярная ариновая циклизация замещенных
о-галогенбензиламинов
Cl
NCHR
NCH2R KNH
2
Me
N Me
Me
R
R = CN, CO2Et, COPh
Образование связей С(1)-С(1а) + С(3)-С(3а)
NR
- CH CH
+
NR
200°C
N
R
H2
Pd/C
10%
~ 50%
NR
- CH2=CH2
11.
Изомеризация [1,4]бензодиазепиноновR
R
O
N
R
O
N
Na
N
MeI
H
Me
N
N
Ar
Ar
Ar
a
b
R
R
N
O-
O
N
H
B
N -
CONHR
N
- N Na+
Ar
~ 80%
Ar
O
N
Ar
A
12.
Построение бензольного кольцаКонденсация 1,4-дикетонов с пирролами или аминами
R
2
R
O
+
1
R
2
R
1
NR
NR
O
R
R
2
1
R
R
O
2
O
R
R
+
R1NH2
2
R
1
R
N R1
R
R
13.
Химические свойства изоиндоловCOMe
N
Ph
CHO
Ac2 O
N
Ph
Me2NCHO
N
Ph
POCl3
Формилирование по Вильсмайеру
PhN2+ ClN=NPh
N
Азосочетание
Ph
14.
Индолизины8
1
7
6
5
2
N
4
3
N
N
N
C(1)-C(2)
C(2)-C(3)
C(3)-N
N
C(1)-C(1a)
N
C(1)-C(1a) + C(2)-C(3)
15.
Образование связи С(1)-С(2)Реакция Чичибабина – получение индолизинов
внутримолекулярной
циклизацией солей N- -оксоалкилпиридиния
R
Hal
CH2R
R2CHCOR1
+
N
N
Hal–
+
N
CH2R
O
R
2
R
CH2R
O
R
R
2
+
N
R
2
R
1
R
2
R
1
R
R
O
1
2
CHR
O
R
2
R
1
N
1
R
1
R
N
H2 O
CHR
O
B-
N
+
NaHCO3
+ H+
- H2 O
R
R
N
+
1
- H+
R
N
R
2
R
2
1
16.
Циклизация солей 1-( -оксоалкил)-2-ацилпиридинияR
R
COR
+
N
N
NH2NH2
N
+
CH2 COR1
Br
Br
N
R
N
1
R
N
R
·
R
1
N
R
·
- N2
N
– HBr
N
Liebigs Ann., 679, 136 (1964)
R
1
1
17.
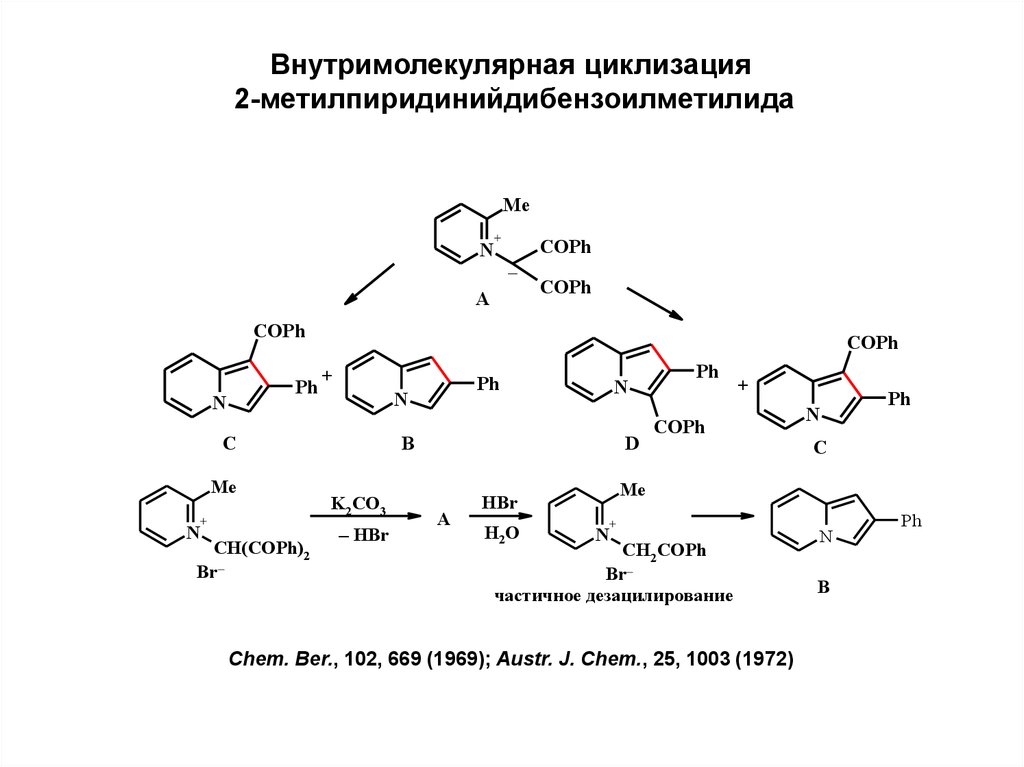
Внутримолекулярная циклизация2-метилпиридинийдибензоилметилида
Me
N
+
COPh
–
A
COPh
COPh
Ph
N
COPh
+
N
C
Me
N
+
CH(COPh)2
Br–
Ph
N
B
K2 CO3
– HBr
D
A
+
COPh
N
Ph
C
Me
HBr
H2O
Ph
N
+
CH2 COPh
Br–
частичное дезацилирование
Chem. Ber., 102, 669 (1969); Austr. J. Chem., 25, 1003 (1972)
N
B
Ph
18.
Me+
N
COPh
_
COPh
A
Me
N
+
O
COPh
Ph
CH2 COPh
O
+
внутримолекуля
рная
я
N
перегруппировка
Ph
E
COPh
N
D
Ph
N
COPh
C
Ph
19.
Метод Штольца – синтез индолизинов из -пиколинаи ангидридов кислот
(сопровождается образованием связи С(3)-N)
CH(COMe)2
Ac2 O
N
N
Me
NH
H2 C
COMe
N
N
OH
COMe
Ac2 O
- H2O
COMe
COMe
+
H
N
N
COMe
Ber., 45, 734, 1718 (1912)
OH
20.
Образование связи С(2)-С(3)Синтез из солей 1-бензил-2-алкилпиридиния при
последовательной
обработке ангидридами кислот и основаниями
COPh
Me
N
+
CH2 Ar
Ph
1. (PhCO)2O
N
2. Et3N
Br–
O
Ph
(PhCO)2O
140°C
N
Ar
(PhCO)2O
Ar
(PhCO)2O
100°C
Ar
140°C
COPh
Ph
N
O
Ph
N
Ar
21.
Конкурентное образование связей С(1)-С(2) или C(2)-C(3) приобработке солей N- -оксоалкил-2-алкилпиридиния
ангидридами кислот в присутствии основания
COPh
Me
N
1. (PhCO)2O
+
CH2 COPh
2. Et3N
Ph
N
Br-
+
Ph
N
D COPh
C
1:2
N
Ph
COPh
COPh
N
–
+
D
COPh
G COPh
COPh
N
H
COPh
N
C
Ph
22.
Образование связи С(3)-NЦиклизация 2-( -оксоалкил)пиридинов
CO2 Et
Br
O
CO2 Et
Me
N
N
O
Me
Ac2O
CO2 Et
N
Me
R
N
O
R
1
R
N
+
O
R
1
+ H+
– H2 O
R
+
N
R
1
– H+
R
N
R
1
23.
Циклизация 2-циннамоилпиридиновCOCH2R
N CHC6 H4 X-p
p-XC6H4CHO
AcONH4
N
N
C6 H4 X-p
O
O
Me
O
p-XC6H4CHO
N
N
C6 H4 X-p
+N
H
C6 H4 X-p
N=CHC6 H4 X-p
OH
NH3, p-XC6H4CHO
N
- 2H2O
C6 H4 X-p
N
C6 H4 X-p
24.
Рециклизаця 4Н-хиназолиновCO2Me
MeCO2 CC CCO2Me
CO2Me
N
N
CO2Me
CO2Me
H
CO2Me
PhOH
N
или HCO2H
CH2 CO2Me
Br2 или HNO3, HClO4
CO2Me
N
CO2Me
CO2Me
CO2Me
CO2Me
CO2Me
N
CO2Me
CO2Me
CO2Me
+N
MeCO2 CH2
CO2Me
CO2Me
25.
Образование связи С(1)-С(1а)Циклизация солей пиридиния, образующихся при использовании в
качестве кватернизующего агента 4-бром-1,3-дифенил2-бутен-1-она (внутримолекулярная циклизация илидов)
BrCH2 C CHCOPh
COPh
Ph Ph
+N
N
COPh
+N
-
Ph
H
N
Ph
K2 CO3
EtOH, 20°C
H
COPh
COPh
Ph
– 2H
N
Ph
26.
Образование связей С(1)-С(1а) + С(2)-С(3)1,3-диполярное циклоприсоединение ацетиленов
к фенацилпиридиний илиду
+
N – COPh
+
N – COPh
CN
+
+
N – COPh
H
CN
N
R
H
R = H, Cl
CN
R
COPh
– 2H
N
R
COPh
5-25%
27.
MeCO2Me
+
N – CN
CN
Me
+
R
N
R
CO2Me
CO2Me
+
Me
CN
R
N
CN
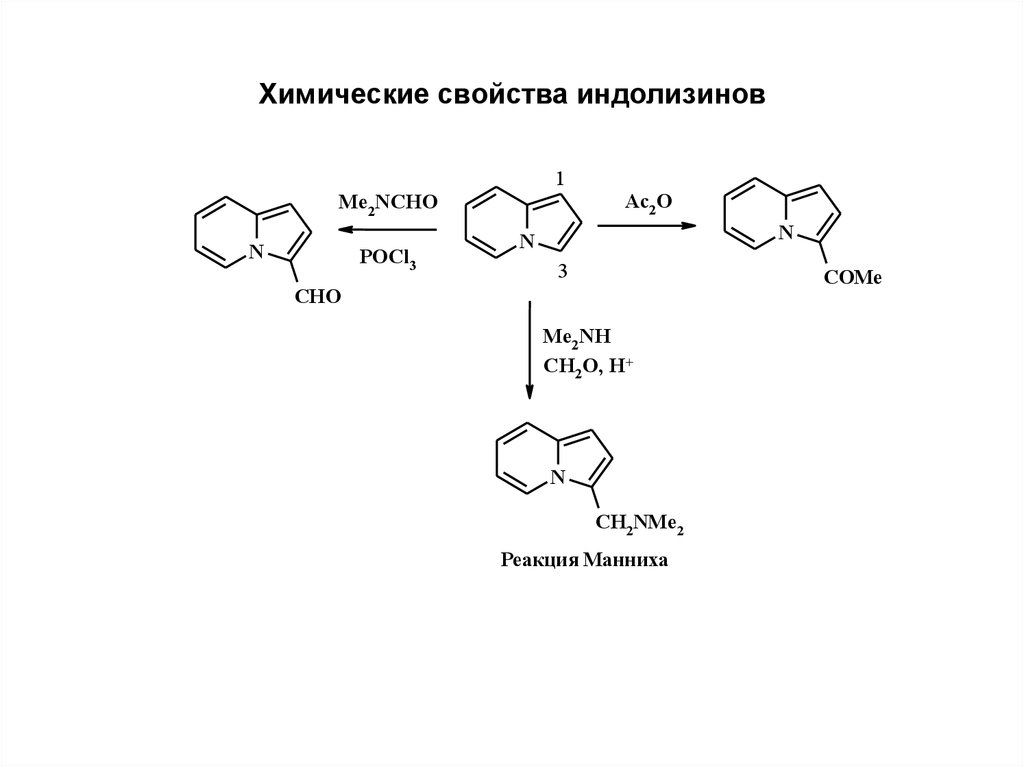
28. Химические свойства индолизинов
1Me2NCHO
N
POCl3
Ac2 O
N
N
3
COMe
CHO
Me2NH
CH2O, H+
N
CH2NMe2
Реакция Манниха
29.
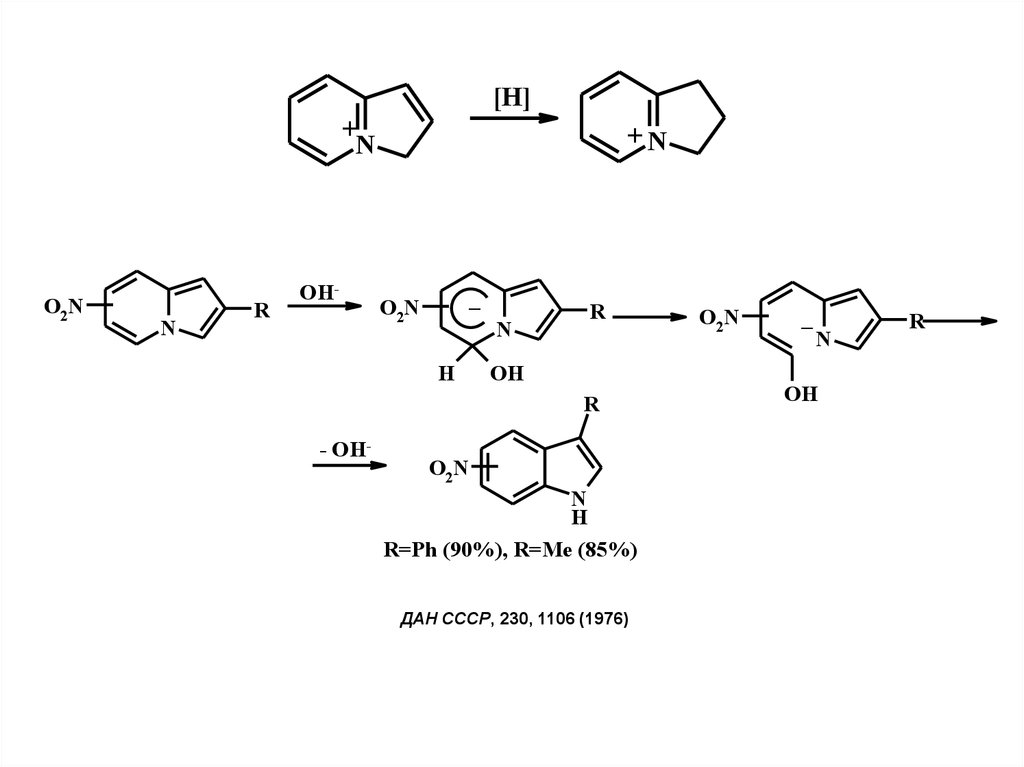
[H]+
N
O2N
N
R
OH-
+N
–
O2N
H
N
R
OH
R
- OH-
O2N
N
H
R=Ph (90%), R=Me (85%)
ДАН СССР, 230, 1106 (1976)
O2N
–
N
OH
R























 chemistry
chemistry