Similar presentations:
07b15888bdd34f70bb05b96049ee37a0 (1)
1.
В 1648 году И. Глаубер получил это веществонагреванием селитры с серной кислотой, а в 1763 году М.
В. Ломоносов исследовал и описал этот метод его
получения.
Технология получения этого вещества существенно не
менялась до конца XVIII столетия, когда был впервые
осуществлен крупномасштабный промышленный способ
производства его разложением нитрата натрия
концентрированной серной кислотой при 150–170C в
чугунных ретортах, обогреваемых топочными газами.
В последующем применение вакуума позволило
снизить температуру процесса до 80–100C. Метод получил
широкое распространение. Например, в России в
подобных установках было получено в 1910 г. 8100 тонн, а
в 1914 г. 18 000 тонн вещества.
В современном производстве это вещество
получают из аммиака.
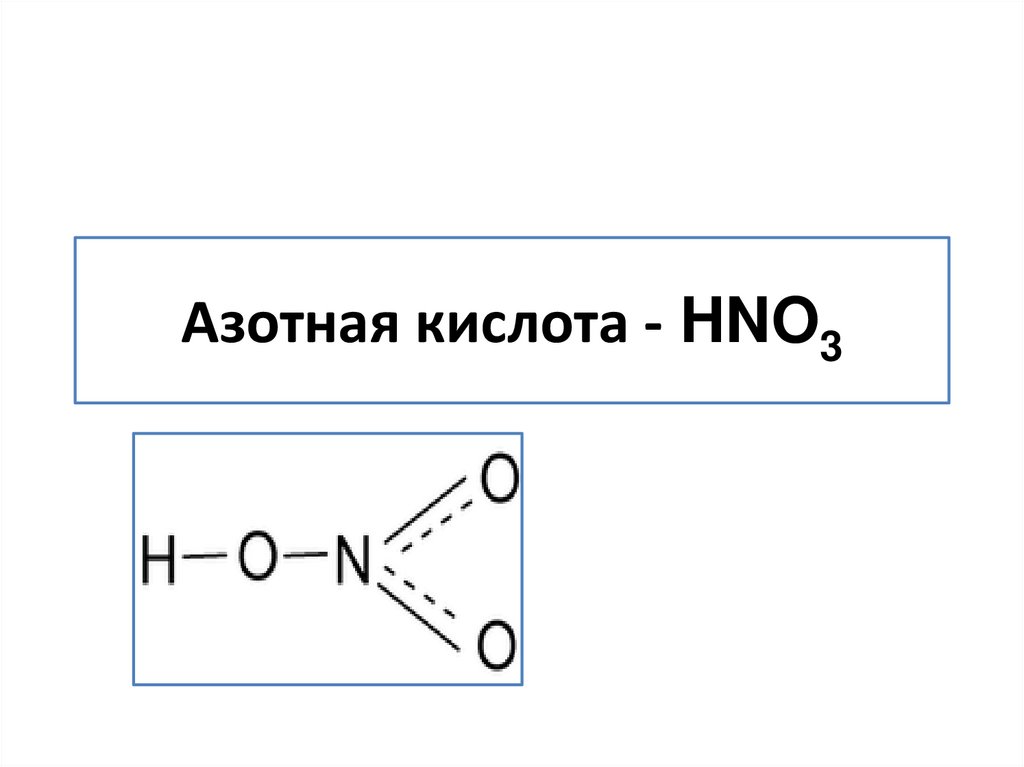
2. Азотная кислота - HNO3
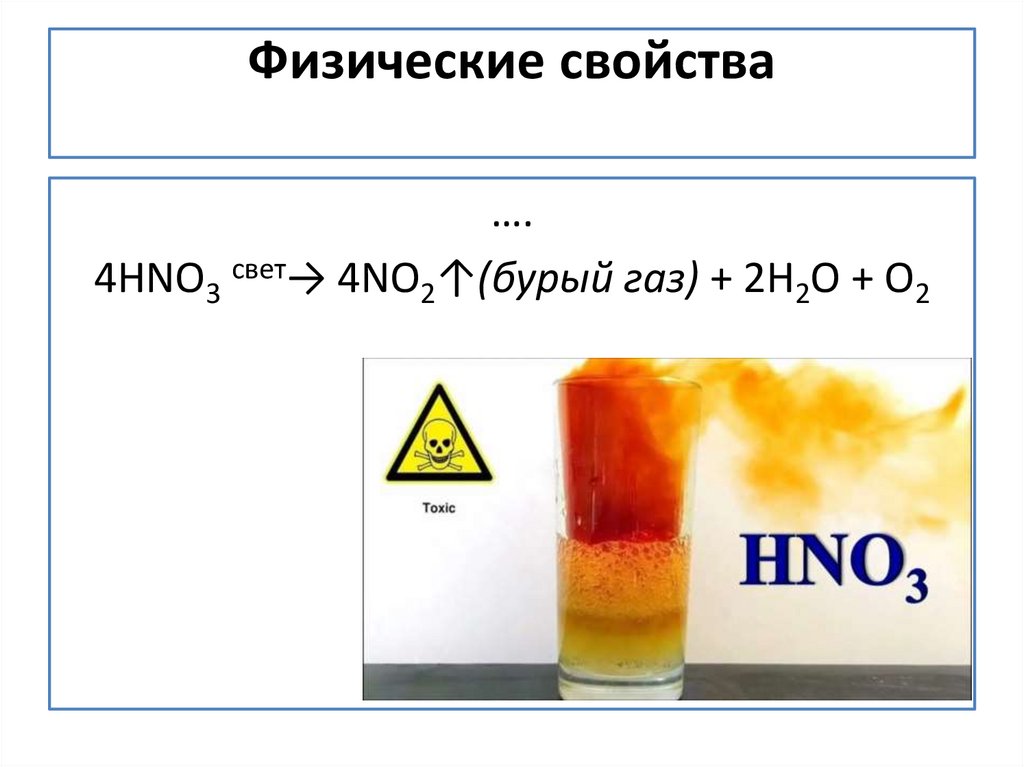
3. Физические свойства
….4НNО3 свет→ 4NО2↑(бурый газ) + 2Н2О + О2
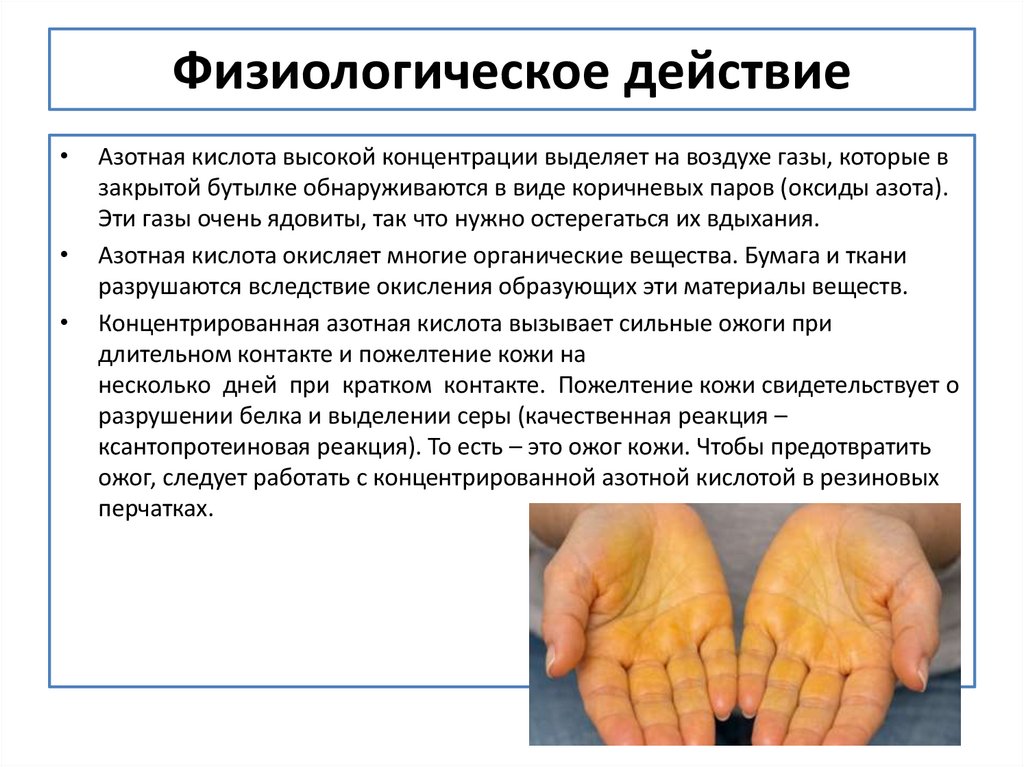
4. Физиологическое действие
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в
закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота).
Эти газы очень ядовиты, так что нужно остерегаться их вдыхания.
Азотная кислота окисляет многие органические вещества. Бумага и ткани
разрушаются вследствие окисления образующих эти материалы веществ.
Концентрированная азотная кислота вызывает сильные ожоги при
длительном контакте и пожелтение кожи на
несколько дней при кратком контакте. Пожелтение кожи свидетельствует о
разрушении белка и выделении серы (качественная реакция –
ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить
ожог, следует работать с концентрированной азотной кислотой в резиновых
перчатках.
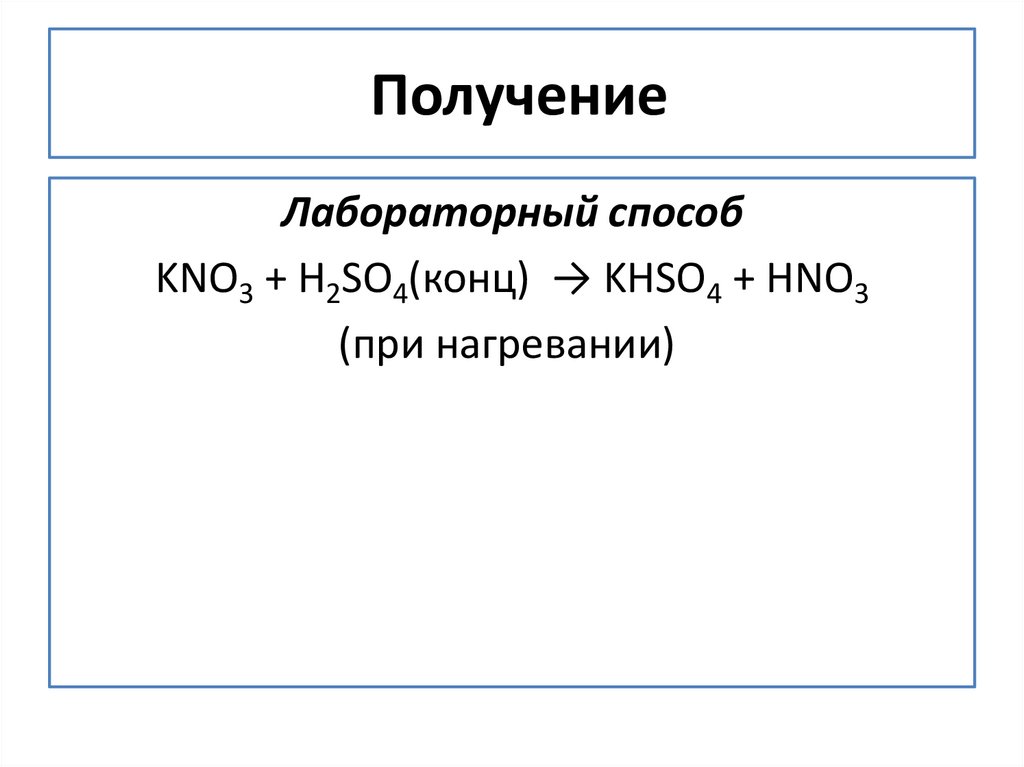
5. Получение
ПолучениеЛабораторный способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3
(при нагревании)
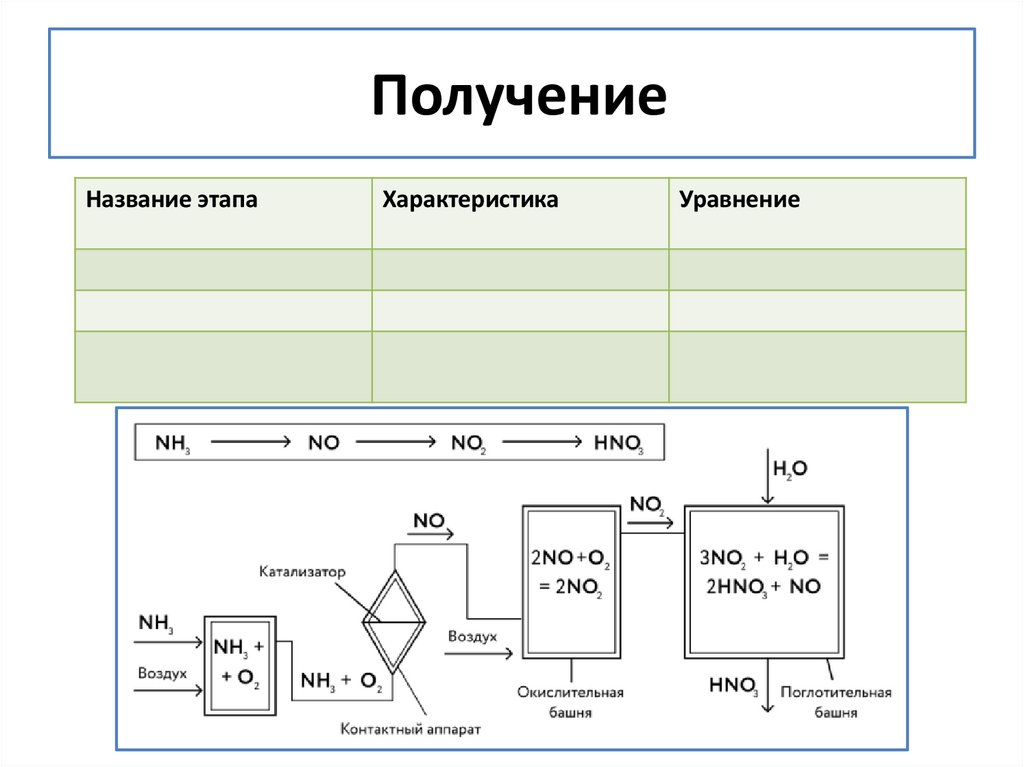
6. Получение
ПолучениеНазвание этапа
Характеристика
Уравнение
7. Применение
• в производстве минеральных удобрений;• в военной промышленности;
• в фотографии — подкисление некоторых
тонирующих растворов;
• в станковой графике — для травления
печатных ;
• в производстве взрывчатых и отравляющих
веществ.
8. Химические свойства
1. Общие с другими кислотами1) Очень сильная кислота.
Индикаторы в её растворе изменяют цвет.
МетиловооранжевыйЛакмусДиссоциирует в водном растворе: HNO3 →
2) Реагирует с основными оксидами
K2O + HNO3 →
3) Реагирует с основаниями
HNO3 + KOH →
4) Реагирует с солями, вытесняет слабые кислоты из их солей
HNO3 + Na2SO3 →
9. Химические свойства
2. Специфические свойстваСильный окислитель
N+5 → N+4→ N+2→ N+1→ No → N-3
1) Разлагается на свету и при нагревании
4HNO3 t˚C→ 2H2O + 4NO2 + O2
2) Окрашивает белки в оранжево-желтый цвет
(при попадании на кожу рук - "ксантопротеиновая
реакция")
10. Химические свойства
3) Реагирует с металлами.• HNO3 (р.)+Me (до H2)→нитрат+H2O+NH3 (NH4NO3)
Zn + HNO3(р.) →
• HNO3 (р.)+Me (после H2)→нитрат+H2O+NO
HNO3 (р.) + Cu →
• HNO3 (к.)+Me (до H2)→нитрат+H2O+N2O (N2)
Zn + HNO3(к.) →
• HNO3 (к.)+Me (после H2)→нитрат+H2O+NO2
HNO3 (к.) + Cu →
• С «Al, Cr, Fe»- при комнатной температуре не реагирует.
• На Au, Pt не действует.
11. Химические свойства
4) Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяетблагородные металлы.
5) Реагирует с неметаллами.
• HNO3 (конц.) + неметалл = окисление неметалла до
кислоты в высшей степени окисления + NO2 + вода
S + HNO3(конц) →
• HNO3 (разбав.) + неметалл + вода = окисление неметалла
до кислоты в высшей степени окисления + NO
P + HNO3 + H2O →






 chemistry
chemistry








