Similar presentations:
f7a7359a96004af3b8080a65a140dbbd
1.
Классификация неорганическихсоединений и их свойства.
Соли в свете теории ЭД
Айрапетян Л.Р.
2020 г
2.
Соли в свете теории ЭДСоли — это электролиты, которые
диссоциируют на катионы металла (или
аммония) и анионы кислотного остатка.
3.
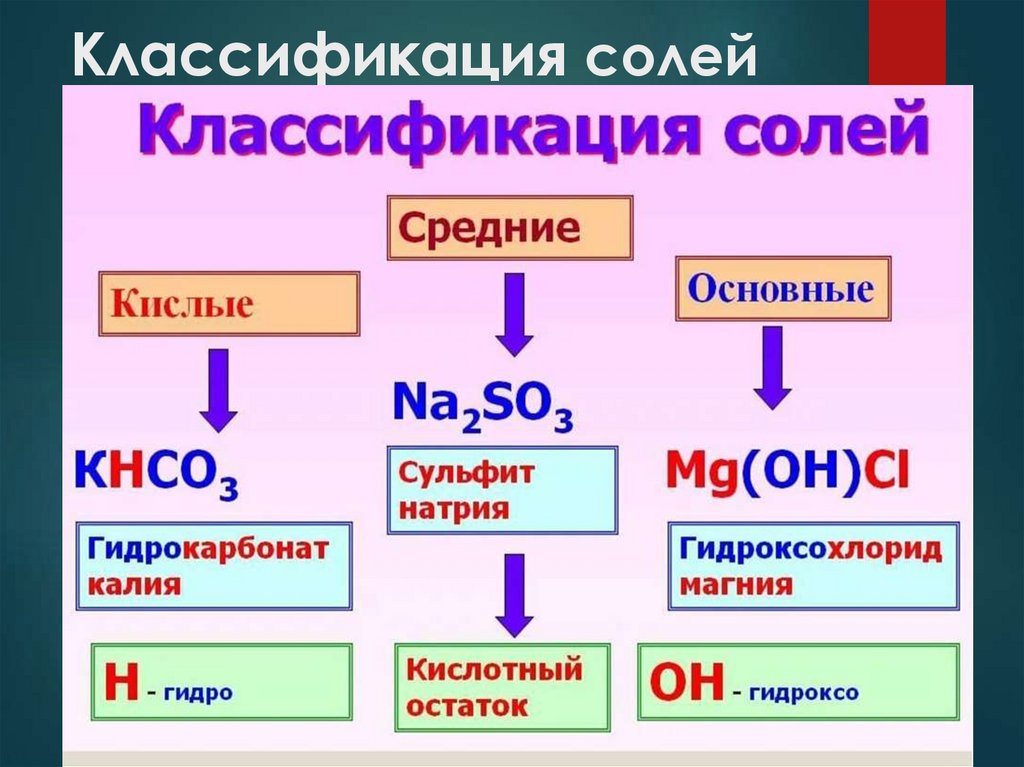
Классификация солейГруппа солей
Характеристика
Примеры
полного NaCl, СaСO3, K2SiO3,
Средние (или Продукты
замещения
атомов
нормальные) водорода в молекуле Ва(NO3)2 , NH4Cl
кислоты
металла
аммония
на
или
атомы
ионы
Кислые
Продукты
неполного NaHСO3, Cа(H2РO4)2
замещения
атомов
водорода в молекуле
кислоты
на
атомы
металла
Основные
Продукты
неполного (CuOH)2СO3, ZnOHCl
замещения
гидроксогрупп
в
молекуле основания на
кислотный остаток
4.
Классификация солей5.
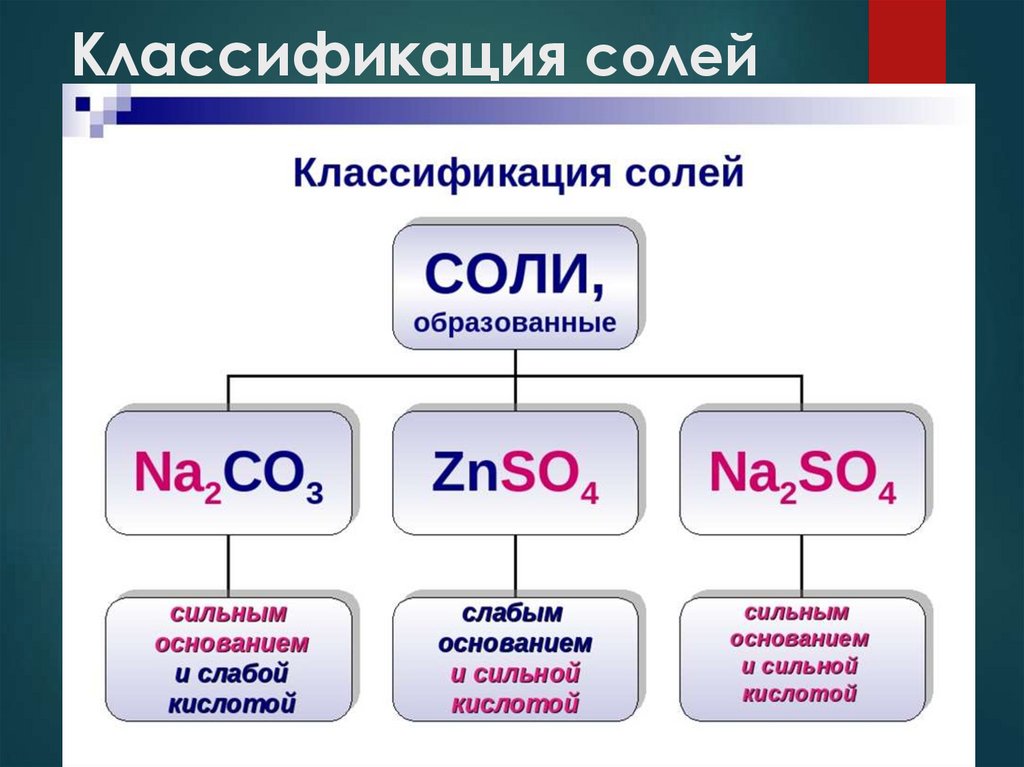
Классификация солей6.
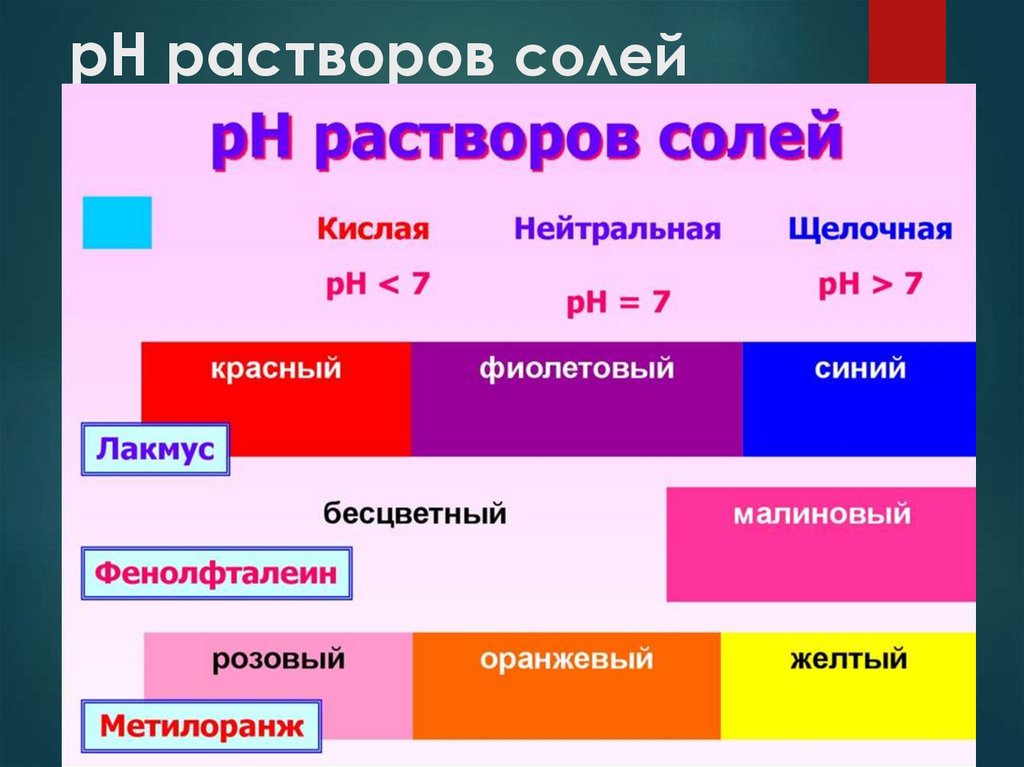
рН растворов солей7.
Химические свойства солей1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием
новой соли и новой кислоты. Для осуществления
этой реакции необходимо, чтобы кислота была
более сильная чем соль, на которую воздействует
кислота:
2NaCl + H2 SO4 = Na2SO4 + 2HCl↑.
8.
Химические свойства солей3. Взаимодействуют с основаниями, образуя новую
соль и новое основание:
Ba(OH)2 + MgSO4 = BaSO4↓ + Mg(OH)2.
4. Взаимодействуют с металлами, которые стоят в
ряду активности до металла, который входит в состав
соли:
Fe + CuSO4 = FeSO4 + Cu↓.
5. Взаимодействуют друг с другом с образованием
новых солей:
NaCl + AgNO3 = AgCl↓ + NaNO3 .
9.
Способы получения солей1. Соли образуются при растворении металлов в
кислотах.
Zn + 2HCl = ZnCl2 + H2
2. Взаимодействие кислот с основными и
амфотерными оксидами.
H2 SO4
+ CuO = CuSO4 + H2O
ZnO + 2НNO3 = Zn (NO3)2 + H2O
3. Взаимодействие кислот с основаниями и
амфотерными гидроксидами.
HCl + NaOH = NaCl + H2O
3 НNO3 + Al(OH)3 = Al(NO3)3
+ 3H2O
10.
Способы получения солей4. Соли образуются при взаимодействии кислот с
солями. Нерастворимые соли взаимодействуют
только с более сильными кислотами (более сильная
кислота вытесняет менее сильную кислоту из соли).
Растворимые соли взаимодействуют с
растворимыми кислотами, если в продуктах реакции
есть осадок, газ или вода, или слабый электролит.
BaCl2 + H2SO4 = BaSO4 + 2HCl
5. Взаимодействие оснований с кислотными
оксидами.
Ca(OH)2 + CO2 = CaCO3↓ + H2O
6. Взаимодействие щелочей с солями
NaOH + CuSO4 = Na2SO4 + Cu(OH)2
11.
Способы получения солей7. Взаимодействие солей с металлами.
CuSO4 + Fe = FeSO4 + Cu
8. Взаимодействие солей с другими солями.
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
9. Взаимодействие основных оксидов с кислотными.
MgO + SO3 = MgSO4↓
10. Взаимодействие металлов с неметаллами. Таким
способом можно получить только соли
бескислородных кислот.
Fe + S → FeS
12.
Домашнее заданиеРаздел 5.3.
Упр.1- 4 стр. 86.










 chemistry
chemistry








