Similar presentations:
Мф ГЛС
1. Тема: Микрофлора готовых лекарственных средств.
Лекция №3 для студентов II курса, обучающихсяпо специальности 33.05.01 – Фармация
К.б.н., доцент Перьянова О.В.
Д.м.н., доцент Хохлова О.Е.
Красноярск, 2021 г.
2. План лекции:
Актуальность проблемы.Источники и пути микробного
загрязнения ГЛС.
Предотвращение контаминации ГЛС.
Возможные контаминанты ГЛС.
Оценка микробной чистоты ГЛС.
Пути повышения микробной чистоты
ГЛС.
Заключение.
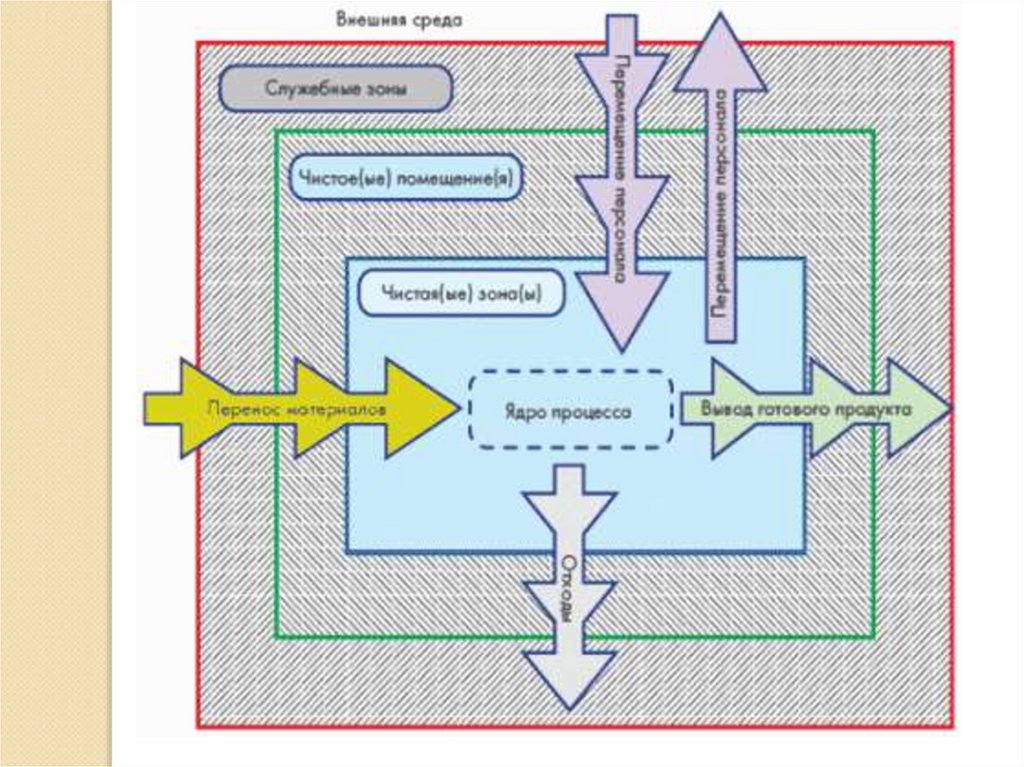
3. Цель лекции:
Ознакомиться с возможнымиисточниками и путями
предотвращения
контаминации готовых
лекарственных средств
4.
«Правила производствалекарственных средств» «Good Manufacturing Practice for Medicinal
Products (GMP)» - Надлежащая
производственная практика
ГОСТ Р 52249-2009 (GMP) «Правила
правильного производства»
5. Приказ МЗ РФ №309 от 21.10.97 «Об утверждении инструкции по режиму аптечных организаций (аптек)»
«Правила производства лекарственныхсредств» • Государственная Фармакопея ХIII издания и ФС
(фармакопейные статьи)
• Приказ Минздрава РФ от 26 октября 2015 г. №751н «Об
утверждении правил изготовления и отпуска
лекарственных препаратов для медицинского
применения аптечными организациями,
индивидуальными предпринимателями, имеющими
лицензию на фармацевтическую деятельность"
• Приказ МЗ РФ №309 от 21.10.97 «Об утверждении
инструкции по режиму аптечных организаций (аптек)»
6. GMP направлены на:
GMP - Система норм и правил,относящихся к производству
лекарственных средств.
GMP направлены на:
обеспечение высокого уровня качества и
безопасности ЛС;
гарантирование того, что ЛС изготовлено в
соответствии со своей формулой (составом);
ЛС не содержит посторонних включений,
маркировано надлежащим образом;
упаковано и сохраняет свои свойства в
течение всего срока годности;
7. Правила GMP устанавливают требования к
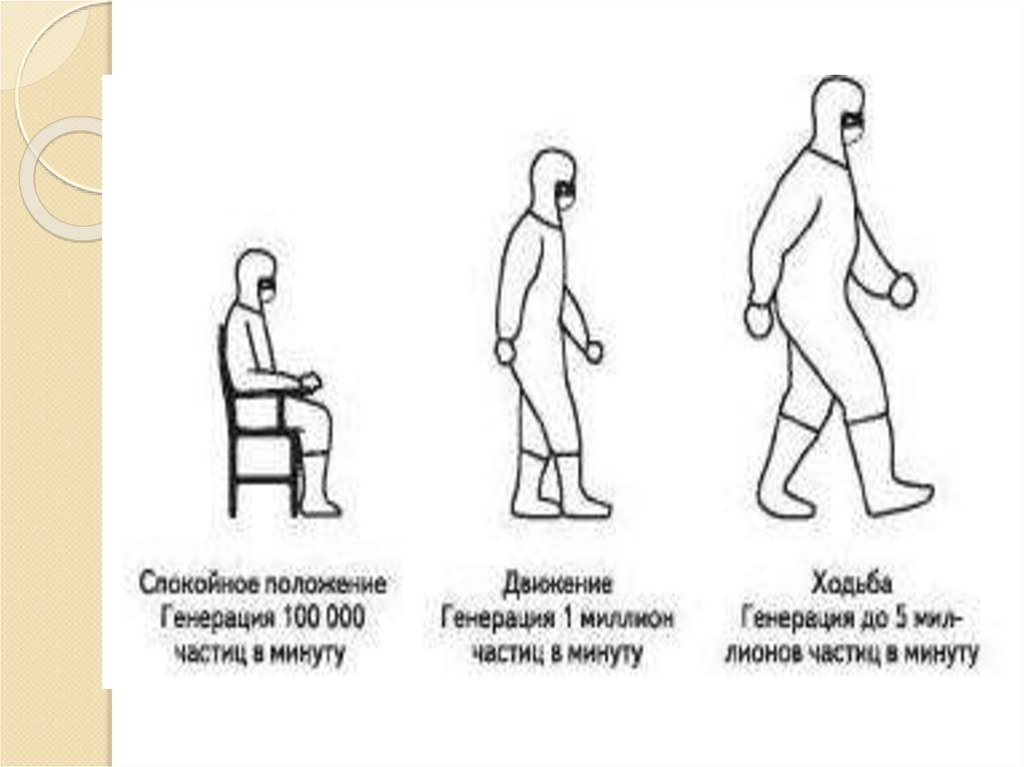
Системе управления качествомКонтролю качества
Персоналу
Помещениям и оборудованию
Документации
Производству продукции
Порядку отзыва продукции
Организации самоинспекций
8. Производство ЛС включает получение:
полупродукта- частично обработанное сырье или лекарственные
вещества, которые должны пройти дальнейшие стадии
производственного процесса;
субстанции или лекарственного вещества
- стандартизованное хим. соединение (в-во), обладающее
лечебными или профилактическими св-вами, разрешенное
к применению и предназначенное для изготовления ЛС;
ГЛС
-
лекарственное средство, предназначенное для отпуска
индивид. потребителю в удобной для применения
(дозированной) форме.
9. Источники и факторы загрязнения лекарственных препаратов:
I. Сырье и вспомогательныевещества на всех стадиях
производства, хранения и
транспортировки продукции
10. ЛЕКАРСТВЕННОЕ СЫРЬЕ
ПРИРОДНОЕрастительное сырье – растения, части растений,
продукты, выделяемые растениями, экстракты;
животное сырье – интактные животные, части
органов, продукты секреции, экстракты или
продукты крови;
человеческое - кровь, ее составляющие и
препараты крови;
СИНТЕТИЧЕСКОЕ (химические препараты - калия
перманганат; химико-фармацевтические
препараты – стрептоцид; антибиотики; витамины;
вакцины и сыворотки и др.)
11. Требования к технологическому процессу (GMP):
Микробное загрязнение сырья и исходныхматериалов должно быть минимальными и
соответствовать требованием к
микробиологической чистоте.
Продукция не может иметь надлежащее качество,
если материалы, из которого она сделана не
соответствуют предъявленным к ним требованиям.
Любое сырье, поступившее на производство
подлежит входному контролю качества, который
включает в себя не только проверку количества
материалов и соответствия упаковки, но и
подтверждение заявляемых производителем сырья
показателей качества.
12. Источники и факторы загрязнения лекарственных препаратов:
II. Тара и упаковочныематериалы :
первичная (индивидуальная)
упаковка);
вторичная;
транспортная.
GMP: Детали, компоненты первичной упаковки, оборудование
и другие предметы, используемые в чистых зонах
асептического производства, должны стерилизоваться и
поступать в чистую зону через проходные стерилизаторы,
встроенные в стены.
13. Источники и факторы загрязнения лекарственных препаратов:
III. Аптечное и заводскоеоборудование
14.
Чистые помещения (чистые комнаты,“cleanrooms”) – …помещения и/или зоны … с чистотой воздуха,
нормируемой по содержанию механических частиц определенного
размеры и жизнеспособных микроорганизмов, сконструированные
и используемые таким образом, чтобы свести к минимуму
проникновение, распространение, образование и сохранение
механических частиц и микроорганизмов внутри этих помещений
(согласно ОСТ 42-510-98. Стандарт отрасли, Правила организации
производства и контроля качества лекарственных средств
(GMP). МЗ РФ)
Класс чистоты помещения - статус "чистой" зоны или
"чистого« помещения, устанавливающий пределы содержания
механических частиц определенного размера и/или
жизнеспособных микроорганизмов в 1 м3 воздуха.
ОАО «Фармак»
15.
Основные подходы к созданию чистыхпомещений:
• Определение принципа разделения зон с
различными классами чистоты. Разработка
планировочных решений чистых помещений.
• Формирование потоков воздуха. Обеспечение
необходимых характеристик однонаправленного
потока воздуха.
• Обеспечение баланса воздухообмена, необходимой
доли наружного воздуха, а для помещений классов 5
ИСО — 9 ИСО — кратности воздухообмена. Построение
системы вентиляции и кондиционирования.
• Применение HEPA и ULPA фильтров и
многоступенчатой фильтрации воздуха.
• Обеспечение необходимого перепада давления.
• Разработка эффективных проектно-конструкторских
решений, использование надлежащих материалов и
оборудования.
16.
Зоны чистых помещенийА – локальная зона для проведения операций,
представляющий высокий риск для качества
продукции, в асептических условиях (вскрытие
ампул и флаконов, укупорка, наполнение и
т.д.); в таких зонах используется
однонаправленный (ламинарный) поток воздуха,
обеспечивающий однородную скорость 0,360,54 м/с;
В – зона, непосредственно окружающая зону А,
и предназначенная для асептического
приготовления и наполнения;
С, D – чистые зоны для выполнения менее
ответственных стадий производства СЛС.
17.
18.
Передаточное окно (pass through) - предназначено перемещенияразличных материалов из одной комнаты чистого помещения в
другую (для помещений с разной категорией чистоты).
"Чистая" камера (модуль) установка, создающая
однонаправленный поток воздуха с нормируемым содержанием
механических частиц определенного размера. Предназначена для
случаев, когда необходимо
разместить оборудование в чистой зоне, но создать специальную
отдельную комнату с шлюзом и остальным техническим
обеспечением не представляется возможным и при этом
стандартные ламинарные шкафы малы для планируемых
исследований.
19. Требования к технологическому процессу (GMP):
Не допускается приготовление лекарственныхсредств микробиологического происхождения в
зонах, используемых для производства других
лекарственных средств.
В чистых зонах, особенно в ходе асептического
производства, любая деятельность должна
быть сведена к минимуму.
20. Требования к технологическому процессу (GMP):
Время между началом приготовления раствораи его стерилизацией должно быть
минимальным. Для каждого продукта
устанавливается максимально допустимое
время с учетом состава продукта и условиями
хранения.
Все процессы стерилизации должны быть
аттестованы (валидированы).
Лекарственные средства, которые не могут
быть стерилизованы в первичной упаковке,
подлежат фильтрации.
21. Источники и факторы загрязнения лекарственных препаратов:
IV. Воздухатмосферный;
вентиляционный;
технологический
22.
“SAS ISOLATOR”• Устанавливается в любом
месте изолятора или чистой
комнаты
• Отсутствуют возмущения
непрямого воздушного потока
• Быстрый забор пробы (до
1000 л за 6 или 10 минут)
• Все параметры (объем,
время ожидания, число
циклов) регулируются
снаружи.
• Совместим с большинством
общепринятых
обеззараживающих средств
• Возможность распечатки
(места отбора, параметров,
имени оператора)
• Позволяет использовать
чашки любого типа.
Чистота воздуха СанПин
2.1.3.1375-03
23. Источники и факторы загрязнения лекарственных препаратов:
V. Вода, используемая впроизводстве
24. Санитарно-микробиологическая оценка воды используемой при изготовлении ЛС
Питьевая вода – не ≥50 КОЕ/мл, нет БГКП(СанПин 2.1.4.1070-01)
Вода очищенная - не ≥100 КОЕ/мл, нет
БГКП, S. aureus, P. aeruginosa (ФС 42-261997)
Вода для инъекций – не ≥10 КОЕ/100 мл,
апирогенная (ФС 42-2620-97)
25. Источники и факторы загрязнения лекарственных препаратов:
VI. Персонал, занятый впроизводстве
26. Причины контаминации ЛС от персонала
Наличие микрофлоры тела человека;Выполнение технологических
операций людьми:
страдающими заболеваниями ЖКТ, кожи,
дыхательных путей,
являющихся микробоносителями,
имеющими индивидуальную
повышенную потливость или сухость
кожи;
27. Причины контаминации ЛС от персонала
Отсутствие или плохое состояниетехнологической одежды;
Несоблюдение персоналом
требований к личной и
производственной гигиене;
Несоблюдение персоналом правил
поведения в ходе выполнения
технологического процесса;
28. Требования к персоналу (GMP):
В чистых зонах должно находитьсяминимальное количество необходимого
персонала.
Весь персонал, включая технический, должен
проходить систематическое обучение по
вопросам производства стерильных продуктов,
включая гигиену и основы микробиологии.
Не допускается вход в зоны стерильного
производства персонала, работающего с
материалами из тканей животных или
культурами микроорганизмов, которые не
используются в текущем технологическом
процессе.
29. Требования к персоналу (GMP):
Необходимо выполнять требования к личнойгигиене и чистоте; следует организовать
контроль за состоянием здоровья персонала.
Переодевание и мытьё следует выполнять в
соответствии с инструкциями, чтобы свести к
минимуму риск загрязнения одежды,
предназначенной для чистых зон, и внесения
загрязнения в чистые зоны.
Наружная одежда не должна попадать в комнаты
для переодевания, ведущие в зоны В и С.
Каждый работник в зонах А и В должен быть
обеспечен стерильной одеждой на каждую
смену.
30. При работе в асептических условиях ЗАПРЕЩАЕТСЯ:
входить в асептическую комнату в нестерильнойодежде и выходить из асептического блока в
стерильной;
иметь под стерильной санитарной одеждой объемную
ворсистую одежду или в которой работник находится
на улице;
использовать косметику и аэрозольные дезодоранты;
носить часы и ювелирные украшения;
вносить личные вещи (ключи, расчески, носовые
платки и др.);
31. При работе в асептических условиях ЗАПРЕЩАЕТСЯ:
очищать нос. Для этого следует выйти в шлюз,использовать стерильный платок или салфетку;
затем вымыть и продезинфицировать руки;
поднимать и повторно использовать предметы,
упавшие на пол во время работы;
смеяться, петь, свистеть, кричать, хаотично
бесцельно ходить;
протирать руки или лицо, чесать голову,
наклоняться над флаконами или другими
емкостями с лекарственными средствами;
использовать карандаши, ластики, перьевые
ручки.
32. Микробной порче подвергаются ГЛС:
Сухие (порошки, сборы, таблетки),Жидкие (микстуры, настои,
отвары, капли)
Мягкие (мази, пасты, шарики,
свечи)
Стерильные инъекционные
препараты
Любой лекарственный препарат
может служить питательной
средой для микроорганизмов!!!
33. Последствия инфицирования ГЛС:
Уменьшение содержания действующих веществ,изменение физических и органолептических свойств утрата фармакологических свойств (разрушение
активного начала);
Появление токсических свойств, связанных с
продукцией метаболитов и микробных токсинов (экзо- и
эндотоксинов);
Появление инфекционных свойств в результате
накопления микробов до концентраций,
соответствующих инфицирующей дозе;
Пирогенность инъекционных препаратов - накопление
продуктов метаболизма и распада микробных клеток,
особенно грамотрицательных;
Неблагоприятные побочные реакции – аллергизация;
Передача резистентности к АМП;
Сокращение сроков хранения;
Потеря товарного вида.
34. Готовые лекарственные средства:
18% - стерильные ЛС -не допускается
содержание
жизнеспособных
микроорганизмов
82% - нестерильные ЛС,
допускается содержание
живых микроорганизмов,
количество и качественный
состав которых зависит от
вида и назначения
продукции и нормируется
соответствующей
документацией, в т.ч.:
- 14% средства для местного
применения
- 68% для приема внутрь
35. Лекарственные средства, к которым предъявляется требования стерильности (СЛС):
инъекционные и инфузионные растворы и другиевиды препаратов для парентерального введения
(вводимые в полость суставов, в плевральную
полость и т.д.);
глазные капли (после стерилизации и изготовленные
в асептических условиях);
глазные препараты (мази, пленки,
офтальмологические растворы для орошения и др.);
препараты для нанесения на открытые раны и
ожоги;
жидкие лекарственные средства для
новорожденных;
медицинские иммунобиологические препараты
(МИБП).
36. Стерильность ЛС обеспечивается:
соблюдение правил асептики приизготовлении лекарственного
средства
выбор правильного метода и
режима стерилизации
37.
Нестерильные препараты производят внеасептических условиях,
приближенных к асептическим.
Требуемый уровень микробиологической
чистоты обеспечивается:
организация производственных
помещений,
выбор и эксплуатация оборудования,
микробиологический контроль
производства и готовой продукции.
38. Основные нормативные документы
«Правила производства лекарственныхсредств» - «Good Manufacturing Practice for
Medicinal Products (GMP)» http://gmpnews.ru/
ГОСТ Р 52249-2009 (GMP) «Правила правильного
производства»
Приказ МЗ РФ №309 от 21.10.97 «Об утверждении
инструкции по санитарному режиму аптечных
организаций (аптек)» и др.
Государственная Фармакопея ХIII издания и ФС
(фармакопейные статьи)
Приказ № 214 от 16 июля 1997г. “О контроле
качества лекарственных средств, изготовляемых
в аптеках”,
Методические указания по изготовлению
стерильных растворов в аптеках (от 24 августа
1994 г),
39. Объекты санитарно-микробиологического контроля на фармацевтическом производстве:
технологический и вентиляционный воздух;технологическое оборудование,
руки оператора в перчатках и одежда
персонала – контроль критических
поверхностей (непосредственно
контактирующих с материалом);
сырье и вспомогательные вещества на всех
стадиях производства, хранения и
транспортировки продукции;
тара и упаковочные материалы;
вода, используемая в производстве.
40. Контроль качества (GMP)
Отбор пробПроведение испытаний
(анализов)
Оформление
соответствующей
документации
Запрещается
использования
исходного сырья и
материалов и
реализация ГЛС до
подтверждения
41. Санитарно-микробиологическое исследование НЛС
От каждой серии ЛС берут среднююпробу 50 г (мл), состоящую из равных
разовых проб как минимум из 10
разных упаковок
Комплекс из 15 питательных сред
42. Санитарно-микробиологическое исследование НЛС
определение общего микробного числа(микробная обсемененность) – ОМЧ или
МАФАМ;
определение бактерий группы кишечной
палочки - БГКП;
определение дрожжевых и плесневых
грибов;
определение условно - патогенных и
патогенных микроорганизмов.
43. Методы санитарно-микробиологического исследования НЛС:
• БАКТЕРИОЛОГИЧЕСКИЙ,• МИКОЛОГИЧЕСКИЙ
Для количественного определения
микроорганизмов используют методы:
Чашечный агаровый метод
Метод мембранной фильтрации
Метод наиболее вероятностных
чисел (НВЧ)
44. Предварительная деконтаминация:
Использование различных методовконсервации
Холодовая цепь – это постоянно
функционирующая система
организационных и практических
мероприятий, обеспечивающая
оптимальный температурный режим
хранения и транспортировки медицинских
препаратов на всех этапах пути их
следования от предприятия-изготовителя
до пациента.
45. Способы деконтамиции сырья и ГЛС
1.2.
3.
4.
Термический
Химический (окись этилена или смесь
окиси этилена и бромистого метила)
УФ-облучение
Ионизирующее излучение
(антибиотики, витамины, ферменты,
гормоны и др.)
46. Литература
Медицинская микробиология, вирусологияи иммунология: Учебник для студентов
медицинских вузов / Под ред. А.А.
Воробьева. – М.: ООО «МИА», 2006.
Основы фармацевтической микробиологии:
Учебное пособие/ В.А. Галынкин, Н.А.
Заикина, В.И. Коцеровец и др. – СПб:
«Проспект Науки», 2008.
47.
48. Стерильное производство ЛС
49. Уборка чистых помещений
50.
51. Примеры загрязнений, генерируемых операторами:
Частицы: чешуйки кожи, волосы, ресницы,косметика, частицы из носа и рта, табачный дым
Химические/органические вещества,
содержащие: Na, Mg, Al, Si, P, S, Cl, K, Ca, Fe –
Косметика (Bi, Ba, Ti) – Жиры – Испарения из
носа (риск попадания в окружающую среду Na и
К) – Испарения изо рта (риск попадания К и CI)
Биологические: бактерии, вирусы и пирогены
Электростатическое заряжение: от 20 до 40 000
вольт.
52. Возможные контаминанты ГЛС
плесневые и дрожжевые грибы -Penicillium, Aspergillus, Mucor,
Candida;
кокки - стафилококки (S. aureus),
энтерококки;
Pseudomonas aeruginosa,
спорообразующие палочковидные
бактерии - B. subtillis, B. mesentericus
Патогенные микроорганизмы.
53. Требования к технологическому процессу (GMP):
Источники водоснабжения, оборудование подготовкиводы и приготовленная вода должны регулярно
контролироваться на наличие химических и
биологических загрязнений и, в необходимых случаях,
на эндотоксины.
Принципы конструкции трубопроводов
Непрерывное движение воды в турбулентном режиме со
скоростью 1-3 м/с
Возможность полного удаления из системы воды и воздуха
Трубопровод и все его компоненты должны быть изготовлены
из нержавеющего материала
Ни одна часть трубопровода не должна находиться в
горизонтальном положении
Не должно быть потоков со встречным направлением
Точки спуска воды должны быть спроектированы с учетом
правила 6-кратного диаметра
•Должна быть предусмотрена очистка системы
54. Примеры загрязнений, генерируемых операторами:
Частицы: чешуйки кожи, волосы, ресницы,косметика, частицы из носа и рта, табачный дым
Химические/органические вещества,
содержащие: Na, Mg, Al, Si, P, S, Cl, K, Ca, Fe –
Косметика (Bi, Ba, Ti) – Жиры – Испарения из
носа (риск попадания в окружающую среду Na и
К) – Испарения изо рта (риск попадания К и CI)
Биологические: бактерии, вирусы и пирогены
Электростатическое заряжение: от 20 до 40 000
вольт.
55.
При чихании – на расстояние ≥10 м распространяется ~ 105микроорганизмов
Со слюной ~ 106 КОЕ/мл
С отделяемым носа ~ 106 КОЕ/мл
56. ВОЗМОЖНЫЕ ПУТИ КОНТАМИНАЦИИ СФЕРЫ ПРОИЗВОДСТВА И ГЛС
Воздушно-капельный;Воздушно-пылевой;
Контактный
57.
Любой лекарственный препаратможет служить питательной
средой для микроорганизмов!!!
58.
Санитарно-микробиологическоеисследование СЛС
Цель: подтверждение отсутствия любых
микроорганизмов
Посев в соотношении 1:10 в среду для
контроля стерильности
Соблюдение строгих правил асептики!!!
59. Микробиологическая чистота лекарственных средств
КатегорияПрименение
Нормы
Госфармакопея
XII издания
1.
Для инъекций, инфузий
и других видов
парентерального
введения;
В полость тела, где
отсутствуют
микроорганизмы;
Глазные препараты;
На открытые раны,
ожоги
Препараты для
новорожденных.
Стерильность
60. Пирогенные свойства стерильных инъекционных ЛС
в результате:микробного загрязнения
дистиллированной воды пирогенами –
эндотоксинами Гр- бактерий,
61. Пирогенность ЛС зависит от:
1. Исходной (до стерилизации) микробнойконтаминации раствора (особенно грамотрицательными
бактериями), степень которой обусловлена:
*качеством используемых субстанций и вспомогательных
веществ (микробиологическая чистота),
*качеством воды для инъекций (микробиологическая чистота)
*интервалом времени от начала производства препарата до
стерилизации (т.к. микробы могут использовать
компоненты препарата в качестве питательных веществ и
размножаться в нём) – не должен превышать 3 часов
(Приказ №309 от 21 октября 1997 г.),
*внешней средой асептического бокса (чистой зоны на
фармацевтических заводах) – оборудование, воздух
(микробная контаминация),
*качеством обработки рук провизора,
*соблюдением правил работы в асептическом боксе (чистой
зоне на фармацевтических заводах) и технологии
производства лекарственного препарат;
62. Пирогенность ЛС зависит от:
2. Внесения пирогенных веществ(липополисахаридов, липополипротеидов бактерий) с
водой, субстанциями, растворителями, со стенок
флаконов – возвратной аптечной посуды, что обусловлено:
*накоплением продуктов жизнедеятельности и распада
(после тепловой стерилизации!) микроорганизмов в
субстанциях, растворителях,
*накоплением продуктов жизнедеятельности и распада
микроорганизмов в воде для инъекций (при нарушении
правил подготовки дистиллятора к работе, обработки
баллонов для сбора воды, сроков и условий хранения воды
для инъекций),
*накоплением продуктов жизнедеятельности и распада
микроорганизмов на стенках возвратной аптечной
посуды – флаконов (при нарушении правил её
дезинфекции, мытья и стерилизации) (см. разделы
«Вода», «Асептика», Приказ №309)
63. Инфекционные заболевания, возникающие в результате использования контаминированных ЛС
Гнойно-септические инфекции (местные игенерализованные)
Грибковые поражения кожи, слизистых,
органов (местные и генерализованные)
Заболевания вирусной природы
Кишечные инфекции (эшерихиозы,
сальмонеллезы).
64. Микробиологическая чистота лекарственных средств
Категория2.
Применение
Местно,
трансдермально
(пластыри),
интравагинально;
В полости уха,
носа;
Для введения в
дыхательные пути
За исключением
тех лек.
препаратов, кт.
должны быть
стерильны
Нормы - Госфармакопея XIII
издания
Не более 102 аэробных бактерий и
грибов суммарно в или в 1 мл или
на 1 пластырь (включая клейкую
сторону и основу);
Отсутствие энтеробактерий и
других грамотрицательных
бактерий, Pseudomonas aeruginosa,
Staphylococcus aureus на 1
пластырь (включая клейкую
сторону и основу)
Не более 101 энтеробактерий и
других грамотрицательных
бактерий в или в 1 мл
65. Микробиологическая чистота лекарственных средств
Категория3.а
Применение
Для приема внутрь
или введения
ректально
А. Лекарственные
средства из
субстанций
синтетического
происхождения
Нормы
Госфармакопея XIII
издания
Не более 103 аэробных
бактерий в или в 1 мл
Не более 102 грибов в
или в 1 мл
Отсутствие E. coli в 1г
или в 1 мл.
66. Микробиологическая чистота лекарственных средств
Категория3.б
Применение
Нормы Госфармакопея XIII
издания
ОМЧ бактерий не более
Для приема внутрь – из сырья
104 в 1 мл или в
природного происхождения
ОМЧ грибов не
(животного, растительного или
2
минерального), уровень микробного более10 в 1г или в 1 мл
Отсутствие E. coli, S.
загрязнения которого невозможно
снизить в процессе предварительной aureus в 1г или в 1 мл
Отсутствие Salmonella
обработки и относительно
spp в или в 10 мл;
которого федеральный орган
не более 102 в 1г или в
контроля качества лекарственных
1мл энтеробактерий и
средств допускает уровень
микробной загрязненности более 103 других
жизнеспособных микроорганизмов в грамотрицательных
бактерий.
1 г или в 1 мл. Исключением
являются лекарственные
растительные средства,
включенные в Категорию 4.
67. Микробиологическая чистота лекарственных средств
Категория4.
Применение
Нормы
Госфармакопея XIII
издания
ОМЧ бактерий не
Лекарственные
средства, состоящие из более 107 в или в 1мл
ОМЧ грибов не
одного вида сырья
(фасованная продукция) более 105 в или в 1
или нескольких (сборы), мл
E. coli не более 102
а также растительное
1г или в1 мл
сырьё «ангро»
68. Микробиологическая чистота лекарственных средств
Категория4.А
4.Б
Применение
Лекарственные растительные
препараты или лекарственное
растительное сырьё «ангро»,
применяемые в виде настоев,
отваров, приготовленные с
использованием кипящей воды
Лекарственные растительные
препараты или лекарственное
растительное сырьё «ангро»,
приготовленные без использования
кипящей воды
Нормы Госфармакопея XIII
издания
ОМЧ бактерий не более 105 в
1 г или в 1мл
ОМЧ грибов не более 104 в 1 г
или в 1 мл
не более 103 в 1 г или в 1мл
энтеробактерий и других
грамотрицательных бактерий.
ОМЧ бактерий не более 105 в
1 мл или в 1 г
ОМЧ грибов не более 104 в 1г
или в 1 мл
при отсутствии E. coli в 1 г
или в1 мл
при отсутствии Salmonella
spp. в 10 г или в 10 мл;
-не более 103 в 1 г или в 1мл
энтеробактерий и других
грамотрицательных бактерий
69. Примечания
В нормативных документах могут быть указаны в видеисключения и другие нормы в зависимости от состава
препарата и особенностей технологического процесса
производства
При обнаружении во время проведения испытаний
других патогенных бактерий, кроме указанных выше,
считают, что качество лекарственных средств,
субстанций и вспомогательных веществ не
соответствует требованием по показателю
«микробиологическая чистота»
В нормативных документах на препараты для детей
должны быть введены более жесткие нормы:
- количество аэробных бактерий в 1 г или 1 мл в
пределах 100 – 500,
- количество грибов 10 – 50
- отсутствие бактерий сем. Enterobacteriaceae, P.
aeruginosa, S. aureus в 1 г или в 1 мл



































































 medicine
medicine








