Similar presentations:
Сера и ее соединения (11 класс)
1.
2.
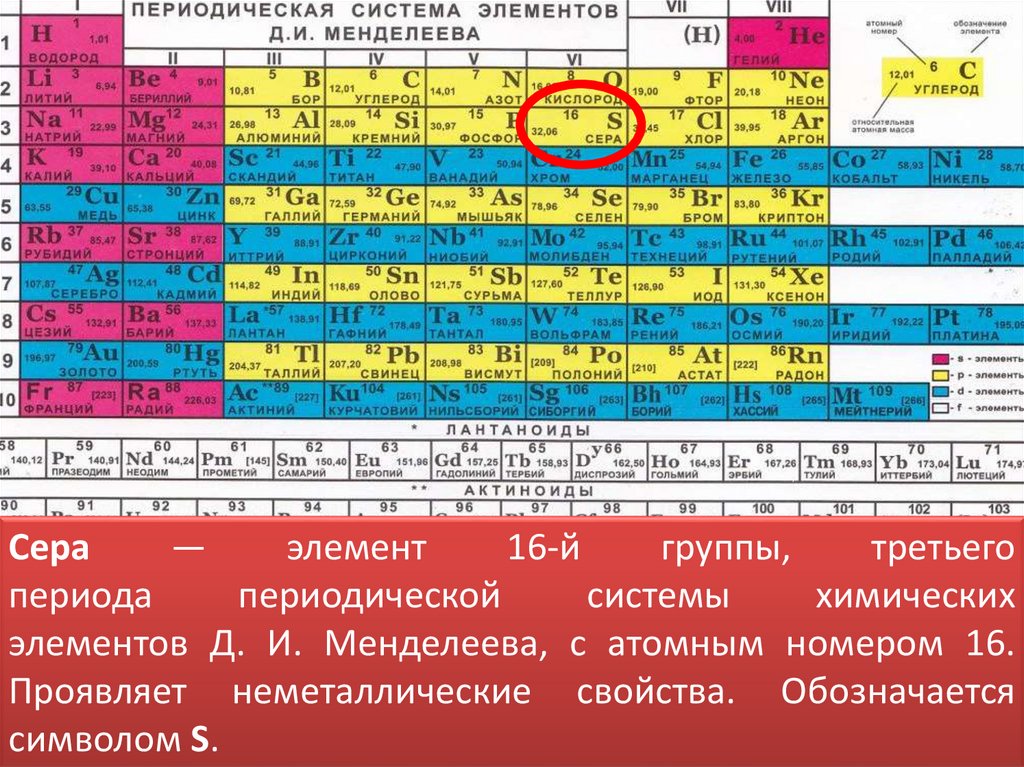
Сера—
элемент
16-й
группы,
третьего
периода
периодической
системы
химических
элементов Д. И. Менделеева, с атомным номером 16.
Проявляет неметаллические свойства. Обозначается
символом S.
3.
4.
•Твердое кристаллическое вещество желтого цвета;•Нерастворима в воде;
•Водой не смачивается (плавает на поверхности). Это
явление называется флоацией;
• t°кип = 445°С
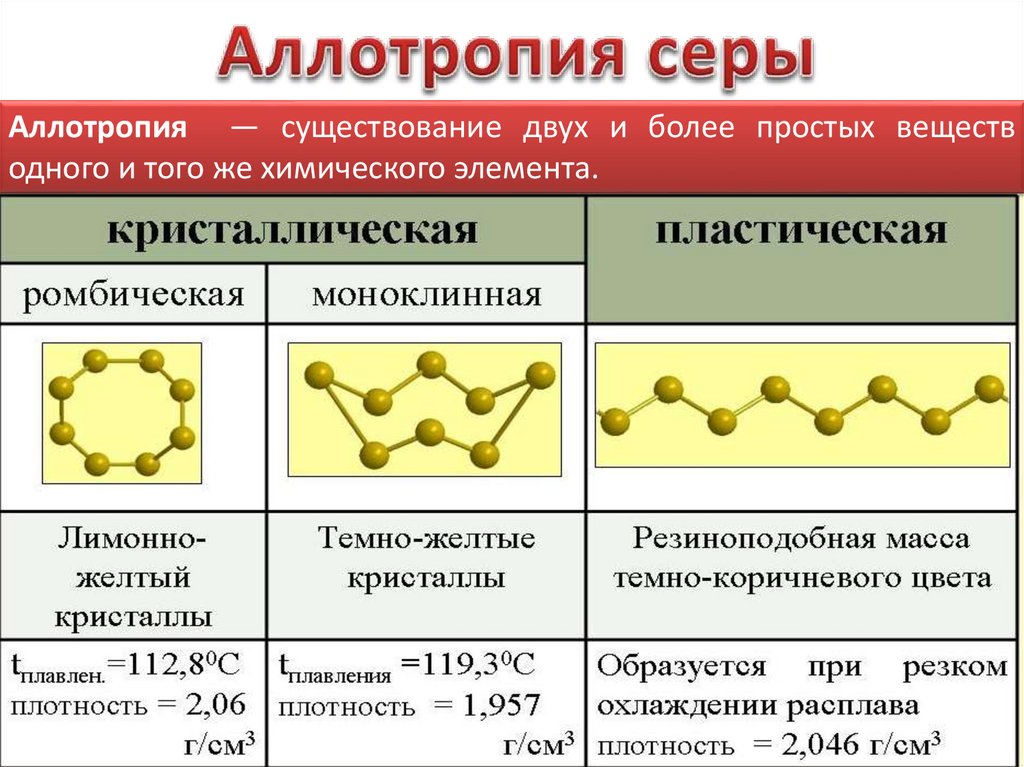
•Для серы характерны несколько аллотропных
5.
Аллотропия — существование двух и более простых веществодного и того же химического элемента.
6.
Сера – окислительS0 + 2ē -> S-2
Сера - восстановитель
S - 2ē -> S+2; S - 4ē -> S+4;
S - 6ē -> S+6
• Сера реагирует со
щелочными металлами без
нагревания:
Na + S -> Na2S
• С остальными металлами
(кроме Au,Pt) - t°:
2Al + 3S –t°-> Al2S3
• С некоторыми
неметаллами сера образует
бинарные соединения:
H2 + S -> H2S
2P + 3S -> P2S3
• С кислородом:
S + O2 –t°-> S+4O2
• С галогенами (кроме йода):
S + Cl2 -> S+2Cl2
• С кислотами - окислителями:
S + 2H2SO4(конц) -> 3S+4O2 +
2H2O
• Реакции
диспропорционирования:
3S0 + 6KOH -> K2S+4O3 + 2K2S-2 +
3H2O
7.
8.
Сера в организмечеловека является
составной частью
четырех аминокислот –
метионин, цистеин,
цистин и таурин.
Поэтому синтез белков
не происходит без ее
участия, каждая клетка
нашего организма
содержит серу.
9.
Достаточно много серы содержится в поверхностных слоях кожи. Серавходит в состав меланина, придающего нашей коже загорелость, он же
"окрашивает" родинки в бурый цвет. Сера - составная часть кератина,
являющегося основой ногтей и волос.
Серу называют «минералом «красоты», так как при её дефиците
волосы начинают ломаться и теряют блеск, а кожа блёкнет и стареет.
10.
Сера применяетсяобязательно при
болезнях:
- чесотка
- аллергия
- артрит и остео артроз
- экзема
11.
Наибольшее содержание серы отмечается в таких растенияхкак капуста, острый перец, хрен, горчица, бобы. Сера есть в
продуктах животного происхождения – яйца, мясо,
морепродукты, молочные продукты, различные крупы,
яблоки, виноград, крапива, орехи, шпинат, хлеб.
12.
13.
В природе встречается довольно редко в составепопутных нефтяных газов, природного газа, вулканических
газах, в растворённом виде в природных водах (например, в
Чёрном море слои воды, расположенные глубже 150—200 м
содержат растворённый сероводород). Образуется при
гниении белков (только тех, которые содержат в составе
серосодержащие аминокислоты).
14.
• В лабораторных условиях:путём воздействия на сульфид железа






























 chemistry
chemistry








