Similar presentations:
Электролиз
1. Демонстрационный опыт
Электролиз растворов хлорида натрияЭлектролиз раствора сахара
Электролиз хлорида меди (II)
2. Немного исторических фактов
Современный способ получения алюминия изобрели американец Ч. Холл и француз П.Эру в 1886 году из раствора оксида алюминия в расплавленном криолите. В
результате чего стоимость алюминия резко упала: если в 1854 году стоимость 1 кг
алюминия составила 1200 рублей, т.е. в 270 раз дороже серебра, то в 1899 году - 1
рубль.
Какой процесс использовали Чарльз Холл и Поль Эру для получения Алюминия?
гексафтороалюминат натрия Na₃[AlF₆]
3. Электролиз расплавов и растворов
4. Что необходимо вспомнить
Демонстрационный опыт: электропроводность раствора хлорида натрия ираствора сахара.
1. Почему при опускании электродов в первый раствор лампочка загорается, а во
второй - нет?
2. Что такое электролиты?
3. А какие классы веществ относятся к электролитам?
Задание: Запишите процесс диссоциации хлорида натрия
4. Как называются положительно заряженные ионы натрия? Почему они получили
такое название?
5. Как называются отрицательно заряженные ионы хлора? К какому электроду они
направляются?
5. Электроды
Различают электролиз с активными и инертными электродами. Активные(растворимые) электроды подвергаются химическим превращениям в процессе
электролиза. Обычно их изготавливают из меди, никеля и других
металлов. Инертные (нерастворимые) электроды химическим превращениям не
подвергаются. Их изготавливают из неактивных металлов, например, платины,
или графита.
6. Электролиз расплавов
Под действием электрического поля катионы Na+ движутся к катоду и принимают отнего электроны.
Na++e = Na0 - процесс восстановления.
Анионы Cl– движутся к аноду и отдают электроны:
2Cl-- 2e = Cl20 - процесс окисления.
Суммарная реакция: 2NaCl = 2Na + Cl2
На катоде выделяется металлический натрий, а на аноде – газообразный хлор.
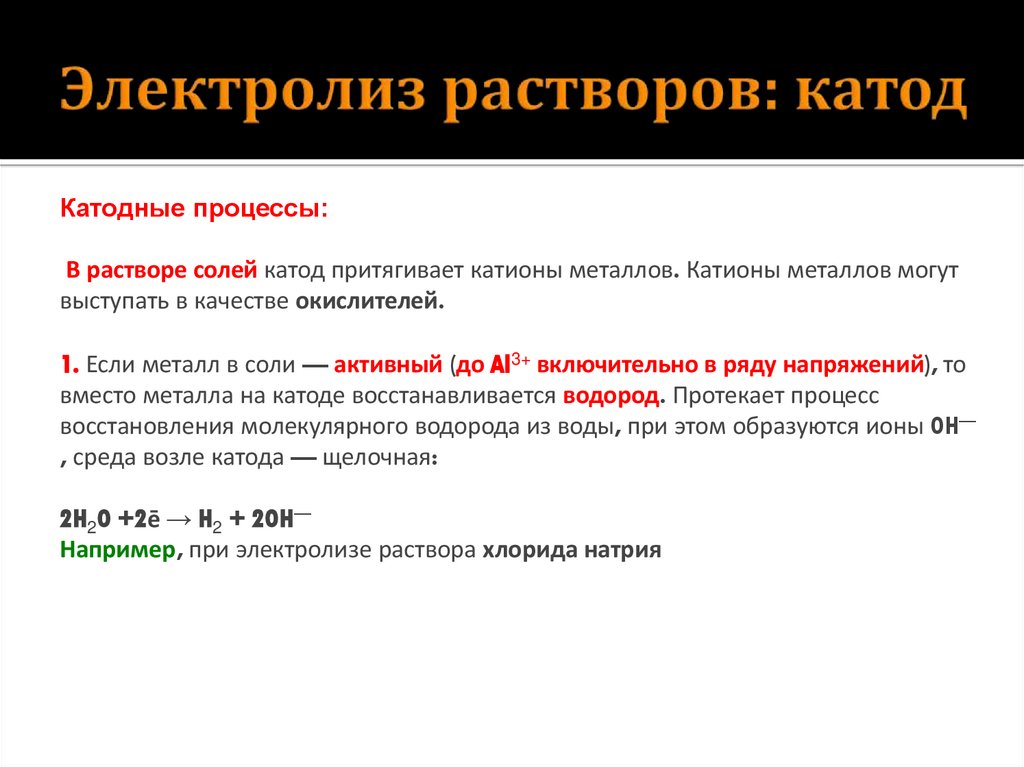
7. Электролиз растворов: катод
Катодные процессы:В растворе солей катод притягивает катионы металлов. Катионы металлов могут
выступать в качестве окислителей.
1. Если металл в соли — активный (до Al3+ включительно в ряду напряжений), то
вместо металла на катоде восстанавливается водород. Протекает процесс
восстановления молекулярного водорода из воды, при этом образуются ионы OH—
, среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH—
Например, при электролизе раствора хлорида натрия
8. Электролиз растворов: катод
2. Если металл в соли – средней активности (между Al3+ и Н+), то на катодевосстанавливается (разряжается) и металл, и водород, так как потенциал таких
металлов сравним с потенциалом водорода:
Men+ + nē → Me0
2H+2O +2ē → H20 + 2OH—
Например, при электролизе раствора сульфата железа (II) на катоде будет
восстанавливаться (разряжаться) и железо, и водород:
Fe2+ + 2ē → Fe0
2H+2O +2ē → H20 + 2OH—
9. Электролиз растворов: катод
3. Если металл в соли — неактивный (после водорода в ряду стандартныхэлектрохимических металлов), то ион такого металла является более сильным
окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Men+ + nē → Me0
Например, при электролизе раствора сульфата меди (II) на катоде будет
восстанавливаться медь:
Cu2+ + 2ē → Cu0
4. Если на катод попадают катионы водорода H+, то они и восстанавливаются до
молекулярного водорода:
2H+ + 2ē → H20
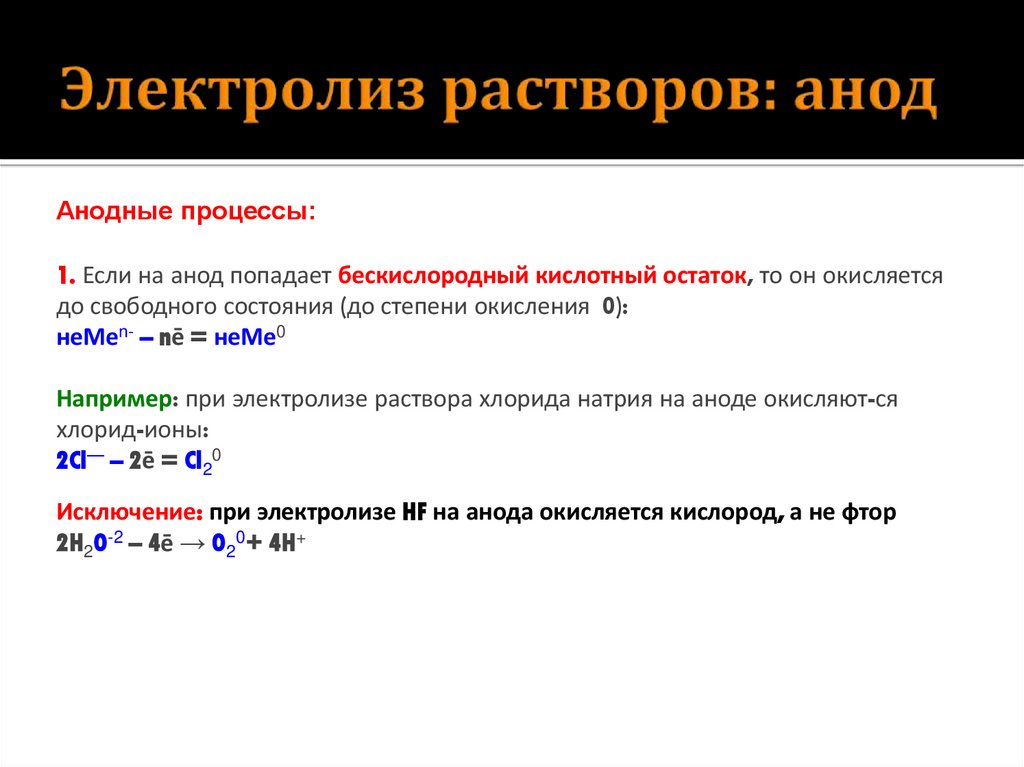
10. Электролиз растворов: анод
Анодные процессы:1. Если на анод попадает бескислородный кислотный остаток, то он окисляется
до свободного состояния (до степени окисления 0):
неМеn- – nē = неМе0
Например: при электролизе раствора хлорида натрия на аноде окисляют-ся
хлорид-ионы:
2Cl— – 2ē = Cl20
Исключение: при электролизе HF на анода окисляется кислород, а не фтор
2H2O-2 – 4ē → O20+ 4H+
11. Электролиз растворов: анод
2. Если на анод попадает кислородсодержащий кислотный остаток, либофторид-ион, то окислению подвергается вода с выделением молекулярно-го
кислорода:
2H2O-2 – 4ē → O20 + 4H+
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит
выделение молекулярного кислорода:
4O-2H– – 4ē → O20 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению подвергается атом углерода карбоксильной группы, выделяется углекислый газ и
соответствующий алкан.
Например, при электролизе растворов ацетатов выделяется углекислый газ и
этан:
2CH3C+3OO– –2ē → 2C+4O2+ CH3-CH3
12. Суммарные процессы электролиза
Например, электролиз раствора сульфата меди.На катоде восстанавливаются ионы меди:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются молекулы воды:
Анод (+): 2H2O-2 – 4ē → O2 + 4H+
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с
ионами водорода в виде серной кислоты:
2Cu2+SO4 + 2H2O-2 → 2Cu0 + 2H2SO4 + O20
13. Суммарные процессы электролиза
Электролиз раствора хлорида натрия:На катоде восстанавливается водород:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются хлорид-ионы:
Анод (+): 2Cl– – 2ē → Cl20
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с
гидроксид-анионами в суммарном уравнении электролиза раствора хлорида
натрия:
2H+2O +2NaCl– → H20 + 2NaOH + Cl20
14. Суммарные процессы электролиза
Электролиз водного раствора карбоната калия:На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2O-2 – 4ē → O20 + 4H+
Таким образом, при электролизе раствора карбоната калия ионы калия и
карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2H2+O-2 → 2H20 + O20
15. Суммарные процессы электролиза
Электролиз водного раствора хлорида меди (II):На катоде восстанавливается медь:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2Cl– – 2ē → Cl20
Таким образом, при электролизе раствора карбоната калия происходит
электролиз воды:
Cu2+Cl2– → Cu0 + Cl20
16. Суммарные процессы электролиза
Электролиз раствора гидроксида натрия:На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4O-2H– – 4ē → O20 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит
разложение воды, катионы натрия в процессе не участвуют:
2H2+O-2 → 2H20 + O20
17. Тест
1. Расплав какого вещества подвержен электролизу?а - оксид кальция б - парафин
в - глюкоза
г – азот
2. Что следует подвергнуть электролизу для получения хлора?
а - хлорную воду
б - раствор хлората калия
в - расплав хлорида калия г - хлор электролизом не получают
3. Цвет лакмуса в околокатодном пространстве при электролизе раствора бромида
натрия
а - малиновый
б - фиолетовый
в - красный г – синий
4. Какое вещество нельзя получить при электролизе раствора поваренной соли?
а - Na б - H2
в - Cl2
г – NaOH
5. При электролизе раствора сульфата цинка с инертными электродами на аноде
выделяется…
18. Домашнее задание
1. Составить уравнения электролиза растворов: AgNO3, CaBr2, FeSO42.Решить задачу: Вычислите объём выделившегося газа при электролизе
раствора нитрата серебра, содержащего 12г соли
















 chemistry
chemistry








