Similar presentations:
физика.призентация
1.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ КРАСНОЯРСКОГО КРАЯкраевое государственное автономное профессиональное
образовательное учреждение
«Красноярский колледж сферы услуг и предпринимательства»
Электролиз в
жидкой среде
Работу выполнила: Н.А. Погорелова
Работу проверила: Н.С. Бойкова
Красноясрк 2026
2.
АКТУАЛЬНОСТЬЭлектролиз — это
процесс,
соединяющий законы
физики и химии.
Открытый в XIX веке,
он является основой
технологий, без
которых невозможно
представить
современную жизнь.
ЦЕЛЬ: исследовать природу электрической
проводимости жидкостей и изучить процесс
электролиза.
ЗАДАЧИ:
1. Выяснить причины разной
электропроводности жидкостей.
2. Изучить механизм ионной проводимости и
электролитической диссоциации.
3. Ознакомиться с открытием и законами
электролиза М. Фарадея.
4. Рассмотреть современное применение
электролиза.
5. Провести эксперимент по электролизу
раствора поваренной соли.
3.
ТВЕРДОЕ ТЕЛОАГРЕГАТНЫЕ СОСТОЯНИЯ
ГАЗООБРАЗНОЕ
ЖИДКОЕ
Главное свойство жидкой
среды - текучесть. Оно
создаёт основу для
возможности появления
тока.
Электрический ток - это
направленное движение
заряженных частиц.
НАПРАВЛЕНИЕ ТОКА:
Условное:
+
Реальное для электронов:
+
4.
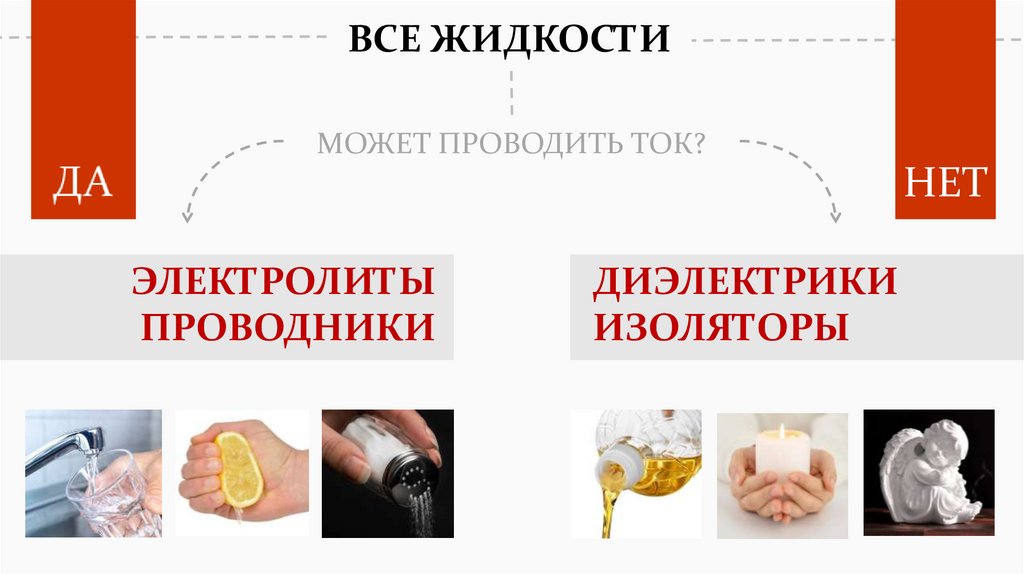
ВСЕ ЖИДКОСТИМОЖЕТ ПРОВОДИТЬ ТОК?
НЕТ
ЭЛЕКТРОЛИТЫ
ПРОВОДНИКИ
ДИЭЛЕКТРИКИ
ИЗОЛЯТОРЫ
5.
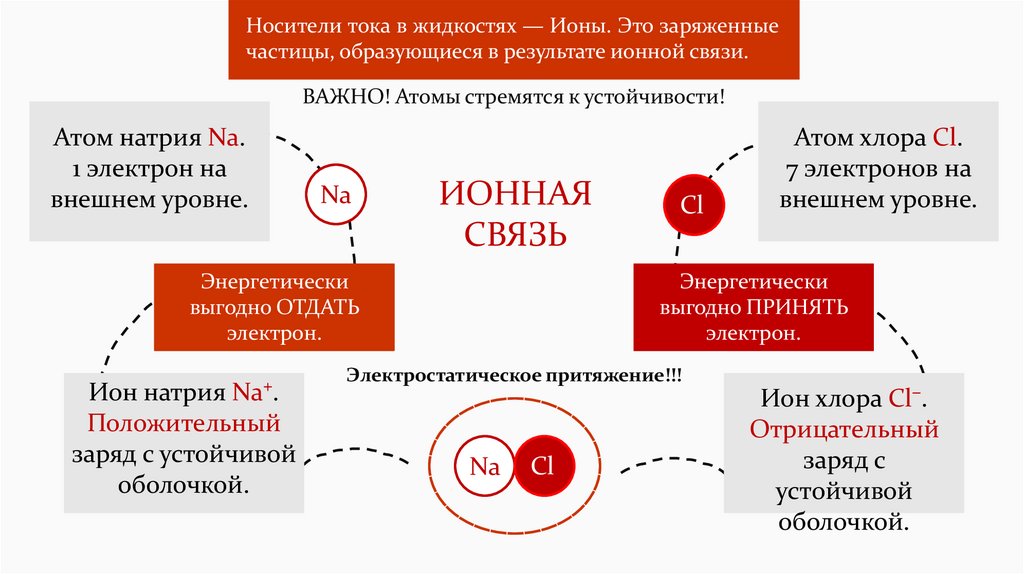
Носители тока в жидкостях — Ионы. Это заряженныечастицы, образующиеся в результате ионной связи.
ВАЖНО! Атомы стремятся к устойчивости!
Атом натрия Na.
1 электрон на
внешнем уровне.
Na
ИОННАЯ
СВЯЗЬ
Энергетически
выгодно ОТДАТЬ
электрон.
Ион натрия Na⁺.
Положительный
заряд с устойчивой
оболочкой.
Cl
Атом хлора Cl.
7 электронов на
внешнем уровне.
Энергетически
выгодно ПРИНЯТЬ
электрон.
Электростатическое притяжение!!!
Na
Cl
Ион хлора Cl⁻.
Отрицательный
заряд с
устойчивой
оболочкой.
6.
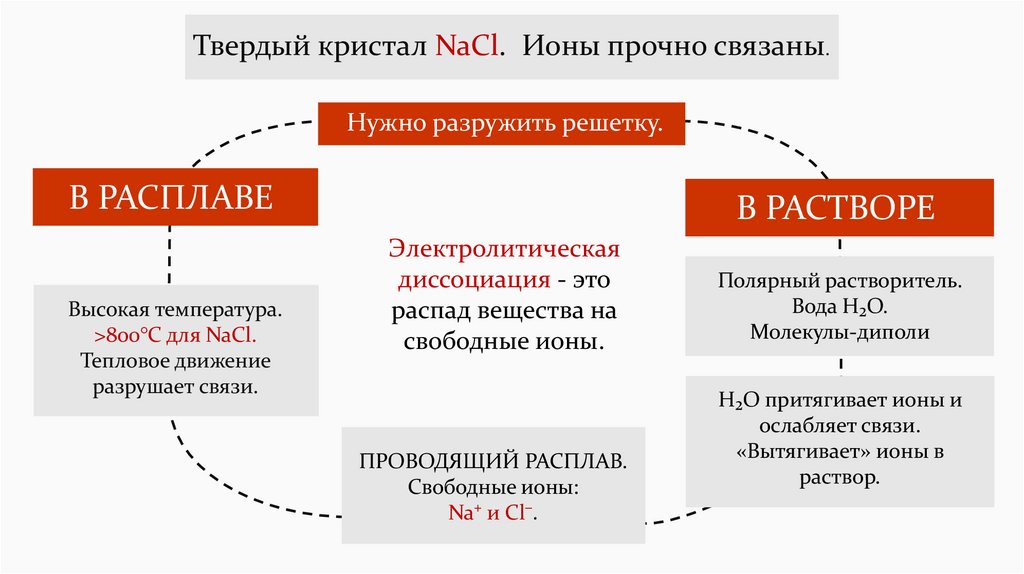
Твердый кристал NaCl. Ионы прочно связаны.Нужно разружить решетку.
В РАСПЛАВЕ
Высокая температура.
>800°C для NaCl.
Тепловое движение
разрушает связи.
В РАСТВОРЕ
Электролитическая
диссоциация - это
распад вещества на
свободные ионы.
ПРОВОДЯЩИЙ РАСПЛАВ.
Свободные ионы:
Na⁺ и Cl⁻.
Полярный растворитель.
Вода H₂O.
Молекулы-диполи
H₂O притягивает ионы и
ослабляет связи.
«Вытягивает» ионы в
раствор.
7.
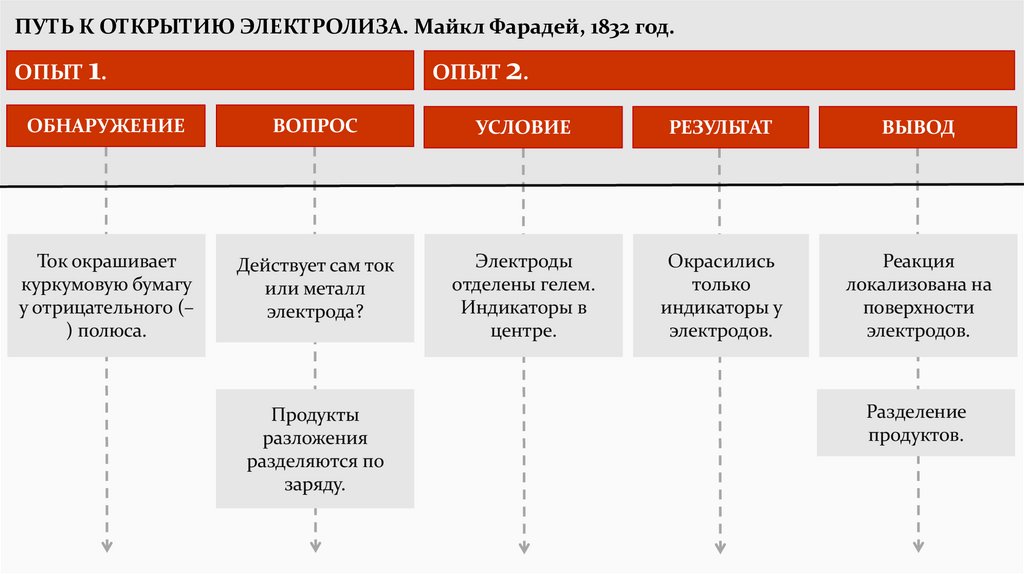
ПУТЬ К ОТКРЫТИЮ ЭЛЕКТРОЛИЗА. Майкл Фарадей, 1832 год.ОПЫТ 1.
ОПЫТ 2.
ОБНАРУЖЕНИЕ
ВОПРОС
УСЛОВИЕ
РЕЗУЛЬТАТ
ВЫВОД
Ток окрашивает
куркумовую бумагу
у отрицательного (–
) полюса.
Действует сам ток
или металл
электрода?
Электроды
отделены гелем.
Индикаторы в
центре.
Окрасились
только
индикаторы у
электродов.
Реакция
локализована на
поверхности
электродов.
Продукты
разложения
разделяются по
заряду.
Разделение
продуктов.
8.
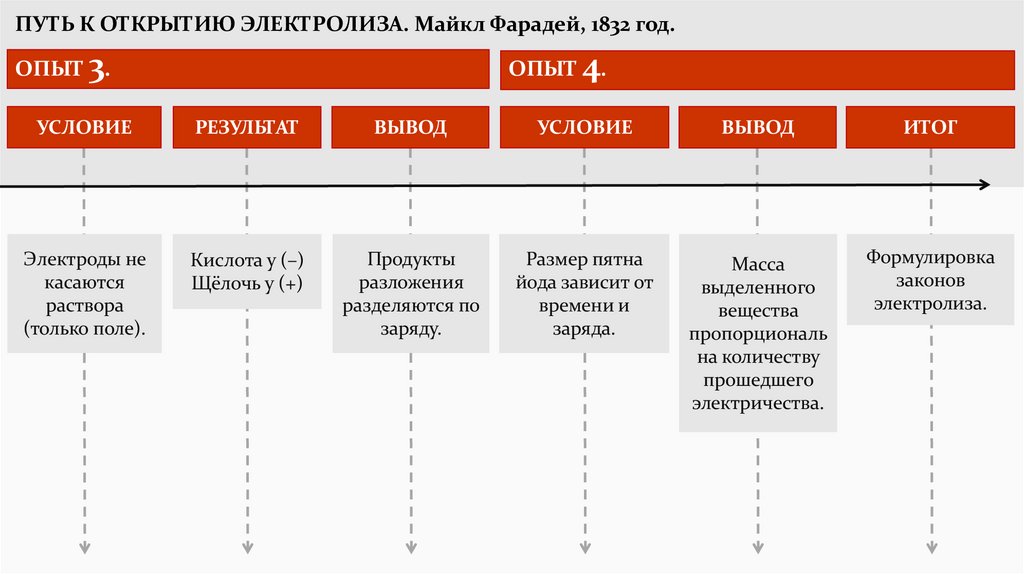
ПУТЬ К ОТКРЫТИЮ ЭЛЕКТРОЛИЗА. Майкл Фарадей, 1832 год.ОПЫТ 3.
ОПЫТ 4.
УСЛОВИЕ
РЕЗУЛЬТАТ
ВЫВОД
УСЛОВИЕ
ВЫВОД
ИТОГ
Электроды не
касаются
раствора
(только поле).
Кислота у (–)
Щёлочь у (+)
Продукты
разложения
разделяются по
заряду.
Размер пятна
йода зависит от
времени и
заряда.
Масса
выделенного
вещества
пропорциональ
на количеству
прошедшего
электричества.
Формулировка
законов
электролиза.
9.
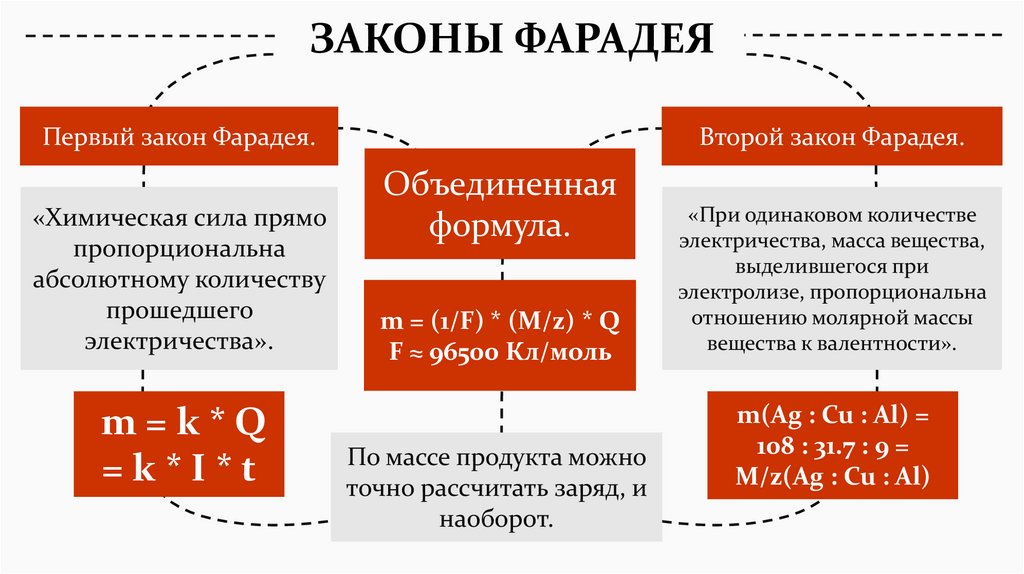
ЗАКОНЫ ФАРАДЕЯПервый закон Фарадея.
«Химическая сила прямо
пропорциональна
абсолютному количеству
прошедшего
электричества».
m=k*Q
=k*I*t
Второй закон Фарадея.
Объединенная
формула.
m = (1/F) * (M/z) * Q
F ≈ 96500 Кл/моль
По массе продукта можно
точно рассчитать заряд, и
наоборот.
«При одинаковом количестве
электричества, масса вещества,
выделившегося при
электролизе, пропорциональна
отношению молярной массы
вещества к валентности».
m(Ag : Cu : Al) =
108 : 31.7 : 9 =
M/z(Ag : Cu : Al)
10.
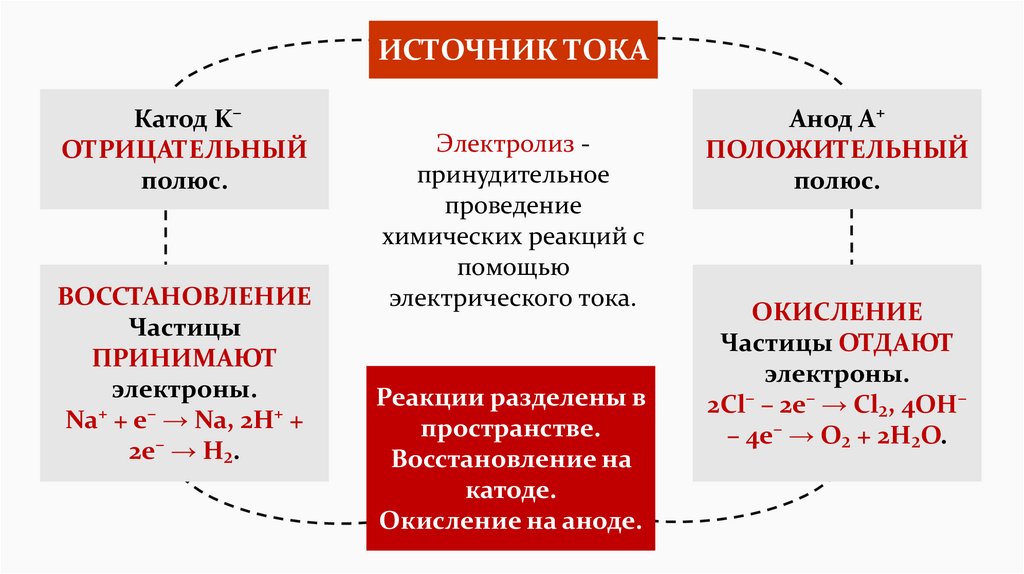
ИСТОЧНИК ТОКАКатод K⁻
ОТРИЦАТЕЛЬНЫЙ
полюс.
ВОССТАНОВЛЕНИЕ
Частицы
ПРИНИМАЮТ
электроны.
Na⁺ + e⁻ → Na, 2H⁺ +
2e⁻ → H₂.
Электролиз принудительное
проведение
химических реакций с
помощью
электрического тока.
Реакции разделены в
пространстве.
Восстановление на
катоде.
Окисление на аноде.
Анод A⁺
ПОЛОЖИТЕЛЬНЫЙ
полюс.
ОКИСЛЕНИЕ
Частицы ОТДАЮТ
электроны.
2Cl⁻ – 2e⁻ → Cl₂, 4OH⁻
– 4e⁻ → O₂ + 2H₂O.
11.
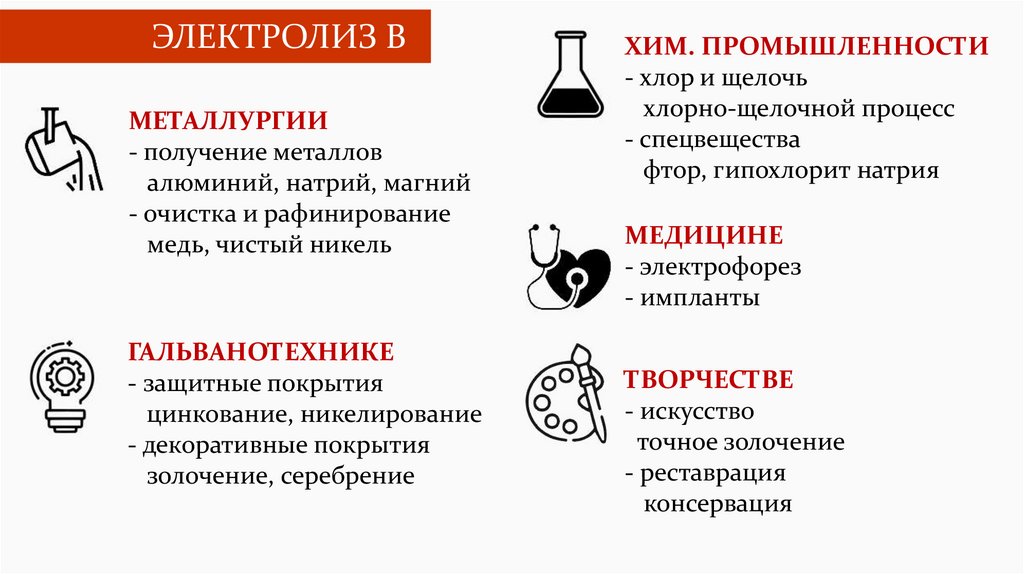
ЭЛЕКТРОЛИЗ ВМЕТАЛЛУРГИИ
- получение металлов
алюминий, натрий, магний
- очистка и рафинирование
медь, чистый никель
ГАЛЬВАНОТЕХНИКЕ
- защитные покрытия
цинкование, никелирование
- декоративные покрытия
золочение, серебрение
ХИМ. ПРОМЫШЛЕННОСТИ
- хлор и щелочь
хлорно-щелочной процесс
- спецвещества
фтор, гипохлорит натрия
МЕДИЦИНЕ
- электрофорез
- импланты
ТВОРЧЕСТВЕ
- искусство
точное золочение
- реставрация
консервация
12.
ВЫВОДЭлектролиз - это химическое
разложение веществ электрическим
током за счёт движения ионов в
жидкости. Практический опыт доказал,
что ток в жидкости возможен только при
наличии свободных ионов.
Таким образом, это явление, описанное
законами Фарадея, является ключевой
технологией для современности.
13.
СПАСИБО ЗАВНИМАНИЕ!
14.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫЖИДКАЯ СРЕДА - это... Значение слова ЖИДКАЯ СРЕДА https://sinonim.org/t/%D0%B6%D0%B8%D0%B4%D0%BA%D0%B0%D1%8F%20%
D1%81%D1%80%D0%B5%D0%B4%D0%B0#opr
Электрический ⭐ ток в различных средах: таблица, краткое описание, формулы
- https://wika.tutoronline.ru/fizika/class/10/chto-nuzhno-znat-ob-elektricheskomtoke-v-raznyh-sredah--kratkoe-opisanie
Электрический ток в жидкостях кратко https://obrazovaka.ru/fizika/elektricheskiy-tok-v-zhidkostyahkratko.html?ysclid=ml1xl6uuws151218122
Изучение явления электролиза и его применение в технике. - https://schoolscience.ru/10/13/45591?ysclid=ml1z4d7l5n189982621
Применение электролиза — Рувики: Интернет-энциклопедия https://ru.ruwiki.ru/wiki/%D0%9F%D1%80%D0%B8%D0%BC%D0%B5%D0%BD%
D0%B5%D0%BD%D0%B8%D0%B5_%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%
D1%80%D0%BE%D0%BB%D0%B8%D0%B7%D0%B0?ysclid=ml1zc9oq8b743149268






 physics
physics








