Similar presentations:
Кислородсодерж соед азота
1. Кислородные соединения азота
2. Оксиды азота
Кислород является более электроотрицательным элементом, поэтому всоединениях с кислородом азот будет проявлять только положительные
степени окисления: +1, +2, +3, +4 и +5.
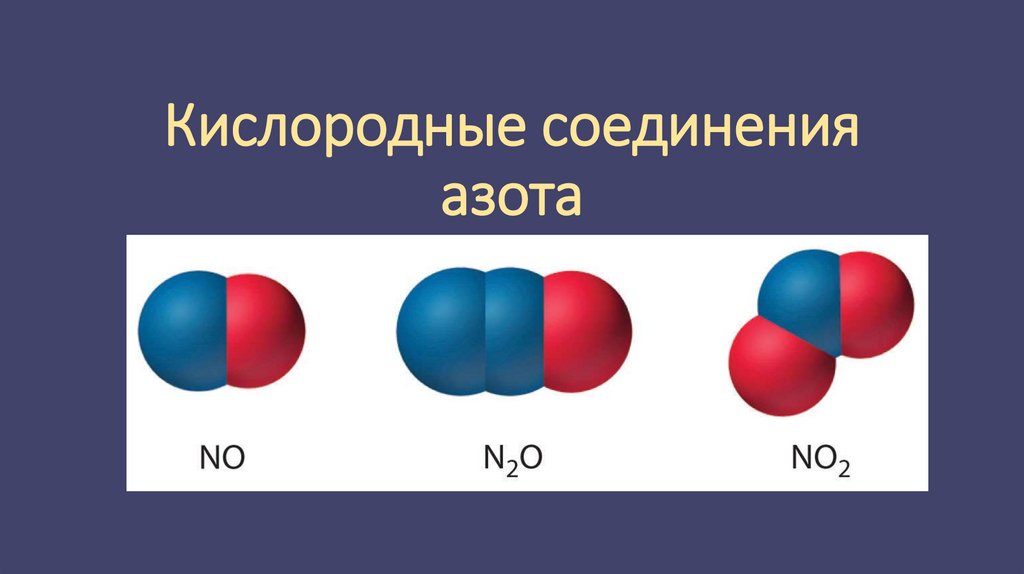
Оксиды азота
Азот взаимодействует с кислородом только при температуре выше 2000°С.
При этом образуется оксид азота (II) NO:
Оксид азота (II) — это бесцветный газ, он относится к несолеобразующим
оксидам, то есть не взаимодействует с кислотами и основаниями с
образованием солей.
3.
Кроме данного оксида, азот образует ещё четыре:• оксид азота (I) N2O — также несолеобразующий оксид, бесцветный газ
со сладковатым запахом;
• оксид азота (III) N2O3 — кислотный оксид, жидкость синего цвета. Ему
соответствует азотистая кислота HNO2 (азот в степени окисления +3,
такая же как в оксиде), она образуется при взаимодействии оксида с
водой:
• оксид азота (IV) NO2 — бурый газ, кислотный оксид, но не совсем
обычный. Азот не образует кислоту, в которой он находился бы в
степени окисления +4, как в оксиде. При взаимодействии с водой
данный оксид образует две кислоты — азотистую и азотную:
4.
• оксид азота (V) N2O5 — кислотный оксид, бесцветные кристаллы. Емусоответствует азотная кислота HNO3 (степень окисления азота +5, как в
оксиде):
5. Азотистая кислота HNO2
Азотистая кислота относится к слабым кислотам. Она легко разлагается,поэтому получить её в свободном состоянии нельзя. В водном растворе она
диссоциирует обратимо:
• Кислород — хороший окислитель. Он может окислять азотистую кислоту,
которая в этом случае будет проявлять восстановительные свойства:
• Слабые окислительные свойства азотистая кислота проявляет с
восстановителями, например:
• Обычные кислотные свойства, азотистая кислота взаимодействует с
щелочами и основными оксидами с образованием нитритов
6.
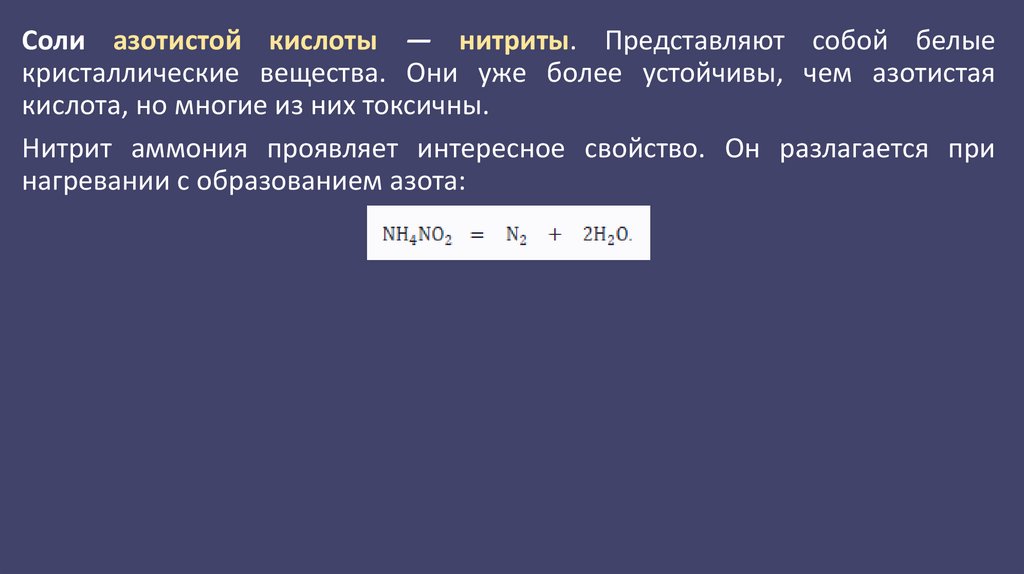
Соли азотистой кислоты — нитриты. Представляют собой белыекристаллические вещества. Они уже более устойчивы, чем азотистая
кислота, но многие из них токсичны.
Нитрит аммония проявляет интересное свойство. Он разлагается при
нагревании с образованием азота:
7. Азотная кислота HNO3
Исходным веществом для получения азотной кислоты служит аммиак.Почему не азот? Как мы уже говорили, азот достаточно инертное
вещество, его сложно заставить взаимодействовать с чем-либо из-за
тройной связи между атомами в молекуле N2.
Связи в аммиаке не такие прочные, их легко разрушить при окислении,
поэтому на производство азотной кислоты из аммиака будет затрачено
меньше ресурсов, чем из азота.
8.
ПолучениеПолучение азотной кислоты происходит в несколько стадий.
• Для начала окисляют аммиак до оксида азота (II) с использованием
катализатора (платина):
4NH3 + 5O2 →кат 4NO + 6H2O.
• Затем оксид азота (II) окисляют кислородом воздуха до оксида азота (IV):
2NO + O2 = 2NO2.
• И на последней стадии оксид азота (IV) реагирует с водой. Здесь
протекает множество сложных реакций, но упрощённо эта стадия
соответствует следующему уравнению реакции:
4NO2 + O2 + 2H2O = 4HNO3.
Так получают раствор азотной кислоты с массовой долей до 60%.
9.
Азотная кислота представляет собой бесцветную жидкость, которая прихранении частично разлагается и приобретает бурый оттенок. Его придаёт
кислоте один из продуктов реакции — оксид азота(IV):
По своим свойствам азотная кислота — сильный электролит, который
полностью диссоциирует в водном растворе.
Химические свойства
И так как HNO3 — типичная кислота, она реагирует с основными и
амфотерными оксидами, с щелочами и нерастворимыми гидроксидами
металлов, а также с солями.
10.
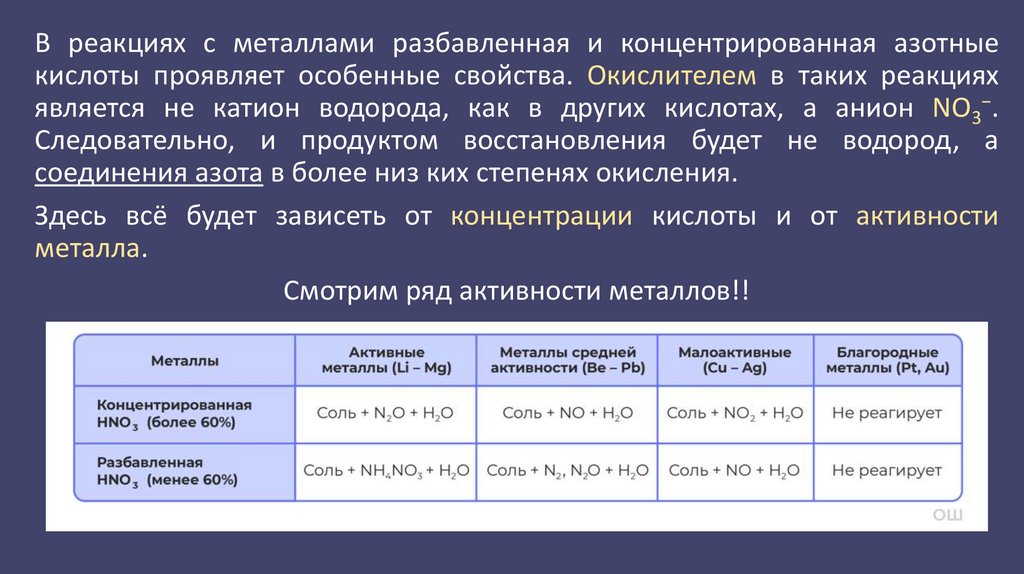
В реакциях с металлами разбавленная и концентрированная азотныекислоты проявляет особенные свойства. Окислителем в таких реакциях
является не катион водорода, как в других кислотах, а анион NO3−.
Следовательно, и продуктом восстановления будет не водород, а
соединения азота в более низ ких степенях окисления.
Здесь всё будет зависеть от концентрации кислоты и от активности
металла.
Смотрим ряд активности металлов!!
11.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2OВзаимодействие концентрированной кислоты с малоактивным металлом (медью)
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Взаимодействие разбавлнной кислоты с малоактивным металлом (медью)
Железо, алюминий и хром пассивируются концентрированной кислотой,
т.е. они покрываются защитной оксидной пленкой и становятся
неактивными.
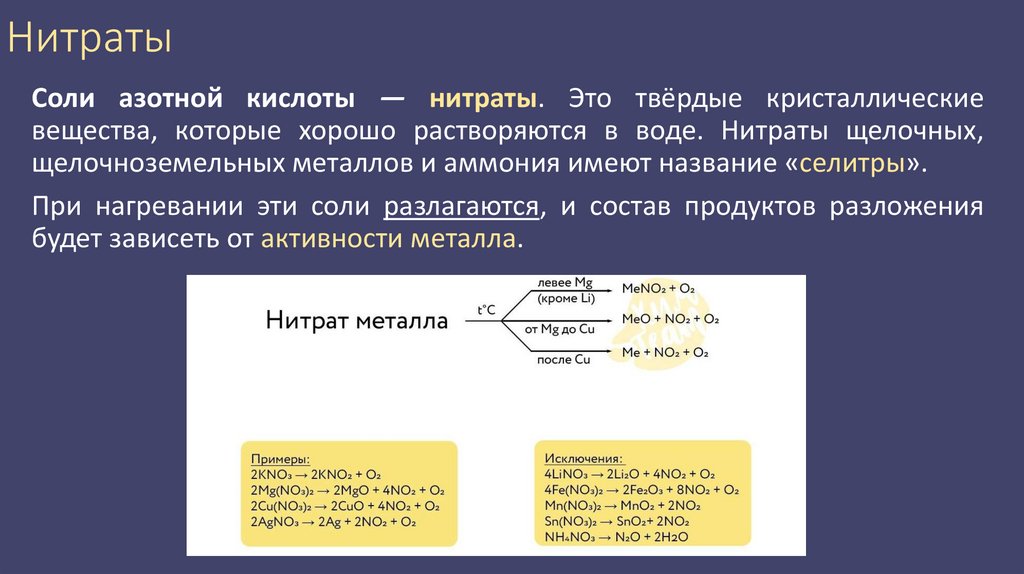
12. Нитраты
Соли азотной кислоты — нитраты. Это твёрдые кристаллическиевещества, которые хорошо растворяются в воде. Нитраты щелочных,
щелочноземельных металлов и аммония имеют название «селитры».
При нагревании эти соли разлагаются, и состав продуктов разложения
будет зависеть от активности металла.








 chemistry
chemistry








