Similar presentations:
Химия 2 лекция 75656BAE
1. Проверка задач для самостоятельного выполнения
Задание 1Из указанных в ряду химических элементов выберите три, которые
в ПСХЭ находятся в одном периоде. Расположите эти элементы в
порядке усиления основных свойств их оксидов.
1) P 2) Na 3) Li 4) Ca 5) Al
Задание 2
Из указанных в ряду химических элементов выберите три, которые
в ПСХЭ находятся в одной группе. Расположите эти элементы в
порядке уменьшения электроотрицательности.
1) S 2) N 3) Br 4) P 5) As
2. Электронная конфигурация атома
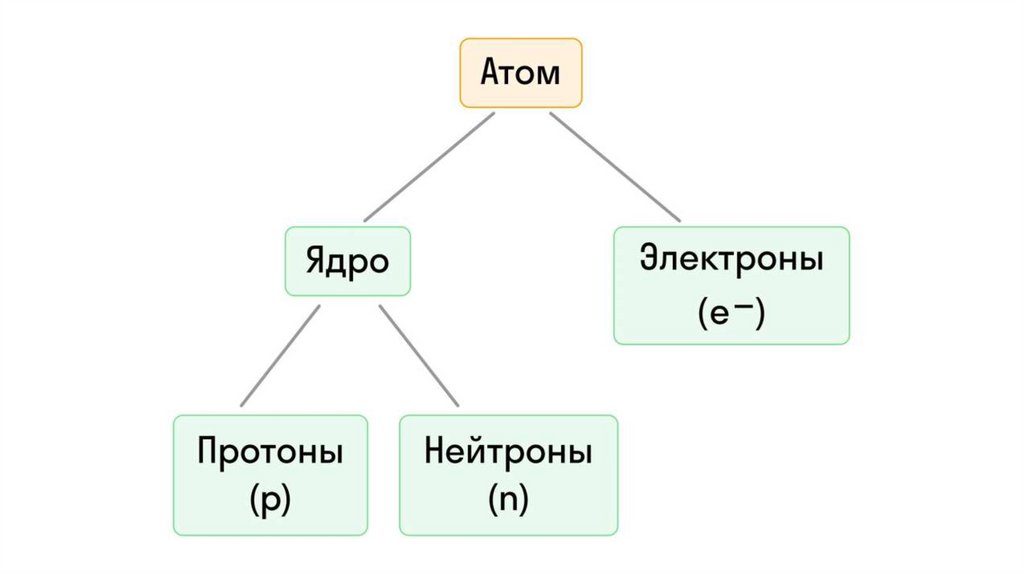
3. Что такое атом?
Это мельчайшая частица химического элемента и источник егоуникальных свойств. Эта фундаментальная единица материи
играет ключевую роль в понимании химических реакций и
взаимодействий, так как она определяет поведение и свойства
различных веществ в природе.
4.
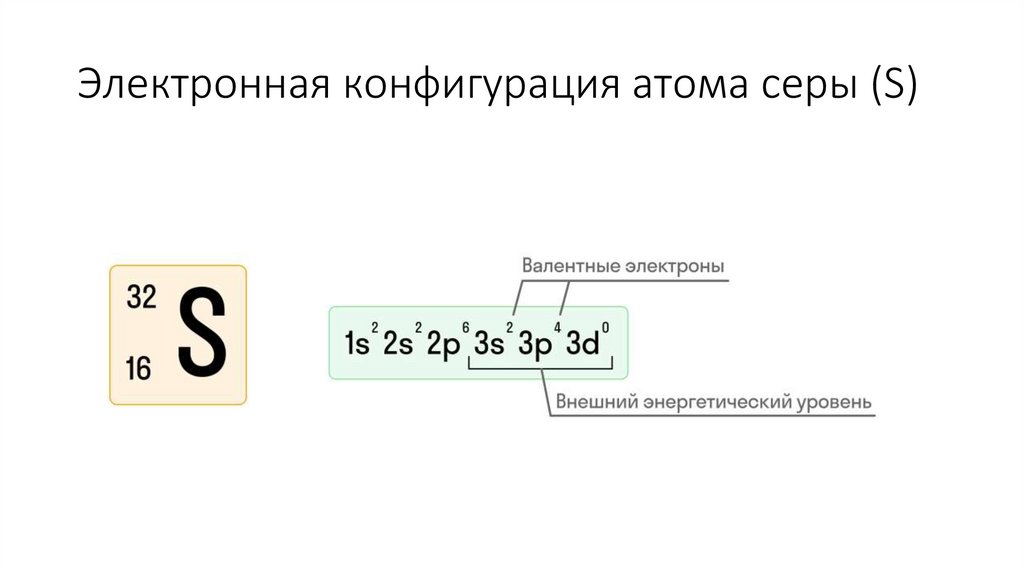
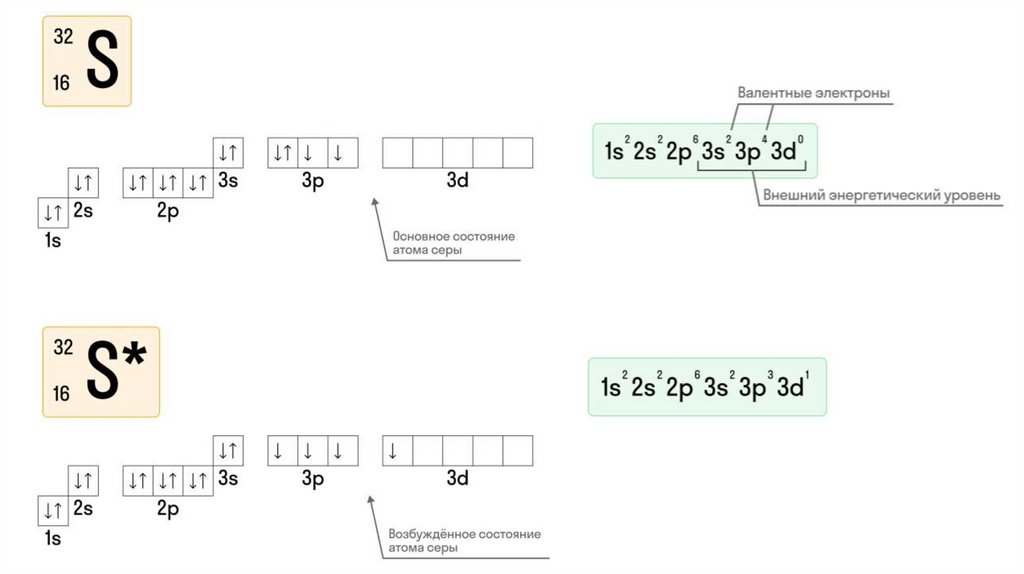
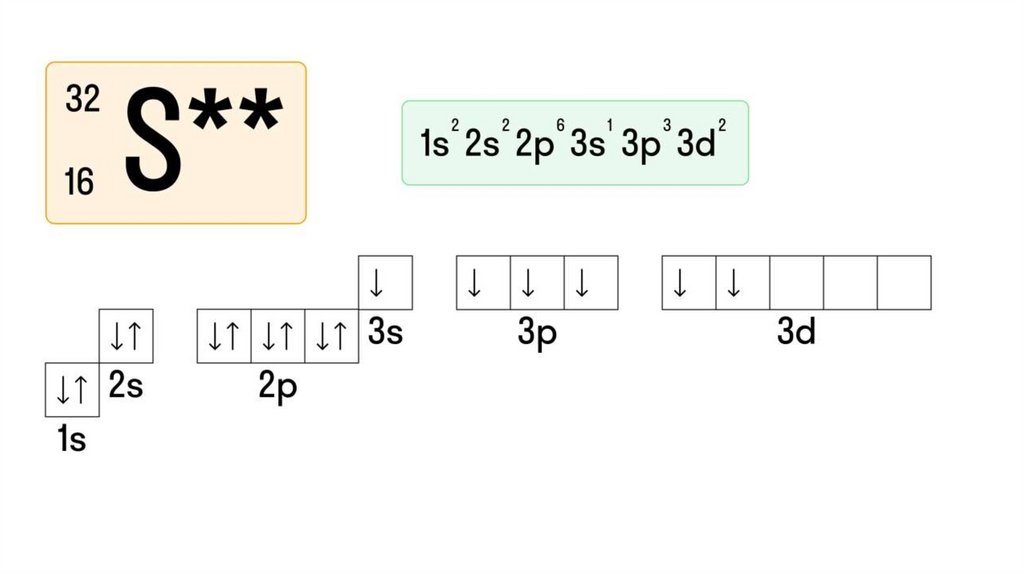
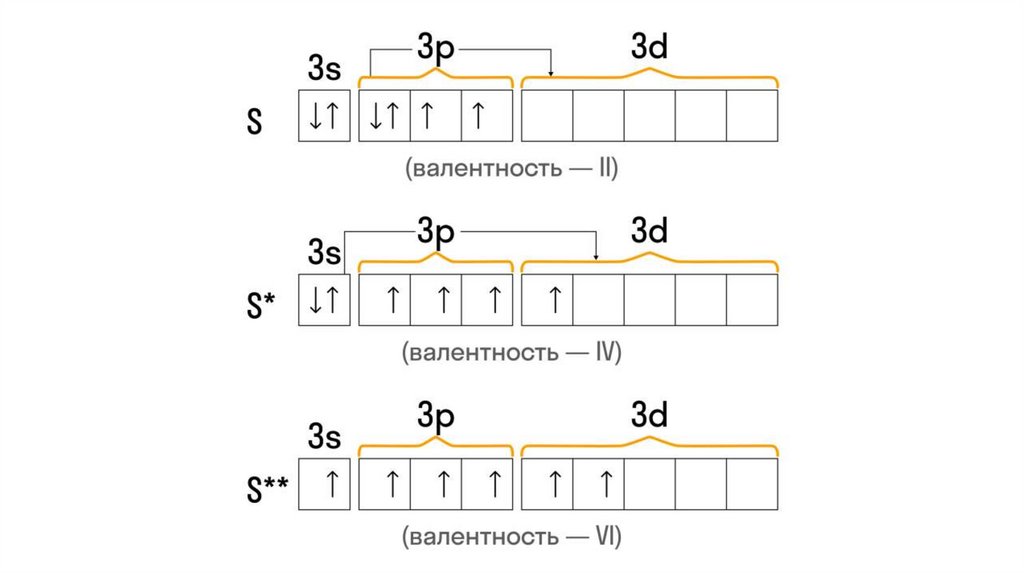
5. Составим характеристику атома серы (S)
6.
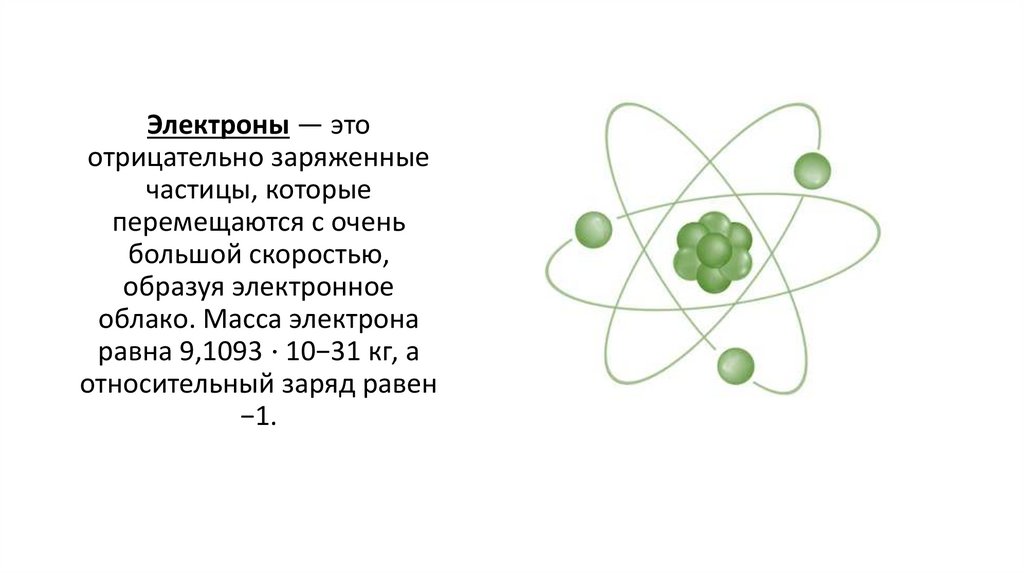
Электроны — этоотрицательно заряженные
частицы, которые
перемещаются с очень
большой скоростью,
образуя электронное
облако. Масса электрона
равна 9,1093 ⋅ 10−31 кг, а
относительный заряд равен
−1.
7. Атомная орбиталь — это участок, в котором вероятность нахождения электрона максимальна.
8. Энергетический уровень — это совокупность электронов с близкой по значению энергией.
Абсолютно все атомы имеют конкретное число электронов,которые располагаются на энергетических уровнях и занимают
отдельное положение на атомных орбиталях.
9.
Квантовые числа1. Энергетические уровни обозначаются номерами с 1 до 7, а
определить количество уровней в атоме конкретного элемента
можно по номеру периода, в котором он находится. Номер
энергетического уровня также является главным квантовым
числом — n.
2. Главное квантовое число всегда на единицу больше, чем
орбитальное квантовое число: n = l + 1.
3. Магнитное квантовое число (ml) обусловливает число
орбиталей на каждом подуровне и описывает их взаимное
расположение. Принимает значения от −1 до +1.
4. Спиновое квантовое число (ms) определяет вектор вращения
электрона вокруг собственной оси и принимает значения +½ и
−½.
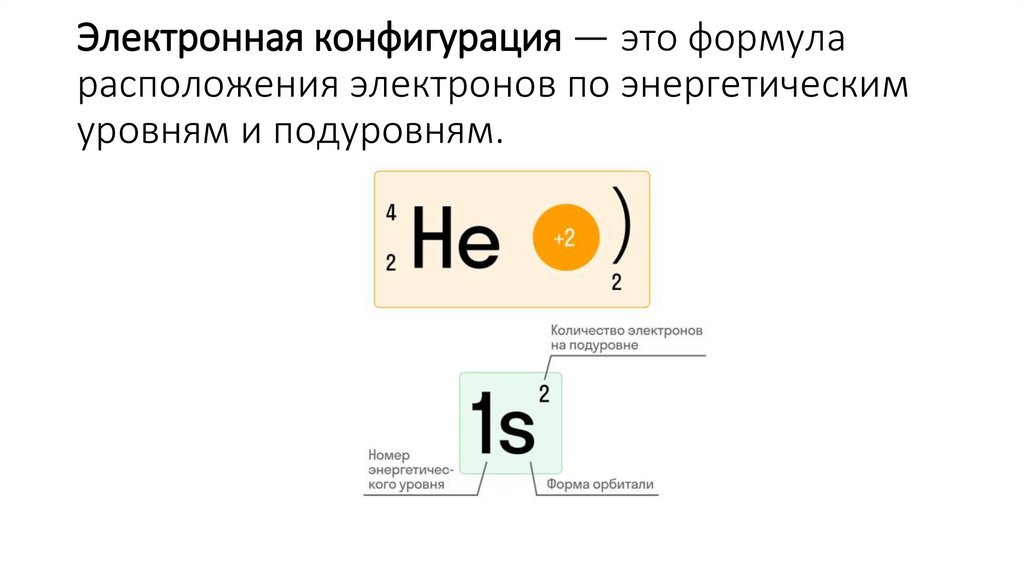
10. Электронная конфигурация — это формула расположения электронов по энергетическим уровням и подуровням.
11. Электронная конфигурация атома серы (S)
12. При составлении электронно-графической конфигурации необходимо соблюдать определенные правила:
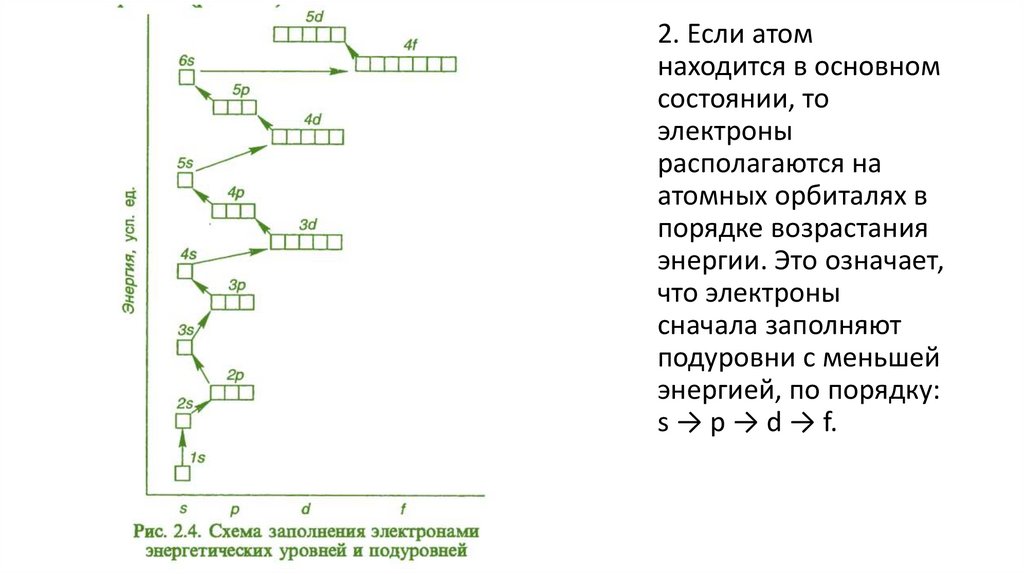
1. Электроны стремятся заполнить ЭУ с минимумом энергии.Поэтому заполнение начинается от первого, самого
ближайшего к ядру атома, и далее по порядку. Каждый
последующий слой не заполняется, если предыдущий является
незавершенным.
13.
2. Если атомнаходится в основном
состоянии, то
электроны
располагаются на
атомных орбиталях в
порядке возрастания
энергии. Это означает,
что электроны
сначала заполняют
подуровни с меньшей
энергией, по порядку:
s → p → d → f.
14.
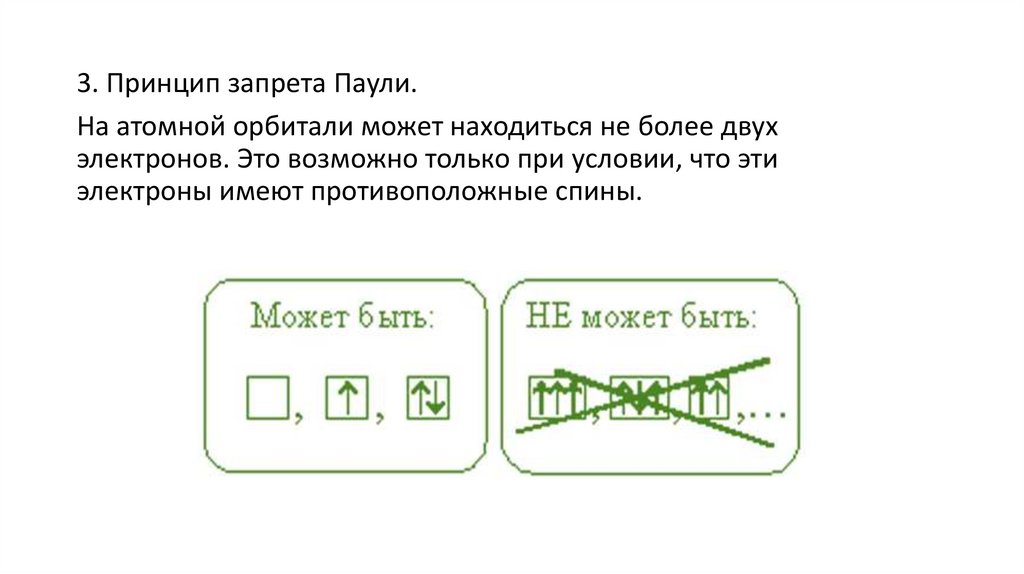
3. Принцип запрета Паули.На атомной орбитали может находиться не более двух
электронов. Это возможно только при условии, что эти
электроны имеют противоположные спины.
15.
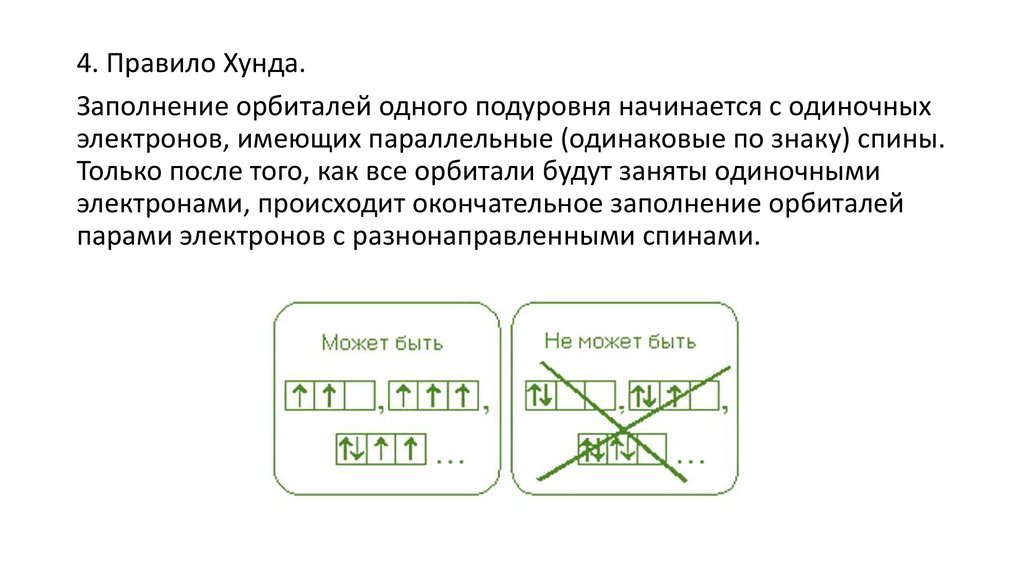
4. Правило Хунда.Заполнение орбиталей одного подуровня начинается с одиночных
электронов, имеющих параллельные (одинаковые по знаку) спины.
Только после того, как все орбитали будут заняты одиночными
электронами, происходит окончательное заполнение орбиталей
парами электронов с разнонаправленными спинами.
16.
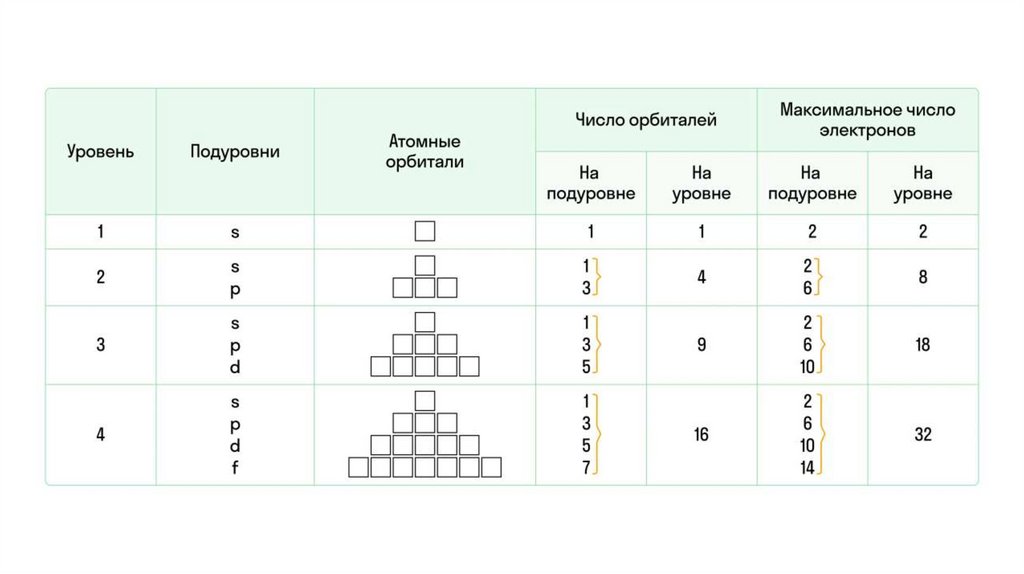
• Каждая орбиталь имеет определенное количество квантовыхячеек: s-орбиталь — одну, p-орбиталь — три, d-орбиталь — пять,
и f-орбиталь — семь.
• В каждой отдельной ячейке может быть не более двух электронов
с различными спинами (то есть направленными в
противоположные стороны).При этом на s-орбитали
максимально возможно присутствие двух электронов, на pорбитали — шести, на d-орбитали — десяти, на f-орбитали —
четырнадцати.
• Если в квантовой ячейке находятся два электрона, то такие
электроны называются спаренными. Если ячейку занимает только
один электрон — он неспаренный.
17.
18.
19.
20.
21. Составьте электронные и графические конфигурации атомов
22. План описания химического элемента
1. Символ элемента и его название2. Заряд ядра химического элемента (= порядковый номер)
3. Число протонов в ядре (= порядковый номер)
4. Число электронов в ядре (= числу протонов)
5. Число нейтронов в ядре (Масса элемента – число протонов)
6. Относительная атомная масса элемента
7. Число энергетических слоев
8. Число электронов на внешнем электронном уровне
9. Электронная конфигурация атома
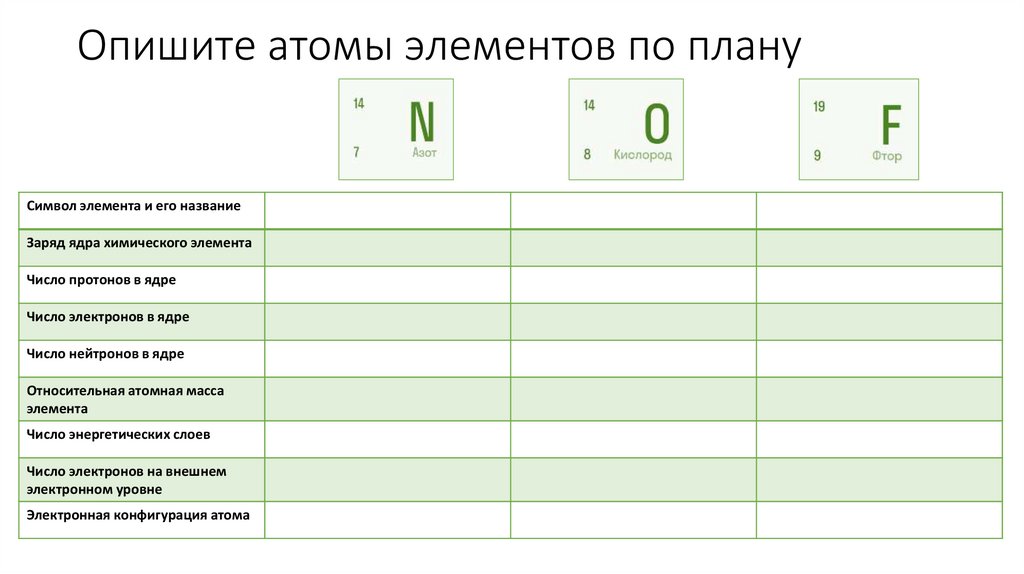
23. Опишите атомы элементов по плану
Символ элемента и его названиеЗаряд ядра химического элемента
Число протонов в ядре
Число электронов в ядре
Число нейтронов в ядре
Относительная атомная масса
элемента
Число энергетических слоев
Число электронов на внешнем
электронном уровне
Электронная конфигурация атома
24. Задание для самостоятельной работы
Составьте электронные и графические конфигурации атомов иопишите их












 chemistry
chemistry








