Similar presentations:
Кристаллические решётки
1. Кристаллические решётки и их виды
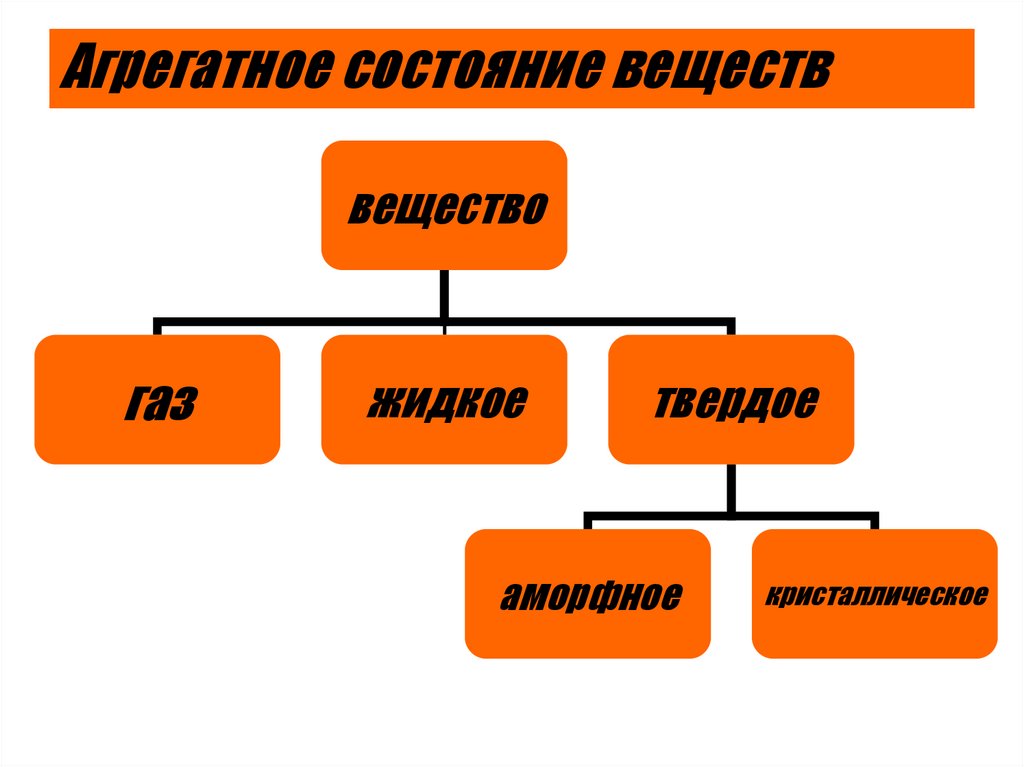
2. Агрегатное состояние веществ
веществогаз
жидкое
твердое
аморфное
кристаллическое
3.
Вещества в твердом состоянии, как правило, имеюткристаллическое строение, для которого характерно
определенное расположение частиц в пространстве
относительно друг друга.
Кристаллические структуры достаточно часто
встречаются в природе. Так, многие вещества
образуют кристаллогидраты, включающие в свой
состав молекулы воды.
Медный купорос
CuSO4
Каменная соль
NaCl
Сульфат никеля
NiSO4
4.
Кристаллы – твердые вещества, частицыкоторых образуют периодически
повторяющуюся в пространстве структуру –
кристаллическую решетку.
Кристаллические решётки веществ - это
упорядоченное расположение
частиц(атомов, молекул, ионов) в строго
определённых точках пространства.
Точки размещения частиц называют
узлами кристаллической решётки.
В узлах кристаллической решетки могут
быть молекулы, атомы или ионы.
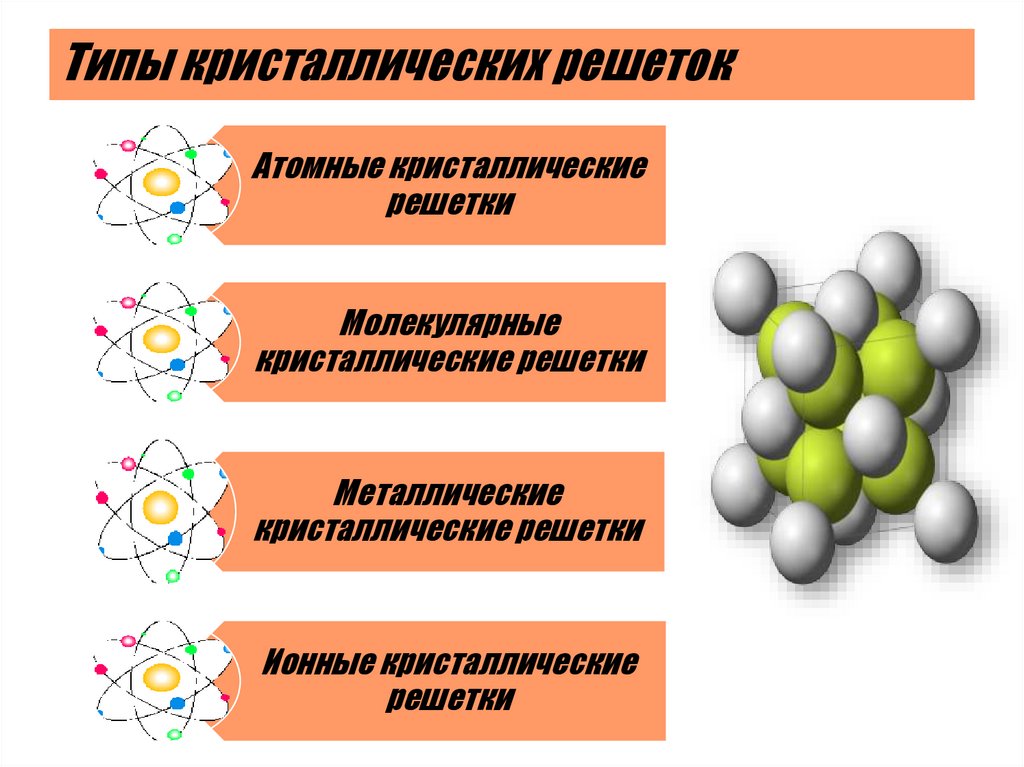
5. Типы кристаллических решеток
Атомные кристаллическиерешетки
Молекулярные
кристаллические решетки
Металлические
кристаллические решетки
Ионные кристаллические
решетки
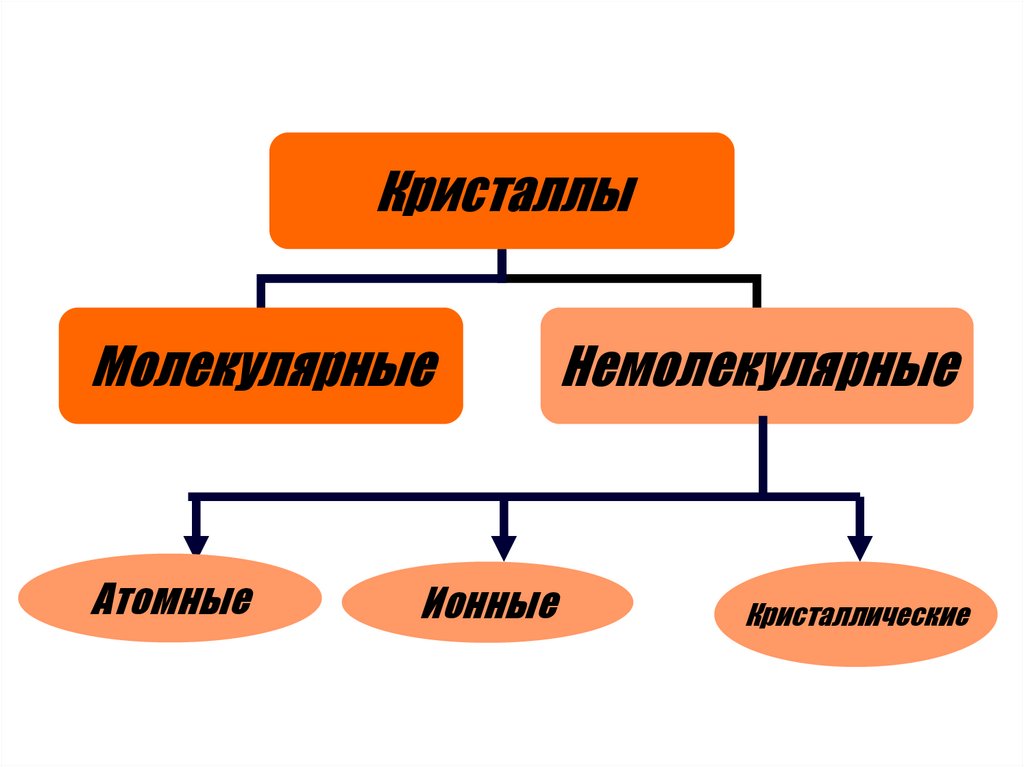
6.
КристаллыМолекулярные
Атомные
Ионные
Немолекулярные
Кристаллические
7.
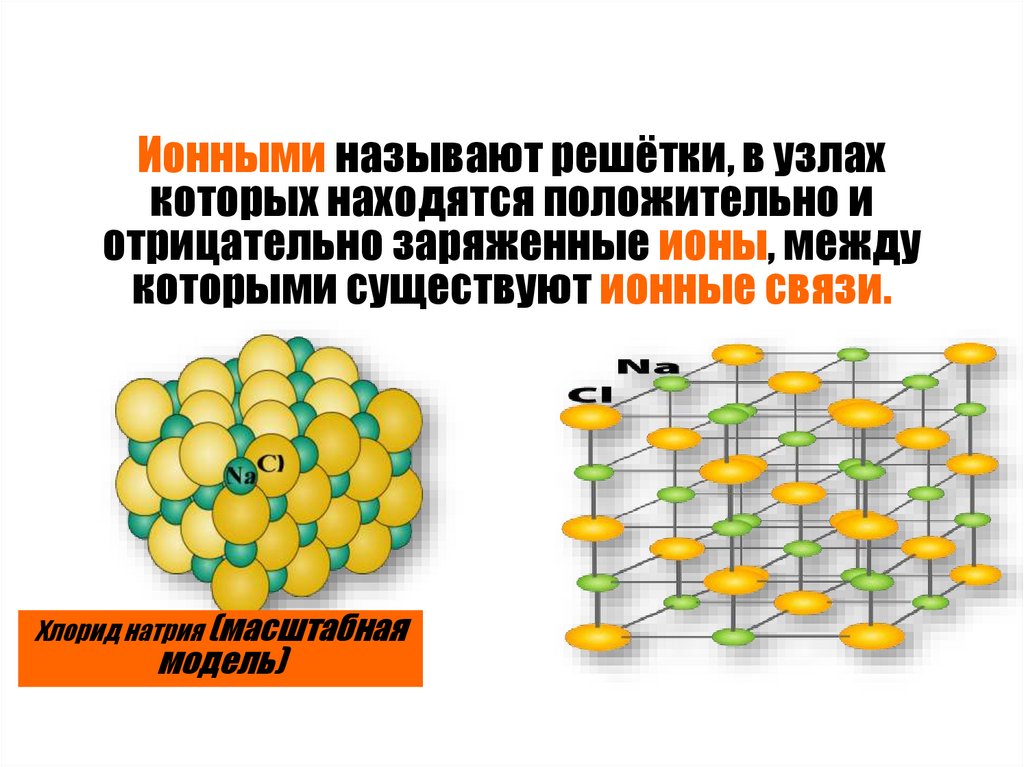
Ионными называют решётки, в узлахкоторых находятся положительно и
отрицательно заряженные ионы, между
которыми существуют ионные связи.
Хлорид натрия (масштабная
модель)
8.
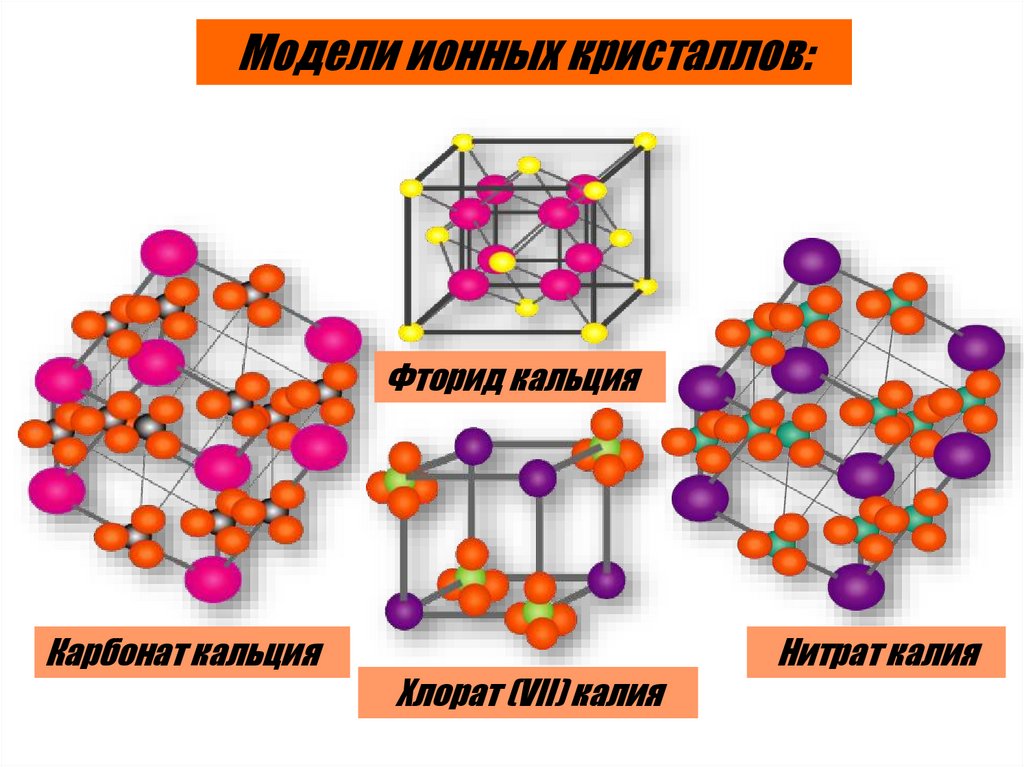
Модели ионных кристаллов:Фторид кальция
Карбонат кальция
Нитрат калия
Хлорат (VII) калия
9.
Физические свойства ионных кристаллическихрешеток
Ионные кристаллы с ионной связью
(большинство солей) обладают
высокой твёрдостью, и
тугоплавкостью, малолетучи,
растворимы только в полярных
растворителях (воде), т. к. силы
притяжения между ионами весьма
значительны.
10. Вещества с ионной кристаллической решеткой
МелПоташ
Каменная
соль
Малахит
11.
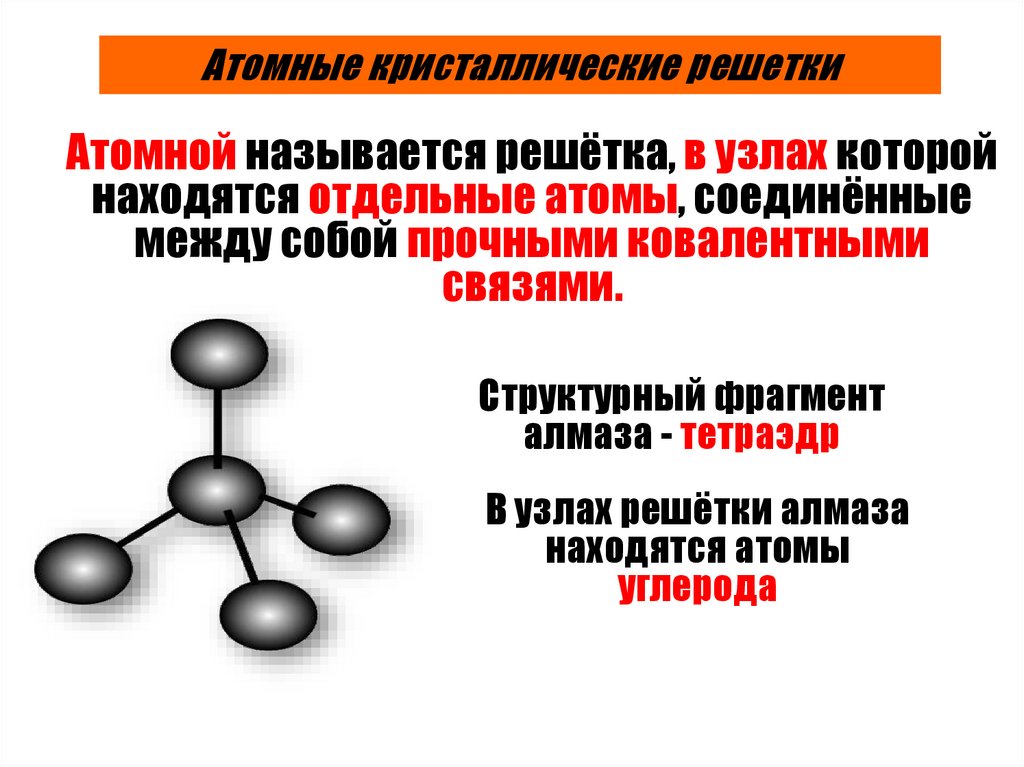
Атомные кристаллические решеткиАтомной называется решётка, в узлах которой
находятся отдельные атомы, соединённые
между собой прочными ковалентными
связями.
Структурный фрагмент
алмаза - тетраэдр
В узлах решётки алмаза
находятся атомы
углерода
12.
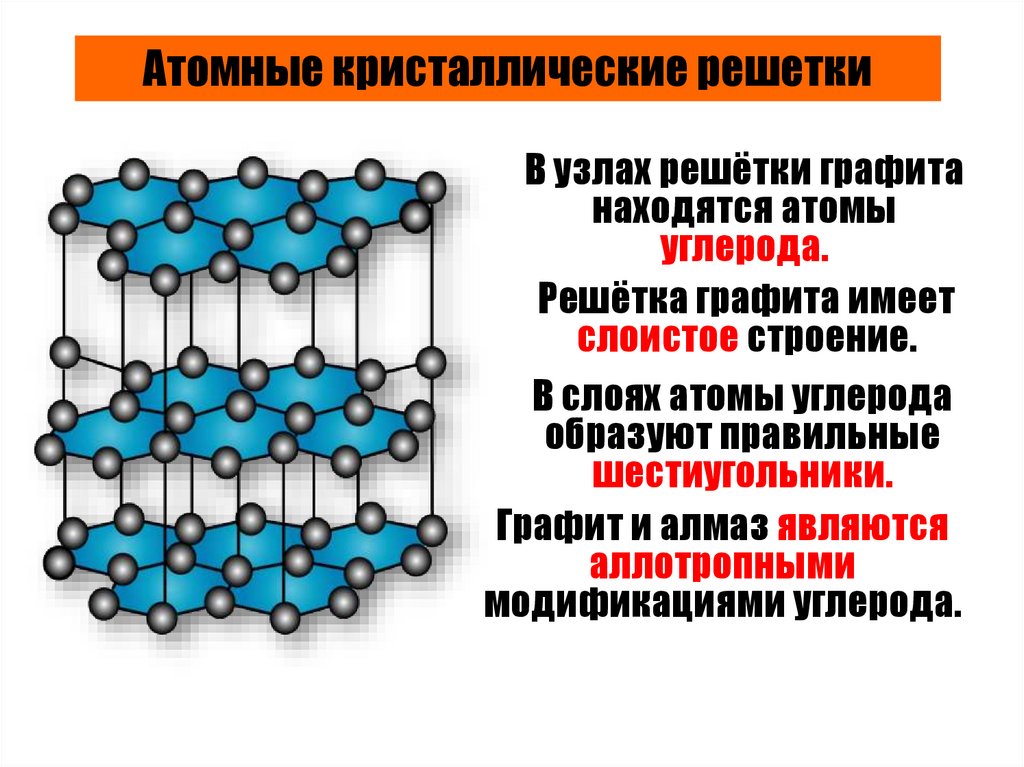
Атомные кристаллические решеткиВ узлах решётки графита
находятся атомы
углерода.
Решётка графита имеет
слоистое строение.
В слоях атомы углерода
образуют правильные
шестиугольники.
Графит и алмаз являются
аллотропными
модификациями углерода.
13.
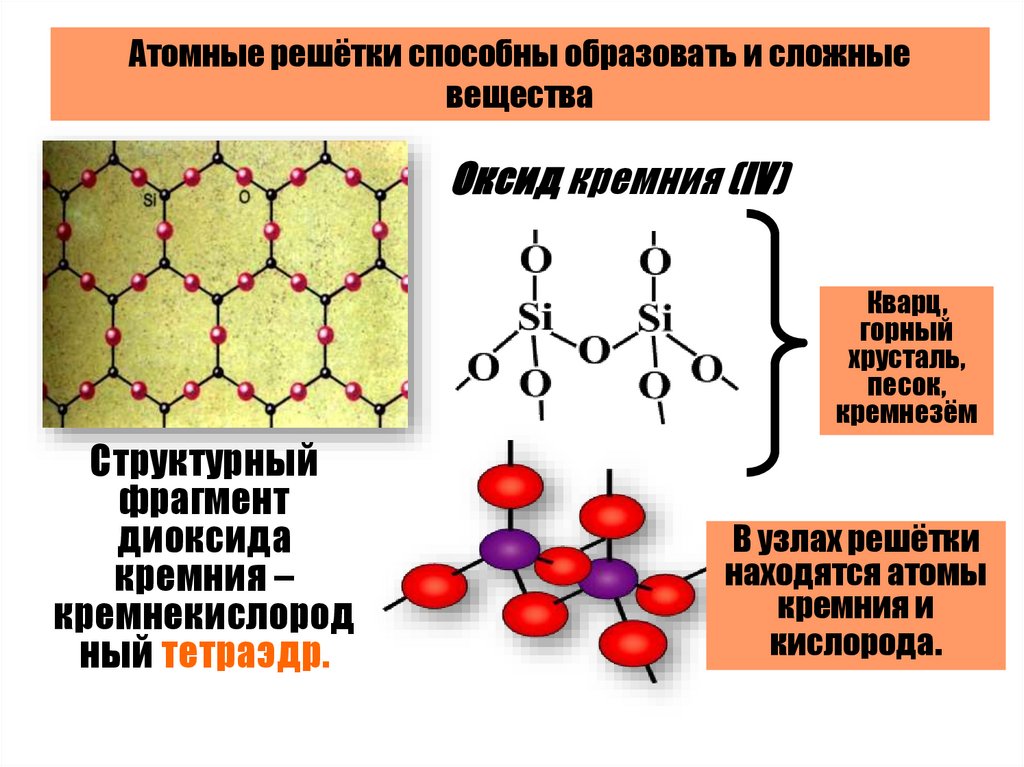
Атомные решётки способны образовать и сложныевещества
Оксид кремния (IV)
Кварц,
горный
хрусталь,
песок,
кремнезём
Структурный
фрагмент
диоксида
кремния –
кремнекислород
ный тетраэдр.
В узлах решётки
находятся атомы
кремния и
кислорода.
14.
Физические свойства атомных кристаллическихрешеток
Атомные кристаллы (алмаз, кремний,
германий, бор, оксид и карбид кремния)
обладают исключительно большой
прочностью и твёрдостью, высокими
температурами плавления, практически
нерастворимы, т. к. между атомами
существуют прочные ковалентные связи.
15. Вещества с атомной кристаллической решеткой
Сложные:Простые:
Графит
Кварц SiO2
Алмаз
Кремний
Карборунд SiC
16.
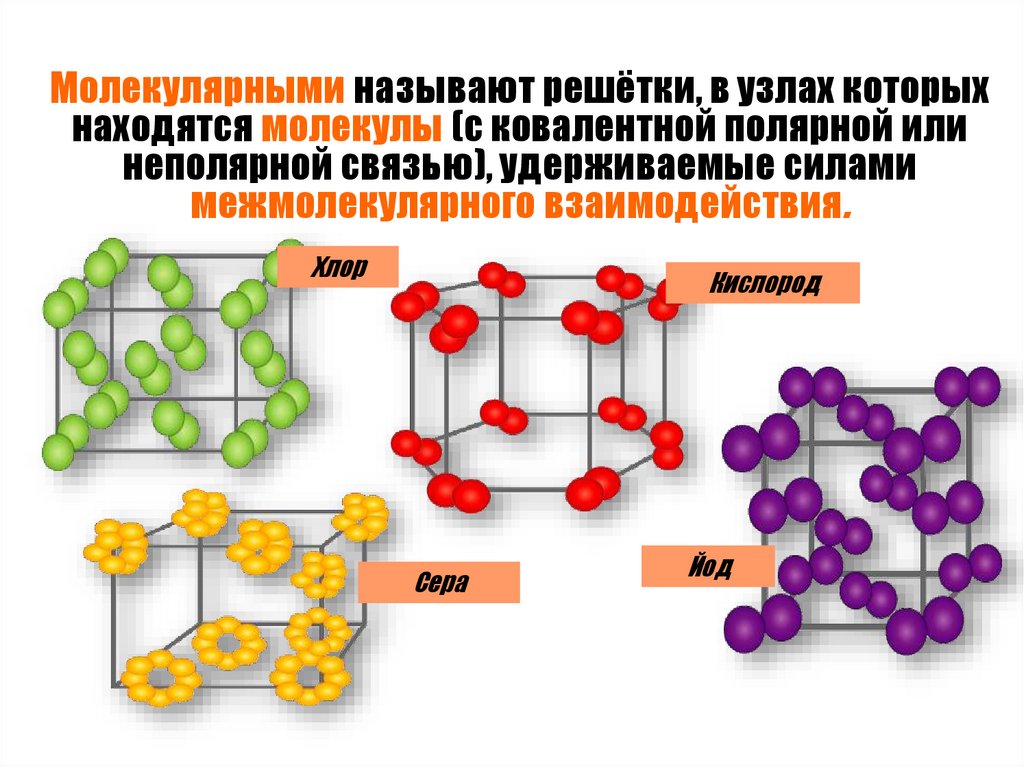
Молекулярными называют решётки, в узлах которыхнаходятся молекулы (с ковалентной полярной или
неполярной связью), удерживаемые силами
межмолекулярного взаимодействия.
Хлор
Кислород
Сера
Йод
17.
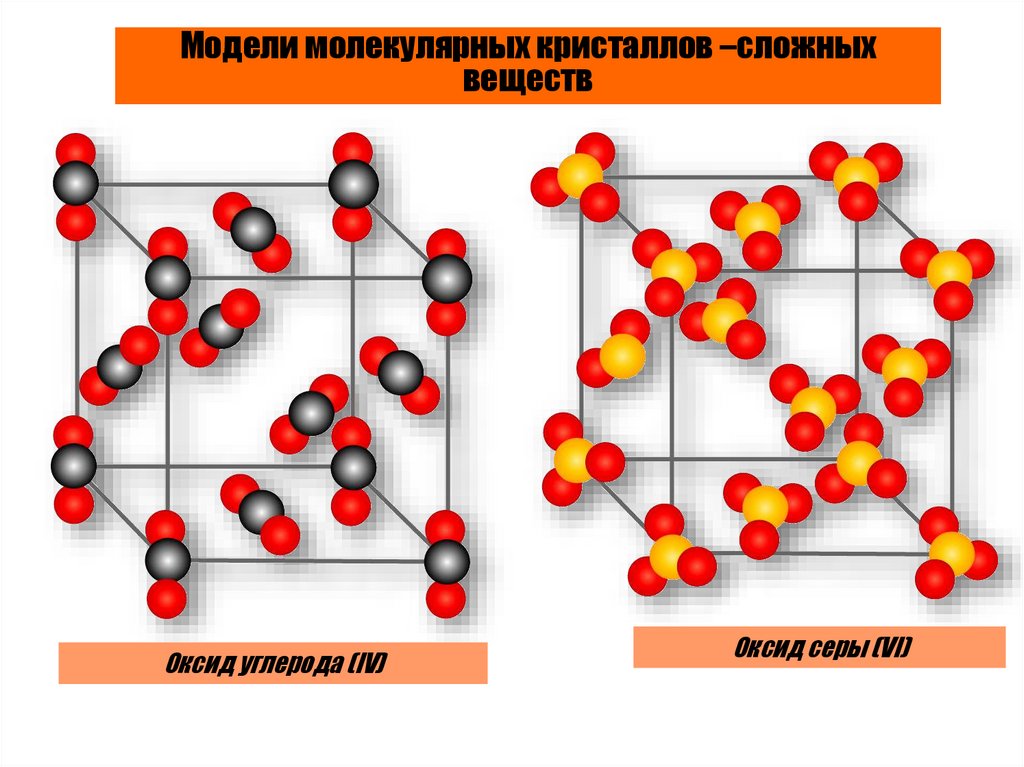
Модели молекулярных кристаллов –сложныхвеществ
Оксид углерода (IV)
Оксид cеры (VI)
18.
Физические свойства молекулярныхкристаллических решеток
Молекулярные кристаллы с
неполярной связью (водород, сера,
фосфор и др.) обладают весьма
низкими температурами плавления,
многие вещества летучи, т. к. связь
между атомами слабая
межмолекулярная.
19. Вещества с молекулярной кристаллической решеткой
Простые:Сложные:
Йод
Неорганические:
Вода
Бром
Органические:
Сахароза
20.
Металлическими называют решётки, в узлахкоторых находятся отдельные атомы или
ионы металлов, которые связаны между собой
металлической связью - за счёт
обобществлённых электронов
Для металлов характерны:
металлический блеск;
ковкость;
пластичность;
теплопроводность;
электрическая
проводимость.
21.
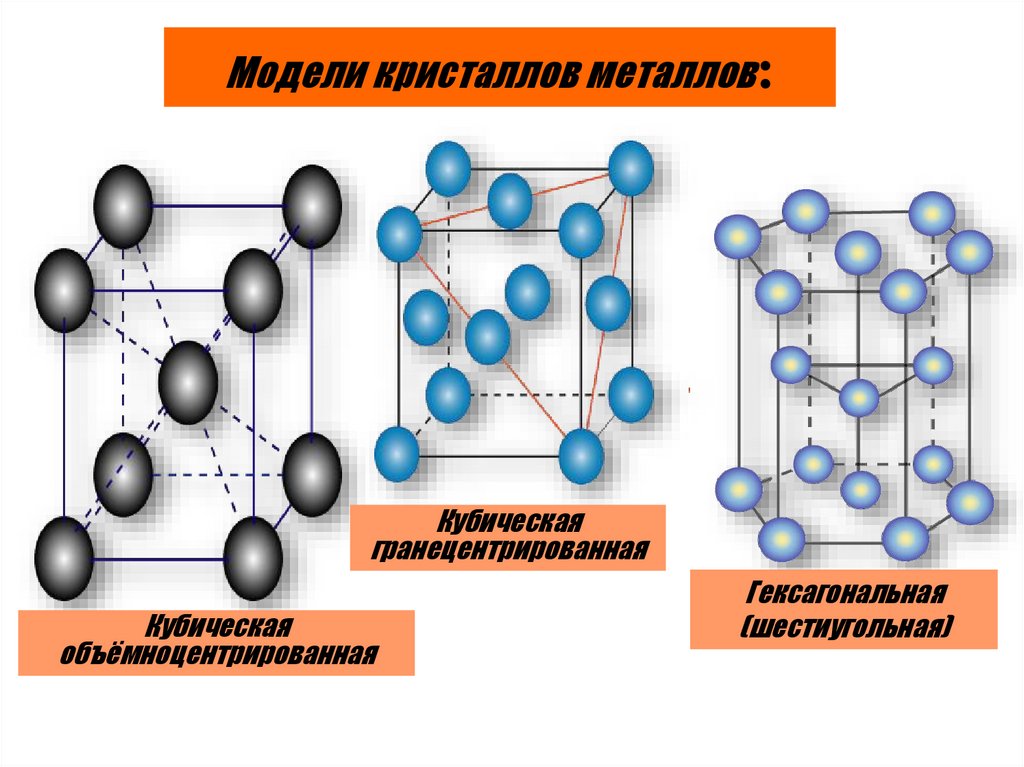
Модели кристаллов металлов:Кубическая
гранецентрированная
Кубическая
объёмноцентрированная
Гексагональная
(шестиугольная)
22. Вещества с металлической кристаллической решеткой
МагнийМедь
Алюминий
Золото
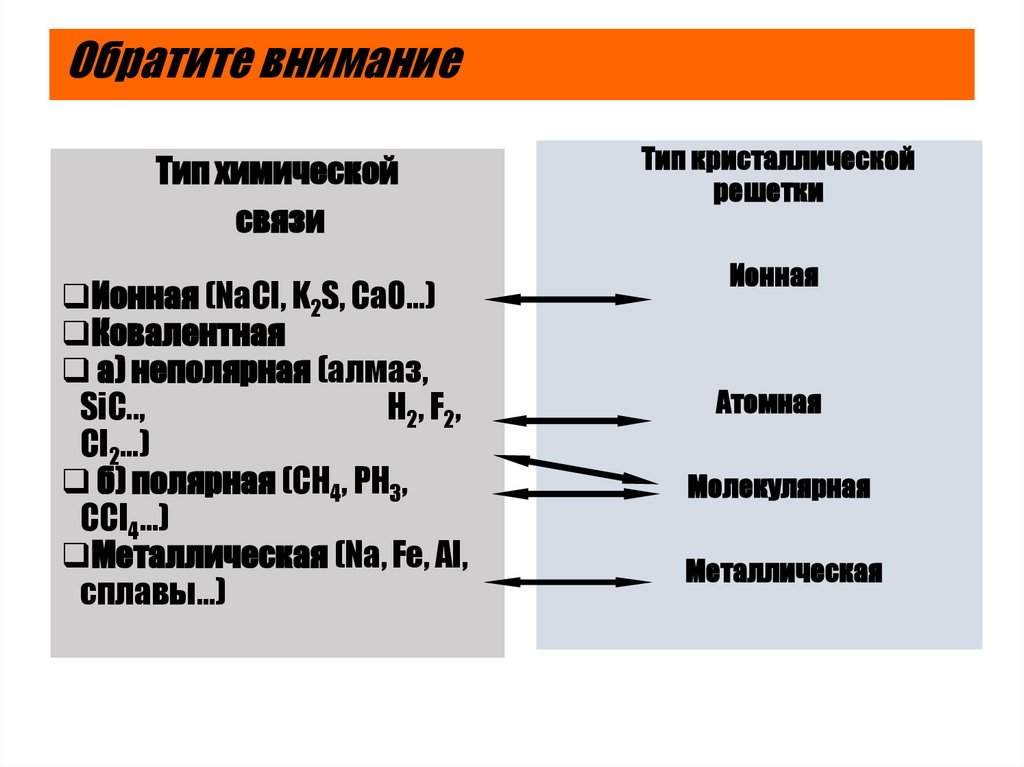
23. Обратите внимание
Тип химическойсвязи
Ионная (NaCI, K2S, CaO…)
Ковалентная
а) неполярная (алмаз,
SiC..,
H2 , F 2 ,
Cl2…)
б) полярная (CH4, PH3,
CCI4…)
Металлическая (Na, Fe, Al,
сплавы…)
Тип кристаллической
решетки
Ионная
Атомная
Молекулярная
Металлическая
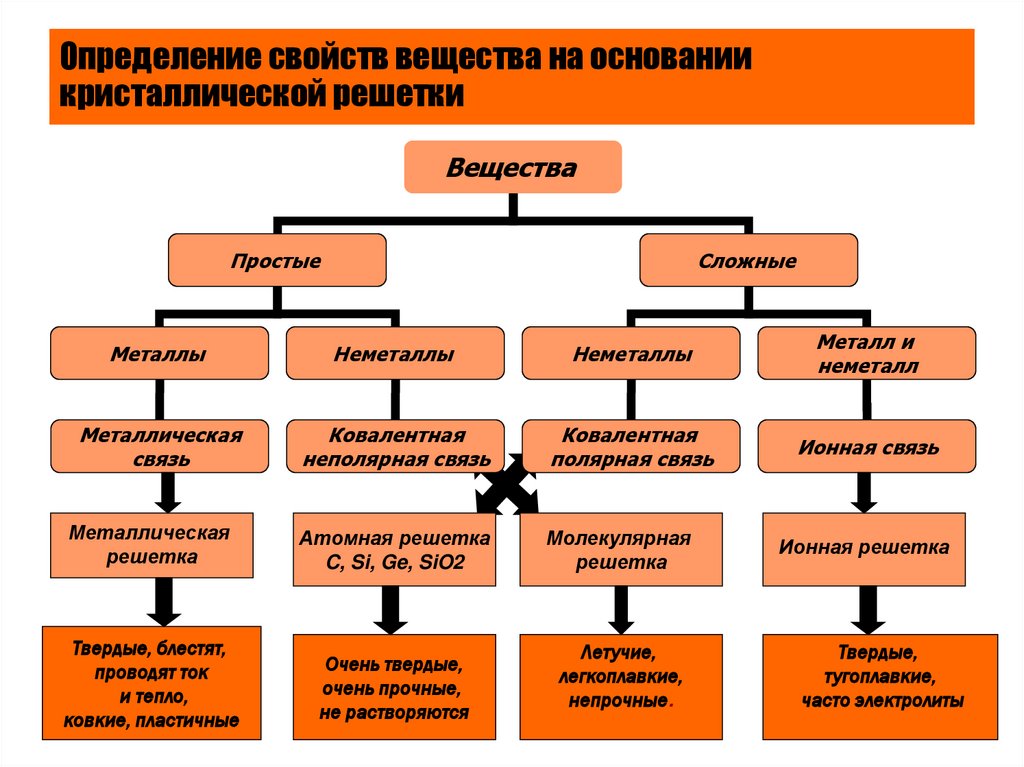
24. Определение свойств вещества на основании кристаллической решетки
ВеществаПростые
Сложные
Металлы
Неметаллы
Неметаллы
Металл и
неметалл
Металлическая
связь
Ковалентная
неполярная связь
Ковалентная
полярная связь
Ионная связь
Металлическая
решетка
Атомная решетка
C, Si, Ge, SiO2
Молекулярная
решетка
Ионная решетка
Твердые, блестят,
проводят ток
и тепло,
ковкие, пластичные
Очень твердые,
очень прочные,
не растворяются
Летучие,
легкоплавкие,
непрочные.
Твердые,
тугоплавкие,
часто электролиты
25.
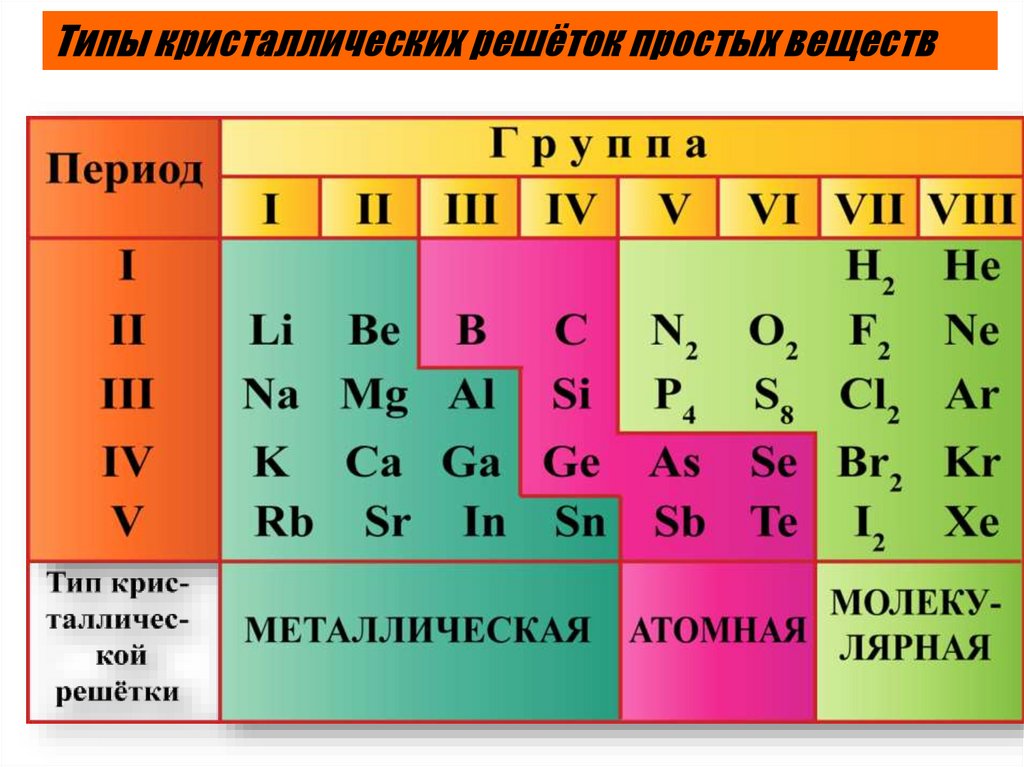
Типы кристаллических решёток простых веществ26.
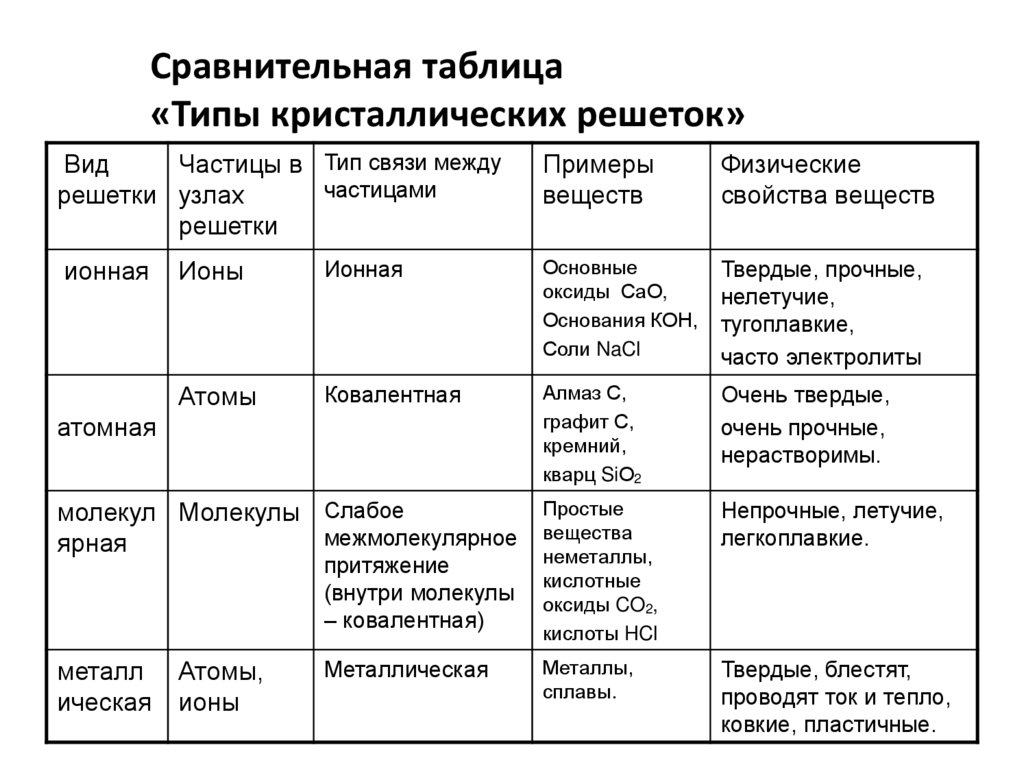
Сравнительная таблица«Типы кристаллических решеток»
Вид
Частицы в Тип связи между
частицами
решетки узлах
решетки
ионная
Физические
свойства веществ
Ионы
Ионная
Основные
оксиды СаО,
Основания КОН,
Соли NaCl
Твердые, прочные,
нелетучие,
тугоплавкие,
часто электролиты
Атомы
Ковалентная
Алмаз С,
графит С,
кремний,
кварц SiО2
Очень твердые,
очень прочные,
нерастворимы.
Простые
вещества
неметаллы,
кислотные
оксиды CO2,
кислоты HCl
Непрочные, летучие,
легкоплавкие.
Металлы,
сплавы.
Твердые, блестят,
проводят ток и тепло,
ковкие, пластичные.
атомная
молекул Молекулы Слабое
межмолекулярное
ярная
притяжение
(внутри молекулы
– ковалентная)
металл
ическая
Примеры
веществ
Атомы,
ионы
Металлическая











 chemistry
chemistry








