Similar presentations:
Тема 1.2_Периодическая система элементов Д.И. Менделеева+практ.задания
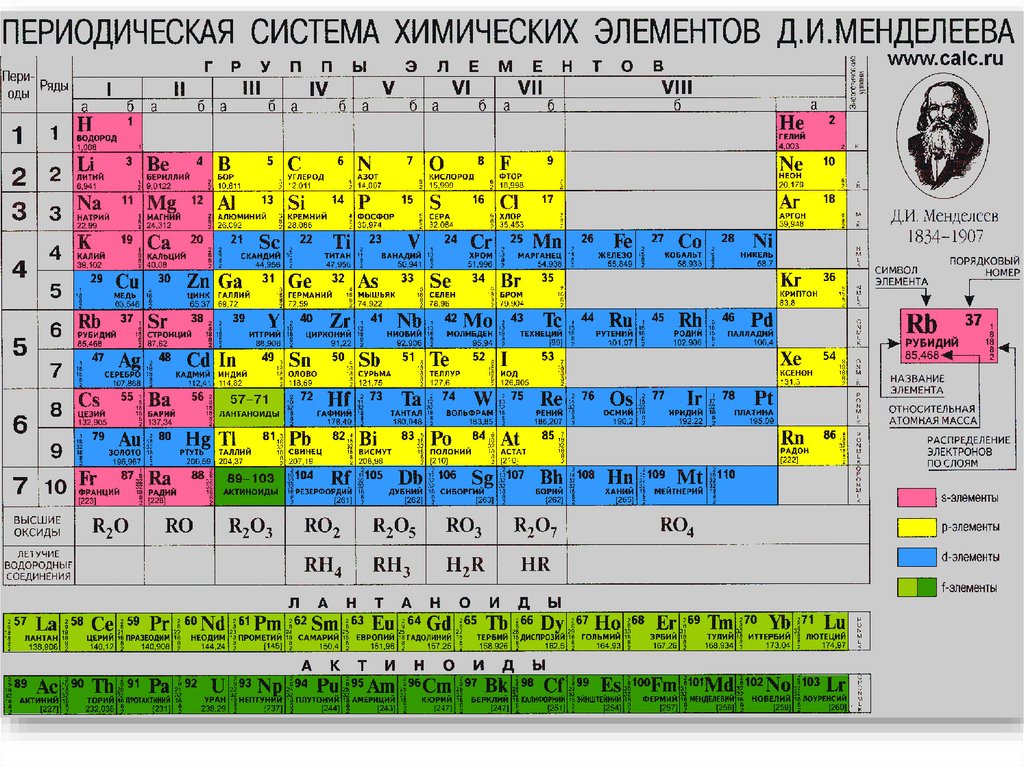
1. Периодическая система химических элементов Д.И. Менделеева
2.
Периодический законД.И. Менделеева (современная
трактовка)
Свойства химических элементов и
образуемых ими соединений
находятся в периодической
зависимости от величины заряда их
атомных ядер
3.
Открытый Д. И. Менделеевым закон ипостроенная на основе закона периодическая
система элементов - это важнейшее
достижение химической науки.
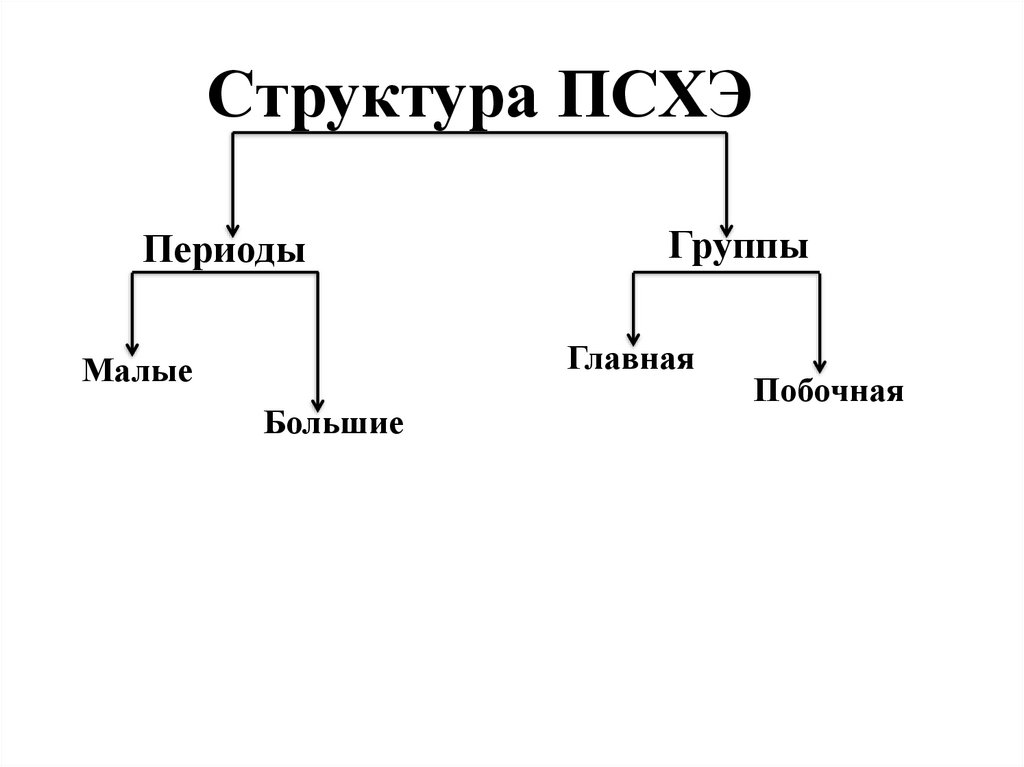
4. Структура ПСХЭ
ПериодыГруппы
Главная
Малые
Большие
Побочная
5.
Периодическая таблица химических элементовПериоды - горизонтальные ряды химических
элементов, всего 7 периодов. Периоды делятся на малые
(I,II,III) и большие (IV,V,VI), VII-незаконченный.
Каждый период (за исключением первого)
начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и
заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn),
которому предшествует типичный неметалл.
6.
Периодическая таблицахимических элементов
Группы
вертикальные
столбцы элементов с одинаковым
числом электронов на внешнем
электронном уровне, равным
номеру группы.
Различают главные (А) и
побочные подгруппы (Б).
Главные подгруппы состоят
из элементов малых и больших
периодов. Побочные
подгруппы состоят из элементов
только больших периодов.
7.
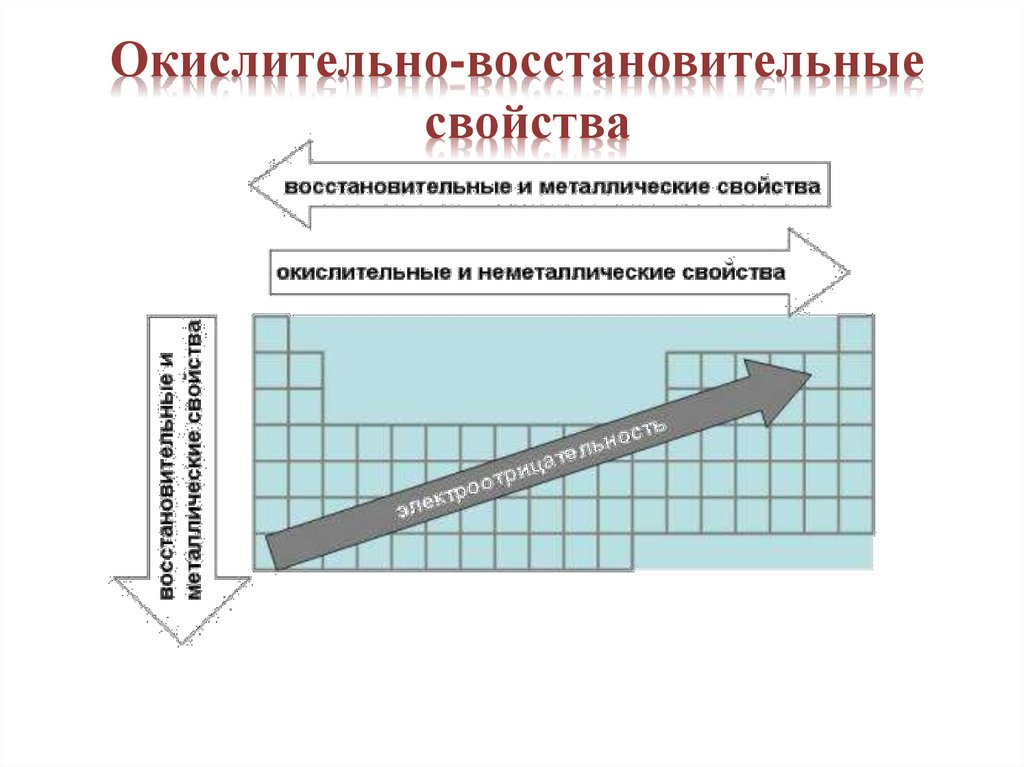
В периодах СЛЕВА НАПРАВОметаллические свойства ослабевают, а
неметаллические усиливаются.
• увеличиваются заряды атомных ядер;
• растет число электронов на внешнем
уровне;
• число энергетических уровней постоянно;
• радиус атома уменьшается;
• электроотрицательность увеличивается
8.
В группах главных • увеличиваются зарядыподгрупп
атомных ядер;
СВЕРХУ ВНИЗ • число электронов на
внешнем уровне
металлические
свойства элементов постоянно;
• растет число
усиливаются, а
энергетических уровней;
неметаллические • увеличивается радиус
ослабевают.
атома;
• электроотрицательность
уменьшается
9.
Окислительно-восстановительныесвойства
10.
Изменение радиуса атома в периодеРадиус атома с увеличением зарядов ядер атомов в
периоде уменьшается, т.к. притяжение ядром электронных
оболочек усиливается. В начале периода расположены
элементы с небольшим числом электронов на внешнем
электронном слое и большим радиусом атома. Электроны,
находящиеся дальше от ядра, легко от него отрываются, что
характерно для элементов-металлов
11.
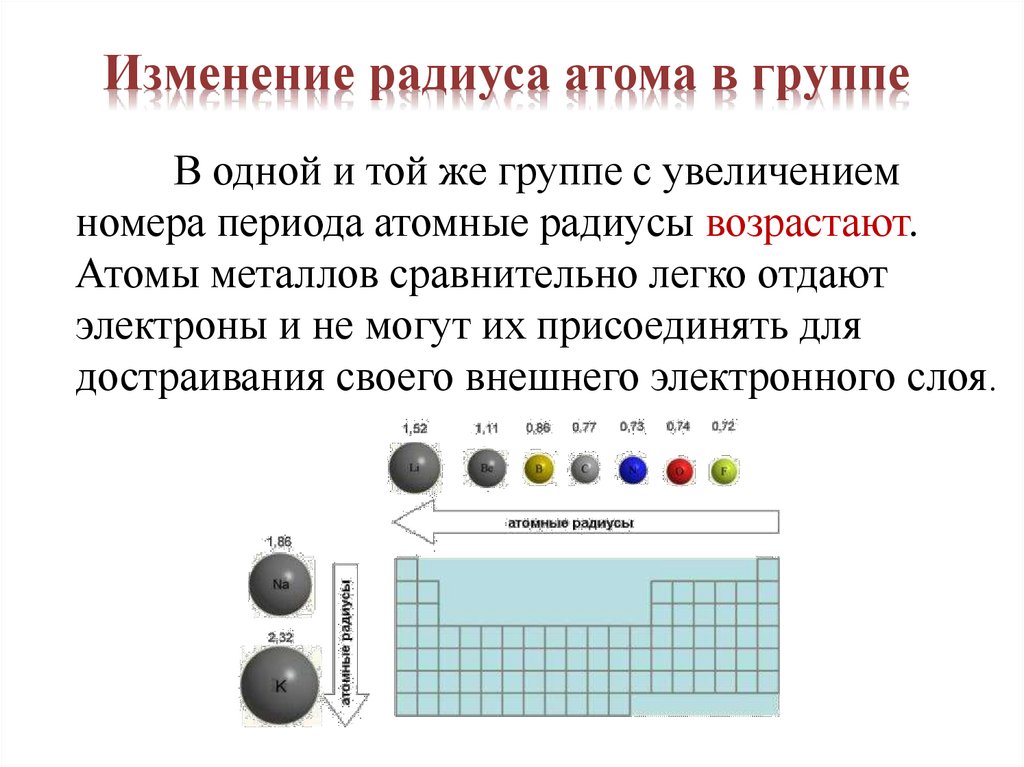
Изменение радиуса атома в группеВ одной и той же группе с увеличением
номера периода атомные радиусы возрастают.
Атомы металлов сравнительно легко отдают
электроны и не могут их присоединять для
достраивания своего внешнего электронного слоя.
12. План характеристики элементов по ПСХЭ
1. Порядковый номер элемента (Z), относительная атомная масса (Ar),
химический знак
2.Строение атома (заряд ядра, количество протонов, нейтронов, электронов).
3. Распределение электронов по энергетическим уровням, электронная
формула, электронно-графическая схема последнего энергетического уровня.
4. Положение элемента в ПС (период, группа, подгруппа), семейство элемента (s,
p, d, f).
5.Характер элемента (металл, неметалл, переходный).
6.Формула высшего оксида, название, его характер.
7.Формула гидроксида (основания или кислоты), название, его характер.
8.Состав летучего водородного соединения (для неметаллов главных подгрупп),
название, характер.
13. Практические задания
• Задание 1.• Напишите химические уравнения металлов: а)
Реакция натрия с хлором. б) Реакция магния с
кислородом. в) Реакция алюминия с серой.
• Задание 2. Вставьте пропуски: Металлы находятся
в левой части Периодической системы, и их
атомы имеют _______________ заряд, что
позволяет им ______________ электроны.
14. Практические задания
• 3. Для элемента серы справедливо следующееутверждение:
• 1) простое вещество — металл, формула
водородного соединения — Н3S, формула высшего
оксида — S2O3
2) простое вещество — неметалл, формула высшего
оксида — SO2, формула водородного соединения —
НS
3) простое вещество — неметалл, формула высшего
оксида — SO3, формула водородного соединения —
Н2S
4) высший оксид проявляет основные свойства
15. Практические задания
• 4. В ряду Si → P → S → Cl металлическиесвойства:
• 1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
16. Практические задания
• 5. Даны элементы N, P, As, S. На основанииположения в таблице Д.И. Менделеева
выберите лишний элемент.
• 1) N
2) P
3) As
4) S
17. Практические задания
• 6. Какая масса оксида алюминия образуетсяпри разложении 15,6 г гидроксида
алюминия.
• 7. Какая масса сульфата натрия образуется
при взаимодействии 20 г гидроксида
натрия с достаточным количеством
раствора серной кислоты?













 chemistry
chemistry








