Similar presentations:
25. Фосфор и его соединения
1.
Фосфор иего соединения
2.
Строение атома фосфораФосфор – элемент VA группы.
Степени окисления от -3 до +5
+15
Радиус Р > радиуса N
2
8
5
ЭО Р < ЭО N
3.
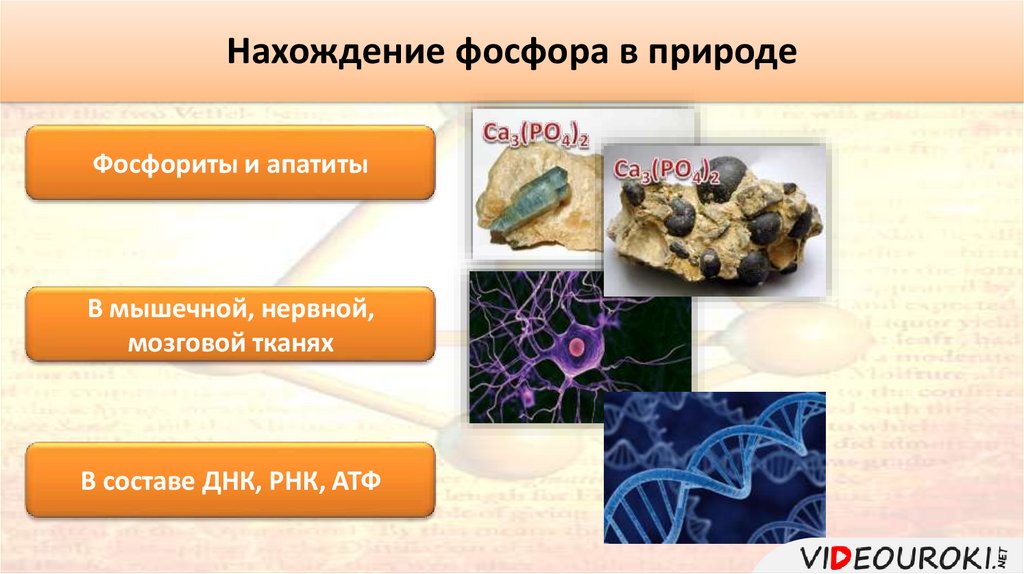
Нахождение фосфора в природеФосфориты и апатиты
В мышечной, нервной,
мозговой тканях
В составе ДНК, РНК, АТФ
4.
Открытие фосфораФосфор был открыт немецким
алхимиком Г. Брандом в 1669 году.
От греческого «фосфор» –
«светоносный».
5.
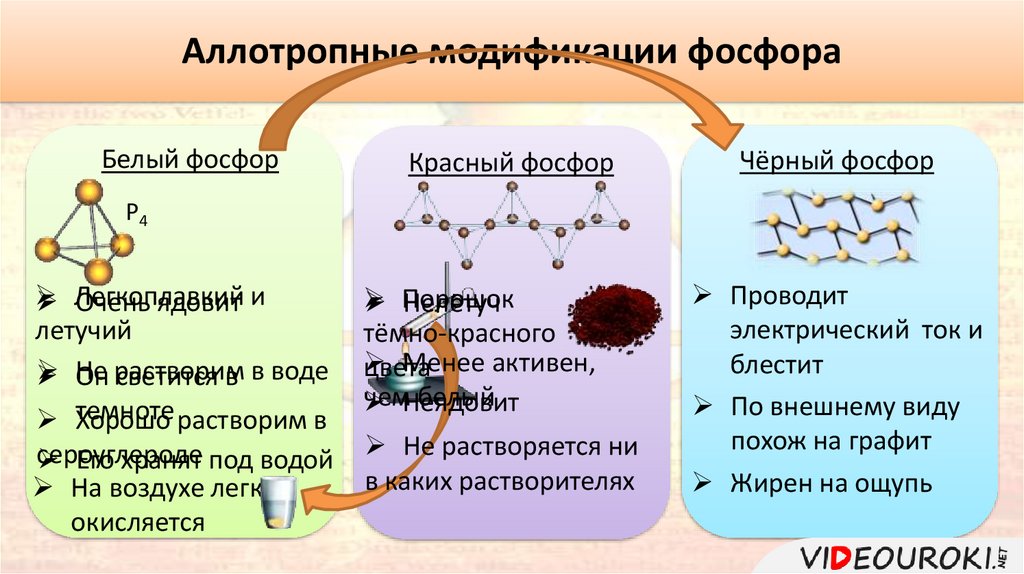
Аллотропные модификации фосфораБелый фосфор
Красный фосфор
Чёрный фосфор
Р4
Легкоплавкий
Очень ядовит и
летучий
Он
Не растворим
светится в в воде
темноте
Хорошо растворим в
сероуглероде
Его хранят под водой
На воздухе легко
окисляется
Порошок
Нелетуч
тёмно-красного
Менее активен,
цвета
чем
белый
Неядовит
Не растворяется ни
в каких растворителях
Проводит
электрический ток и
блестит
По внешнему виду
похож на графит
Жирен на ощупь
6.
Химические свойства фосфораРеакция с кислородом
0
+5-2
0
Восстановительные
4P
+ 5O2 = 2P2O5 свойства
Восст-ль Ок-ль
Реакции с металлами
оксид
фосфора (V)
0
0 t +2 -3
Окислительные
3Ca
+ 2P = Ca3Pсвойства
2
6ē
фосфид
Восст-ль Ок-ль кальция
7.
Водородное соединение фосфораФосфин – PH3
Ca3P2 + 6HCl = 3CaCl2 + 2PH3↑
Ядовитый газ с неприятным запахом.
Легко воспламеняется на воздухе.
8.
9.
Применение фосфора10.
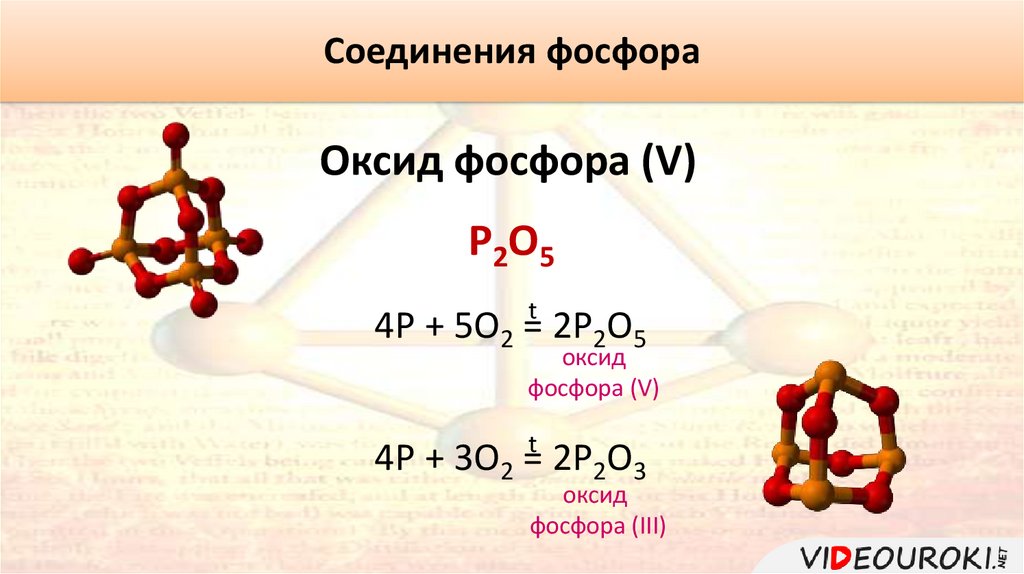
Соединения фосфораОксид фосфора (V)
P2O5
4P + 5O2 =t 2P2O5
оксид
фосфора (V)
4P + 3O2 =t 2P2O3
оксид
фосфора (III)
11.
Соединения фосфораОксид фосфора (V) представляет собой белый порошок.
Он энергично поглощает пары воды из воздуха и постепенно
превращается в прозрачную расплывшуюся массу.
Он широко используется как осушитель.
Многие органические вещества обугливаются при действии на них
этого оксида, при попадании на кожу он может вызвать сильные
ожоги.
12.
Химические свойства оксида фосфора (V)Реакции с основными
оксидами
P2O5 + 3CaO = Ca3(PO4)2
Реакции со щелочами
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
t
фосфат
кальция
фосфат
натрия
Реакция с водой
P2O5 + 3H2O = 2H3PO4
фосфорная кислота
13.
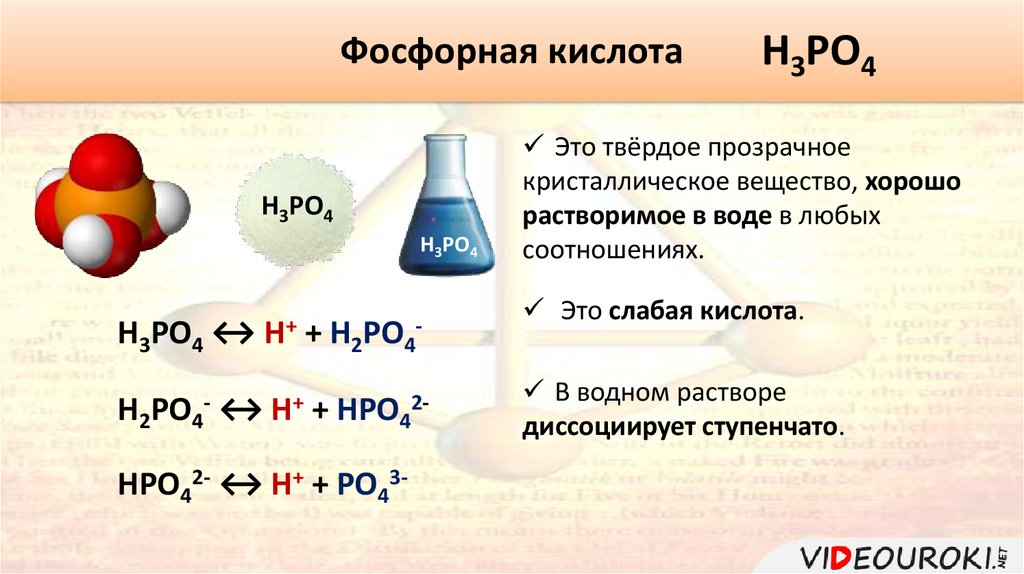
Фосфорная кислотаH3PO4
H3PO4
H3PO4 ↔ H+ + H2PO4-
H2PO4- ↔ H+ + HPO42HPO42- ↔ H+ + PO43-
H3PO4
Это твёрдое прозрачное
кристаллическое вещество, хорошо
растворимое в воде в любых
соотношениях.
Это слабая кислота.
В водном растворе
диссоциирует ступенчато.
14.
Химические свойства фосфорной кислотыРеакции с металлами до
водорода
3Zn + 2H3PO4 = Zn(H2PO4)2 + 3H2↑
Реакции с основными
оксидами
3Li2O + 2H3PO4 = 2Li3PO4 + 3H2O
Реакции с основаниями
3NaOH + H3PO4 = Na3PO4 + 3H2O
дигидрофосфат
цинка
фосфат
лития
фосфат натрия
15.
Соли фосфорной кислотыCa3(PO4)2 – фосфат кальция
средняя соль
CaHPO4 – гидрофосфат кальция
кислая соль
Ca(H2PO4)2 – дигидрофосфат
кислая соль
кальция
Фосфаты всех металлов в
воде нерастворимы
(исключение – фосфаты
щелочных металлов).
Дигидрофосфаты всех
металлов хорошо
растворимы, а
гидрофосфаты занимают
промежуточное
положение.
16.
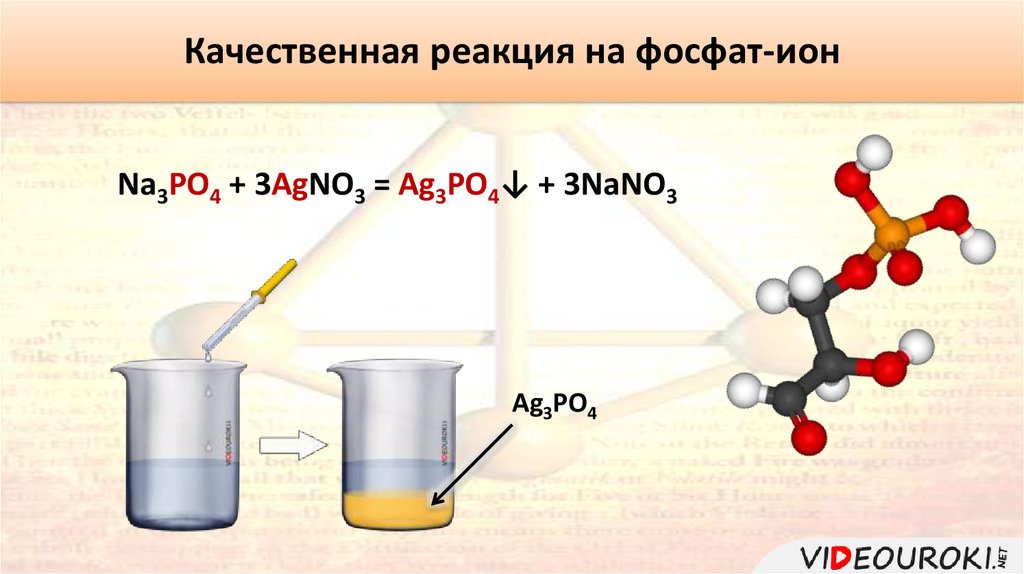
Качественная реакция на фосфат-ионNa3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
Ag3PO4
17.
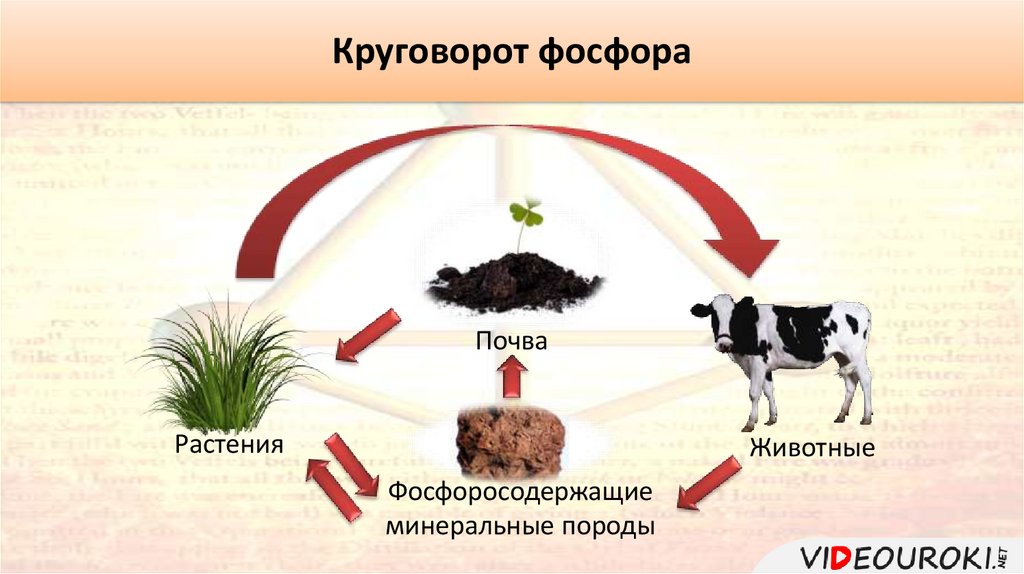
Круговорот фосфораПочва
Растения
Животные
Фосфоросодержащие
минеральные породы
18.
Применение фосфорной кислотыпропитка
катализатор
древесины
кормовые
добавки
напитки
пропитка в медицине
пластмасс
стиральные
пропитка
порошки
тканей
осветление
сахара
фосфорные
удобрения
19.
ВыводыФосфор является элементом VA группы.
На внешнем энергетическом уровне у него 5 электронов.
Для фосфора характерны степени окисления от -3 до +5, но наиболее
типична +5.
В природе фосфор встречается в виде соединений – фосфоритов и
апатитов.
Фосфор образует несколько аллотропных модификаций: белый, красный
и чёрный фосфор.
20.
Наиболее распространёнными соединениями фосфора являются – оксидфосфора (III), оксид фосфора (V), фосфин и фосфорная кислота.
В реакциях с металлами фосфор проявляет окислительные свойства, а в
реакции с кислородом – восстановительные свойства.
Фосфорная кислота – трёхосновная кислота, которая образует три вида
солей: фосфаты, гидрофосфаты и дигидрофосфаты.
Качественной реакцией на фосфат-ион является нитрат серебра (I).
Фосфор и его соединения имеют большое значение в химической
промышленности.














 chemistry
chemistry








