Similar presentations:
Классификация_неорганических_веществ_Лекция_2
1.
Классификация и номенклатуранеорганических веществ
2.
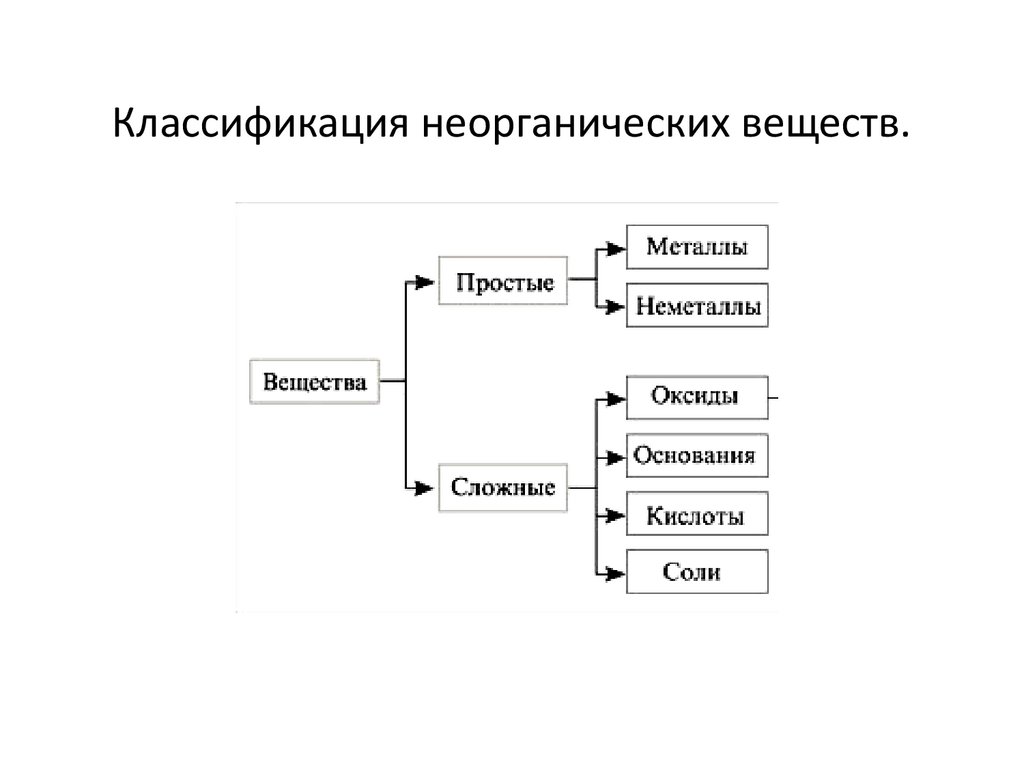
Классификация неорганических веществ.3.
4.
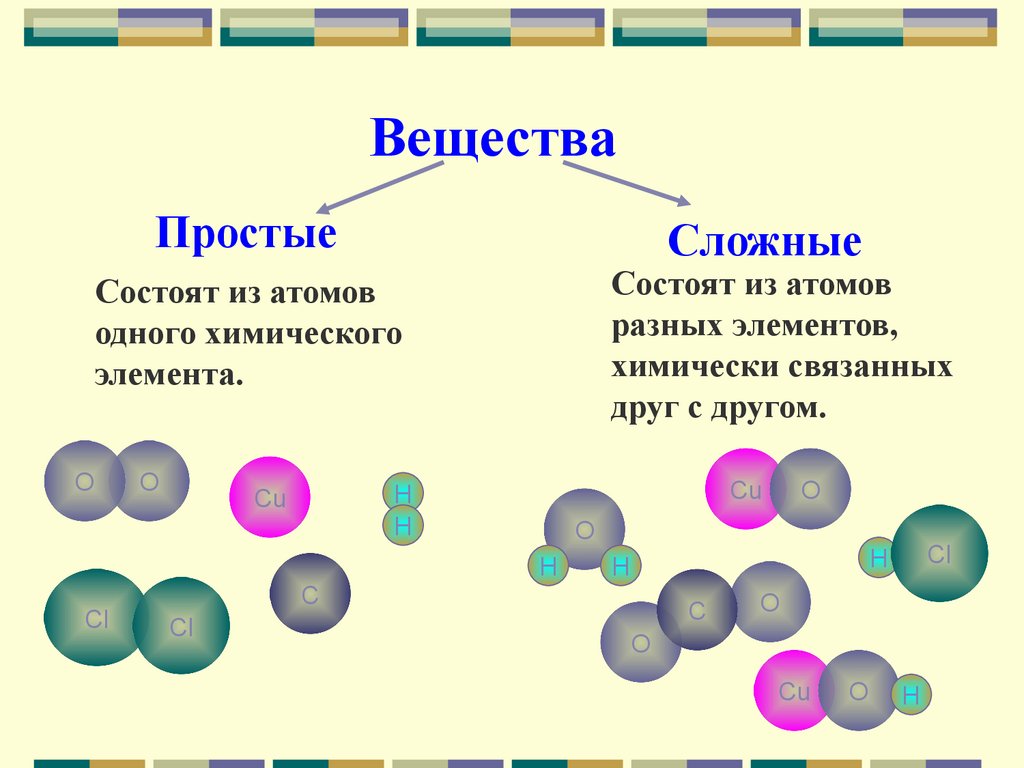
ВеществаПростые
Сложные
Состоят из атомов
разных элементов,
химически связанных
друг с другом.
Состоят из атомов
одного химического
элемента.
О
Cl
О
C
Cl
Cu
Н
Н
Cu
О
О
Н
Cl
Н
Н
C
О
О
Cu
О
Н
5.
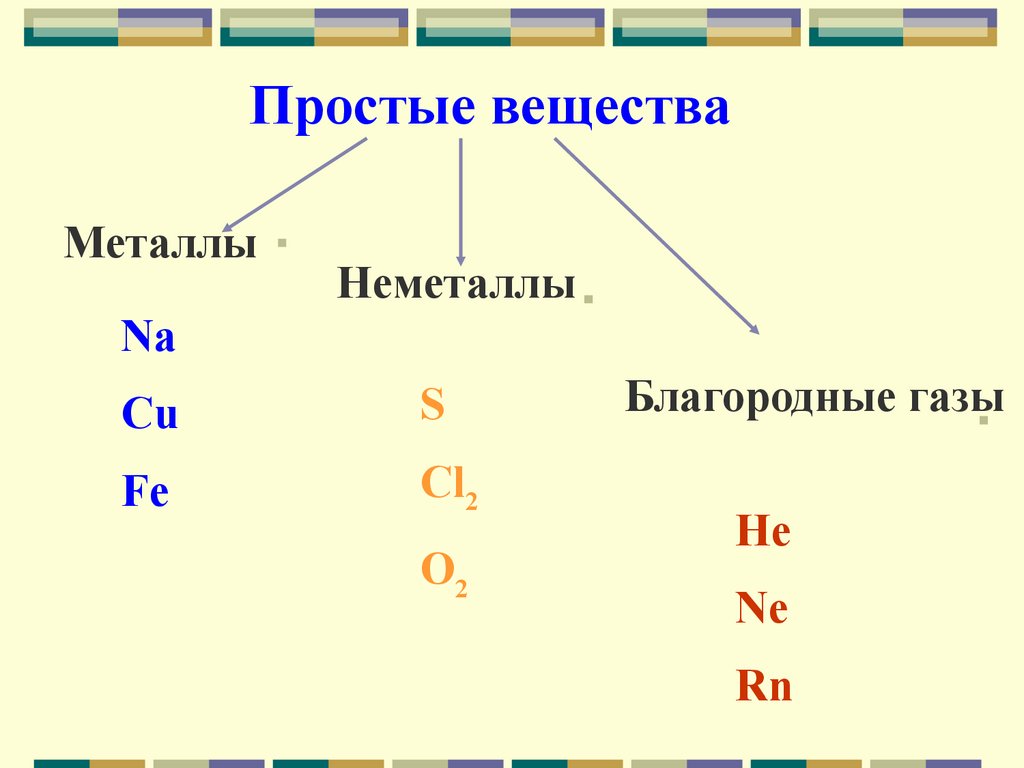
Простые веществаМеталлы
Неметаллы
Na
Cu
S
Fe
Cl2
O2
Благородные газы
He
Ne
Rn
6.
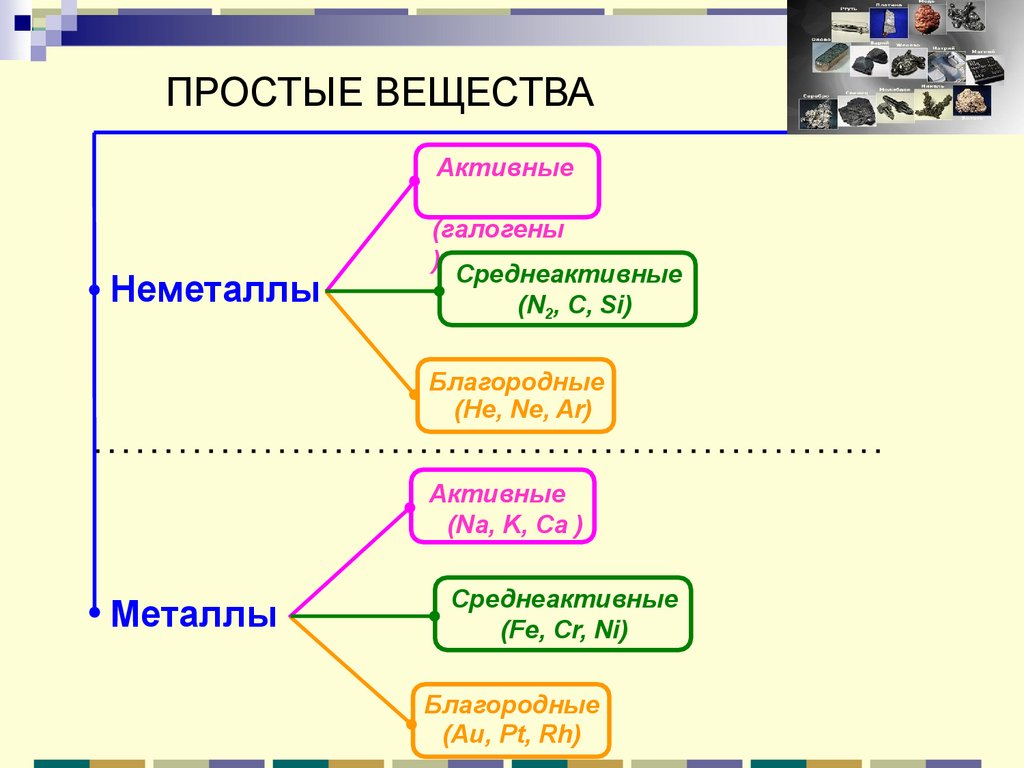
ПРОСТЫЕ ВЕЩЕСТВААктивные
Неметаллы
(галогены
)
Среднеактивные
(N2, С, Si)
Благородные
(He, Ne, Ar)
Активные
(Na, K, Ca )
Металлы
Среднеактивные
(Fe, Cr, Ni)
Благородные
(Au, Pt, Rh)
7.
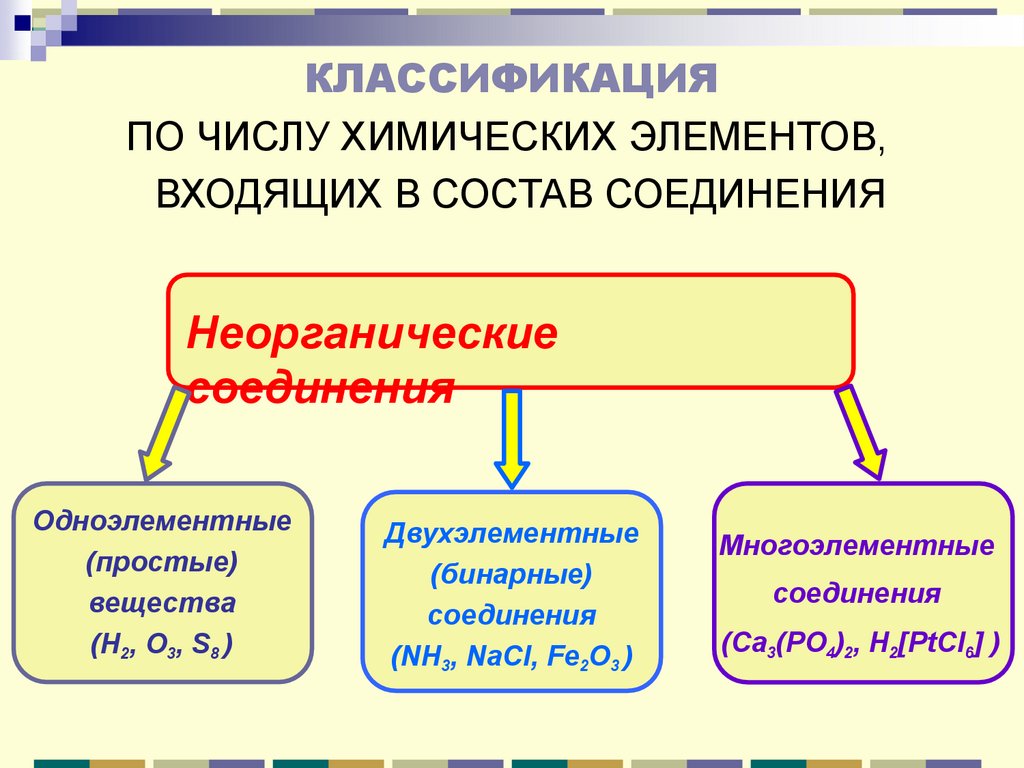
КЛАССИФИКАЦИЯПО ЧИСЛУ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ,
ВХОДЯЩИХ В СОСТАВ СОЕДИНЕНИЯ
Неорганические
соединения
Одноэлементные
(простые)
вещества
(H2, O3, S8 )
Двухэлементные
(бинарные)
соединения
(NH3, NaCl, Fe2O3 )
Многоэлементные
соединения
(Ca3(PO4)2, H2[PtCl6] )
8.
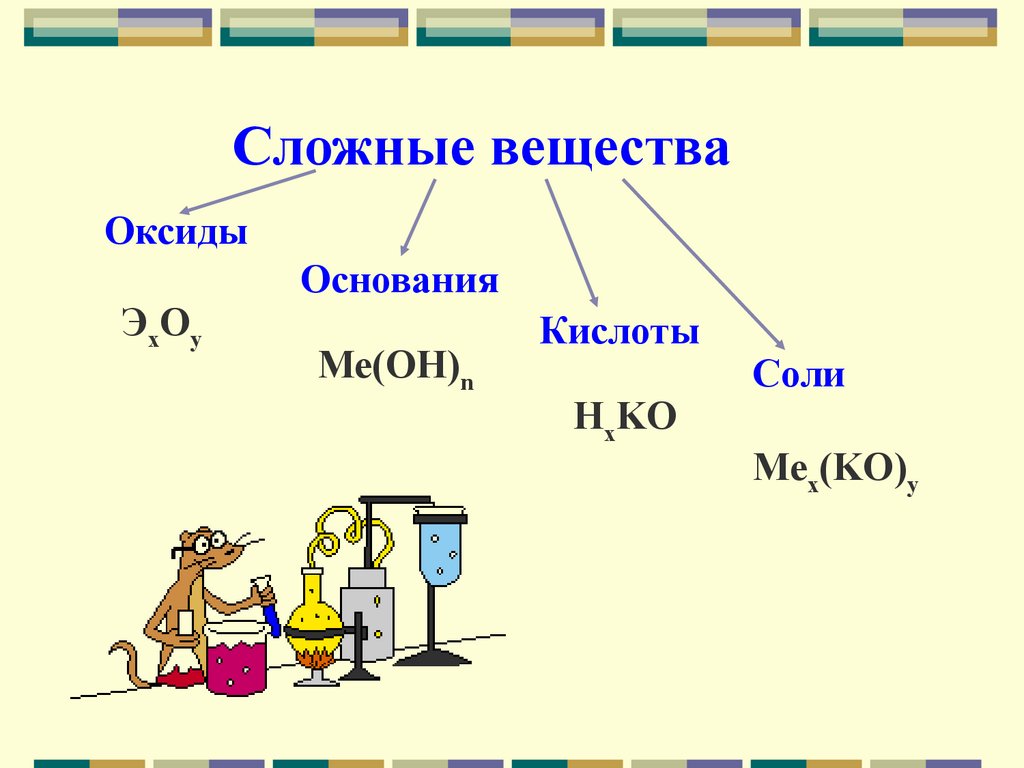
Сложные веществаОксиды
ЭxOy
Основания
Me(OH)n
Кислоты
HxKO
Соли
Mex(KO)y
9.
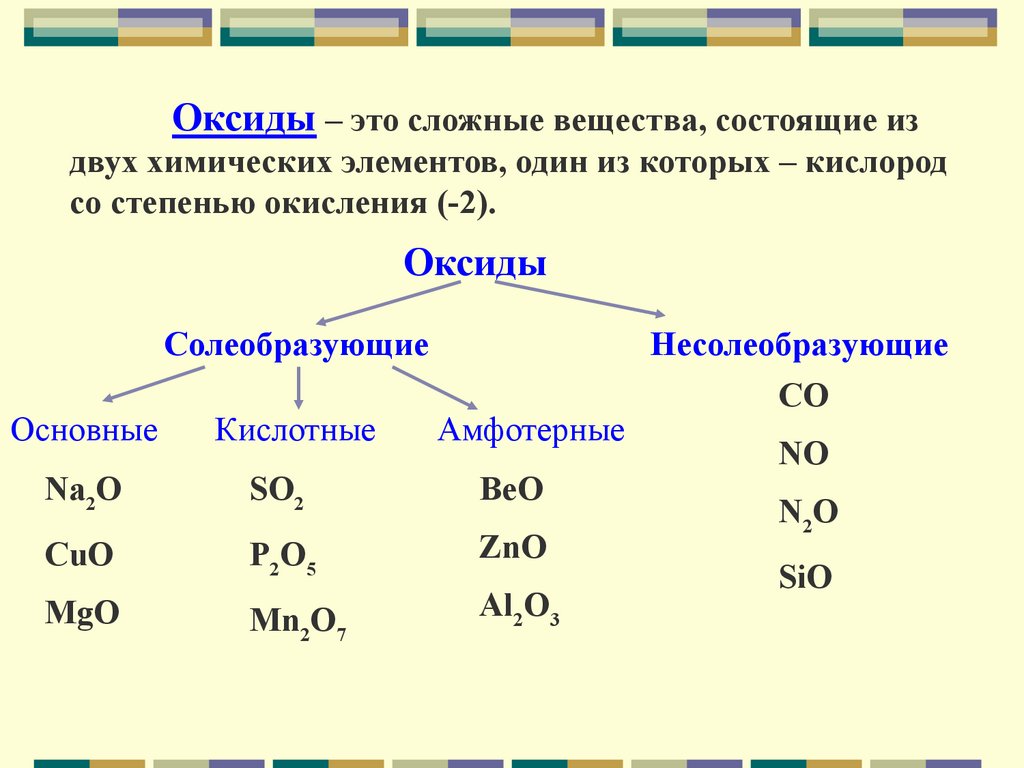
Оксиды – это сложные вещества, состоящие издвух химических элементов, один из которых – кислород
со степенью окисления (-2).
Оксиды
Солеобразующие
Основные
Кислотные
Амфотерные
Na2O
SO2
BeO
CuO
P2O5
ZnO
MgO
Mn2O7
Al2O3
Несолеобразующие
CO
NO
N2O
SiO
10.
ОксидыНесолеобразующие оксиды — оксиды, не
проявляющие ни кислотных, ни основных, ни
амфотерных свойств и не образующие соли
Солеобразующие оксиды – это оксиды,
которые взаимодействуют с кислотами или со
щелочами с образованием соли и воды. Им
соответствуют гидроксиды, содержащие
элемент в той же степени окисления.
11.
Свойства оксидов игидроксидов
• Свойства оксидов и гидроксидов в периоде
изменяются от основных через амфотерные к
кислотным, т.к. увеличивается положительная
степень окисления элементов.
+1
+3
Na2 O, Mg O , Al2 O3
+2
основные
амфотерный
+3
+1
NaOН, Mg+2OН , Al(OН)3
щелочь
Слабое
основание
Амфотерный
гидроксид
• В главных подгруппах основные свойства
оксидов и гидроксидов возрастают сверху
вниз.
12.
Основные оксидыОбщая формула Ме2О, МеО
Физические свойства
• При комнатной температуре основные оксиды твердые,
кристаллические вещества чаще всего нерастворимые в воде;
• Окрашенные в различные цвета, например Cu2O – красного цвета,
СаO – белого.
CaO
CuO
Вa
O
Cu2O
13.
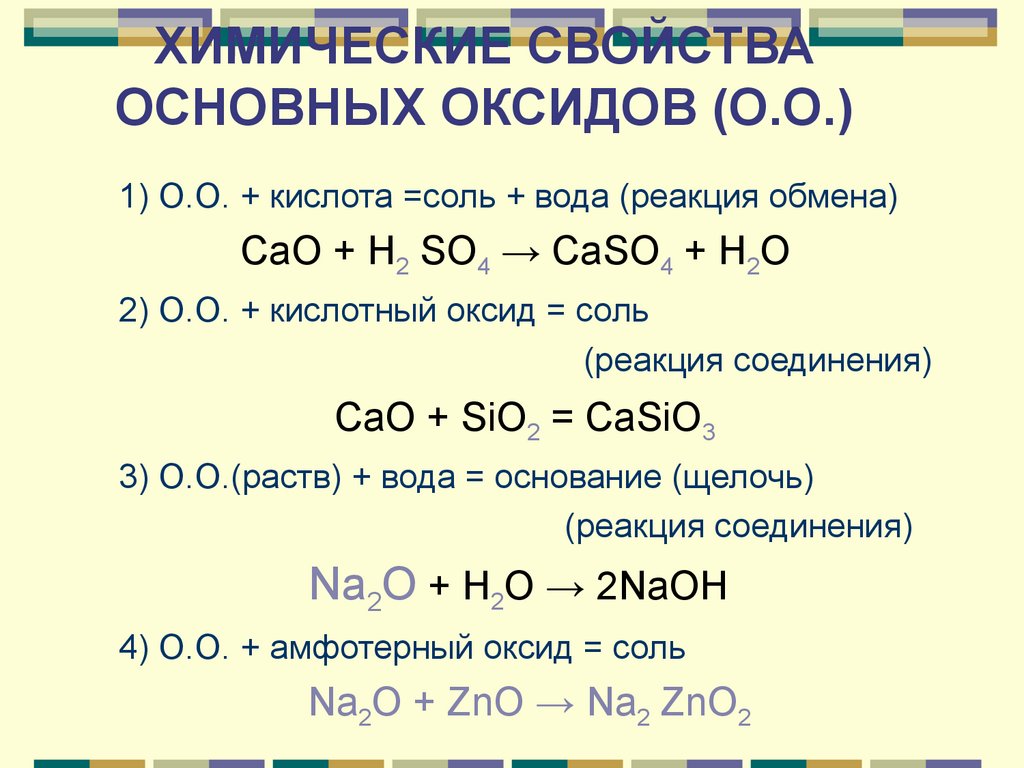
ХИМИЧЕСКИЕ СВОЙСТВАОСНОВНЫХ ОКСИДОВ (О.О.)
1) О.О. + кислота =соль + вода (реакция обмена)
CaO + H2 SO4 → CaSO4 + H2O
2) О.О. + кислотный оксид = соль
(реакция соединения)
СaO + SiO2 = CaSiO3
3) О.О.(раств) + вода = основание (щелочь)
(реакция соединения)
Na2О + H2O → 2NaOH
4) О.О. + амфотерный оксид = соль
Na2О + ZnO → Na2 ZnO2
14.
Химические свойствакислотных оксидов (К.О.)
1) К.О. + основание = соль + вода (реакция обмена)
CO2 + Mg(OН)2= MgCO3 + H2O
2) К.О. +О.О. = СОЛЬ (реакция соединения)
SO3 + MgO = MgSO4
3) К.О. + вода = кислота (кроме SiO2 )
(реакция соединения)
Р2O5 + 3H2O = 2H3РO4
15.
Амфотерные оксидыАмфотерными называются оксиды,
которые в зависимости от условий
проявляют основные или кислотные
свойства.
Примеры: ZnO, Al2O3, Cr2O3, V2O3
Амфотерные оксиды с водой
непосредственно не соединяются.
16.
Химические свойстваамфотерных оксидов
Основные свойства
1. С кислотами: ZnO + 2НСl → ZnСl2 + Н2О
2. С кислотными оксидами: ZnO+ SiO2 = ZnSiO3
силикат цинка
Кислотные свойства
1. С основаниями: ZnO + 2NaОН = Na2ZnO2 +Н2О
цинкат натрия
2. С основными оксидами: ZnO + MgО = MgZnO2
17.
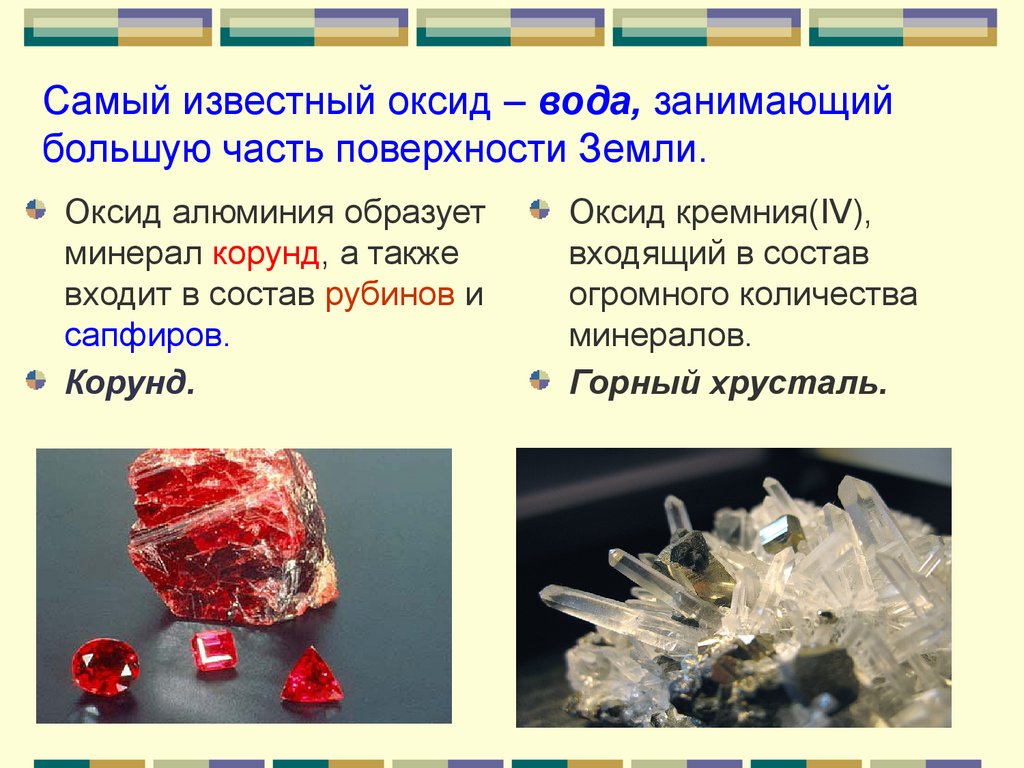
Самый известный оксид – вода, занимающийбольшую часть поверхности Земли.
Оксид алюминия образует
минерал корунд, а также
входит в состав рубинов и
сапфиров.
Корунд.
Оксид кремния(IV),
входящий в состав
огромного количества
минералов.
Горный хрусталь.
18.
Глина, используемая в силикатнойпромышленности для производства керамики, в
ее составе оксиды кремния, алюминия и вода.
Керамика
Фарфор
19.
20.
21.
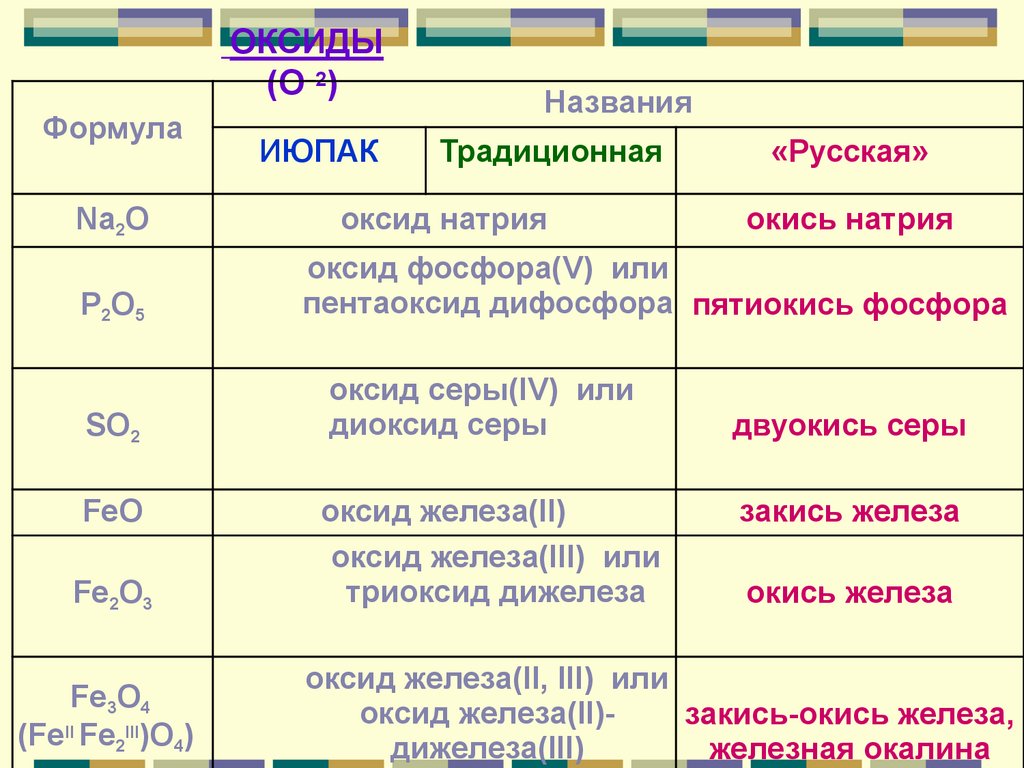
ОКСИДЫ(O 2)
Формула
Na2О
Р2O5
SO2
FeO
Fe2O3
Fe3O4
(FeII Fe2III)O4)
ИЮПАК
Названия
Традиционная
оксид натрия
«Русская»
окись натрия
оксид фосфора(V) или
пентаоксид дифосфора пятиокись фосфора
оксид серы(IV) или
диоксид серы
оксид железа(II)
оксид железа(III) или
триоксид дижелеза
двуокись серы
закись железа
окись железа
оксид железа(II, III) или
оксид железа(II)закись-окись железа,
дижелеза(III)
железная окалина
22.
Способы получения оксидов1) Взаимодействие простых веществ с кислородом.
S + O2—› SO2
4Al + 3O2 —› 2Al2O3
2) Взаимодействие простых веществ и солей с
кислотами-окислителями.
C + 4HNO3(р-р) —› СO2 + 4NO2 + H2O
Cu + 4HNO3(конц.) —› Cu(NO3)2 + 2NO2 + + 2H2O
Na2SO3 + 2H2SO4—› 2NaHSO4 + SO2 + H2O
3) Горение
•сложных веществ: СН4 + 2О2 = СО2 + 2Н2О
•простых веществ: 2Mg + О2 = 2MgО
23.
Способы получения оксидов4) Термическое разложение
1.Нерастворимых оснований
Cu(OН)2=CuО + H2O
CaCO3 = CaO + CO2
Mg(OH)2 = MgO + H2O
2. Некоторых кислот
H2SiO3 = SiO2 + H2O
2H3BO3 = B2O3 + H2O
3. Некоторых солей
24.
Среди веществ найдитеоксиды:
1)CuO
2)HCL
3) AL2O3
4) H2SO4
5) NaCl
6)CaCO3
7)Mg(OH)2
8)AlCl3
9)NaOH
10)CaO
11)H3PO4
12)CO2
13)Na2O
14)HNO3
15)P2O5
16)Ca(OH)2
17)HBr
18)H2O
25.
Основания – это сложные вещества, состоящиеиз атомов металла и одной или нескольких
гидроксогрупп (-OH).
Основания
Растворимые в воде
(щелочи)
Нерастворимые в воде
NaOH
Cu(OH)2
KOH
Al(OH)3
Ba(OH)2
Fe(OH)2
26.
ОснованияОснования – это сложные вещества,
состоящие из ионов металлов и
связанных с ними одного или
- гидроксид-ионов (ОН )
нескольких
М(ОН)n
+
NaOH
где М – металл, n – число групп ОН и в
то же время заряд иона металла
+2
Ca(OH)2
+3
Fe(OH)3
Называем: гидроксид металла
27.
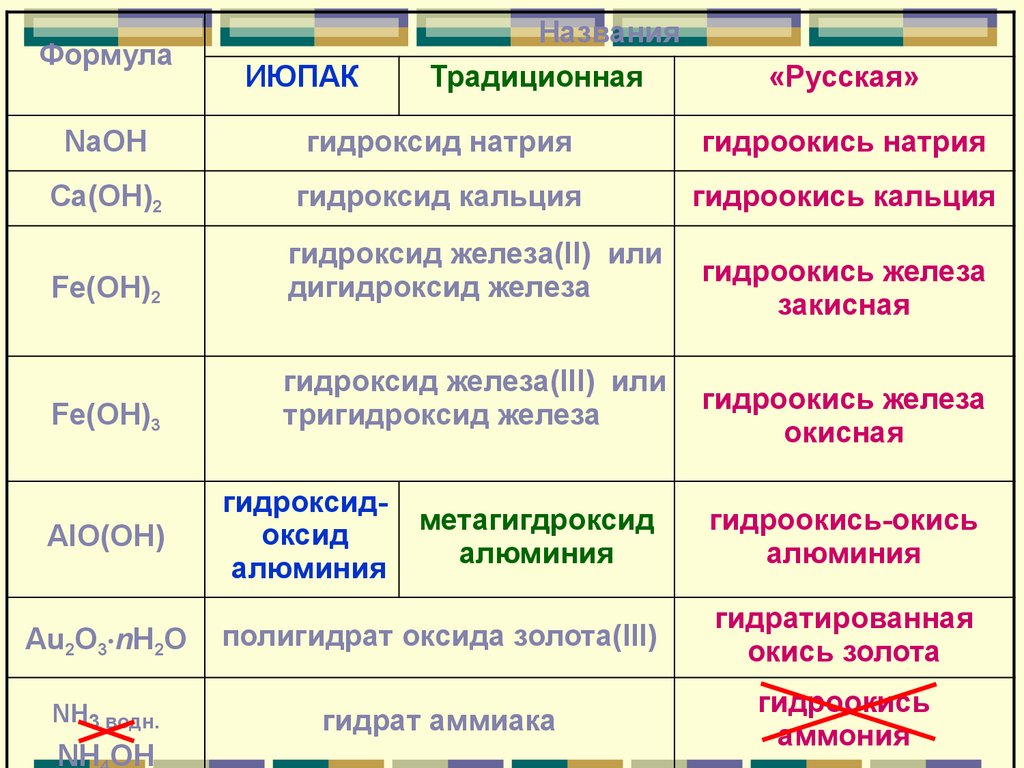
ФормулаИЮПАК
Названия
Традиционная
«Русская»
NaOH
гидроксид натрия
гидроокись натрия
Ca(OH)2
гидроксид кальция
гидроокись кальция
Fe(OH)2
гидроксид железа(II) или
дигидроксид железа
Fe(OH)3
гидроксид железа(III) или
тригидроксид железа
гидроксидоксид
алюминия
гидроокись железа
закисная
гидроокись железа
окисная
метагигдроксид
алюминия
гидроокись-окись
алюминия
Au2O3 nH2O
полигидрат оксида золота(III)
гидратированная
окись золота
NH3 водн.
гидрат аммиака
гидроокись
аммония
AlO(OH)
NH OH
28.
Химические свойства растворимых оснований1. Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
29.
2. Взаимодействуют со всеми кислотами (реакциянейтрализации)
NaOH + HCl → NaCl + H2O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO3 → Na2SO4 + H2O
4. Взаимодействуют с растворами солей, если
образуется газ или осадок
2 NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
30.
5. Взаимодействуют с некоторыминеметаллами (серой, кремнием,
фосфором)
2 NaOH +Si + H2O → Na2SiO3 + 2H2↑
6. Взаимодействуют с амфотерными
гидроксидами
2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4]
31.
Химические свойстванерастворимых оснований
1. Взаимодействуют с кислотами (реакция
нейтрализации)
Fe(OH) 2 + H2SO4 → FeSO4 + 2H2O
2. Разложение при нагревании. Нерастворимые
основания при нагревании разлагаются на основный
оксид и воду: t o
Cu(OH)2↓ → CuO + H2O
32.
Способы получения растворимыхоснований (щелочей)
1. Взаимодействие щелочных и
щелочно-земельных металлов их
оксидов с водой
2Na + 2H2O = 2NaOH + H2
СаO + H2O = Са(OН)2
33.
Способы получениянерастворимых оснований
2. Взаимодействие раствора щелочи с
раствором соли
3NaOH + АlCl3 = Al(OH)3 + 3NaCl
2NaОН + CuSO4 → Cu(OH)2 + Na2SO4
34.
В любой аптечке можно найтинашатырный спирт – гидроксид
аммония.
Гидроксид натрия (едкий
натр, каустическая сода)
применяется для очистки
нефтепродуктов, в
производстве мыла.
Гидроксид кальция –
гашеную известь
используют в
строительстве.
35.
36.
37.
Среди веществ найдите основания:1)CuO
2)HCL
3) AL2O3
4) H2SO4
5) NaCl
6)CaCO3
7)Mg(OH)2
8)AlCl3
9)NaOH
10)CaO
11)H3PO4
12)CO2
13)Na2O
14)HNO3
15)P2O5
16)Ca(OH)2
17)HBr
18)H2O
38.
Кислоты – это сложные вещества, состоящие изатомов водорода, способных замещаться на атомы
металла, и кислотных остатков.
Кислоты
Бескислородные
Кислородсодержащие
HCl
HNO3
HF
H2SO4
H2S
H3PO4
39.
Классификация кислотПризнаки
классификации
Группы кислот Примеры
Наличие кислорода
в кислотном остатке
А) кислородные;
Б) бескислородные
А) H3PO4, H2SO4;
,Б) HBr, H2S
Основность
А) одноосновные;
Б) многоосновные
А) HNO3, HCl;
Б) H2SO4, H3PO4
Растворимость в
воде
А) растворимые;
Б) нерастворимые
А) HNO3, HCl;
Б) H2SiO3
Летучесть
А) летучие;
Б) нелетучие
А) H2S, HNO3
Б) H2SO4, H3PO4
Степень
диссоциации
А) сильные;
Б) слабые
А) HNO3, HCl;
Б) H2SO3, H2CO3
Стабильность
А) стабильные;
Б) нестабильные
А) H2SO4, HCl
Б) H2SO3, H2CO3
40.
КислотыПримеры: HCl – соляная кислота
H2S – сероводородная кислота
HNO3 – азотная кислота
H2SO4 - серная кислота
41.
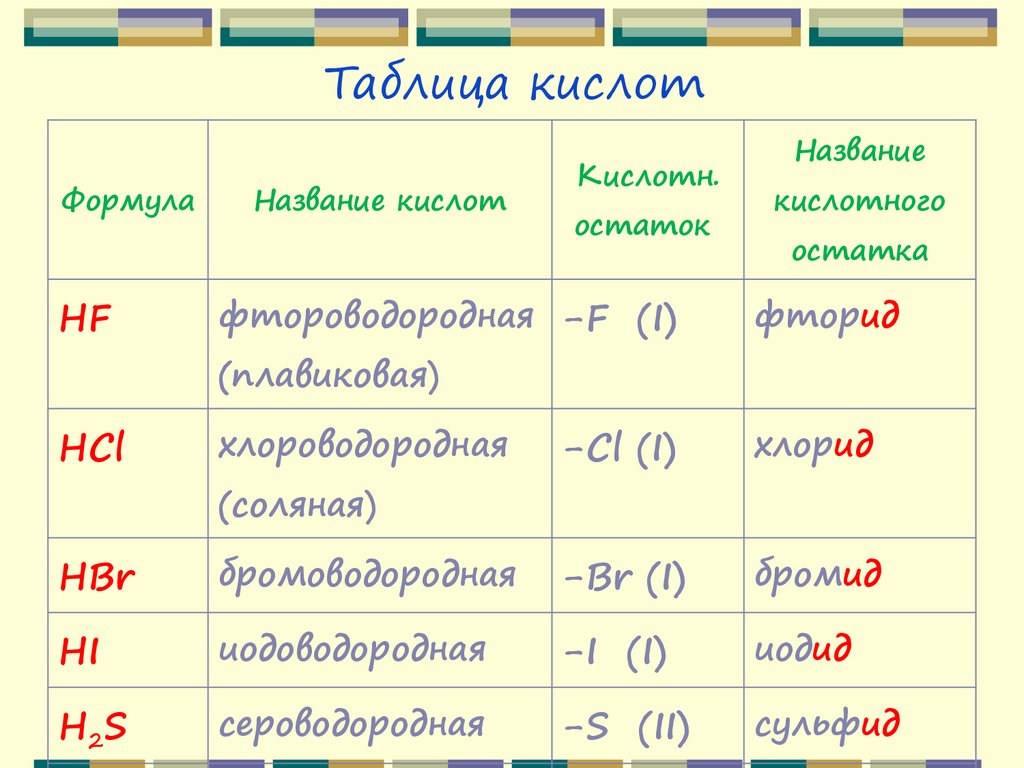
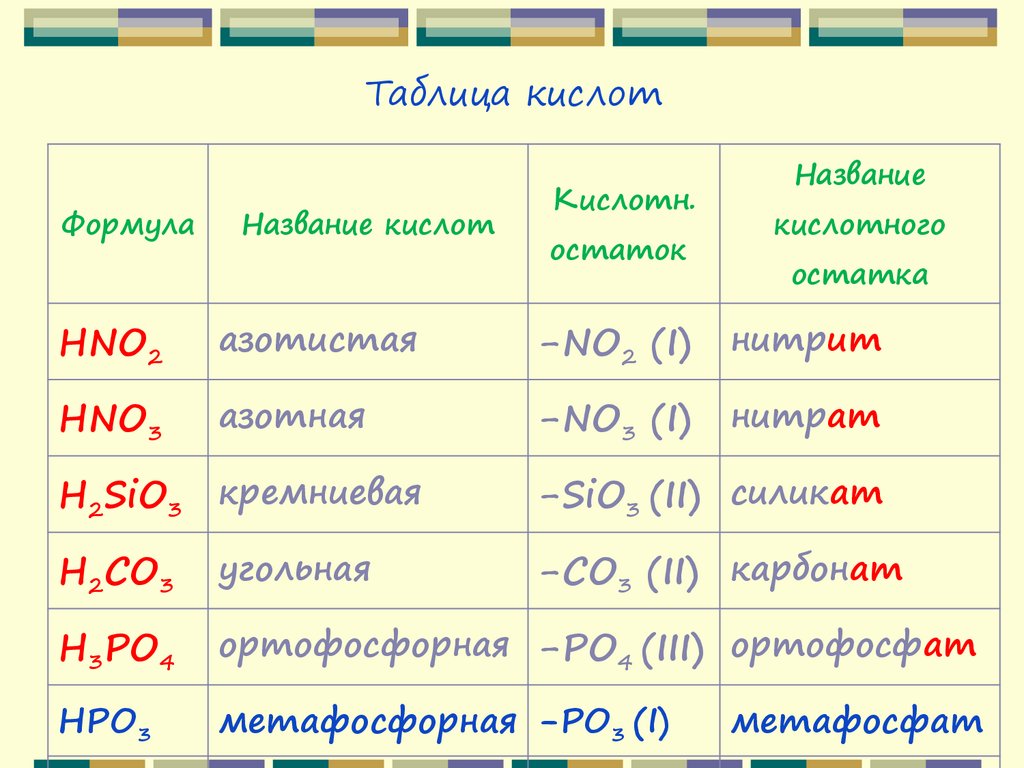
Таблица кислотФормула
Название кислот
Кислотн.
остаток
Название
кислотного
остатка
HF
фтороводородная -F (I)
фторид
HCl
хлороводородная
-Cl (I)
хлорид
HBr
бромоводородная
-Br (I)
бромид
HI
иодоводородная
-I (I)
иодид
H2S
сероводородная
-S (II)
сульфид
(плавиковая)
(соляная)
42.
Таблица кислотФормула
Название кислот
Кислотн.
остаток
Название
кислотного
остатка
HNO2
азотистая
-NO2 (I)
нитрит
HNO3
азотная
-NO3 (I)
нитрат
H2SiO3 кремниевая
-SiO3 (II) силикат
H2CO3
угольная
-CO3 (II) карбонат
H3PO4
ортофосфорная -PO4 (III) ортофосфат
HPO3
метафосфорная -PO3 (I)
метафосфат
43.
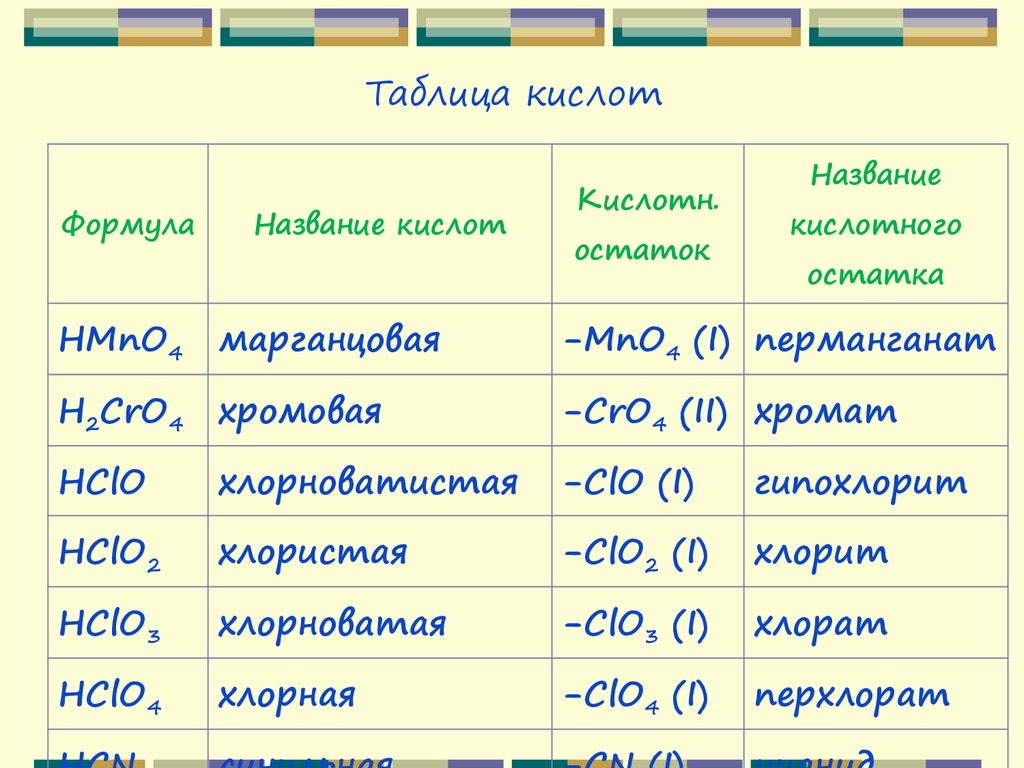
Таблица кислотФормула
Название кислот
Кислотн.
остаток
Название
кислотного
остатка
HMnO4
марганцовая
-MnO4 (I) перманганат
H2CrO4
хромовая
-CrO4 (II) хромат
HClO
хлорноватистая
-ClO (I)
гипохлорит
HClO2
хлористая
-ClO2 (I)
хлорит
HClO3
хлорноватая
-ClO3 (I)
хлорат
HClO4
хлорная
-ClO4 (I)
перхлорат
44.
Типичные реакции кислот1. Кислота + основание = соль + вода
H2SO4 +2 NaOH = Na2SO4 + 2H2O
2. Кислота + оксид металла = соль +
вода
2 HCL+CuO = CuCL2 + H2O
45.
Типичные реакции кислот3. Кислота + металл = водород + соль
2HCL +Zn = ZnCL2 + H2
Условия: - в ряду напряжений металл должен
стоять до водорода
- в результате реакции должна получиться
растворимая соль
4. Кислота + соль = новая кислота +
новая соль
Условия: - в результате реакции должны получиться
газ, осадок или вода.
BaCL2 + H2SO4 = BaSO4 + 2HCL
46.
Способы получения кислот1. Взаимодействие кислотных оксидов с
водой
SO3 + H2O = H2SO4;
CO2 + H2O = H2CO3;
2. Вытеснение более летучей кислоты из её
соли менее летучей кислотой
NaCl + H2SO4(конц.) = HCl + Na2SO4
3. Гидролиз галогенидов или солей
PCl5 + 4H2O = 3H3PO4 + 5HCl
4. Из простых веществ (для бескислородных
кислот)
H2 + Cl2 = HCl
47.
лекарстваКислоты
удобрения
(используют в производстве)
красители
взрывчатые вещества
48.
Среди веществ найдите кислоты:1)CuO
2)HCL
3) AL2O3
4) H2SO4
5) NaCl
6)CaCO3
7)Mg(OH)2
8)AlCl3
9)NaOH
10)CaO
11)H3PO4
12)CO2
13)Na2O
14)HNO3
15)P2O5
16)Ca(OH)2
17)HBr
18)H2O
49.
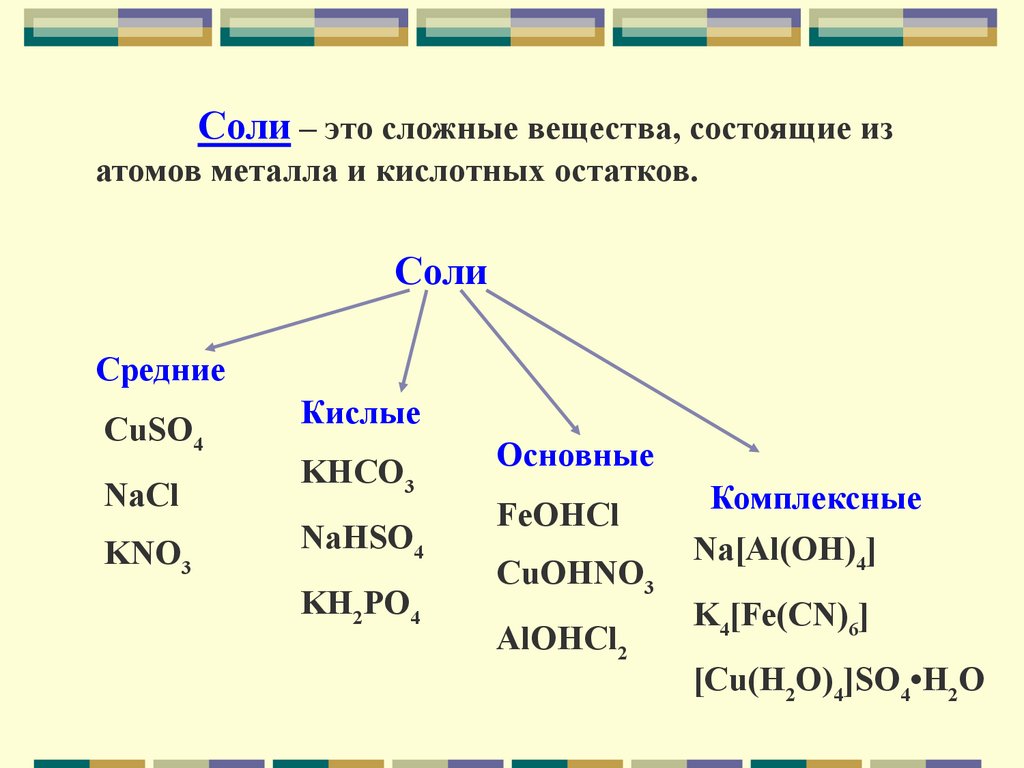
Соли – это сложные вещества, состоящие изатомов металла и кислотных остатков.
Соли
Средние
CuSO4
Кислые
NaCl
KHCO3
KNO3
NaHSO4
KH2PO4
Основные
FeOHCl
CuOHNO3
AlOHCl2
Комплексные
Na[Al(OH)4]
K4[Fe(CN)6]
[Cu(H2O)4]SO4•H2O
50.
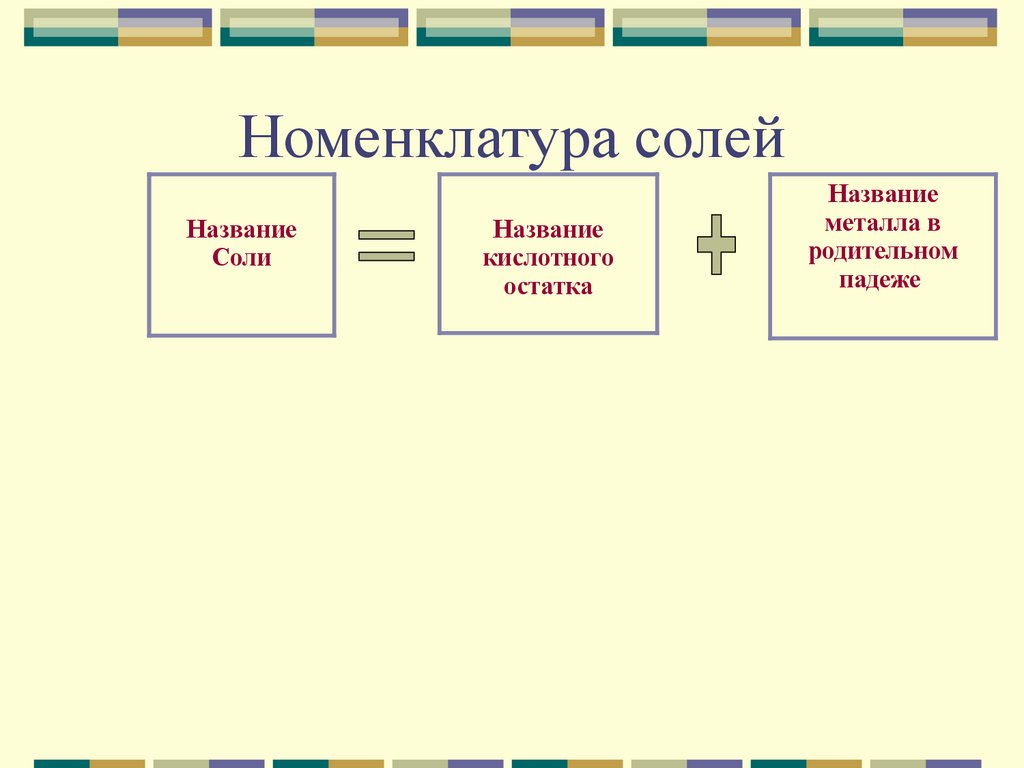
Номенклатура солейНазвание
Соли
Название
кислотного
остатка
Название
металла в
родительном
падеже
51.
Названия солейбескислородных кислот
называем неметалл ( латинское название) с
суффиксом – ид (в им. падеже);
Металл (в род. падеже).
NaCl – хлорид натрия
Al2S3 – сульфид алюминия
FeBr2 – бромид железа (II)
FeBr3 – бромид железа (III)
52.
Названия солей кислородсодержащих кислотНазываем ион кислотного остатка (в
именительном падеже);
с суффиксами:
-ат
для высшей степени окисления;
-ит
для низшей степени окисления.;
Называем металл (в родительном падеже).
Na2SO4– сульфат натрия
Na2SO3 - сульфит натрия
Fe (NO2)2 – нитрит железа (II)
Fe (NO3) 3 – нитрат железа (III)
53.
Номенклатура солейF–
Cl –
Br –
I–
S 2SO3 2-
SO4 2-
CO3 2-
SiO3 2-
NO3 –
NO2 –
PO4 3-
PO3 –
ClO4 –
Na F
NaCl
NaBr
Na I
Na2S
Na2SO3
Na2SO4
Na2CO3
Na2SiO3
Na NO3
Na NO2
Na3PO4
Na PO3
Фторид натрия
Хлорид натрия
Бромид натрия
Иодид натрия
Сульфид натрия
Сульфит натрия
Сульфат натрия
Карбонат натрия
Силикат натрия
Нитрат натрия
Нитрит натрия
Ортофосфат натрия
Метафосфат натрия
54.
Классификация солейСредние: Na3PO4, K2SO4, MgCl2
Кислые: NaH2PO4, Na2HPO4, KHSO4
Основные: Mg(OH)Cl
Двойные: K2NaPO4
Смешанные: CaOCl2
Комплексные: K3 Fe(CN)6
55.
Типы солейНормальные (средние) -это соли, в которых все атомы водорода
соответствующей кислоты замещены на атомы металла.
NaCl, Na2SO4, Na3PO4
Кислые - это соли, в которых атомы водорода замещены только
частично.
NaHSO4, Na2HPO4, NaH2PO4
Основные - это соли, в которых группы ОН соответствующего основания
частично замещены на кислотные остатки.
MgOHCl, Al(OH)2NO3
Двойные (смешанные) - это соли, в которых содержится два разных
катиона и один анион.
KAl(SO4)2, Fe(NH4)2(SO4)2
Комплексные - это соли, в состав которых входит комплексный йон.
Na2[Zn(OH)4], K3[Fe(CN)6]
56.
пищевая содаСоли
гипс
марганцовка
поваренная соль
мрамор
57.
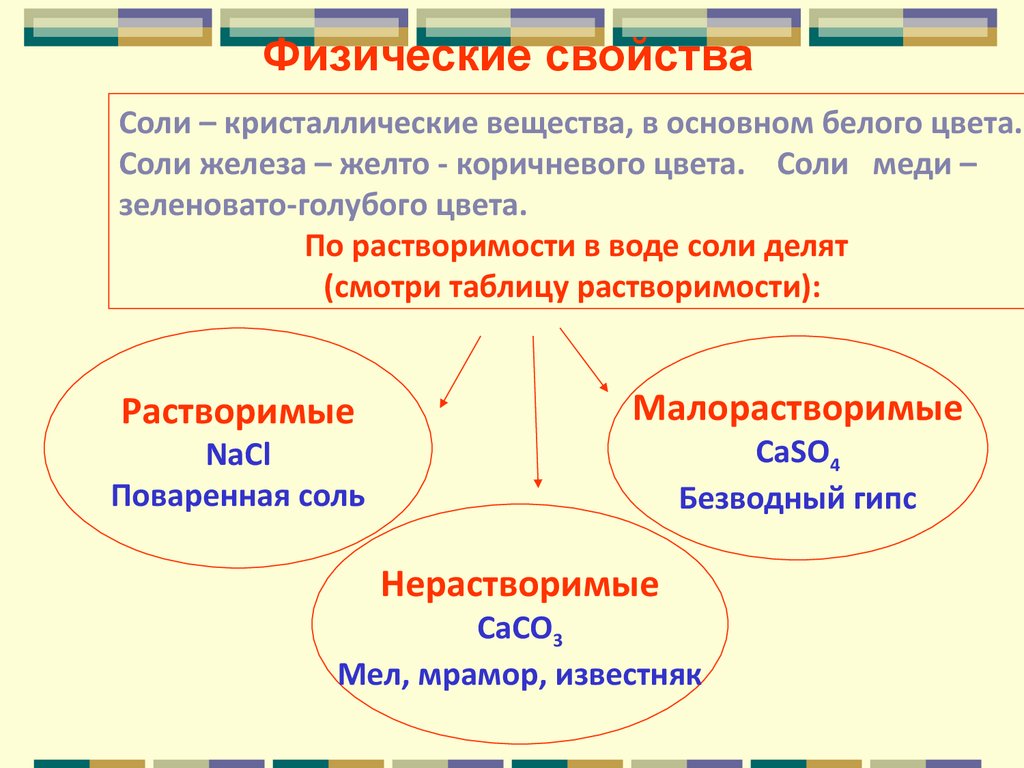
Физические свойстваСоли – кристаллические вещества, в основном белого цвета.
Соли железа – желто - коричневого цвета. Соли меди –
зеленовато-голубого цвета.
По растворимости в воде соли делят
(смотри таблицу растворимости):
Растворимые
Малорастворимые
CaSO4
Безводный гипс
NaCl
Поваренная соль
Нерастворимые
CaCO3
Мел, мрамор, известняк
58.
Химические свойстваСоли реагируют с металлами( исключения
активные металлы: Li, Na, K, Ca, Ba - которые при
обычных условиях реагируют с водой):
Fe + CuSO4 = FeSO4 + Cu
Соли реагируют с кислотами:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Карбонаты, сульфиты разлагаются при
нагревании:
СaCO3 = CaO + CO2
59.
Химические свойстваСоли реагируют с некоторыми кислотными оксидами:
CaCO3 + SiO2 = CaSiO3 + CO2
Соли реагируют с другими солями с образованием новых
нерастворимых солей:
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
Соли реагируют с растворимыми основаниями с образованием
нерастворимого основания:
AlCl3 + 3KOH = Al(OH)3 + 3KCl
60.
Получение солейВзаимодействие металлов и неметаллов:
2Fe + 3Cl2 = 2FeCl3
Взаимодействие кислотных оксидов с основными
и амфотерными оксидами:
CaO + CO2 = CaCO3
ZnO + SiO2 = ZnSiO3
Взаимодействие двух разных солей с
образованием новой
нерастворимой соли:
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
Взаимодействие оснований и кислот:
NaOH + HCl = NaCl + H2O
Взаимодействие более активного металла с
солями:
FeCl2 + Zn = ZnCl2 + Fe
61.
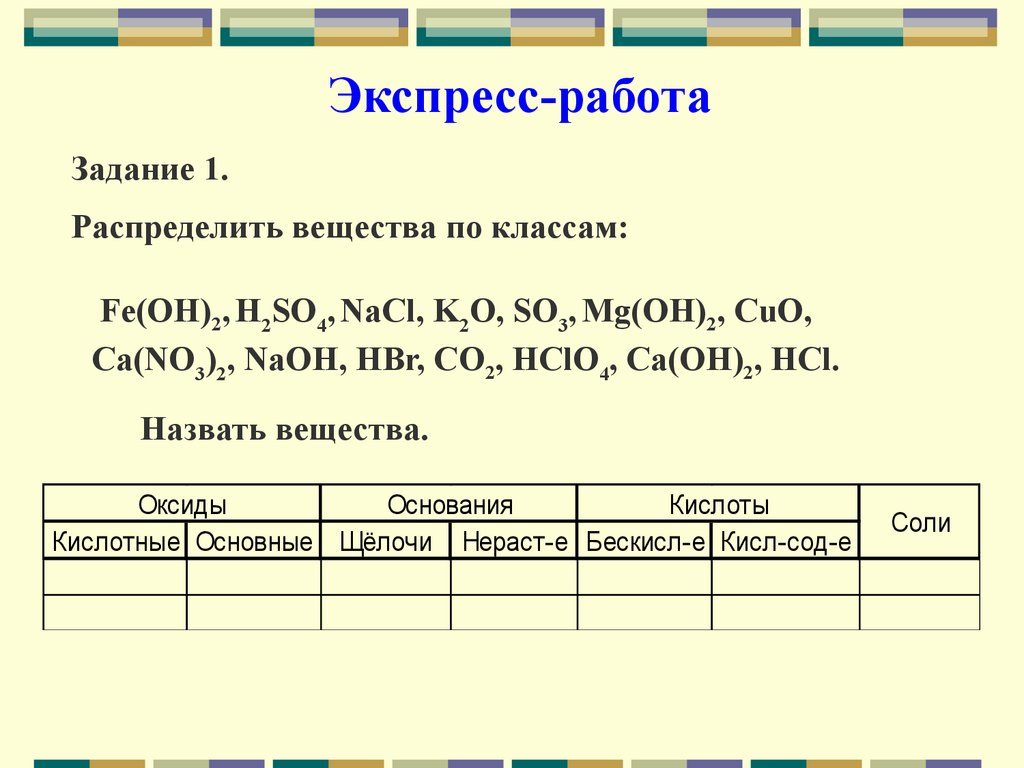
Экспресс-работаЗадание 1.
Распределить вещества по классам:
Fe(OH)2, H2SO4, NaCl, K2O, SO3, Mg(OH)2, CuO,
Ca(NO3)2, NaOH, HBr, CO2, HClO4, Ca(OH)2, HCl.
Назвать вещества.
Оксиды
Основания
Кислоты
Кислотные Основные Щёлочи Нераст-е Бескисл-е Кисл-сод-е
Соли
62.
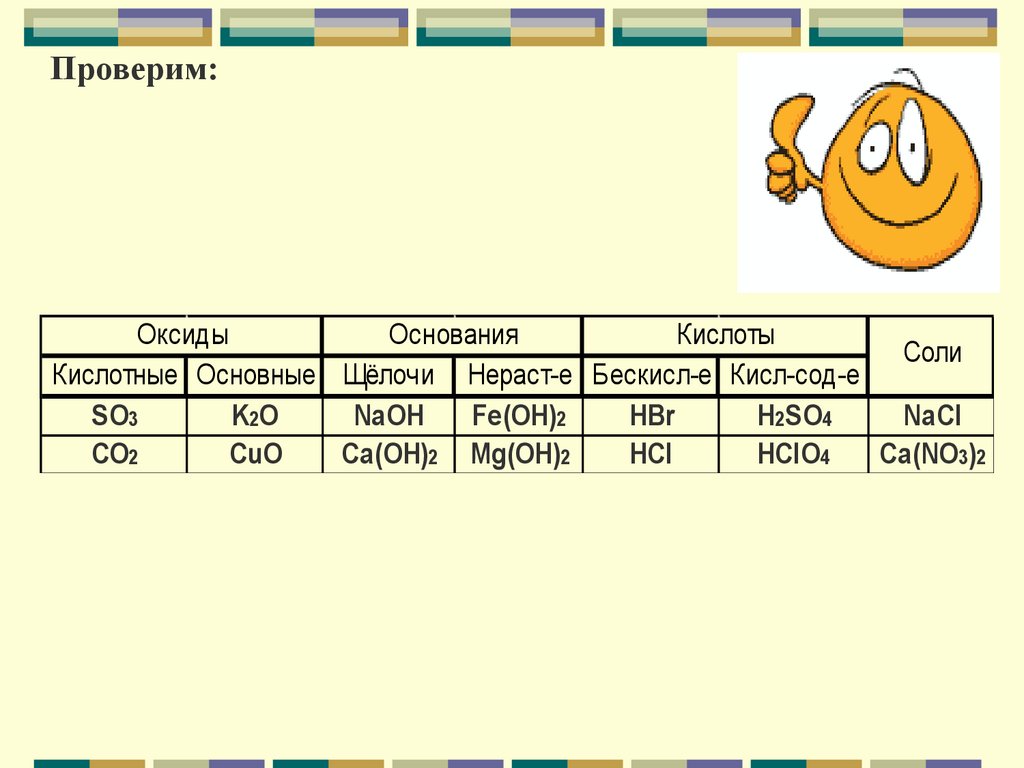
Проверим:Оксиды
Основания
Кислоты
Соли
Кислотные Основные Щёлочи Нераст-е Бескисл-е Кисл-сод-е
SO3
K2O
NaOH
Fe(OH)2
HBr
H2SO4
NaCl
CO2
CuO
Ca(OH)2 Mg(OH)2
HCl
HClO4
Ca(NO3)2
63.
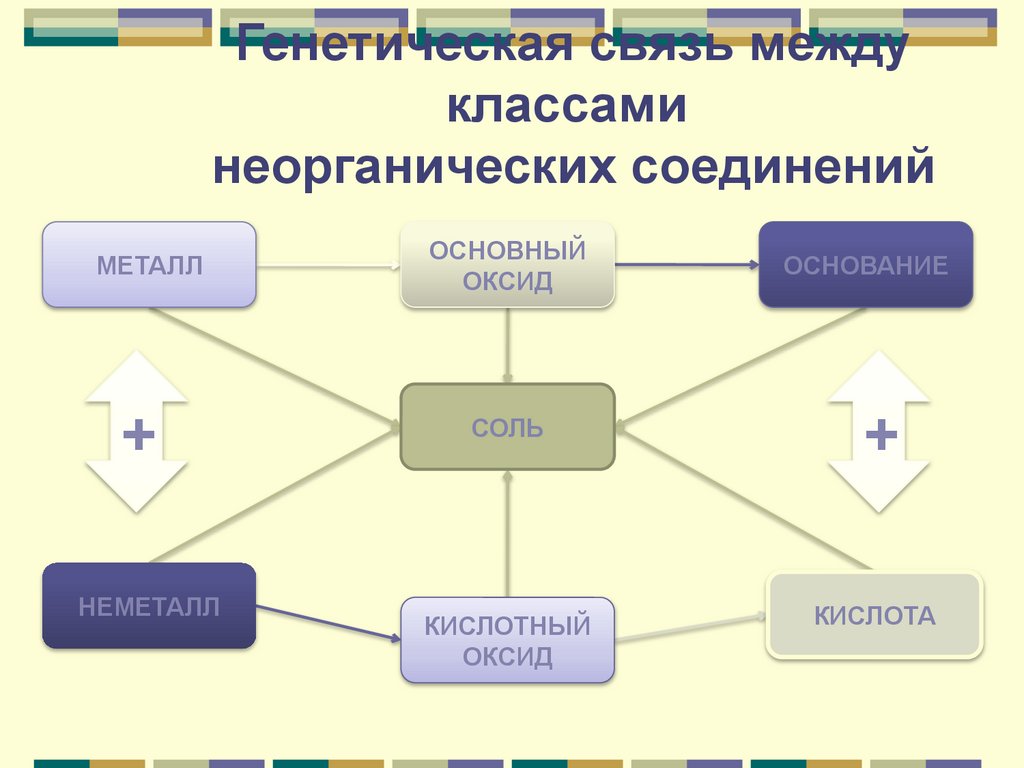
Генетическая связьСвязь между классами
неорганических соединений,
основанная на получении
веществ одного класса из
веществ другого класса,
называется генетической.
64.
Генетическая связь междуклассами
неорганических соединений
МЕТАЛЛ
ОСНОВНЫЙ
ОКСИД
ОСНОВАНИЕ
+
СОЛЬ
+
НЕМЕТАЛЛ
КИСЛОТНЫЙ
ОКСИД
КИСЛОТА












































 chemistry
chemistry








