Similar presentations:
Презентация_Азотная кислота
1.
Тема урока:«Азотная кислота, её физические и
химические свойства»
2.
Физические свойства азотной кислоты:Азотная кислота – это бесцветная жидкость с резким
удушливым
запахом.
При
длительном
хранении
подвергается частичному разложению и приобретает
желтоватую окраску. В воде растворяется неограниченно.
На воздухе «дымит».
HNO3
3.
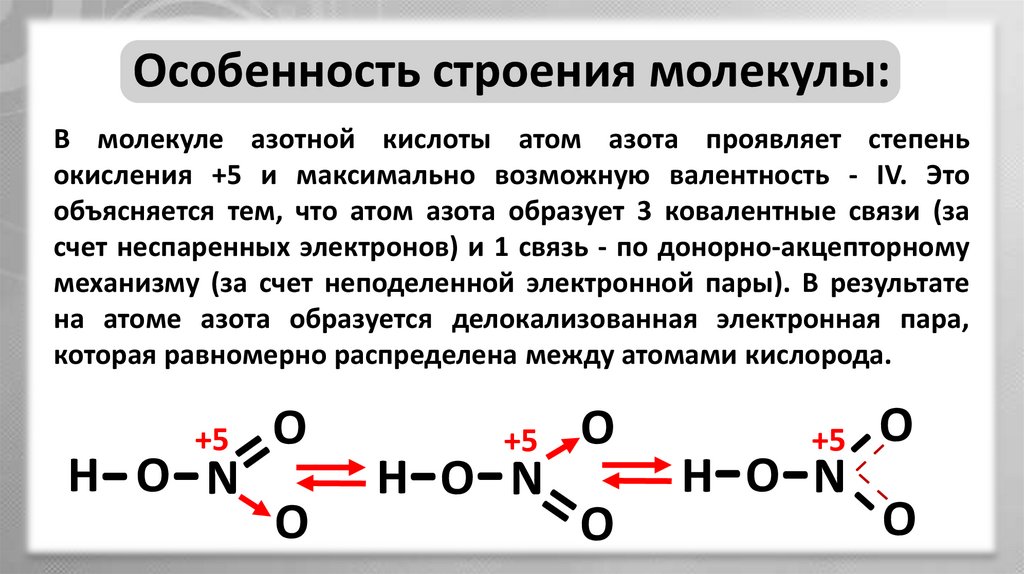
Особенность строения молекулы:В молекуле азотной кислоты атом азота проявляет степень
окисления +5 и максимально возможную валентность - IV. Это
объясняется тем, что атом азота образует 3 ковалентные связи (за
счет неспаренных электронов) и 1 связь - по донорно-акцепторному
механизму (за счет неподеленной электронной пары). В результате
на атоме азота образуется делокализованная электронная пара,
которая равномерно распределена между атомами кислорода.
+5
- -
H O N
O
O
+5
- -
H O N
O
O
- -
+5
H O N
O
O
4.
Получение азотной кислоты:Лабораторный способ:
Действие концентрированной серной кислоты на твёрдые нитраты
Данная реакция протекает при нагревании t⁰
NaNO3 + H2SO4(конц.) = NaHSO4 + HNO3
Промышленный способ:
Каталитическое окисление аммиака
t⁰, Pt
1. 4NH3 + 5O2 = 4NO + 6H2O
2. 2NO + O2 = 2NO2
3. 4NO2 + 2H2O + O2 = 4HNO3
5.
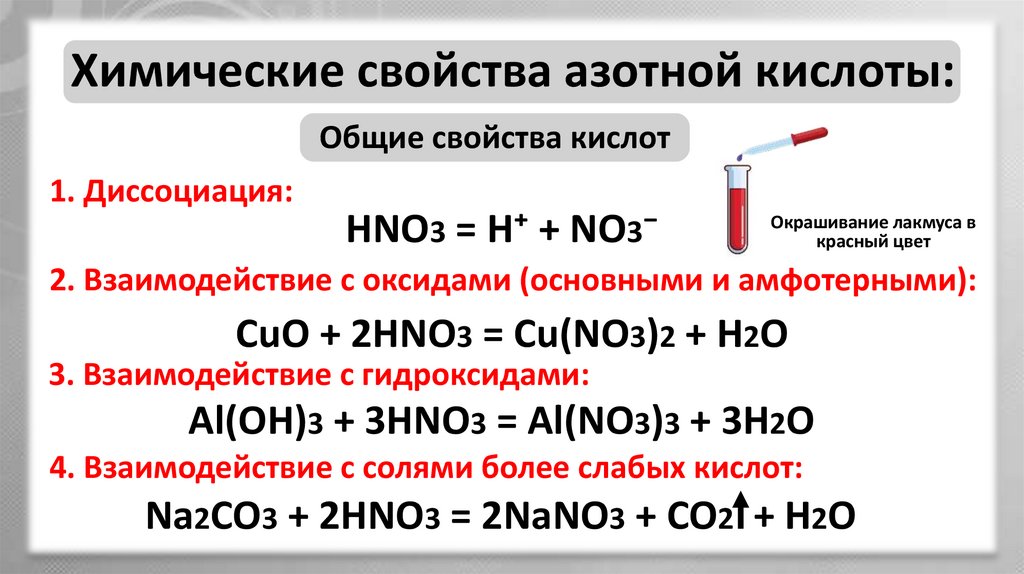
Химические свойства азотной кислоты:Общие свойства кислот
1. Диссоциация:
HNO3 = H⁺ + NO3⁻
Окрашивание лакмуса в
красный цвет
2. Взаимодействие с оксидами (основными и амфотерными):
CuO + 2HNO3 = Cu(NO3)2 + H2O
3. Взаимодействие с гидроксидами:
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
4. Взаимодействие с солями более слабых кислот:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
6.
Химические свойства азотной кислоты:Особые свойства кислот
Реагирует со всеми металлами, кроме благородных (Au и Pt).
Водород при этом никогда не выделяется.
+ Ме активный
NH4NO3 + H2O + соль
+ Ме средней активности
N2 (или N2O) + H2O + соль
+ Ме малоактивный
NO + H2O + соль
разбавленная
7.
Химические свойства азотной кислоты:Особые свойства кислот
Реагирует со всеми металлами, кроме благородных (Au и Pt).
Водород при этом никогда не выделяется.
концентрированная
+ Ме (до Zn), иск.Al
соль + N2O + H2O
+ Ме (от Sn до Ag)
соль + NO2 + H2O
+ Al, Cr, Fe, Co, Ni
пассивирует (на холоду)
+ Pt, Au
не взаимодействует
8.
Применение азотной кислоты:Производство
ракетного топлива
Производство
азотных удобрений
Производство
взрывчатых веществ
В металлургии
Производство
красителей
9.
Выводы:1. Азотная кислота – сильная и очень агрессивная кислота.
2. Её главная особенность – сильные окислительные
свойства, обусловленные атомом N⁺⁵.
3. Продукты
восстановления
азотной
кислоты
разнообразны и зависят от условий реакции.
4. При взаимодействии с металлами водород не
выделяется.
5. Является важнейшим сырьем для многих отраслей
промышленности.







 chemistry
chemistry








