Similar presentations:
Лекция VА
1. Элементы VА группы
ЛЕКТОР ЛАРИНА ВИКТОРИЯВИКТОРОВНА
2.
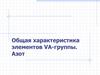
неметаллыПниктогены (от греч.
«пникт» – удушливый,
плохопахнущий
металлы
3. №115 5f146d107s27p3
Uup – унунпентий (2013 г.)Mc – московий (2016 г.)
Искусственно синтезированный радиоактивный элемент.
4.
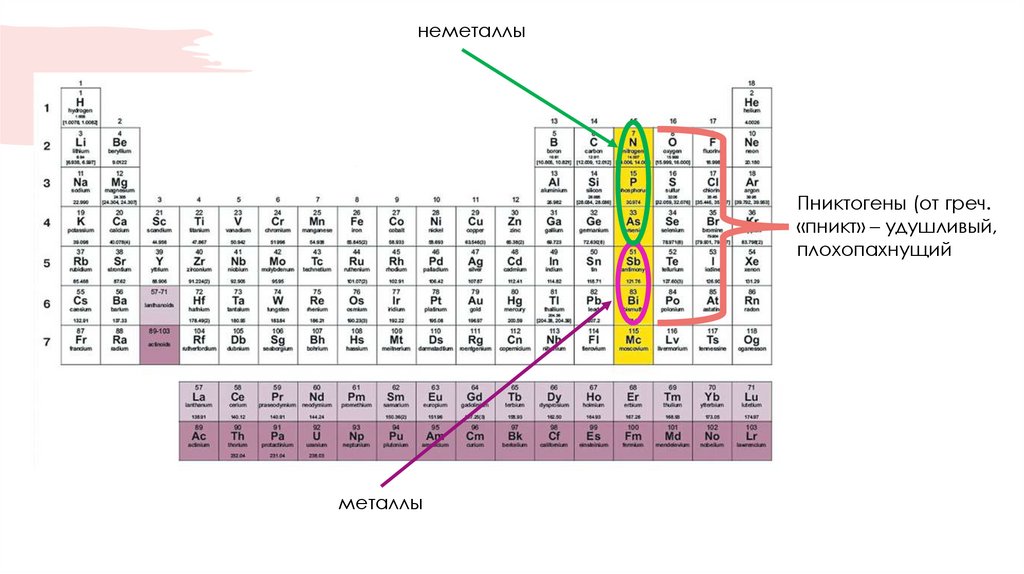
резкое ↑ радиуса атома, резкое ↓ ПИ1радиус атома ↑
N
P
As
Sb
Bi
2s22p3
3s23p3
3d104s24p3
4d105s25p3
4f145d106s26p3
-0,07
0,75
0,81
1,07
0,94
СЭ, эВ
3,04
2,06
2,18
2,05
2,02
ЭО (по
Полингу)
-3 -2 -1 0 +1
+2 +3 +4 +5
-3 (-2) 0 (+2)
+3 (+4) +5
-3 0 +3 +5
-3 0 +3 +5
(-3) 0 +3 (+5)
С.О.
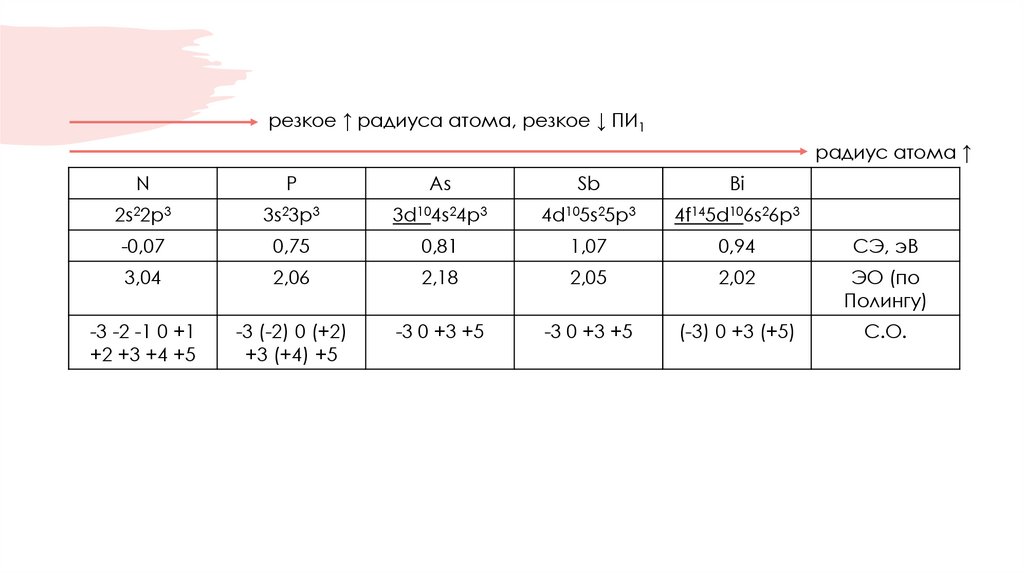
5. Физические свойства
N2P
газ
As
Sb
Bi
твердый при н.у.
аллотропия
только N2
белый
красный
черный
Гитторфа
серый
(крист.)
желтый
(аморфн.)
серый
(крист.)
желтый
(аморфн.)
серебристобелый
металл
Eсв.,
кДж/моль
N≡N 946
N−N 160
214
134
126
104
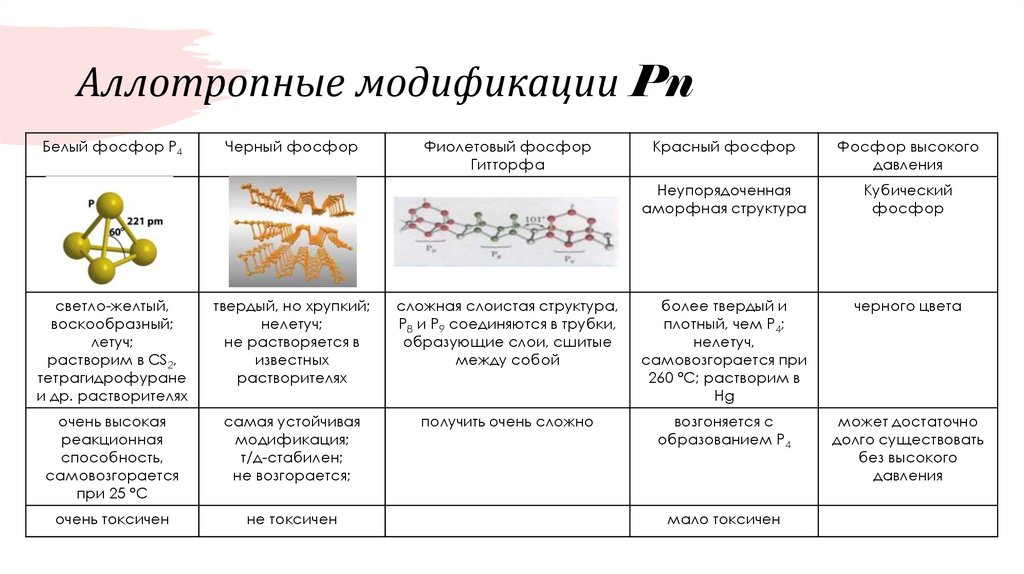
6. Аллотропные модификации Pn
Белый фосфор Р4Черный фосфор
Фиолетовый фосфор
Гитторфа
Красный фосфор
Фосфор высокого
давления
Неупорядоченная
аморфная структура
Кубический
фосфор
светло-желтый,
воскообразный;
летуч;
растворим в CS2,
тетрагидрофуране
и др. растворителях
твердый, но хрупкий;
нелетуч;
не растворяется в
известных
растворителях
сложная слоистая структура,
Р8 и Р9 соединяются в трубки,
образующие слои, сшитые
между собой
более твердый и
плотный, чем Р4;
нелетуч,
самовозгорается при
260 °С; растворим в
Hg
черного цвета
очень высокая
реакционная
способность,
самовозгорается
при 25 °С
самая устойчивая
модификация;
т/д-стабилен;
не возгорается;
получить очень сложно
возгоняется с
образованием Р4
может достаточно
долго существовать
без высокого
давления
очень токсичен
не токсичен
мало токсичен
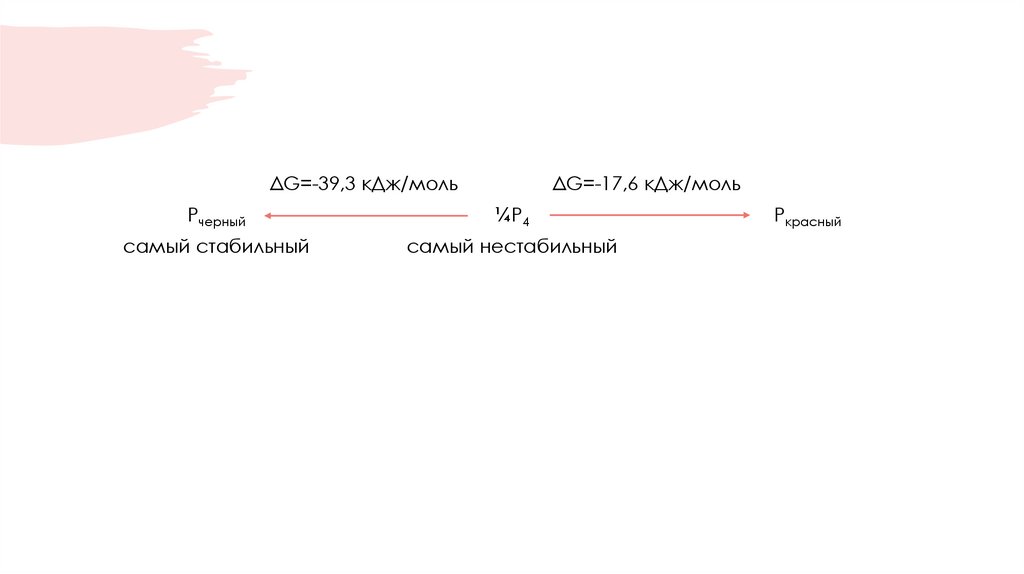
7.
ΔG=-39,3 кДж/мольΔG=-17,6 кДж/моль
Рчерный
¼Р4
самый стабильный
самый нестабильный
Ркрасный
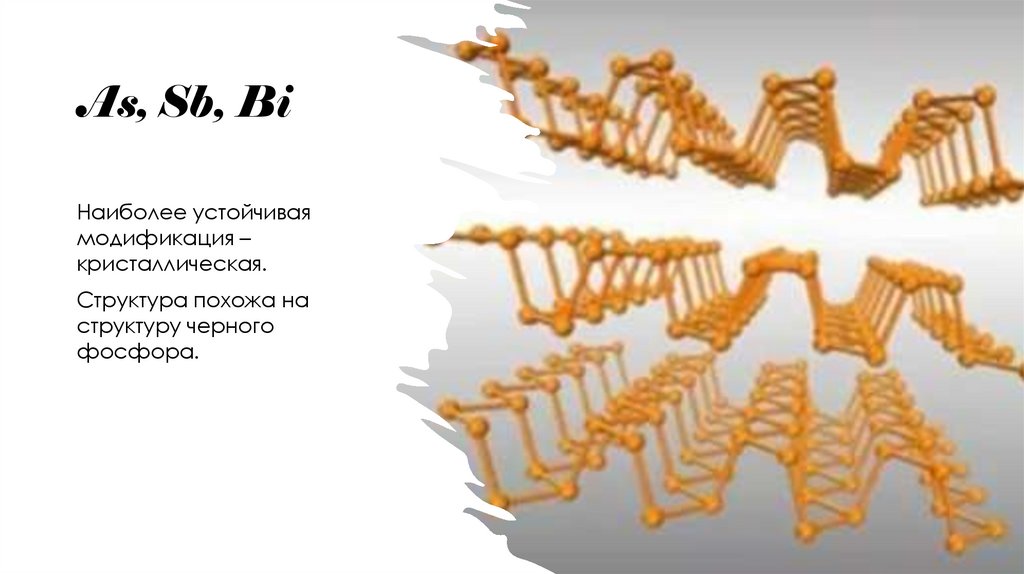
8. As, Sb, Bi
Наиболее устойчиваямодификация –
кристаллическая.
Структура похожа на
структуру черного
фосфора.
9. Нахождение Pn в природе
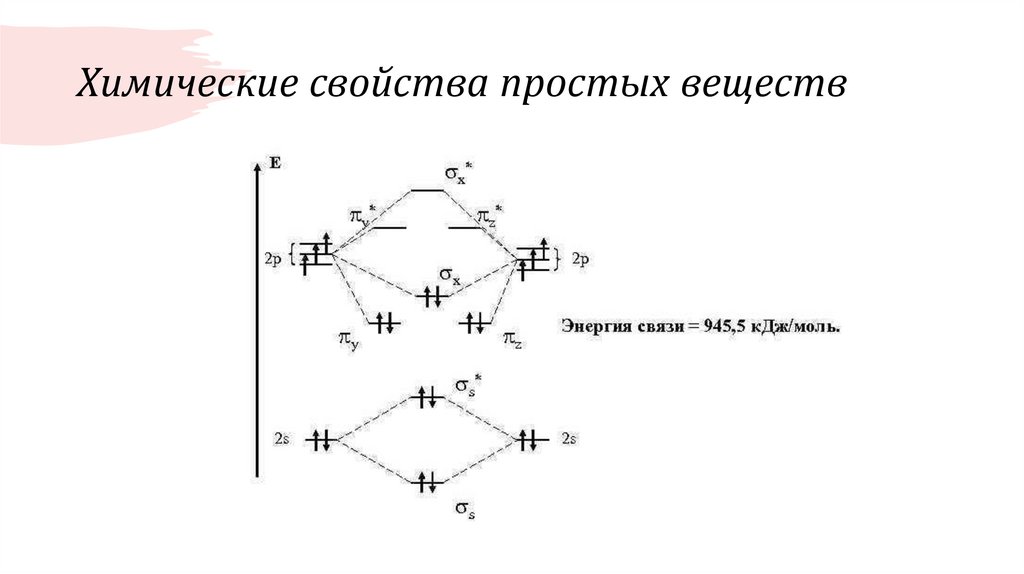
Самостоятельно!10. Химические свойства простых веществ
11. Химические свойства простых веществ Pn
N2P
As
Sb
Bi
-
-
-
1. C Me
только с Li при н.у., с
остальными Ме – при
t
N2 + Al = 2AlN (900 °C)
N2 + 3Mg = Mg3N2 (450
°C)
при t
2Р + 3Сa = Ca3Р2
2. С неМе
с H2, O2
N2 + 3H2 2NH3 (p, t,
kat) (процесс БошаГабера)
N2 + O2 = 2NO (эл.
разряд)
с O2, Г2
P4 + 5O2 = 2P2O5
самовозгорание (Ркрасный)
2Pкр. + 5Сl2 = 2PCl5 (или
PCl3)
Только для Р4:
P4 + 3NaOH + 3H2O = PH3 +
3NaH2PO2 (+P2H4)
P4 + 20HNO3 (конц.) =
4H3PO4 + 20NO2 + 4H2O
4P4 + 2Na = Na2P16 (в
диметилформамиде)
7P4 + 12Na = 4Na3(P7)3- (в
диметиловом эфире ДЭГ)
с O2 (горение на воздухе), Г2
4As + 3O2 = 2As2O3
2As + 5F2 = 2AsF5
(Cl2)
2Sb + 2O2 = Sb2O4
(Sb+3Sb+5O4)
2Sb + 5F2 = 2SbF5
(Cl2)
4Bi + 3O2 = 2Bi2O3
2Bi + 3Cl2 = 2BiCl3
(только до с.о.
+3)
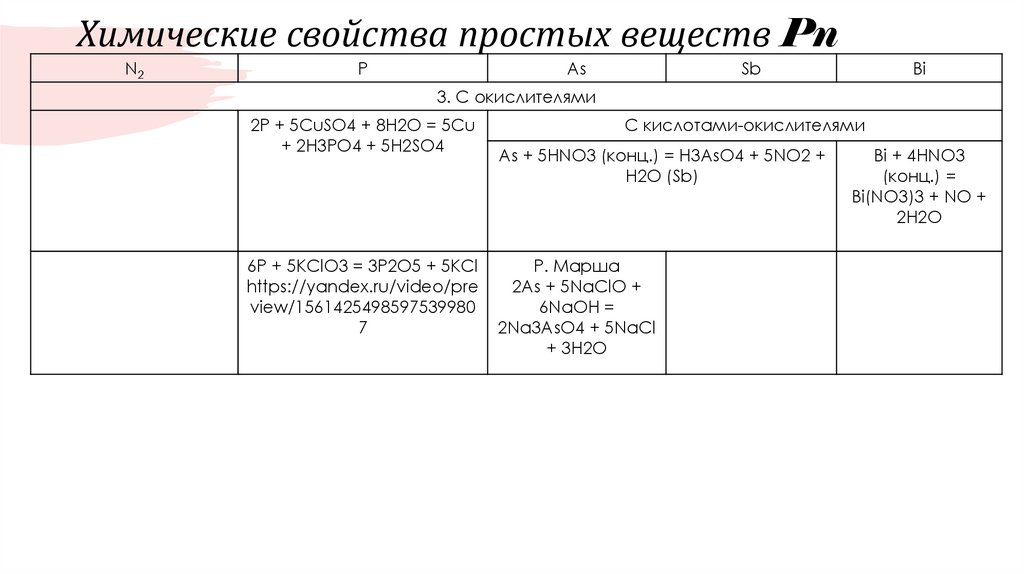
12. Химические свойства простых веществ Pn
N2P
As
Sb
Bi
3. С окислителями
2P + 5CuSO4 + 8H2O = 5Cu
+ 2H3PO4 + 5H2SO4
6P + 5KClO3 = 3P2O5 + 5KCl
https://yandex.ru/video/pre
view/1561425498597539980
7
С кислотами-окислителями
As + 5HNO3 (конц.) = H3AsO4 + 5NO2 +
H2O (Sb)
Р. Марша
2As + 5NaClO +
6NaOH =
2Na3AsO4 + 5NaCl
+ 3H2O
Bi + 4HNO3
(конц.) =
Bi(NO3)3 + NO +
2H2O
13. Получение простых веществ Pn
N2P
В промышленности:
- фракционирование
воздуха перегонкой;
- разделение воздуха
на мембранах,
пропускающих О2
В лаборатории:
2NaN3 = 2Na + 3N2 (t)
NH4NO2 = N2 + 2H2O (60 –
70 °C)
Из минералов:
апатиты Сa5(PO4)3X (X=OHили F-)
фосфорит Сa3(PO4)2
2Сa3(PO4)2 + 6SiO2 + 10C =
6CaSiO3 + 10CO + P4
(сплавление при 1400 °C)
As
Sb
Bi
I Обжиг сульфидов:
As2S3 + 9O2 = 2As2O3 + 6SO2 (при t) (или из As4S4 (реальгар), Bi2S3
(висмутовый блеск))
Sb2S3 + 5O2 = Sb2O4 + 3SO2 (при t)
II Восстановление оксидов:
As2O3 + 3C = 2As + 3CO (Bi)
Sb2O4 + 4C = 2Sb + 4CO
14. Гидриды пниктогенов имеют резкий запах
NH3PH3
AsH3
N2H4
P2H4
As2H4
P4H2
N3H
SbH3
BiH3
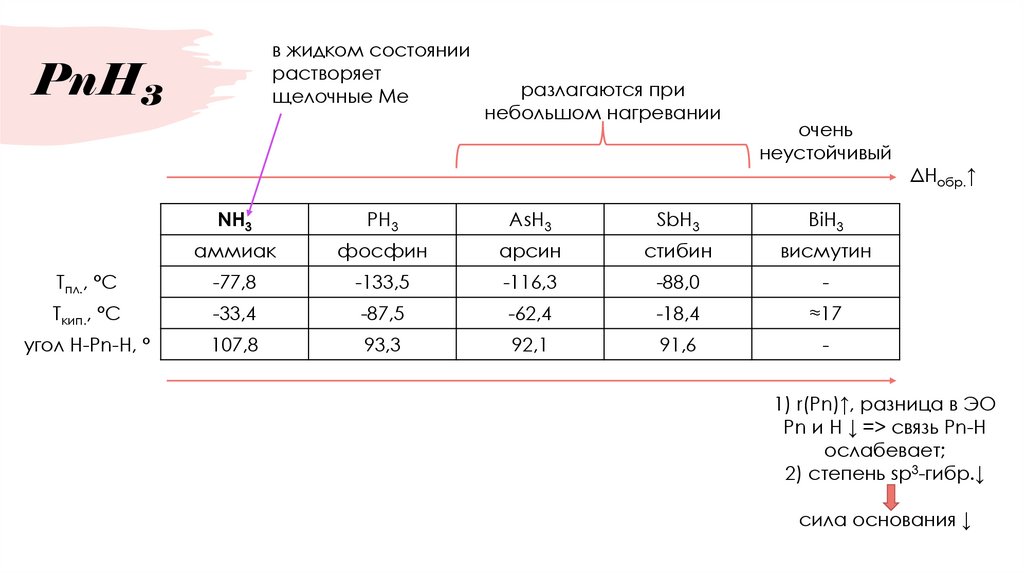
15. PnH3
в жидком состояниирастворяет
щелочные Ме
PnH3
разлагаются при
небольшом нагревании
очень
неустойчивый
NH3
PH3
AsH3
SbH3
BiH3
аммиак
фосфин
арсин
стибин
висмутин
Tпл., °С
-77,8
-133,5
-116,3
-88,0
-
Tкип., °С
-33,4
-87,5
-62,4
-18,4
≈17
угол H-Pn-H, °
107,8
93,3
92,1
91,6
-
ΔHобр.↑
1) r(Pn)↑, разница в ЭО
Pn и H ↓ => связь Pn-H
ослабевает;
2) степень sp3-гибр.↓
сила основания ↓
16. Химические свойства PnH3
1)Являются основаниями
NH3 + H2O NH4+ + OH- рKb=4,75
=> реагируют с кислотами
NH3 реагирует легче всего, PH3 только с сильными кислотами
PH3 + HI = PH4I
2) Окисление
NH3: 4NH3 + 3O2 = 2N2 + 6H2O без kat
за счет регулирования
потока газов через kat
4NH3 + 5O2 = 4NO + 6H2O kat Rh/Pt или Pt (быстро)
получают нужные
2NH3 + 2O2 = NH4NO3 + H2O kat Rh/Pt или Pt (медленно)
продукты реакции
PH3 + O2 = HPO3 + H2O
17. Реакции в жидком аммиаке
Хорошо растворимы нитраты, а также соли металлов,которые образуют с NH3 комплексы.
2AgCl + Ba(NO3)2 = 2AgNO3 + 2BaCl2
р. в NH3
NH4Br + KNH2 = 2NH3 + KBr (р. нейтрализации)
кислота
основание
Zn(NO3)2 + 4KNH2 = K2[Zn(NH2)4] + 2KNO3
тетраамидоцинкат калия
18. Получение PnH3
NH3PH3
Mg3N2 + 6H2O = 2NH3 +
3Mg(OH)2 (kat – щелочь)
2NH4Clтв. + Ca(OH)2тв. =
2NH3 + CaCl2 + 2H2O
KNO3 + 4Zn + 7KOH + 6H2O
= NH3 + 2K2[Zn(OH)4)
Zn3P2 + 6HCl = 2PH3 +
3ZnCl2
[PH4]I + KOH = PH3 + KI +
H2O
P4 + 3KOH + 3H2O = PH3 +
3KH2PO2
AsH3
SbH3
2K3AsO3 + 6Zn + 9H2SO4 = 2AsH3 + 6ZnSO4 +
3K2SO4 + 6H2O (аналогично из K3SbO3)
Процесс Боша-Габера:
N2 + 3H2 2NH3 ΔHпр.<0 (при низких t равновесие смещено вправо)
ΔS<0 (при t↑ равновесие смещается влево)
=> реакцию нужно
проводить при низких t
Однако при низких t прямая реакция идет очень медленно, т.к. N2 очень инертен. При повышении
t скорость реакции увеличивается, но также усиливается реакция разложения.
Оптимальный баланс между выходом аммиака и скоростью реакции достигнут при условиях:
P = 200 атм; t = 450 °C; kat Fe3O4 + Al2O3 + K2O + SO2
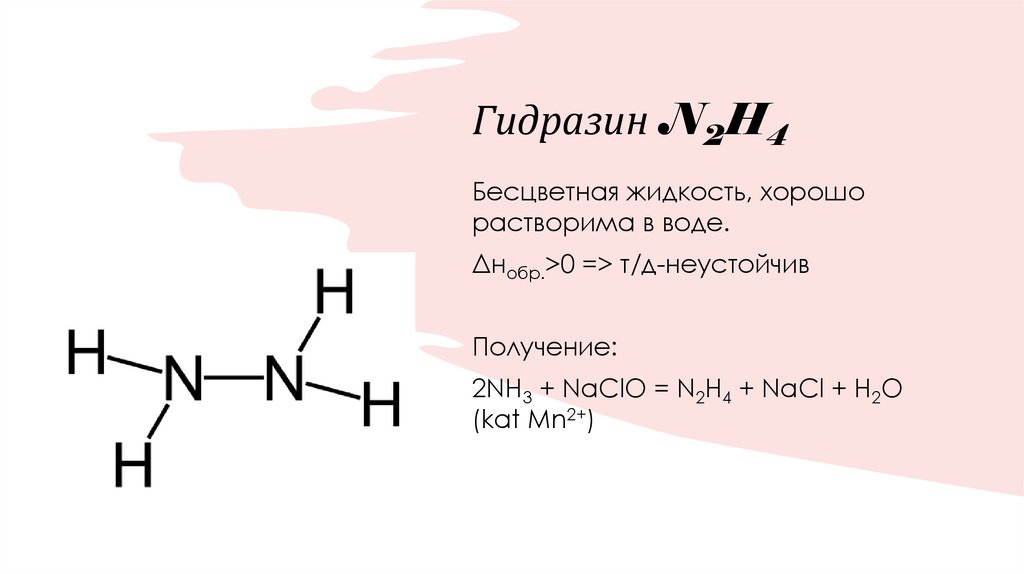
19. Гидразин N2H4
Бесцветная жидкость, хорошорастворима в воде.
Δнобр.>0 => т/д-неустойчив
Получение:
2NH3 + NaClO = N2H4 + NaCl + H2O
(kat Mn2+)
20. Химические свойства гидразина
1) является основанием: в молекуле N2H4 2 НЭП, по 1 НЭП укаждого атома азота => 2 ступени диссоциации:
N2H4 + H2O N2H5+ + OH- pKb1=6,01 (менее сильное
основание, чем аммиак)
N2H5+ + H2O N2H62+ + OH- pKb2≈14
2) окисление: N2H4 + O2 = N2 + 2H2O (при t)
3) разложение: 3N2H4 = N2 + 4NH3
4) гидразин и его соли являются сильными восстановителями:
N2H5Cl + KIO3 + HCl = N2 + KCl + ICl + 3H2O
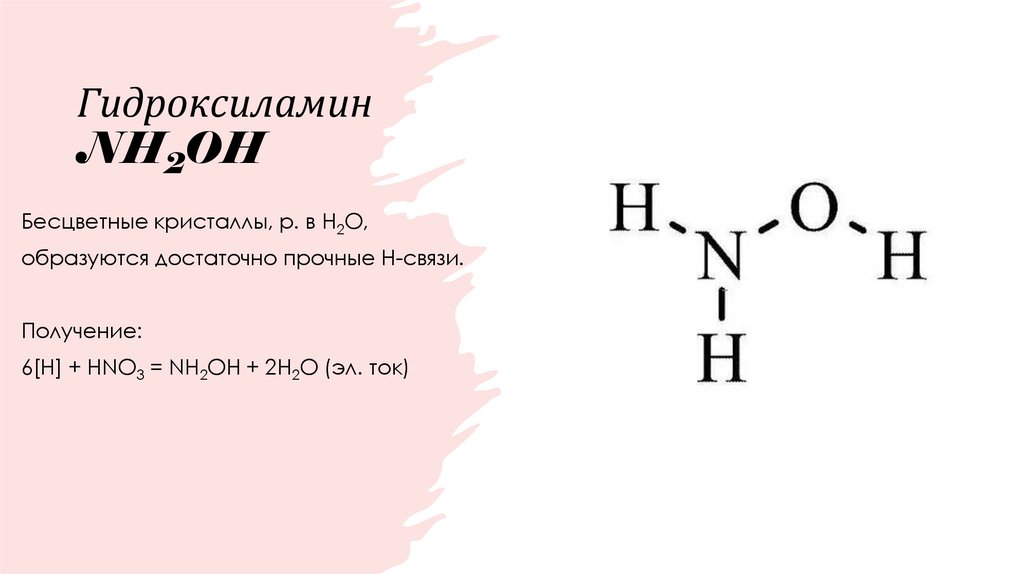
21. Гидроксиламин NH2OH
Бесцветные кристаллы, р. в H2O,образуются достаточно прочные Н-связи.
Получение:
6[H] + HNO3 = NH2OH + 2H2O (эл. ток)
22. Химические свойства гидроксиламина
1) является основанием: NH2OH + H2O NH3OH+ + OH- pKb=7,182) разложение: 3NH2OH = NH3 + N2 + 3H2O
3) гидроксиламин и его соли проявляют ОВД:
2NH2OH + I2 = N2 + 2HI + 2H2O
восстановитель
[NH3OH]Cl + FeCl2 + 2HCl = NH4Cl + FeCl3 + H2O
окислитель
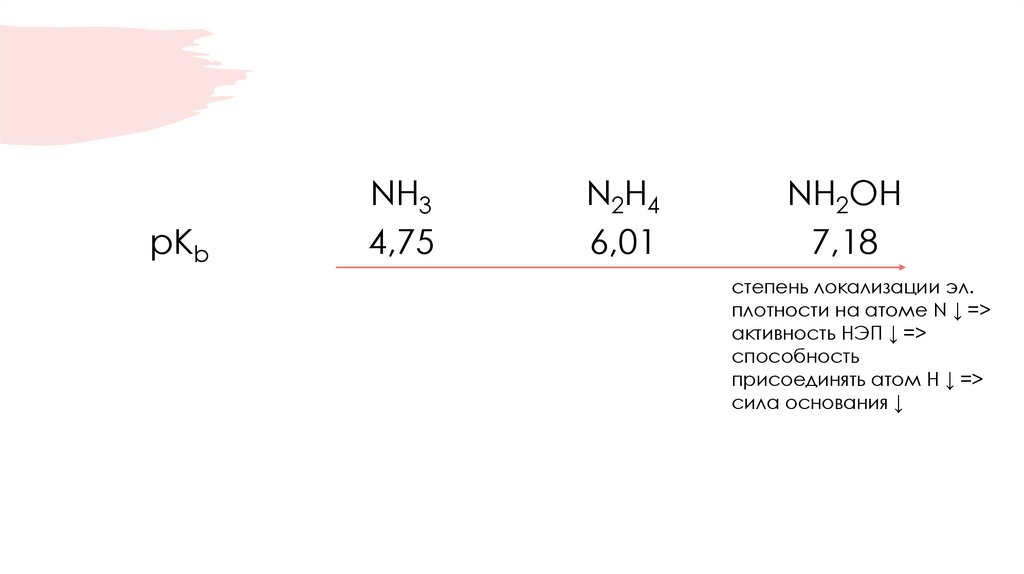
23.
pKbNH3
4,75
N2H4
6,01
NH2OH
7,18
степень локализации эл.
плотности на атоме N ↓ =>
активность НЭП ↓ =>
способность
присоединять атом Н ↓ =>
сила основания ↓
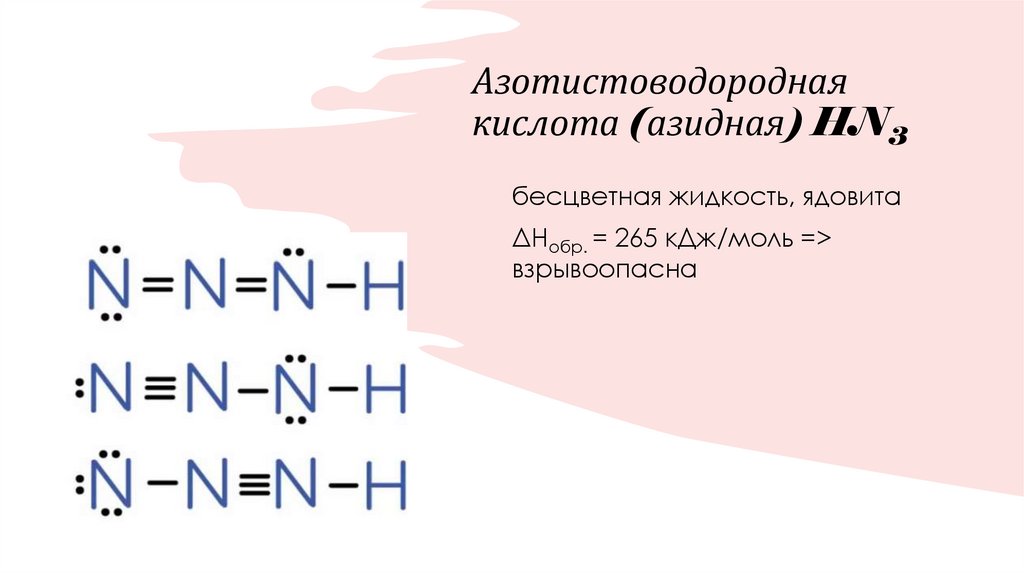
24. Азотистоводородная кислота (азидная) HN3
бесцветная жидкость, ядовитаΔНобр. = 265 кДж/моль =>
взрывоопасна
25.
Химические свойства HN3:1) является слабой кислотой: HN3 H+ + N3- pKa=4,76
2) является окислителем: Сu + 3HN3 = Cu(N3)2 + N2 + NH3
после Н
азид меди (II)
Получение:
2NaNH2 + N2O = NaN3 + NaOH + NH3 (200 °C)
2NaN3 + H2SO4 = Na2SO4 + 2HN3
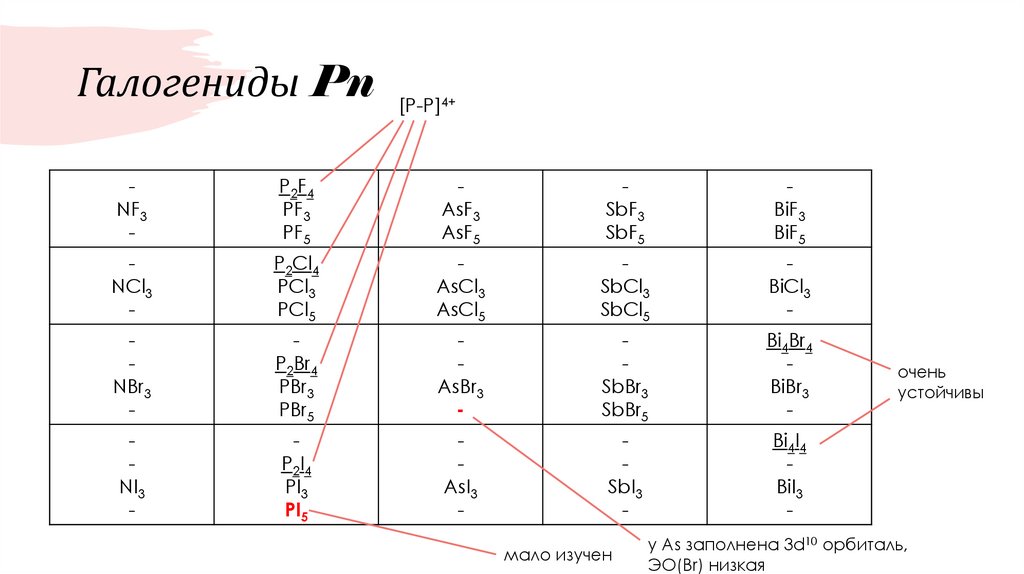
26. Галогениды Pn
[P-P]4+
NF3
-
P2F4
PF3
PF5
AsF3
AsF5
SbF3
SbF5
BiF3
BiF5
NCl3
-
P2Cl4
PCl3
PCl5
AsCl3
AsCl5
SbCl3
SbCl5
BiCl3
-
NBr3
-
P2Br4
PBr3
PBr5
AsBr3
-
SbBr3
SbBr5
Bi4Br4
BiBr3
-
NI3
-
-
AsI3
-
SbI3
-
Bi4I4
BiI3
-
P2I4
PI3
PI5
мало изучен
очень
устойчивы
у As заполнена 3d10 орбиталь,
ЭО(Br) низкая
27. NГ3
• N+3F-13 НЭП почти не активна => высокая устойчивость; газ,низкие Тпл. И Ткип.
Получение: 4NH3 + 3F2 = NF3 + 3NH4F (kat – Cu)
Свойства: 1) NF3 + H2 = N2 + HF свечение;
2) Не реагирует с Н2О, Н+ и ОН• N-3Cl+13 маслянистая жидкость, получают аналогично NF3
Свойства: 1) NCl3 + H2O = 2HOCl+1 + NH3
• N-3Br3
разлагаются при низких температурах
-3
• N I3
устойчивость ↓
28. Царская водка
HNO3 + 3HCl = NOCl + Cl2 + 2H2Oнитрозил хлорид
(окислитель)
(окислитель)
29. Галогениды фосфора
PF3PCl3
PBr3
PI3
газ, бесцветный
жидкость,
бесцветный
жидкость,
бесцветный
твердый, желтокрасный
разлагается при 61 °С
2PI3 = P2I4 + I2
реагирует с водой
очень медленно
гигроскопичны
PГ3 + 3H2O = H3PO3 + 3HГ
PF5
PCl5
PBr5
PI5
газ, бесцветный
твердый, бесцветный
твердый, желтый
[PCl4]+[PCl6]-
[PBr4]+Br-
очень неустойчив,
не исследован
[PF5]
гигроскопичны
PГ5 + 4H2O = H3PO3 + 5HГ
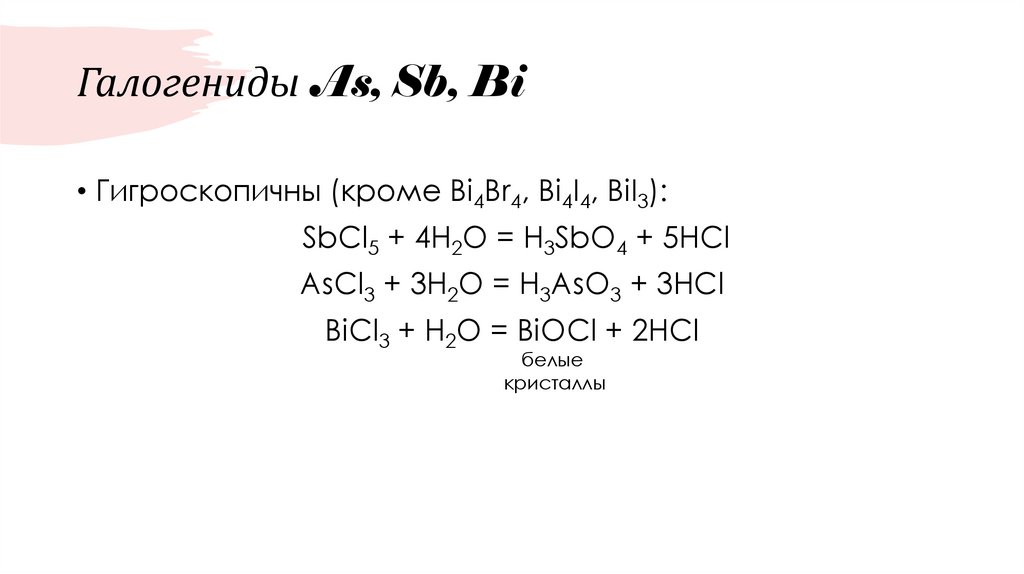
30. Галогениды As, Sb, Bi
• Гигроскопичны (кроме Bi4Br4, Bi4I4, BiI3):SbCl5 + 4H2O = H3SbO4 + 5HCl
AsCl3 + 3H2O = H3AsO3 + 3HCl
BiCl3 + H2O = BiOCl + 2HCl
белые
кристаллы
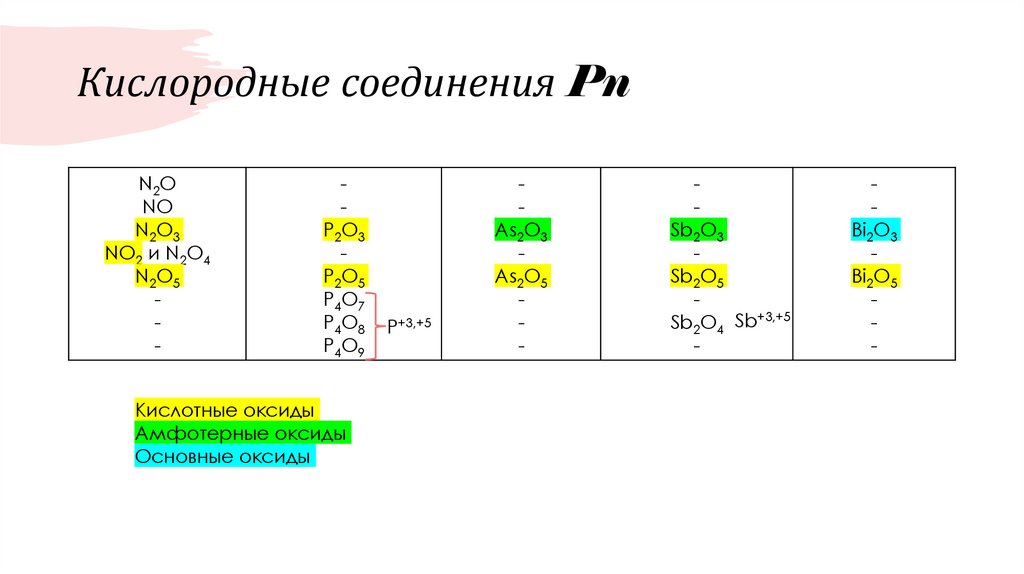
31. Кислородные соединения Pn
N2ONO
N2O3
NO2 и N2O4
N2O5
-
P2O3
P2O5
P4O7
P4O8
P4O9
Кислотные оксиды
Амфотерные оксиды
Основные оксиды
Р+3,+5
As2O3
As2O5
-
Sb2O3
Sb2O5
Sb2O4 Sb+3,+5
-
Bi2O3
Bi2O5
-
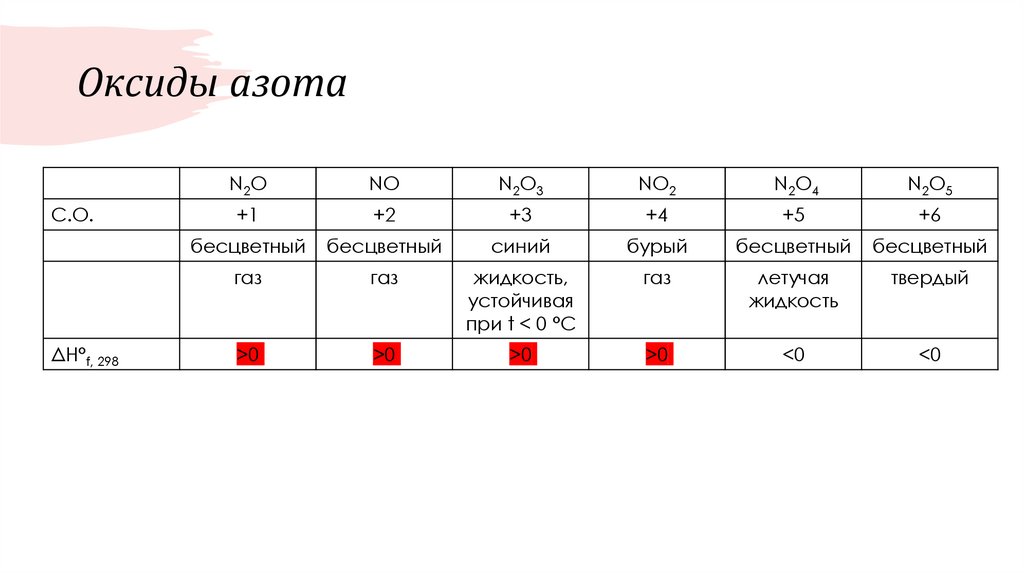
32. Оксиды азота
С.О.ΔH°f, 298
N2O
NO
N2O3
NO2
N2O4
N2O5
+1
+2
+3
+4
+5
+6
бесцветный
бесцветный
синий
бурый
бесцветный
бесцветный
газ
газ
жидкость,
устойчивая
при t < 0 °C
газ
летучая
жидкость
твердый
>0
>0
>0
>0
<0
<0
33. N2O «веселящий газ», закись азота
Получение: NH4NO3 = N2O + 2H2O (250 °C)NH2OH + HNO2 = N2O + 2H2O
Химические свойства:
1) поддерживает горение С + 2N2O = CO2 + 2N2
Резонансные
структуры
рассмотреть
самостоятельно!!!
34. NO монооксид азота
Получение:- в промышленности
4NH3 + 5O2 = 4NO + 6H2O (1000 °с,
kat Rh/Pt)
- в лаборатории
3Сu + 8HNO3 (30 %) = 3Cu(NO3)2 +
2NO + 4H2O
2KNO2 + 2KI + 2H2SO4 = 2K2SO4 + I2 +
2NO + 2H2O
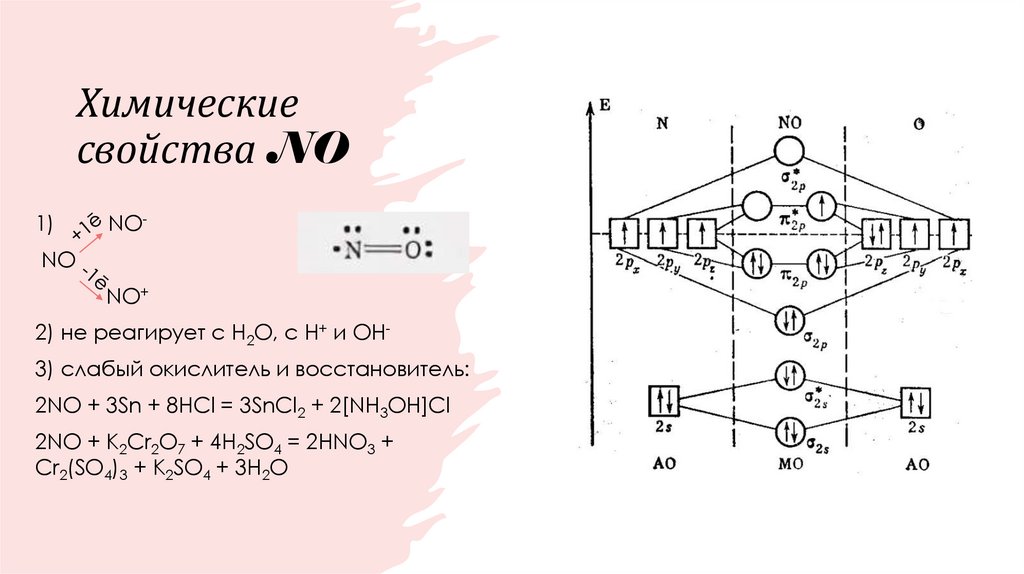
35. Химические свойства NO
1)NO-
NO
NO+
2) не реагирует с Н2О, с Н+ и ОН3) слабый окислитель и восстановитель:
2NO + 3Sn + 8HCl = 3SnCl2 + 2[NH3OH]Cl
2NO + K2Cr2O7 + 4H2SO4 = 2HNO3 +
Cr2(SO4)3 + K2SO4 + 3H2O
36. N2O3 азотистый ангидрид
Получение: NO + NO2 N2O3Химические свойства:
1) N2O3 + H2O 2HNO2
2) разлагается при низких
температурах
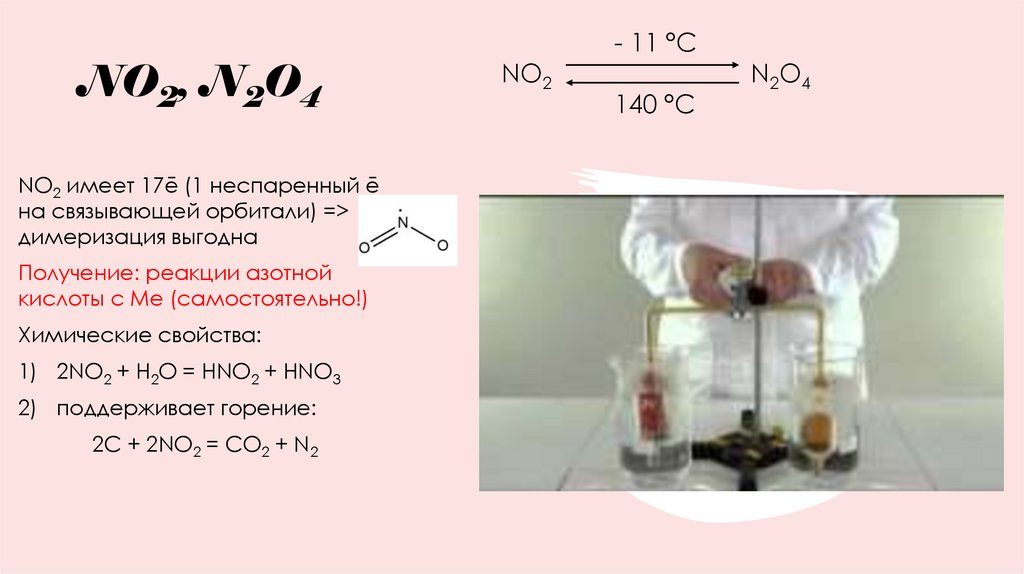
37. NO2, N2O4
NO2 имеет 17ē (1 неспаренный ēна связывающей орбитали) =>
димеризация выгодна
Получение: реакции азотной
кислоты с Ме (самостоятельно!)
Химические свойства:
1) 2NO2 + H2O = HNO2 + HNO3
2) поддерживает горение:
2С + 2NO2 = CO2 + N2
NO2
- 11 °C
140 °C
N2O4
38. N2O5 азотный ангидрид
Получение: 2HNO3 + P2O5 = N2O5 + 2HPO3Химические свойства:
1) взрывоопасен, т. к. является очень сильным
окислителем => присутствие восстановителя может
вызвать очень бурную реакцию;
2) N2O5 + I2 = I2O5↓ + N2
белый
39. Оксиды фосфора
P2O3P2O5
белый, твердый
белый, твердый
молекулярная структура
молекулярная структура
4P + 3O2 = 2P2O3 (при t)
4P + 5O2(изб.) = 2P2O5 (при t)
P2O3 + 3H2O = 2H3PO3 (является в-лем)
P2O5 + 3H2O = 2H3PO4 (не является в-лем)
сильное водоотнимающее средство
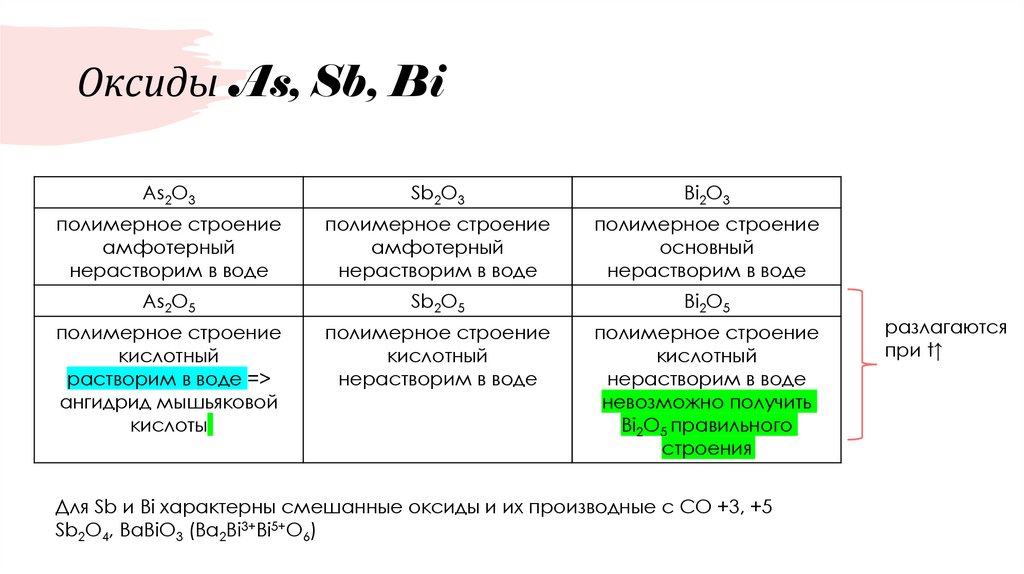
40. Оксиды As, Sb, Bi
As2O3Sb2O3
Bi2O3
полимерное строение
амфотерный
нерастворим в воде
полимерное строение
амфотерный
нерастворим в воде
полимерное строение
основный
нерастворим в воде
As2O5
Sb2O5
Bi2O5
полимерное строение
кислотный
растворим в воде =>
ангидрид мышьяковой
кислоты
полимерное строение
кислотный
нерастворим в воде
полимерное строение
кислотный
нерастворим в воде
невозможно получить
Bi2O5 правильного
строения
Для Sb и Bi характерны смешанные оксиды и их производные с СО +3, +5
Sb2O4, BaBiO3 (Ba2Bi3+Bi5+O6)
разлагаются
при t↑
41. Химические свойства оксидов As, Sb, Bi
1)Взаимодействие с водой (только As2O5):
As2O5 + 3H2O = 2H3AsO4
2) Взаимодействие с щелочами (кроме Bi2O3):
As2O3 + 6KOH = 2K3AsO3 + 3H2O
арсенит калия
3) Взаимодействие с кислотами (кроме As2O5):
Sb2O3 + 3H2SO4 = Sb2(SO4)3 + 3H2O (Sb является металлоидом)
Sb2O5 + 12HCl = 2H[SbCl]6 + 5H2O
4) As2O5, Sb2O5, Bi2O5 – сильные окислители
Bi2O5 >> Sb2O5 ≈ As2O5 >> P2O5 (не ок-ль)
Sb2O5(тв.) + 10HCl(конц.) = 2SbCl3 + 2Cl2 + 5H2O
42. Кислородсодержащие кислоты азота
1) Азотноватистая кислота H2N2O2очень неустойчивая, рКа=7
Получение: - NH2OH + HNO2 = H2N2O2 + H2O (низкий выход)
- Ag2N2O2 + 2HCl = H2N2O2 + 2AgCl
Химические свойства: - H2N2O2 = N2O + H2O (при t)
- c щелочами образует гипонитриты
43.
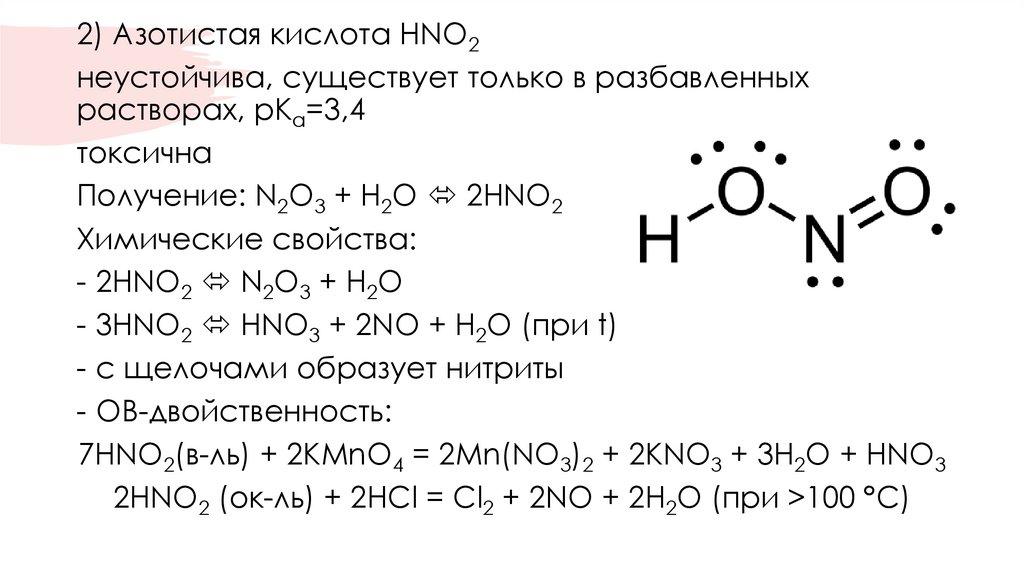
2) Азотистая кислота HNO2неустойчива, существует только в разбавленных
растворах, pKa=3,4
токсична
Получение: N2O3 + H2O 2HNO2
Химические свойства:
- 2HNO2 N2O3 + H2O
- 3HNO2 HNO3 + 2NO + H2O (при t)
- с щелочами образует нитриты
- ОВ-двойственность:
7HNO2(в-ль) + 2KMnO4 = 2Mn(NO3)2 + 2KNO3 + 3H2O + HNO3
2HNO2 (ок-ль) + 2HCl = Cl2 + 2NO + 2H2O (при >100 °C)
44.
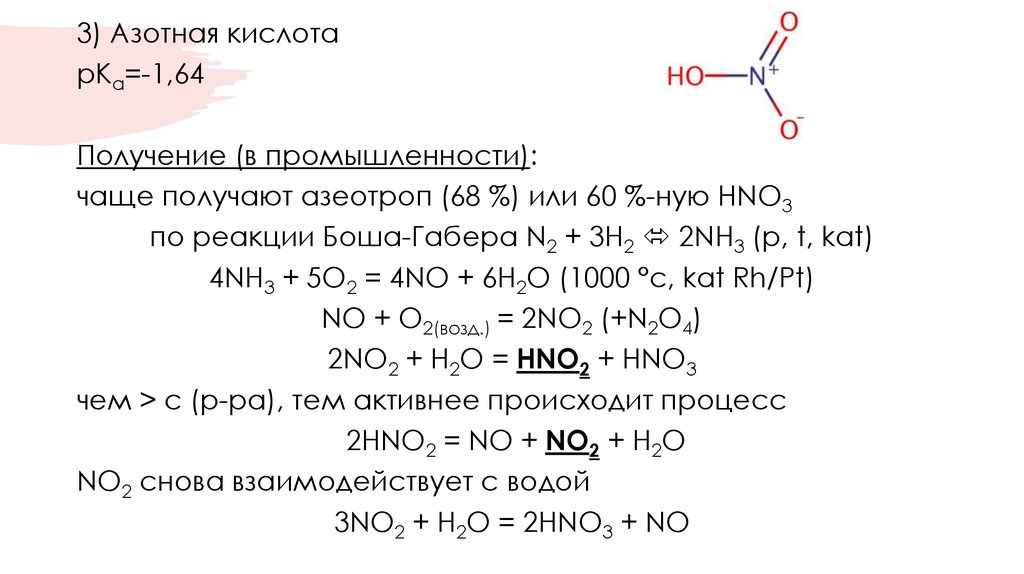
3) Азотная кислотарКа=-1,64
Получение (в промышленности):
чаще получают азеотроп (68 %) или 60 %-ную HNO3
по реакции Боша-Габера N2 + 3H2 2NH3 (p, t, kat)
4NH3 + 5O2 = 4NO + 6H2O (1000 °с, kat Rh/Pt)
NO + O2(возд.) = 2NO2 (+N2O4)
2NO2 + H2O = HNO2 + HNO3
чем > c (р-ра), тем активнее происходит процесс
2HNO2 = NO + NO2 + H2O
NO2 снова взаимодействует с водой
3NO2 + H2O = 2HNO3 + NO
45. Химические свойства HNO3
• разлагается 4HNO3 = 4NO2 + O2 + 2H2O• реагирует почти со всеми Ме (нарисовать схему
самостоятельно!);
• с неМе (хуже, чем с Ме, часто только б/в. HNO3):
S + 6HNO3 = 2H2O + 6NO2 + H2SO4
46. Нитраты
1) Разлагаются при t (нарисовать схему самостоятельно!);2) Являются окислителями в H+ или в расплаве:
MnO2(тв.) + 2KOH(ж.) + KNO3(ж.) = K2MnO4 + KNO2 + H2O (расплав)
47. ОВ-способность О-содержащих кислот и солей азота
• у N в положительной СО окислительные свойства вышев Н+, чем в ОН• у N в отрицательной СО восстановительные свойства
выше в ОН-, чем в Н+
• в Н+ N во всех СО диспропорционирует с
образованием N2, HNO3, NH4+
• в ОН- NO и N2O4 сопропорционируют:
2NO + N2O4 + 4OH- = 4NO2- + 2H2O
48. Кислородсодержащие кислоты фосфора
H3P+1O2H3P+3O3
H4P+42O6
фосфорноватистая
гипофосфиты
фосфористая
фосфиты
фосфорноватая
фосфонаты
H3P+5O4
H4P+52O7
(HP+5O3)n (n=3,4)
H5P+53O10
фосфорная
фосфаты
пирофосфорная
пирофосфаты
метафосфорная
метафосфаты
(полифосфаты)
трифосфорная
трифосфаты
49.
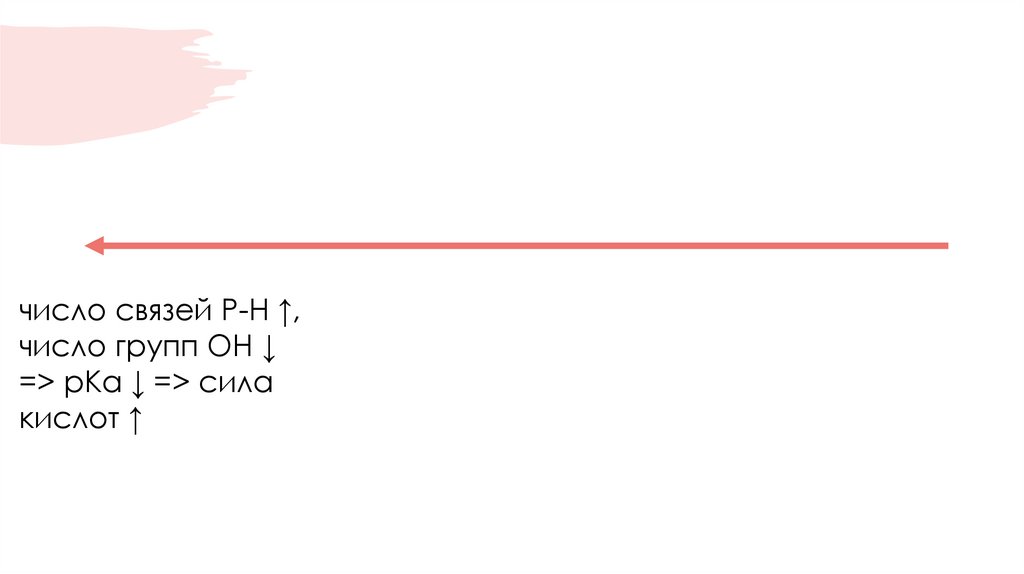
число связей Р-Н ↑,число групп ОН ↓
=> рКа ↓ => сила
кислот ↑
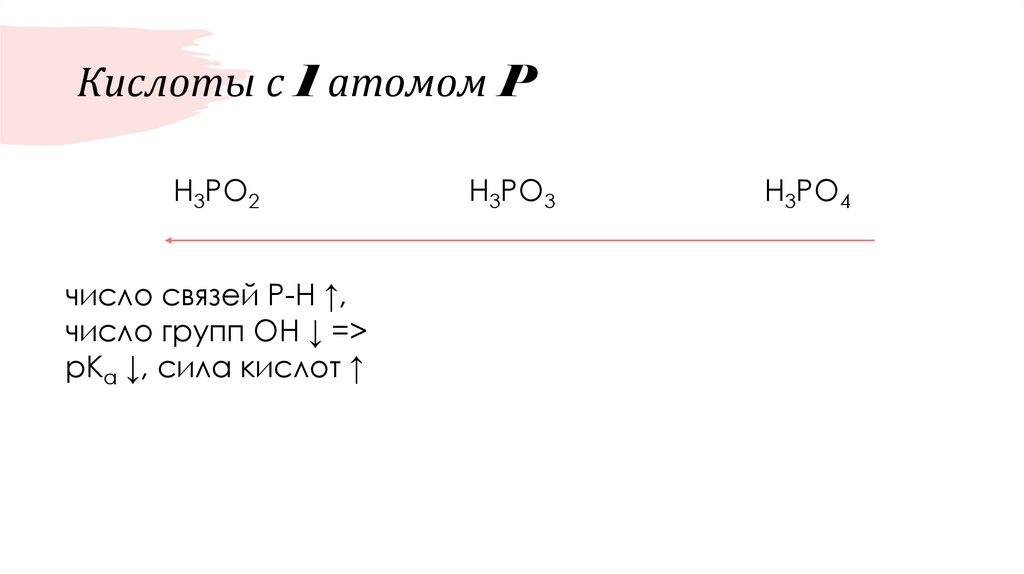
50. Кислоты с 1 атомом P
H3PO2число связей Р-Н ↑,
число групп ОН ↓ =>
pKa ↓, сила кислот ↑
H3PO3
H3PO4
51.
рКа ↓ => силакислот ↑
52. Кислоты с 2 атомами P
H4P2O6H4P2O7
pKa ↓, сила кислот ↑
4-основные, но образуют только 2 ряда солей:
4-замещенные и 2-замещенные
53. Фосфорноватистая кислота H3PO2
Получение: Ba(H2PO2)2 + H2SO4 = 2H3PO2 + BaSO4Химические свойства:
1) диспропорционирует при t:
H3PO2 = H3PO4 + PH3
2) кислота и ее соли являются восстановителями:
H3PO2 + 4FeCl3 + 2H2O = H3PO4 + 4FeCl2 + 4HCl
NaH2PO2 + 4AgNO3 + 2H2O = 4Ag + H3PO4 + NaNO3 + 3HNO3
(без t)
54. Фосфористая кислота H3PO3
Получение: P2O3 + 3H2O = 2H3PO3Химические свойства:
1) диспропорционирует при t: 4H3PO3 = PH3 + 3H3PO4
2) кислота и ее соли являются < сильными
восстановителями, чем фосфорноватистая:
2AgNO3 + Na2HPO3 + H2O → 2Ag + H3PO4 + 2NaNO3 (при t)
без t – реакция обмена с образованием белого осадка
фосфита серебра
55. Фосфорноватая кислота H4P2O6
Растворима в воде, соли не растворимыПолучение: 2Pкр. + 4NaClO + 2NaOH = Na2H2P2O6↓ +
4NaCl
Химические свойства:
• диспропорционирует при комнатной температуре
H4P2O6 + H2O = H3PO4 + H3PO3
56. Пирофосфорная H4P2O7 и метафосфорная (HPO3)n кислоты
250 °C400 °C
2
2
Получение: 2H3PO4 -→
H4P2O7 -→
2HPO3
HO
HO
Химические свойства:
Na4P2O7 + 4AgNO3 = Ag4P2O7↓ + 4NaNO3
белый
при t не разлагается
57. Фосфорная кислота H3PO4
Не разлагается, кислота и соли не являются окислителямиH2PO4- все соли растворимы
HPO42- растворимы соли щелочных Ме (кроме Li)
PO43Могут растворяться в кислотах за счет изменения концентраций ионов:
Na3PO4 + 3AgNO3 = 3NaNO3 + Ag3PO4↓
Ag3PO4 + 3HNO3 = H3PO4 + AgNO3
Кач. р. на PO43-:
7H3PO4 + 12(NH4)6Mo7O24 + 51HNO3 → 7(NH4)3(PMo12O40)· 3H2O + 15H2O +
51NH4NO3
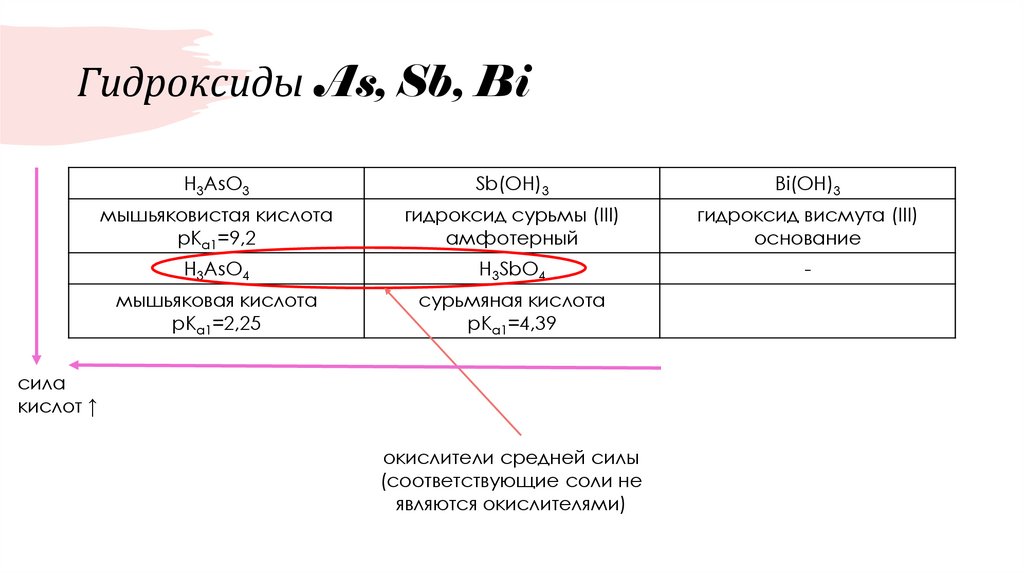
58. Гидроксиды As, Sb, Bi
H3AsO3Sb(OH)3
Bi(OH)3
мышьяковистая кислота
рКа1=9,2
гидроксид сурьмы (III)
амфотерный
гидроксид висмута (III)
основание
H3AsO4
H3SbO4
-
мышьяковая кислота
рКа1=2,25
сурьмяная кислота
рКа1=4,39
сила
кислот ↑
окислители средней силы
(соответствующие соли не
являются окислителями)
59. Получение гидроксидов As, Sb, Bi
Только H3AsO4 можно получить из соответствующегооксида:
As2O5 + 3H2O = 2H3AsO4
2SbCl3 + 3Na2CO3 + 3H2O = 2Sb(OH)3 + 6NaCl + 3CO2
Bi(NO3)3 + 3NaOH = Bi(OH)3↓ (раств. в кислотах) + 3NaNO3
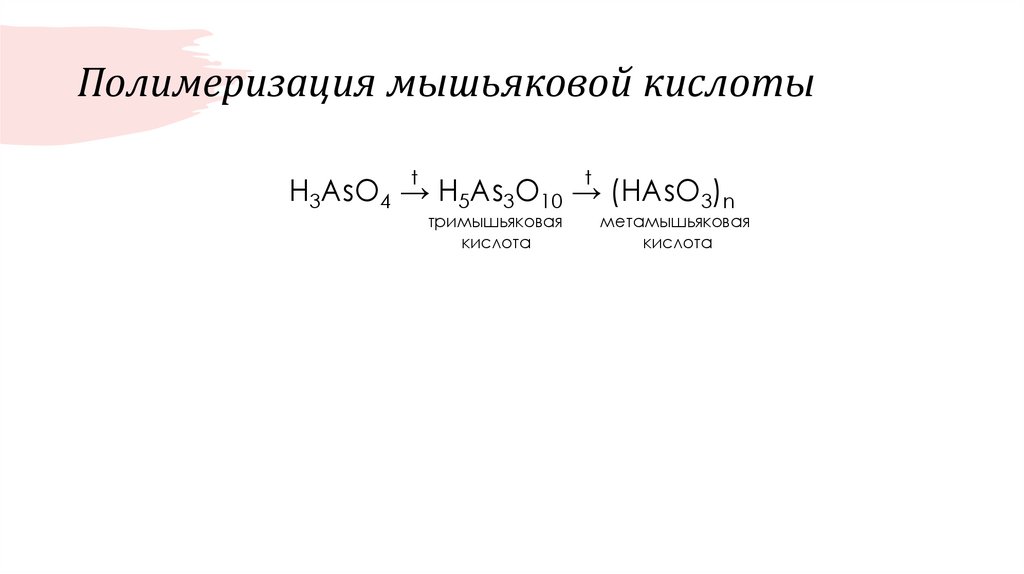
60. Полимеризация мышьяковой кислоты
tt
H3AsO4 → H5As3O10 → (HAsO3)n
тримышьяковая
кислота
метамышьяковая
кислота
61.
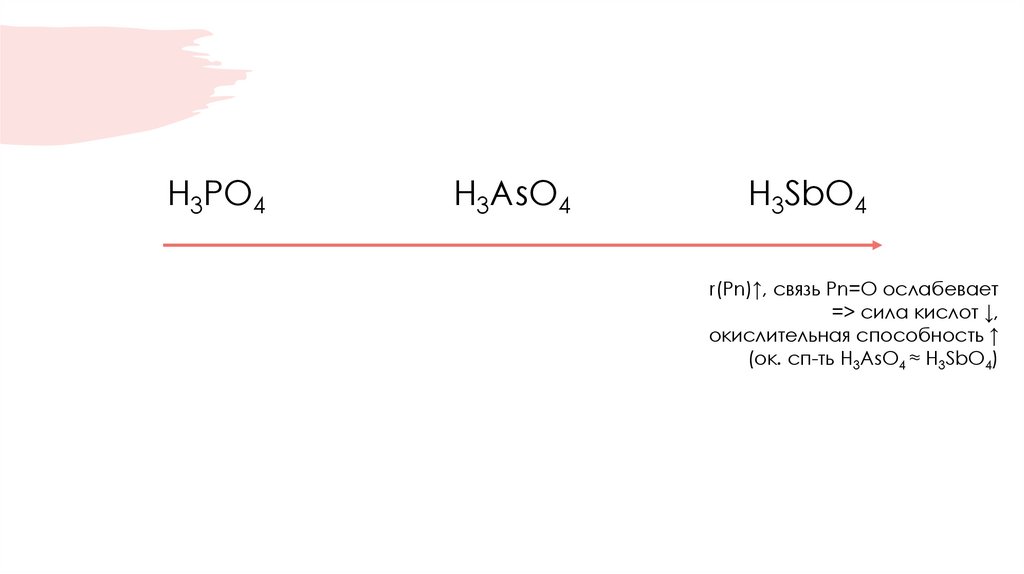
H3PO4H3AsO4
H3SbO4
r(Pn)↑, связь Pn=O ослабевает
=> сила кислот ↓,
окислительная способность ↑
(ок. сп-ть H3AsO4 ≈ H3SbO4)
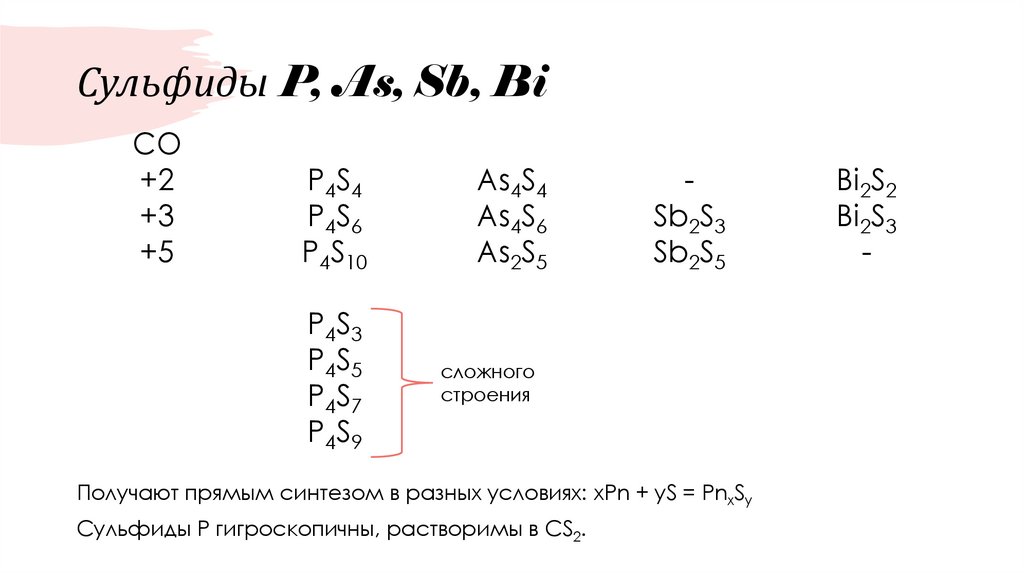
62. Сульфиды P, As, Sb, Bi
CO+2
+3
+5
P4S4
P4S6
P4S10
As4S4
As4S6
As2S5
P4S3
P4S5
P4S7
P4S9
сложного
строения
Sb2S3
Sb2S5
Получают прямым синтезом в разных условиях: xPn + yS = PnxSy
Сульфиды Р гигроскопичны, растворимы в CS2.
Bi2S2
Bi2S3
-
63. Применение
АзотСоздание инертной атмосферы, синтез аммиака, охлаждение (до 77 К), для
заполнения электрических ламп
Фосфор
Производство фосфорных удобрений (минералы), в пищевой
промышленности (H3PO4), в химическом синтезе (P2O5, PCl3), в качестве
растворителя (PCl3)
Мышьяк
Инсектициды, полупроводники, в качестве катализаторов
Сурьма
В электронной технике (Sb, Sb2S3), в качестве катализаторов
Висмут
В легкоплавких сплавах, в качестве катализаторов, в качестве красителей (Bi2O3)



































 chemistry
chemistry