Similar presentations:
22-25. Сера и ее соединения
1. Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород
2. Элементы VI группы главной подгруппы.
O• S
• Se
• Te
• Po
Халькогены, т.е
«рождающие руды».
3. Se и Te -минералов не образуют Ро - очень редкий радиоактивный элемент
4. Сера
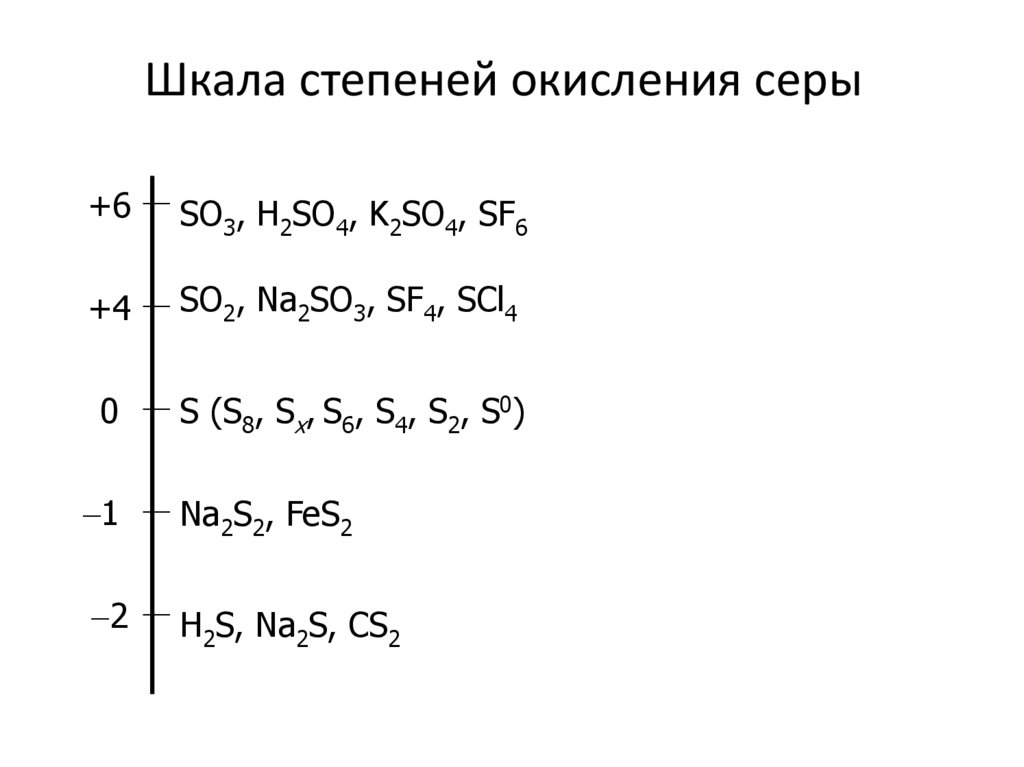
5. Шкала степеней окисления серы
+6SO3, H2SO4, K2SO4, SF6
+4
SO2, Na2SO3, SF4, SCl4
0
S (S8, Sx, S6, S4, S2, S0)
1
Na2S2, FeS2
2
H2S, Na2S, CS2
6.
7.
8.
9.
10.
11.
— твердое агрегатноесостояние
— желтого цвета
— не растворима в воде
— не смачивается водой
— растворяется в
органических
растворителях
12.
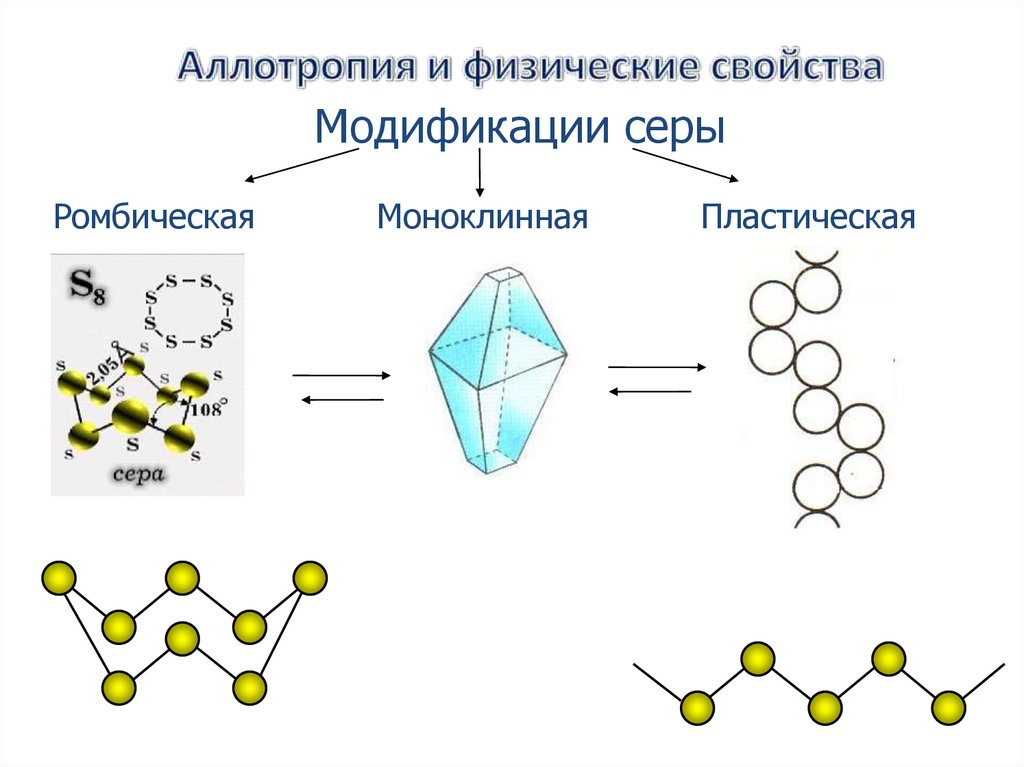
Модификации серыРомбическая
Моноклинная
Пластическая
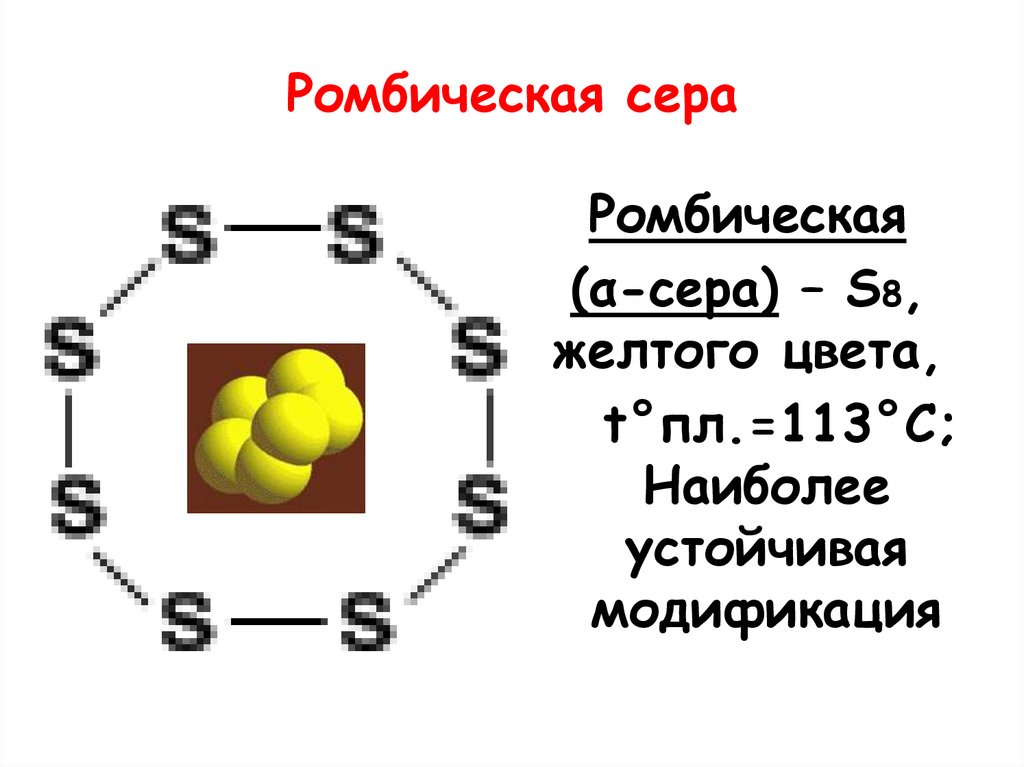
13. Ромбическая сера
Ромбическая(α-сера) – S8,
желтого цвета,
t°пл.=113°C;
Наиболее
устойчивая
модификация
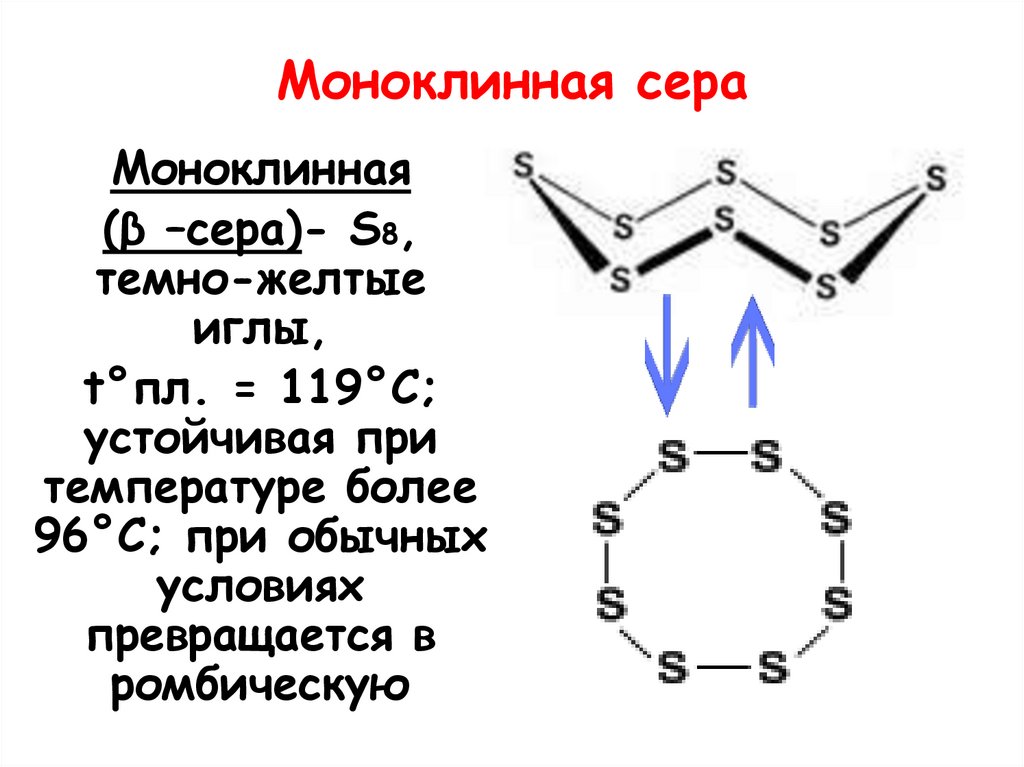
14. Моноклинная сера
Моноклинная(β –сера)- S8,
темно-желтые
иглы,
t°пл. = 119°C;
устойчивая при
температуре более
96°С; при обычных
условиях
превращается в
ромбическую
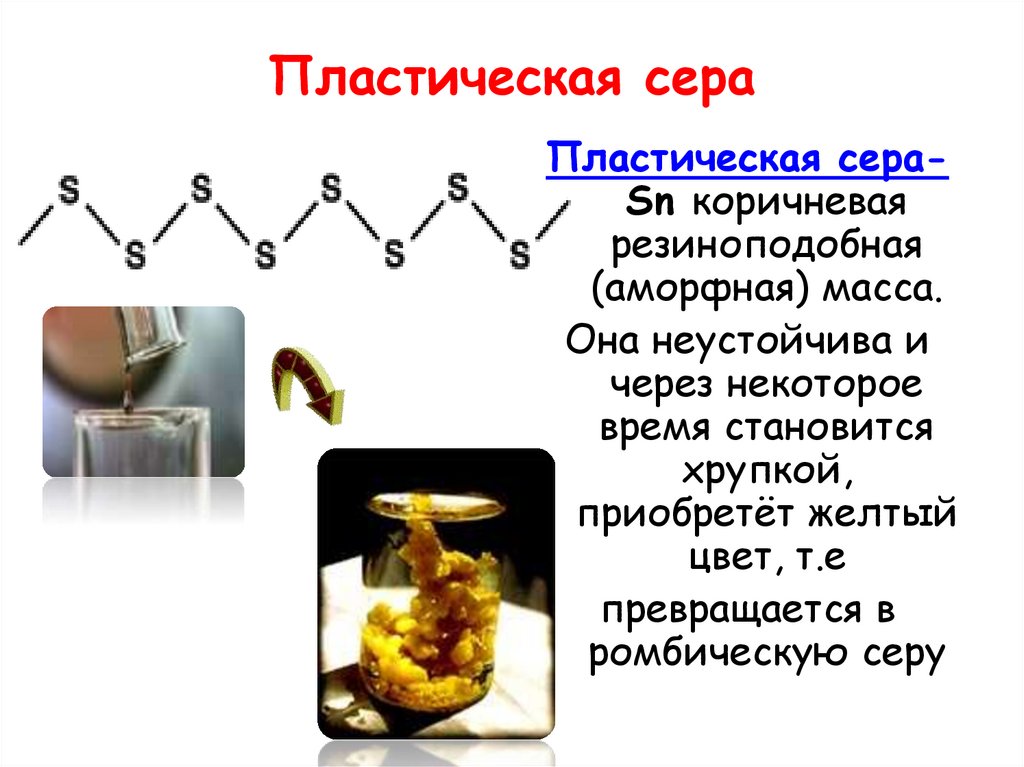
15. Пластическая сера
Пластическая сераSn коричневаярезиноподобная
(аморфная) масса.
Она неустойчива и
через некоторое
время становится
хрупкой,
приобретёт желтый
цвет, т.е
превращается в
ромбическую серу
16.
Пластическаясера
Резиноподобное вещество
коричневого цвета.
17.
18.
Получение.1. Выплавление из горных пород
FeS2 → FeS + S (без доступа воздуха)
2. В лаборатории
Неполное окисление сероводорода (при
недостатке кислорода).
1) H2S + O2 → S + Н2О
2) H2SO3 + H2S → S + H2O
19.
Химические свойства серыВзаимодействует со многими
металлами, кроме золота и платины:
Mg + S = MgS
2Al + 3S = Al2S3
Cu + S = CuS
Hg + S = HgS
20.
Химические свойства серыИз неметаллов с серой не реагируют
только азот, йод и благородные газы.
S + O2 = SO2
H2 + S = H2S
21.
Химические свойства серыВзаимодействие с кислотами
S +
H2SO4(конц.) = SO2 ↑ + H2O
S + HNO3 (конц.) = H2SO4 + NO2↑ + H2O
22.
Химические свойства серыВзаимодействие со щелочами
S + KOH = K2S + K2SO3 + H2O
23. СЕРА в организме человека
• Сера входит в составбелков(волосы)
• Сера- составная часть
активных веществ:
витаминов и гормонов
• При недостатке серы в
организме наблюдаются
хрупкость и ломкость
костей, выпадение
волос.
24. Применение серы
25. Домашнее задание
• Параграф 13• Напишите уравнения реакций, с помощью
которых можно осуществить цепочки
превращений веществ:
А) Сера→сероводород → сульфид калия
→сульфид меди (II)
Б) Сера→сероводород → сера→сульфид
меди (II)→ оксид серы (IV)
В уравнениях ОВР расставьте коэффициенты
методом электронного баланса, укажите
окислитель и восстановитель.
26. Сероводород.
27.
28.
Сероводород в природеВходит в состав вулканических газов. Образуется при
гниении белков. Встречается в минеральных
источниках (Мацеста, Пятигорск, Кавказ).
29.
Физические свойстваГаз, без цвета, с запахом тухлых яиц, ядовит (в
больших концентрациях без запаха), тяжелее
воздуха, растворим в воде (в 1V H2O растворяется
2,4V H2S при н.у.); t°пл = -86°C; t°кип = -60°С.
Ядовит! Способен взаимодействовать с железом,
входящим в гемоглобин крови.
Работать с
сероводородом в
вытяжном шкафу и
герметичных
приборах!
30.
Влияние сероводорода на организмОчень ядовит. Даже один вздох чистого
сероводорода ведет к потере сознания из-за
паралича дыхательного центра.
Его коварство заключается в том, что после
легкого
отравления
его
запах
перестает
ощущаться.
31.
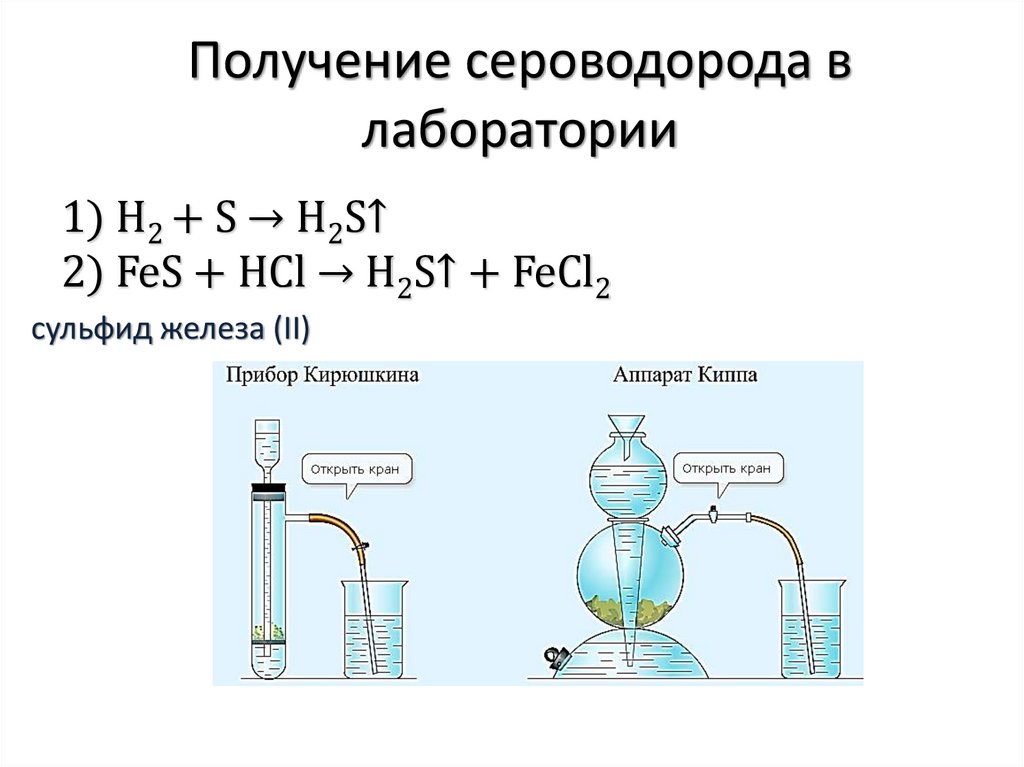
Получение сероводорода влаборатории
1) H2 + S → H2S↑
2) FeS + HCl → H2S↑ + FeCl2
cульфид железа (II)
32. Химические свойства:
33.
1) Горение сероводорода.Полное сгорание (при избытке O2)
H2S + O2 → SO2 + H2O
Неполное сгорание (недостаток O2)
H2S + O2 → S + H2O
34.
2)Восстановительные
галогенами,
солями,
кислотами).
свойства
(с
кислородом,
H2S-2 + Br2 → S0 + HBr
H2S-2 + FeCl3 → FeCl2 + S0 + HCl
35.
3) Взаимодействие с водой.Раствор H2S в воде – слабая двухосновная кислота
(сероводородная кислота)
Диссоциация происходит в две ступени:
I ст. H2S⇄ H+ + HS- (гидросульфид - ион)
II ст. HS- ⇄ H+ + S2- (сульфид-ион)
Средние соли(сульфиды): Na2S – сульфид натрия
CaS – сульфид кальция
Кислые соли(гидросульфиды):
NaHS – гидросульфид натрия
Ca(HS)2 – гидросульфид кальция
36.
4) Кислотные свойства.Взаимодействует с основаниями:
H2S + 2NaOH изб. → Na2S+ 2H2O
сульфид натрия
H2S изб. + NaOH → NaHS + H2O
гидросульфид натрия
37.
5) Качественная реакция насероводородную кислоту и сульфиды.
Н2S + Pb(NO3)2 → PbS↓ + 2HNO3
K2S + Cu(NO3)2 → CuS↓ + 2KNO3
38.
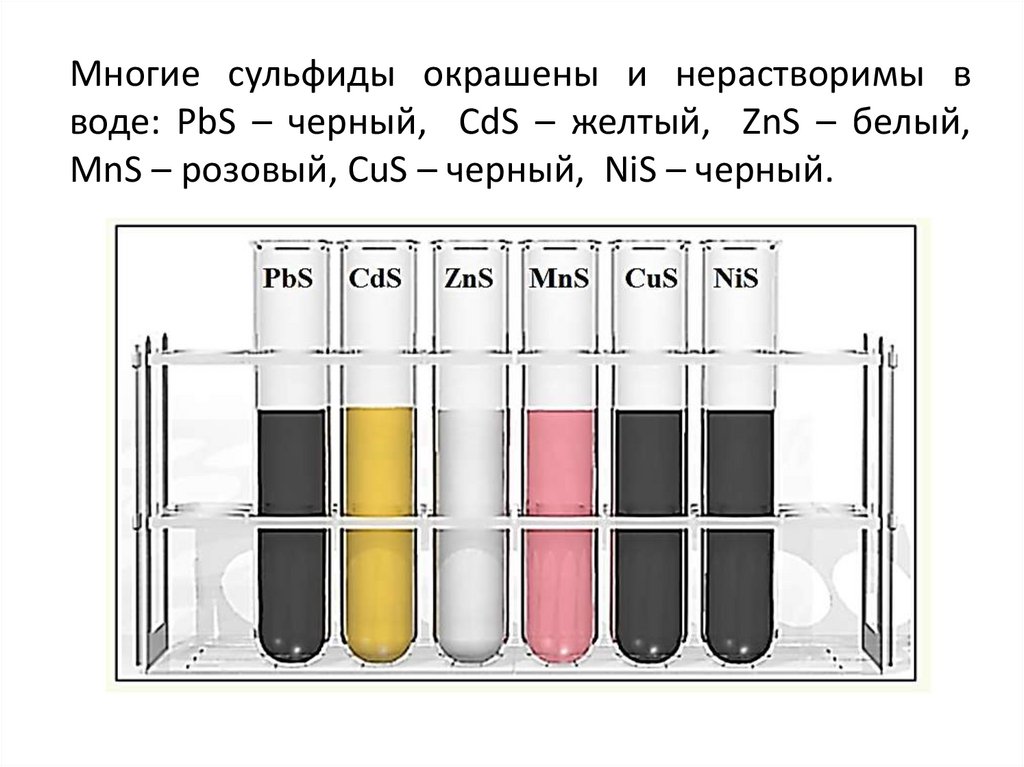
Многие сульфиды окрашены и нерастворимы вводе: PbS – черный, CdS – желтый, ZnS – белый,
MnS – розовый, CuS – черный, NiS – черный.
39.
Применение сероводородаСероводород из-за своей токсичности
находит ограниченное применение.
В медицине - в составе природных и
искусственных
сероводородных
ванн
(нормализует работу сердца и нервной
системы,
артериальное
давление,
используют при кожных заболеваниях.
Сероводород
применяют
для
получения
серной
кислоты,
серы,
сульфидов.
40. Домашнее задание
• Параграф 14• Вычислите объем сернистого газа,
полученного при сжигании 100 л
сероводорода, содержащего 15%
негорючих примесей.
41. Оксиды серы. Серная кислота.
42. Оксид серы (IV)
SO2Физические свойства: При обычной
температуре SO2 - газ с резким запахом, без
цвета, тяжелее воздуха. В воде растворим
хорошо - при 20°С в 1 л воды растворяется 40
л SO2. SO2 - ядовит
43. Оксид серы (VI)
SO3 – оксид серы (VI), триоксид серы, серныйангидрид
Физические свойства: при обычных условиях
представляет собой бесцветную жидкость с
резким запахом. На воздухе SO3 «дымит» и
сильно поглощает влагу. SO3 – тяжелее воздуха,
хорошо растворим в воде. SO3 ядовит
44. Кислотные оксиды
Химические свойства:1) Взаимодействие с водой:
2) Взаимодействие со щелочами:
3) Взаимодействие с основными иамфотерными
оксидами:
45. Физические свойства
H2SO4 жидкость,Обладает
бесцветная маслянистая тяжелая
без
запаха,
нелетучая
сильным
при
водоотнимающим
свойством. Хорошо растворяется в воде.
Техника безопасности:
Кислоту приливают в воду
осторожно, тоненькой
струйкой.
н.у.
46. Разбавление серной кислоты
47. Химические свойства серной кислоты
1) Диссоциация в водном растворе:H2SO4= 2H+ + SO422)
Раствор серной кислоты изменяет
окраску индикаторов.
Лакмус + H+ = раствор красного цвета.
Метилоранж + H+ = раствор розового цвета.
Фенолфталеин не изменяет свою окраску в
присутствии кислот.
48.
3) Взаимодействие с металлами (разбавленнаякислота)
Кислота + металл (до Н) = соль + Н2↑
Для того чтобы реакция между кислотой и металлом
прошла, необходимы следующие условия:
• Металл должен находиться в ряду напряжений до
водорода.
• Должна получиться растворимая соль.
Концентрированная серная кислота иначе
реагируют с металлами.
49.
50.
51.
52.
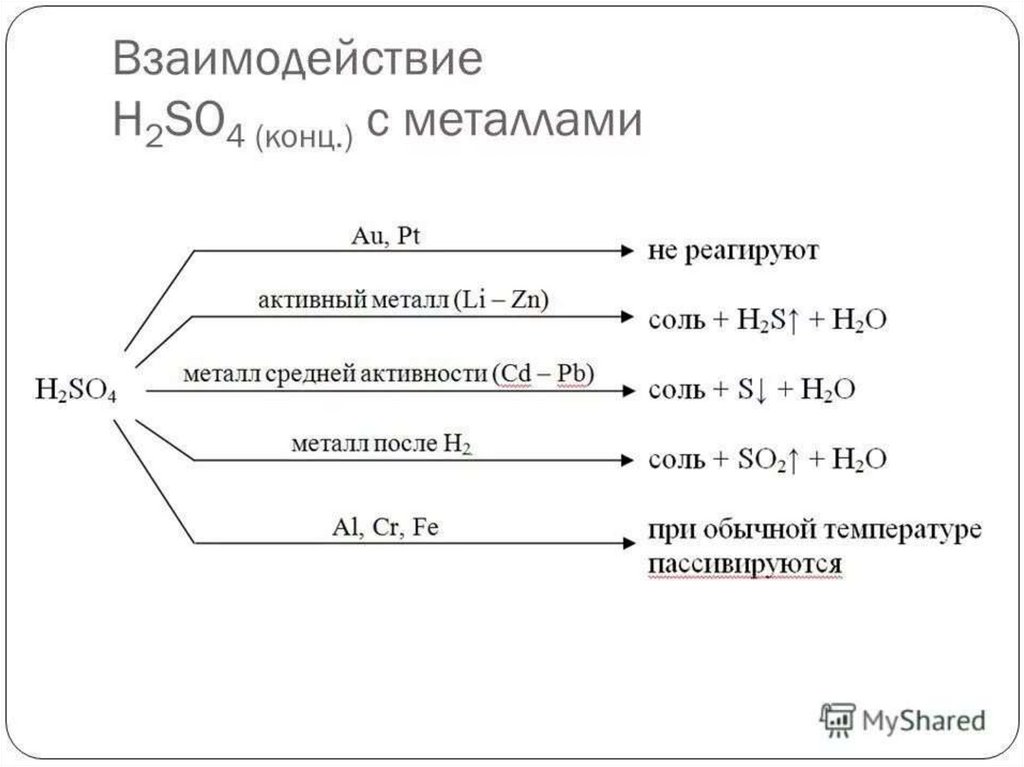
3) Взаимодействие с неметаллами(концентрированная кислота)
H2SO4(конц)+ НеМе= SO2 + кислота+ H2O
53.
4)Взаимодействиес
оксидами
металлов
(основными и амфотерными)
Это реакция обмена
Кислота + оксид металла = соль + вода
5) Взаимодействие с основаниями.
Кислоты реагируют с основаниями: щелочами и
нерастворимыми в воде.
Этот тип реакций
относится
к
реакциям
обмена.
Реакция
взаимодействия кислот с основаниями – реакция
нейтрализации.
Кислота + основание = соль + вода
54.
6) Взаимодействие с солями.Реакция кислот с солями относится к реакциям
обмена, при этом образуется новая кислота и
новая соль. Эти реакции протекают в том
случае, если образуется осадок или газ.
Кислота + соль = новая кислота
+ новая соль
55. Серная кислота в природе
Европа – спутникЮпитера
Кислотное озеро на
глубине вулкана Малый
Семячик
Облака планеты
Венера
Кипящее
озеро
(Курильски
е острова)
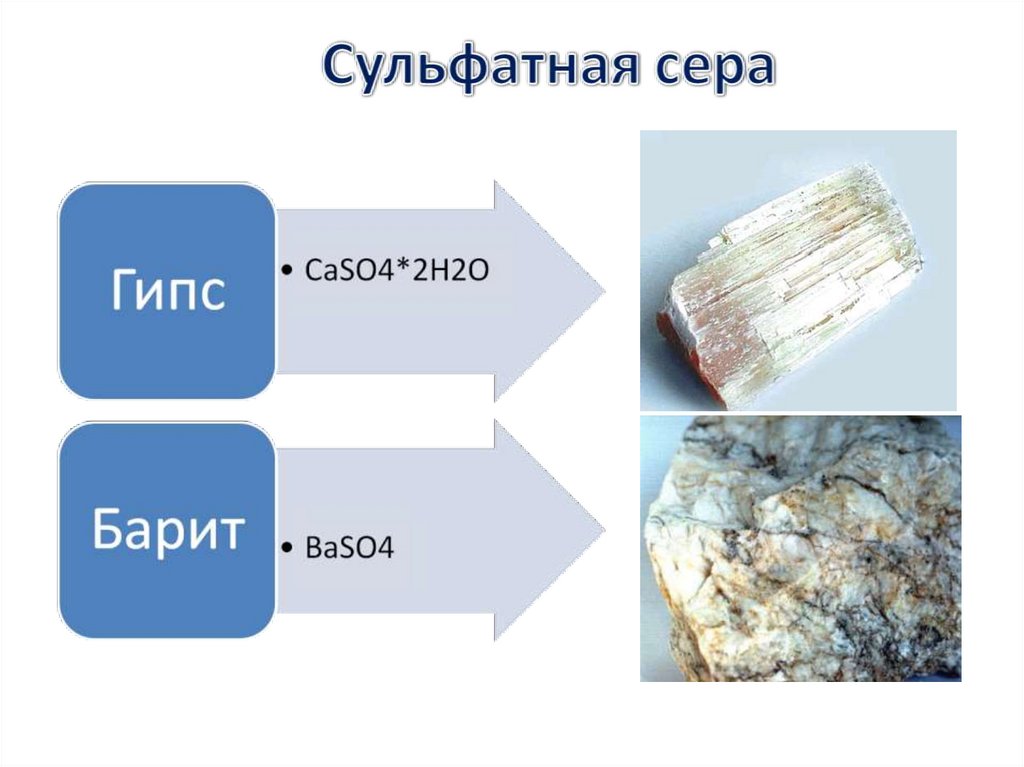
56. Соли серной кислоты
Na2SO4× 10H2OГлауберова
соль
CaSO4×2H2O
Гипс
BaSO4
Сульфат
бария
CuSO4×5H2O
Медный
купорос
57. Домашнее задание:
• Параграф 15• Смешали два раствора, содержащих
соответственно серную кислоту массой 196 г
и гидроксид кальция массой 222 г.
Вычислите массу образовавшейся соли.
Какова реакция среды в растворе после
реакции?
• Составьте уравнения реакций, с помощью
которых можно осуществить превращения:
















































 chemistry
chemistry








