Similar presentations:
1_Задачи на растворы+ стакан
1.
§22. Расчеты с использованиемпонятия «массовая доля вещества
в растворе»
2.
1. Растворы и смеси (массовая доля вещества врастворе или смеси)
Концентрация – количественная мера содержания
вещества в растворе.
4
3.
Для растворов общее выражение принимает вид:ω=
mв
· 100%
mраствора
где - массовая доля (или %-ная концентрация) данного
вещества в растворе
mв-ва – масса растворённого вещества
mр-ра – масса раствора,
массы вещества и раствора должны быть выражены в
одинаковых единицах (г и г, кг и кг и т.п.)
6
4.
Большинство практически важных растворов – жидкости.Концентрацию наиболее часто выражают в массовых
долях, поэтому необходимо помнить,
как связаны масса вещества и его объём:
m
=
V
где - плотность (г/мл, г/см3, и др.)
m – масса вещества (г, кг, и др.)
V – объём (мл, см3, и др.)
Масса и объём вещества должны быть выражены в
единицах, соответствующих размерности плотности.
7
5.
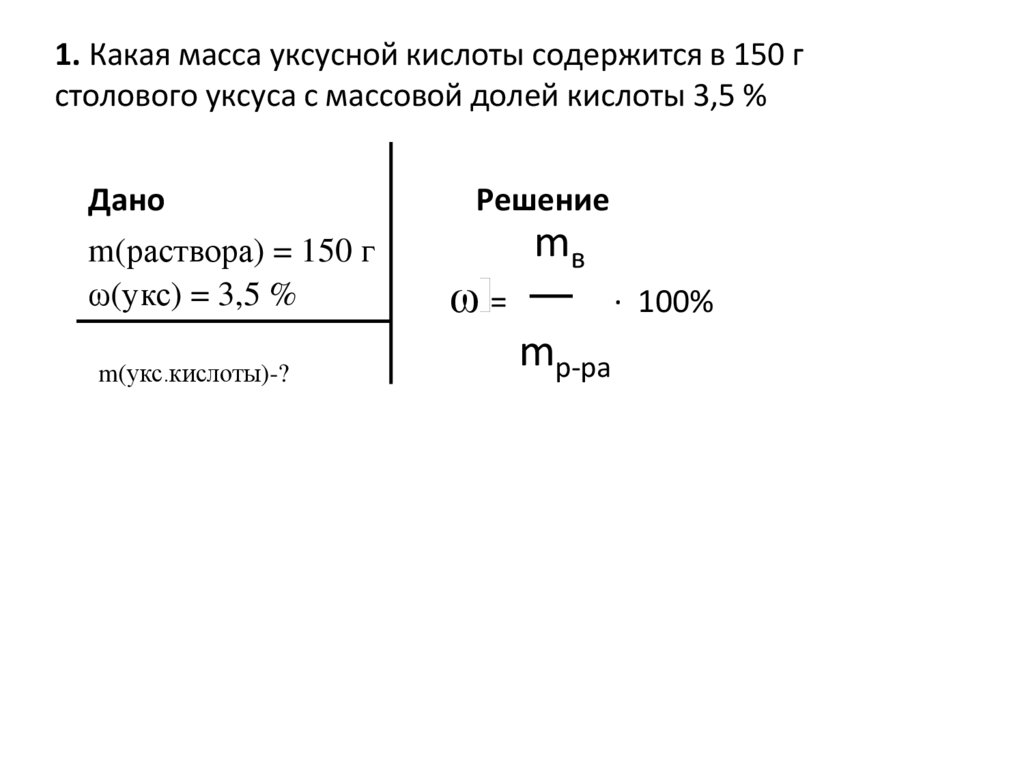
1. Какая масса уксусной кислоты содержится в 150 гстолового уксуса с массовой долей кислоты 3,5 %
Дано
m(раствора) = 150 г
ω(укс) = 3,5 %
m(укс.кислоты)-?
Решение
ω=
mв
· 100%
mр-ра
6.
1. Какая масса уксусной кислоты содержится в 150 гстолового уксуса с массовой долей кислоты 3,5 %
Дано
m(раствора) = 150 г
ω(укс) = 3,5 %
Решение
ω=
mв
· 100%
mр-ра
m(укс.кислоты)-?
m(кислоты)=(3,5·150)/100=5,25г
Ответ: 5,25г
7.
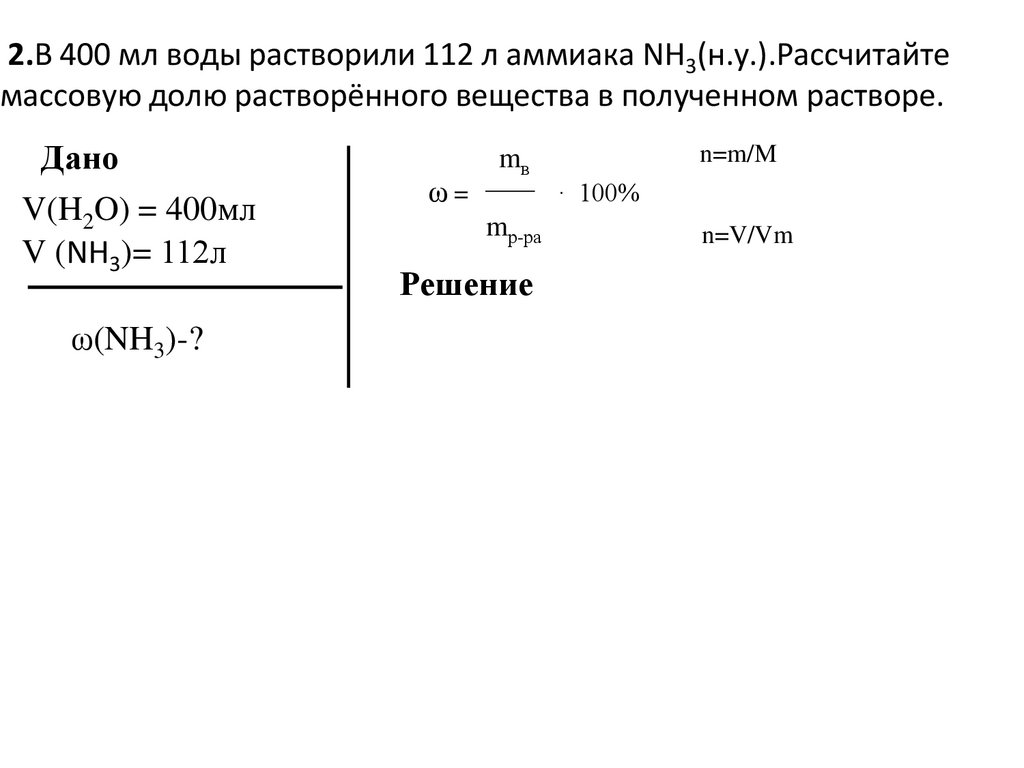
2.В 400 мл воды растворили 112 л аммиака NH3(н.у.).Рассчитайтемассовую долю растворённого вещества в полученном растворе.
Дано
V(H2O) = 400мл
V (NH3)= 112л
ω(NH3)-?
ω=
n=m/M
mв
· 100%
mр-ра
Решение
n=V/Vm
8.
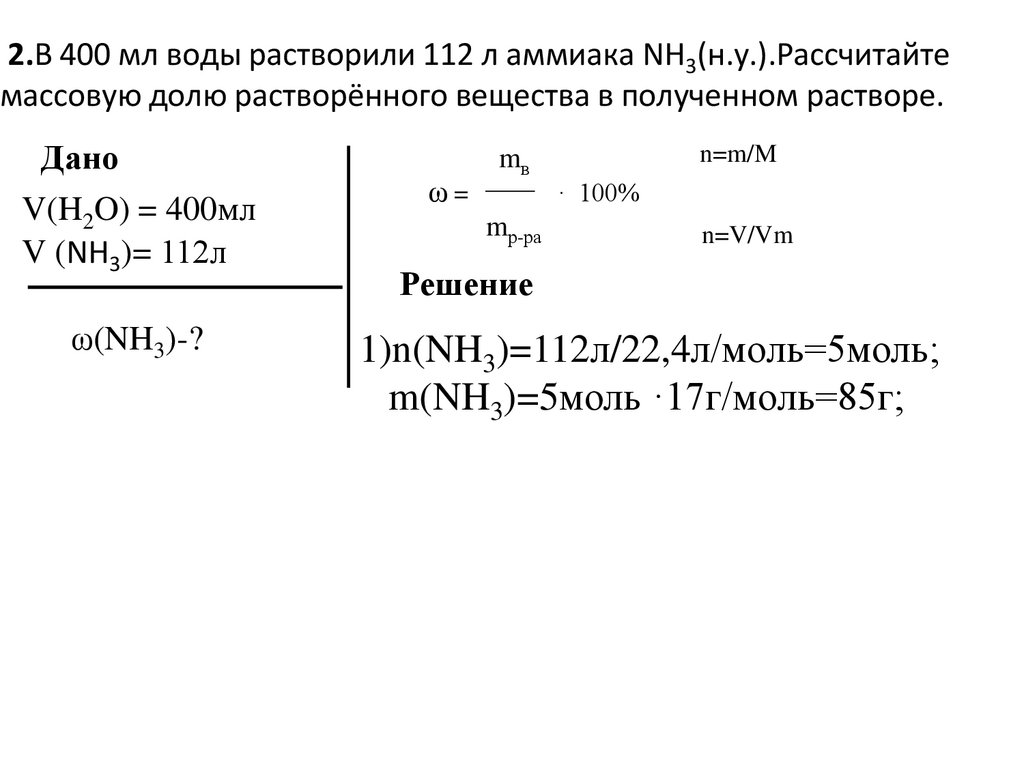
2.В 400 мл воды растворили 112 л аммиака NH3(н.у.).Рассчитайтемассовую долю растворённого вещества в полученном растворе.
Дано
V(H2O) = 400мл
V (NH3)= 112л
ω(NH3)-?
ω=
n=m/M
mв
· 100%
mр-ра
n=V/Vm
Решение
1)n(NH3)=112л/22,4л/моль=5моль;
m(NH3)=5моль ·17г/моль=85г;
9.
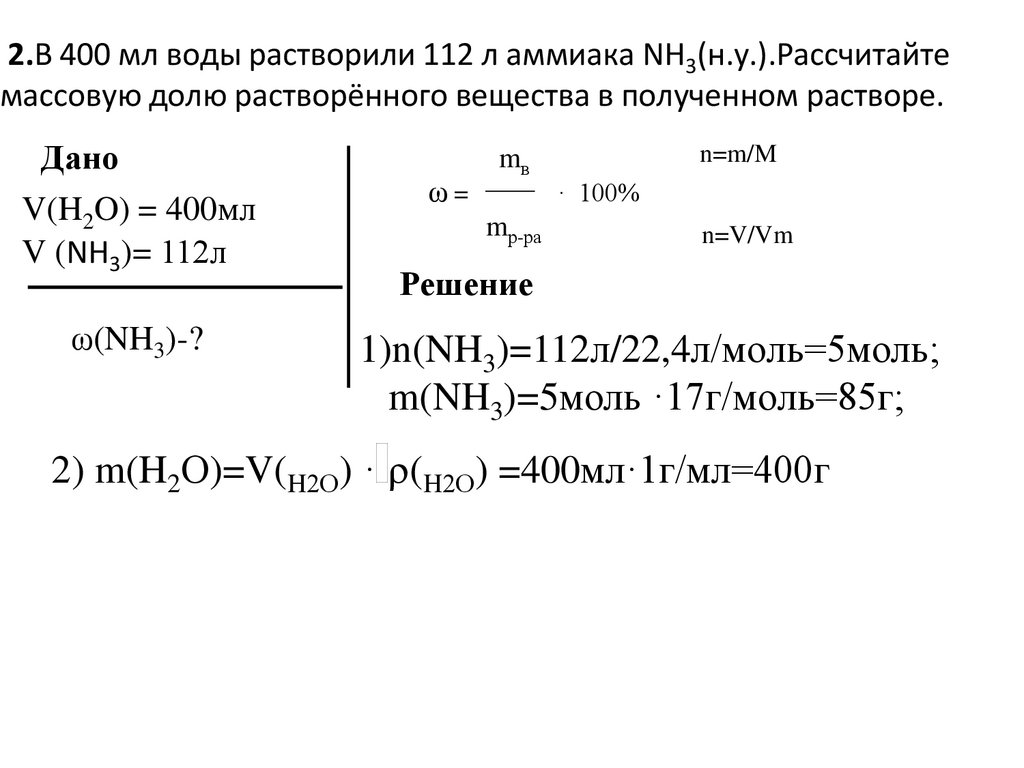
2.В 400 мл воды растворили 112 л аммиака NH3(н.у.).Рассчитайтемассовую долю растворённого вещества в полученном растворе.
Дано
V(H2O) = 400мл
V (NH3)= 112л
ω(NH3)-?
ω=
n=m/M
mв
· 100%
mр-ра
n=V/Vm
Решение
1)n(NH3)=112л/22,4л/моль=5моль;
m(NH3)=5моль ·17г/моль=85г;
2) m(H2О)=V(H2О) · (H2О) =400мл·1г/мл=400г
10.
2.В 400 мл воды растворили 112 л аммиака NH3(н.у.).Рассчитайтемассовую долю растворённого вещества в полученном растворе.
Дано
V(H2O) = 400мл
V (NH3)= 112л
ω(NH3)-?
ω=
n=m/M
mв
· 100%
mр-ра
n=V/Vm
Решение
1)n(NH3)=112л/22,4л/моль=5моль;
m(NH3)=5моль ·17г/моль=85г;
2) m(H2О)=V(H2О) · (H2О) =400мл·1г/мл=400г
3) m(раств-ра)=m H2О +m NH3 =400+85=485г
11.
2.В 400 мл воды растворили 112 л аммиака NH3(н.у.).Рассчитайтемассовую долю растворённого вещества в полученном растворе.
Дано
V(H2O) = 400мл
V (NH3)= 112л
ω(NH3)-?
ω=
n=m/M
mв
· 100%
mр-ра
n=V/Vm
Решение
1)n(NH3)=112л/22,4л/моль=5моль;
m(NH3)=5моль ·17г/моль=85г;
2) m(H2О)=V(H2О) · (H2О) =400мл·1г/мл=400г
3) m(раств-ра)=m H2О +m NH3 =400+85=485г
4) ω(NH3)= m NH3/ m раств-ра=85/485=0,175 или 17,5%
12.
3.Определите массовую долю сахара в растворе,полученном при растворении 15 г сахара в 185 г воды.
Дано
m(сахар) = 15 г
m(H2O) = 185 г
ω(сахар) - ?
Решение
mв
= m р-ра
13.
Пример 1. Определите массовую долю сахара в растворе,полученном при растворении 15 г сахара в 185 г воды.
Алгоритм работы
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
100 %
15г
+
0%
185г
=
х%
15+185г=200
14.
Пример 1. Определите массовую долю сахара в растворе,полученном при растворении 15 г сахара в 185 г воды.
100 %
15
+
0%
=
185
х%
15+185г=200
3) Составляем уравнение и решаем его:
8
15.
Пример 1. Определите массовую долю сахара в растворе,полученном при растворении 15 г сахара в 185 г воды.
100 %
15
+
0%
=
185
х%
15+185г=200
3) Составляем уравнение и решаем его:
15·100
+ 0·185
=
Х·200
Х=7,5%
8
16.
Пример 2. К раствору сахара массой 250 г с массовой долей сахара 15%добавили 100 мл воды. Массовая доля сахара в полученном растворе равна
_____ %.
Дано
mр-ра1 (сахара) = 250 г
ω1 (сахар) = 15%, или 0,15
V(H2O)доб.= 100 мл
(H2O) = 1 г/мл
ω2 (сахар) - ?
mв
= m р-ра
=
m
V
Решение
10
17.
Пример 2. К раствору сахара массой 250 г с массовой долей сахара 15%добавили 100 мл воды. Массовая доля сахара в полученном растворе равна
_____ %.
Алгоритм работы
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
+
=
10
18.
Пример 2. К раствору сахара массой 250 г с массовой долей сахара 15%добавили 100 мл воды. Массовая доля сахара в полученном растворе равна
_____ %.
15 %
250
+
0%
100
х%
=
250+100=350
10
19.
Пример 2. К раствору сахара массой 250 г с массовой долей сахара 15%добавили 100 мл воды. Массовая доля сахара в полученном растворе равна
_____ %.
15 %
250
+
0%
100
х%
=
250+100=350
3) Составляем уравнение и решаем его:
10
20.
Пример 2. К раствору сахара массой 250 г с массовой долей сахара 15%добавили 100 мл воды. Массовая доля сахара в полученном растворе равна
_____ %.
15 %
250
+
х%
0%
=
250+100=350
100
3) Составляем уравнение и решаем его:
15·250 + 0·100
=
Х·350
10
21.
Пример 2. К раствору сахара массой 250 г с массовой долей сахара 15%добавили 100 мл воды. Массовая доля сахара в полученном растворе равна
_____ %.
15 %
+
250
х%
0%
=
250+100=350
100
3) Составляем уравнение и решаем его:
15·250 + 0·100
=
Х·350
Х=10,71%
10
22.
Пример 3. К 150 г 10%-ного раствора сахара добавили 10 г сахара.Массовая доля сахара в полученном растворе равна _____ %.
Алгоритм работы
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
14
23.
Пример 3. К 150 г 10%-ного раствора сахара добавили 10 г сахара.Массовая доля сахара в полученном растворе равна _____ %.
10 %
150
х%
100 %
+
=
10
150+10=160
14
24.
Пример 3. К 150 г 10%-ного раствора сахара добавили 10 г сахара.Массовая доля сахара в полученном растворе равна _____ %.
10 %
150
х%
100 %
+
=
10
150+10=160
3) Составляем уравнение и решаем его:
10·150 + 100·10
=
Х·160
14
25.
Пример 3. К 150 г 10%-ного раствора сахара добавили 10 г сахара.Массовая доля сахара в полученном растворе равна _____ %.
10 %
х%
100 %
+
150
=
10
150+10=160
3) Составляем уравнение и решаем его:
10·150 + 100·10
=
Х·160
Х=15,625%
14
26.
Пример 4. Смешали 200 г 5%-ного и 300 г 30%-ного раствора сахара. Массовая долсахара в полученном растворе равна_____ %.
Алгоритм работы
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
+
=
18
27.
Пример 4. Смешали 200 г 5%-ного и 300 г 30%-ного раствора сахара. Массовая долсахара в полученном растворе равна_____ %.
5%
200
+
30%
300
=
Х%
200+300=500
18
28.
Пример 4. Смешали 200 г 5%-ного и 300 г 30%-ного раствора сахара. Массовая долсахара в полученном растворе равна_____ %.
5%
200
+
30%
300
=
Х%
200+300=500
3) Составляем уравнение и решаем его:
18
29.
Пример 4. Смешали 200 г 5%-ного и 300 г 30%-ного раствора сахара. Массовая долсахара в полученном растворе равна_____ %.
5%
200
+
30%
=
300
Х%
200+300=500
3) Составляем уравнение и решаем его:
5·200 + 30·300
=
Х·500
18
30.
Пример 4. Смешали 200 г 5%-ного и 300 г 30%-ного раствора сахара. Массовая долсахара в полученном растворе равна_____ %.
5%
200
+
30%
=
300
Х%
200+300=500
3) Составляем уравнение и решаем его:
5·20 + 30·300
=
Х·500
Х= 20%
18
31.
Пример 5. Сколько миллилитров воды необходимо добавить к 450 мл 10%-ногораствора нитрата калия плотностью 1,08 г/мл для получения раствора с массовой
долей соли 3%?
Алгоритм работы
2) В стаканчики записываем проценты вещества (чистое вещество = 100%, чистый
растворитель = 0%) под стаканчиками - массы
21
32.
Пример 5. Сколько миллилитров воды необходимо добавить к 450 мл 10%-ногораствора нитрата калия плотностью 1,08 г/мл для получения раствора с массовой
долей соли 3%?
Алгоритм работы
2) В стаканчики записываем проценты вещества (чистое вещество = 100%, чистый
растворитель = 0%) под стаканчиками - массы
+
=
21
33.
Пример 5. Сколько миллилитров воды необходимо добавить к 450 мл 10%-ногораствора нитрата калия плотностью 1,08 г/мл для получения раствора с массовой
долей соли 3%?
10%
450·1,08
0%
+
3%
=
Х
(450·1,08)+Х
21
34.
Пример 5. Сколько миллилитров воды необходимо добавить к 450 мл 10%-ногораствора нитрата калия плотностью 1,08 г/мл для получения раствора с массовой
долей соли 3%?
10%
450·1,08
0%
+
3%
=
Х
(450·1,08)+Х
3) Составляем уравнение и решаем его:
21
35.
Пример 5. Сколько миллилитров воды необходимо добавить к 450 мл 10%-ногораствора нитрата калия плотностью 1,08 г/мл для получения раствора с массовой
долей соли 3%?
10%
450·1,08
0%
+
3%
=
Х
(450·1,08)+Х
3) Составляем уравнение и решаем его:
10·486 + 0·Х
= 3·(486+Х)
21
36.
Пример 5. Сколько миллилитров воды необходимо добавить к 450 мл 10%-ногораствора нитрата калия плотностью 1,08 г/мл для получения раствора с массовой
долей соли 3%?
10%
450·1,08
0%
+
3%
=
Х
(450·1,08)+Х
3) Составляем уравнение и решаем его:
10·486 + 0·Х
= 3·(486+Х)
4860 = 1458+3Х
Х= 1134
21
37.
СЛОЖНЫЕ ЗАДАЧИ38.
Пример 6. К 150 г 8-ного раствора бромида натрия добавили 15 г 50%-ого раствора этойсоли, 10 г бромида натрия и 25 мл воды. Концентрация бромида натрия в полученном
растворе равна ____ %.Ответ: _____ (Запишите число с точностью до десятых.)
24
39.
Пример 6. К 150 г 8-ного раствора бромида натрия добавили 15 г 50%-ого раствора этойсоли, 10 г бромида натрия и 25 мл воды. Концентрация бромида натрия в полученном
растворе равна ____ %.Ответ: _____ (Запишите число с точностью до десятых.)
Алгоритм работы
2) В стаканчики записываем проценты вещества (чистое вещество = 100%, чистый
растворитель = 0%) под стаканчиками - массым
24
40.
Пример 6. К 150 г 8-ного раствора бромида натрия добавили 15 г 50%-ого раствора этойсоли, 10 г бромида натрия и 25 мл воды. Концентрация бромида натрия в полученном
растворе равна ____ %.Ответ: _____ (Запишите число с точностью до десятых.)
8%
150
+
50%
15
+
100%
10
+
0%
25
=
Х%
150+15+10+25
24
41.
Пример 6. К 150 г 8-ного раствора бромида натрия добавили 15 г 50%-ого раствора этойсоли, 10 г бромида натрия и 25 мл воды. Концентрация бромида натрия в полученном
растворе равна ____ %.Ответ: _____ (Запишите число с точностью до десятых.)
8%
150
+
50%
15
+
100%
10
+
0%
25
=
Х%
150+15+10+25
3) Составляем уравнение и решаем его:
24
42.
Пример 6. К 150 г 8-ного раствора бромида натрия добавили 15 г 50%-ого раствора этойсоли, 10 г бромида натрия и 25 мл воды. Концентрация бромида натрия в полученном
растворе равна ____ %.Ответ: _____ (Запишите число с точностью до десятых.)
8%
150
+
50%
15
+
100%
10
+
0%
25
=
Х%
150+15+10+25
3) Составляем уравнение и решаем его:
8·150 + 50·15 + 100·10+0·25 = Х·200
24
43.
Пример 6. К 150 г 8-ного раствора бромида натрия добавили 15 г 50%-ого раствора этойсоли, 10 г бромида натрия и 25 мл воды. Концентрация бромида натрия в полученном
растворе равна ____ %.Ответ: _____ (Запишите число с точностью до десятых.)
8%
150
+
50%
15
+
100%
10
+
0%
25
=
Х%
150+15+10+25
3) Составляем уравнение и решаем его:
8·150 + 50·15 + 100·10+0·25 = Х·200
Х = 14,75
24
44.
Пример 7. Какую массу 17%-ного раствора хлорида калия надо взять, чтобы при добавлении15 г воды получить раствор с массовой долей соли 10%? (Запишите число с точностью до
целых.)
30
45.
Пример 7. Какую массу 17%-ного раствора хлорида калия надо взять, чтобы при добавлении15 г воды получить раствор с массовой долей соли 10%? (Запишите число с точностью до
целых.)
17%
0%
+
Х
10%
=
15
Х+15
30
46.
Пример 7. Какую массу 17%-ного раствора хлорида калия надо взять, чтобы при добавлении15 г воды получить раствор с массовой долей соли 10%? (Запишите число с точностью до
целых.)
17%
0%
+
Х
10%
=
15
Х+15
3) Составляем уравнение и решаем его:
30
47.
Пример 7. Какую массу 17%-ного раствора хлорида калия надо взять, чтобы при добавлении15 г воды получить раствор с массовой долей соли 10%? (Запишите число с точностью до
целых.)
17%
0%
+
Х
10%
=
15
Х+15
3) Составляем уравнение и решаем его:
17·Х + 0·15
= 10·(Х+15)
30
48.
Пример 7. Какую массу 17%-ного раствора хлорида калия надо взять, чтобы при добавлении15 г воды получить раствор с массовой долей соли 10%? (Запишите число с точностью до
целых.)
17%
0%
+
Х
10%
=
15
Х+15
3) Составляем уравнение и решаем его:
17·Х + 0·15
= 10·(Х+15)
Х= 21,43
30
49.
Пример 8. Рассчитайте массовую долю серной кислоты в растворе,полученном при смешивании 200 г 10%-ного и 300 г 2%-ного растворов.
Ответ запишите с точностью до сотых.
Алгоритм работы
1) Рисуем стаканчики по числу указанных действий:
32
50.
Пример 8. Рассчитайте массовую долю серной кислоты в растворе,полученном при смешивании 200 г 10%-ного и 300 г 2%-ного растворов.
Ответ запишите с точностью до сотых.
Автор: Ирина Ивановна Попова, г. Воронеж, школа № 52
Алгоритм работы
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
10 %
2%
X%
200
300
(200 + 300) = 500
3) Составляем уравнение и решаем его:
10·200 + 2·300
= x·500
x = (10·200 + 2·300) / 500 = 5,2 %
33
51.
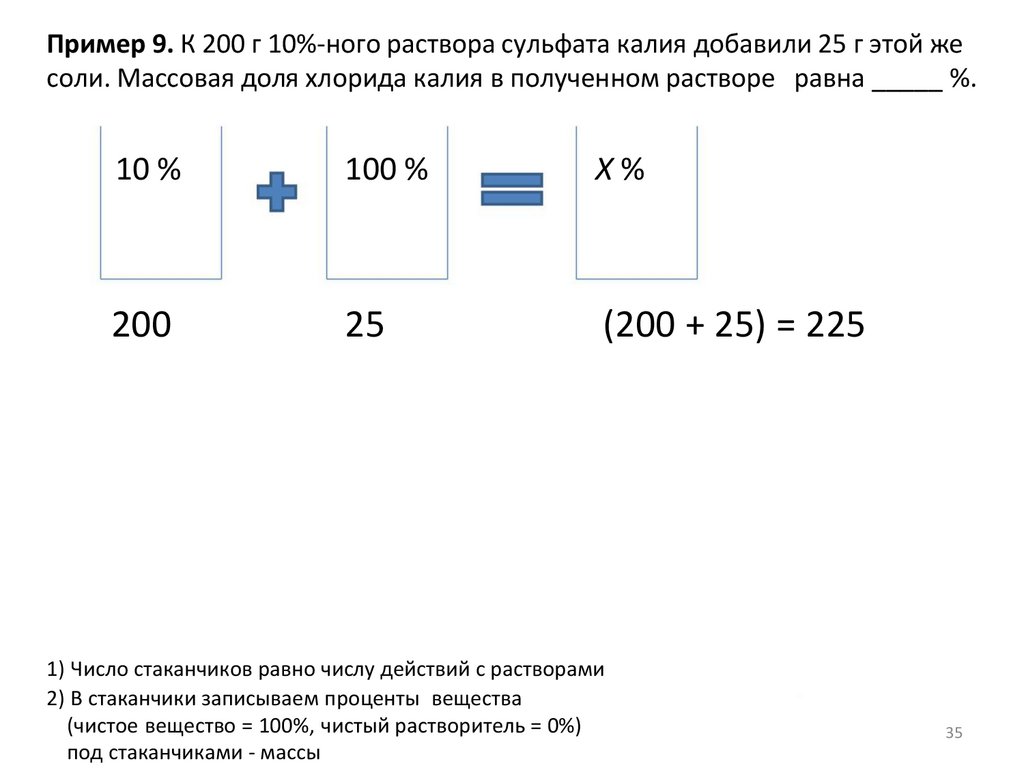
Пример 9. К 200 г 10%-ного раствора сульфата калия добавили 25 г этой жесоли. Массовая доля хлорида калия в полученном растворе равна _____ %.
1) Число стаканчиков равно числу действий с растворами
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
34
52.
Пример 9. К 200 г 10%-ного раствора сульфата калия добавили 25 г этой жесоли. Массовая доля хлорида калия в полученном растворе равна _____ %.
10 %
100 %
X%
200
25
(200 + 25) = 225
1) Число стаканчиков равно числу действий с растворами
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
35
53.
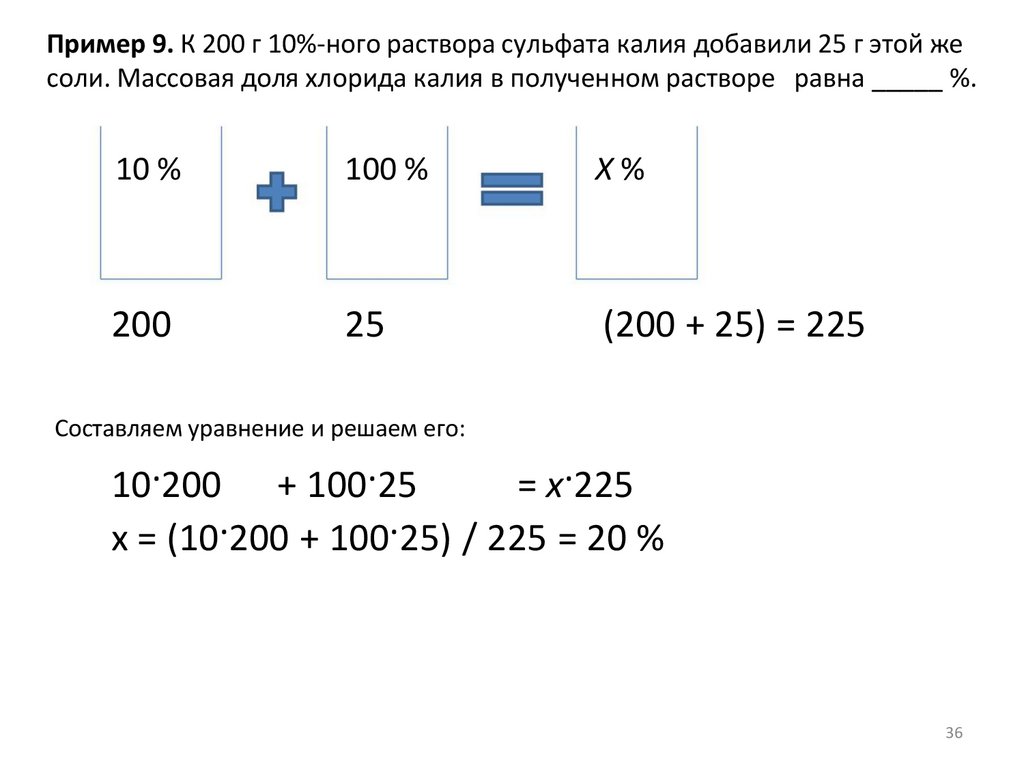
Пример 9. К 200 г 10%-ного раствора сульфата калия добавили 25 г этой жесоли. Массовая доля хлорида калия в полученном растворе равна _____ %.
10 %
100 %
X%
200
25
(200 + 25) = 225
Составляем уравнение и решаем его:
10·200 + 100·25
= x·225
x = (10·200 + 100·25) / 225 = 20 %
36
54.
Пример 10. Сколько миллилитров воды необходимо добавить к 400 мл 10%ного раствора хлорида калия плотностью 1,08 г/мл для получения раствора смассовой долей соли 3%?
1) Число стаканчиков равно числу действий с растворами
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
37
55.
Пример 10. Сколько миллилитров воды необходимо добавить к 400 мл 10%ного раствора хлорида калия плотностью 1,08 г/мл для получения раствора смассовой долей соли 3%?
10 %
0%
3%
1,08·400
x
1,08·400 + x
Составляем уравнение и решаем его:
10·432 + 0·x
= 3·(432 + x)
x = (10·432 - 3·432) / 3 = 1008 г
V(H2O) = 1008 / 1 = 1008 мл
1) Число стаканчиков равно числу действий с растворами
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
38
56.
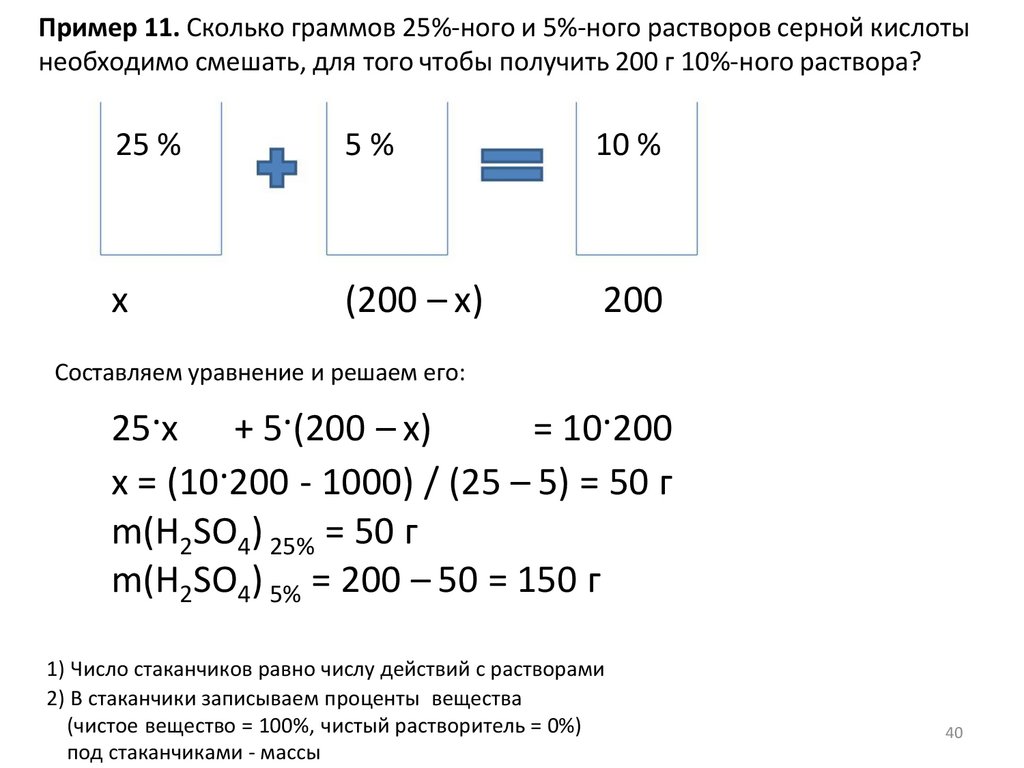
Пример 11. Сколько граммов 25%-ного и 5%-ного растворов серной кислотынеобходимо смешать, для того чтобы получить 200 г 10%-ного раствора?
25 %
5%
10 %
200
1) Число стаканчиков равно числу действий с растворами
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
39
57.
Пример 11. Сколько граммов 25%-ного и 5%-ного растворов серной кислотынеобходимо смешать, для того чтобы получить 200 г 10%-ного раствора?
25 %
5%
10 %
x
(200 – x)
200
Составляем уравнение и решаем его:
25·x + 5·(200 – x)
= 10·200
x = (10·200 - 1000) / (25 – 5) = 50 г
m(H2SO4) 25% = 50 г
m(H2SO4) 5% = 200 – 50 = 150 г
1) Число стаканчиков равно числу действий с растворами
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
40
58.
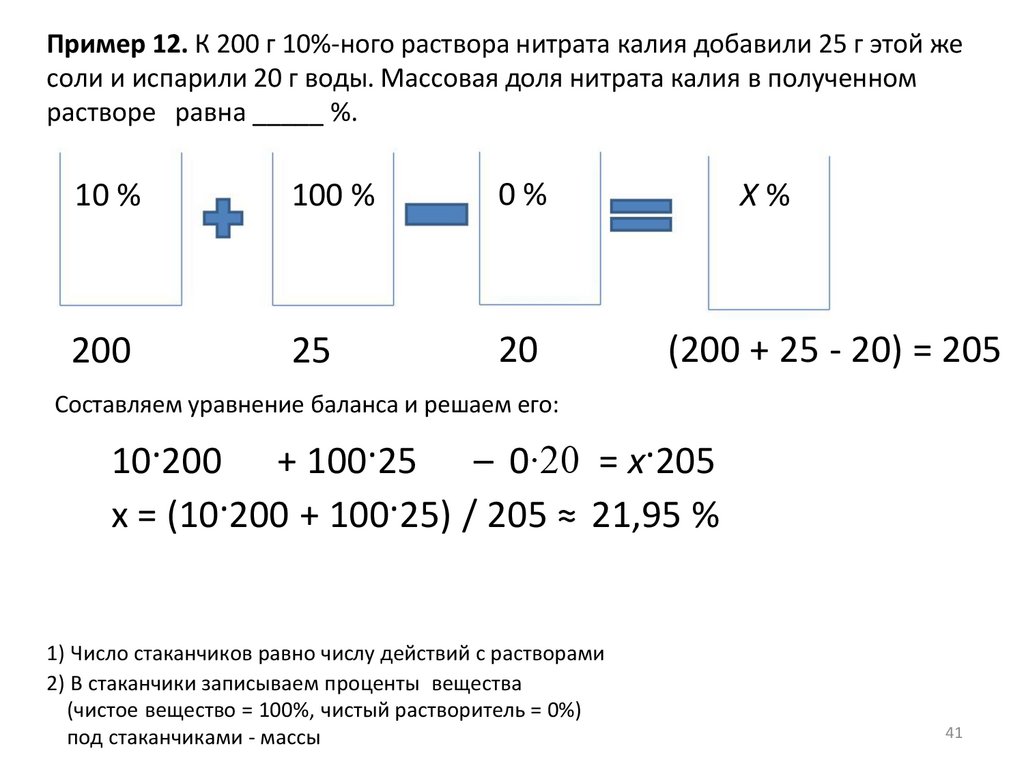
Пример 12. К 200 г 10%-ного раствора нитрата калия добавили 25 г этой жесоли и испарили 20 г воды. Массовая доля нитрата калия в полученном
растворе равна _____ %.
10 %
100 %
0%
200
25
20
X%
(200 + 25 - 20) = 205
Составляем уравнение баланса и решаем его:
10·200 + 100·25 – 0∙20 = x·205
x = (10·200 + 100·25) / 205 ≈ 21,95 %
1) Число стаканчиков равно числу действий с растворами
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
41
59.
Пример 7а. Какую массу 17%-ного раствора хлорида калия надо взять, чтобы придобавлении 15 г воды получить раствор с массовой долей соли 10%? (Запишите
число с точностью до целых.)
17 %
0%
10 %
x
15
(х + 15)
17·x + 0·x
= 10·(х + 15)
17х = 10х + 150
7х = 150
x = 150 / 7 ≈ 21,43 ≈21 г
1) Число стаканчиков равно числу действий с растворами
2) В стаканчики записываем проценты вещества
(чистое вещество = 100%, чистый растворитель = 0%)
под стаканчиками - массы
42