Similar presentations:
РАСТВОРЫ
1. РАСТВОРЫ
2.
3.
4.
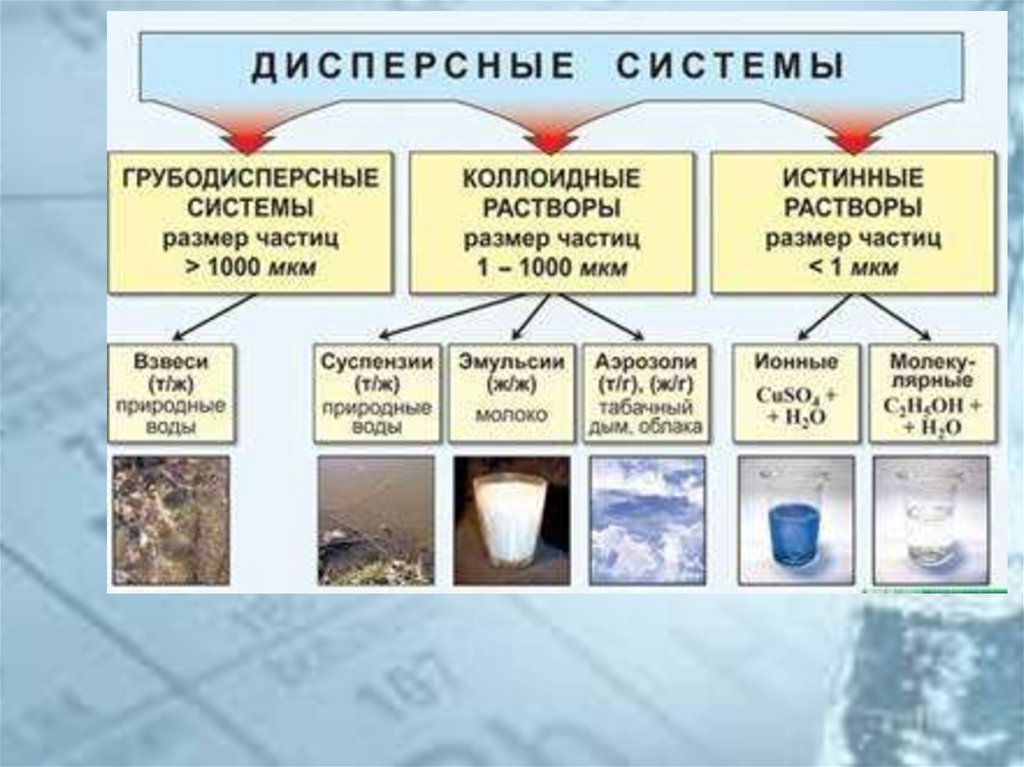
Растворы (по агрегатному состоянию):1. Жидкие (соли в воде)
2. Твердые(сплав Ni и Cu – монеты)
3. Газообразные (воздух)
5.
6.
7.
8.
9.
10.
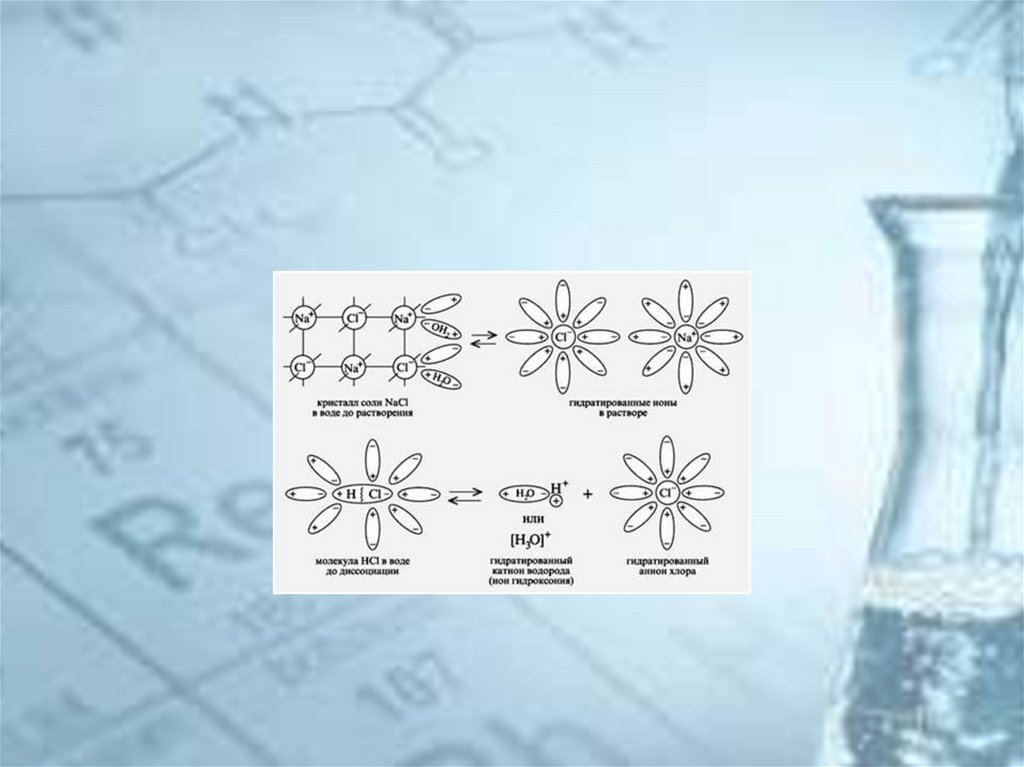
11. Процесс образования растворов
12.
13.
14.
15.
16.
17.
18. Законы Рауля
РАУЛЬ (Raoult), Франсуа Мари10 мая 1830 г. – 1 апреля 1901 г.
Раулем выполнены исследования понижения
температуры замерзания и понижения упругости
пара (или, что то же самое, повышения
температуры кипения) растворителя при
введении в него растворенного вещества. Рауль
пришёл к выводу: количества различных
веществ,
которые вызывают одинаковое (по
сравнению с чистым растворителем)
понижение температуры замерзания или
повышение температуры кипения, зависят только
от их молекулярных масс.
19.
20.
21.
22. Эбуллиоскопический и криоскопический методы определения молярной массы растворённого вещества
g2m2
M 2 g1
g1 – масса растворителя, кг
g2 – масса растворённого вещества, г
M2 – молярная масса растворённого вещества, г/моль
23. Эбуллиоскопический и криоскопический методы определения молярной массы растворённого вещества
g2 EM2
g1 Tкипения
g2 K
M2
g1 Tзамерзания
24.
25.
26.
27.
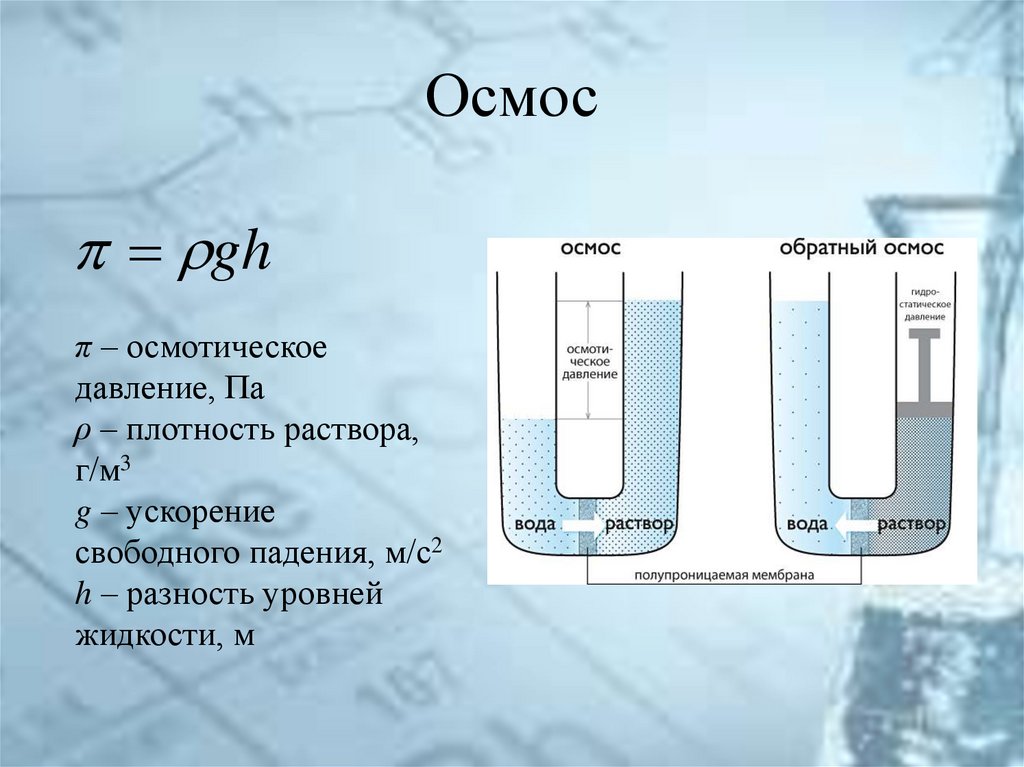
28. Осмос
НОЛЛЕ (Nollet), Жан Антуан19 ноября 1700 г. – 2 апреля 1770 г.
Впервые наблюдал (1747) явление
осмоса. Нолле наполнил сосуд
винным спиртом, закрыл его
плотно мембраной (использовался
кусок мочевого пузыря свиньи) и
погрузил в чан с водой. Вода
проходила внутрь сосуда со
спиртом и создавала в нём такое
давление, что пузырь раздувался
и лопался. Ввёл понятие об
осмотическом давлении.
29. Осмос
ghπ – осмотическое
давление, Па
ρ – плотность раствора,
г/м3
g – ускорение
свободного падения, м/с2
h – разность уровней
жидкости, м
30. Осмос
Якоб Генрик ВАНТ-ГОФФ (van't Hoff)(1852 – 1911 гг.)
Нобелевская премия по химии,
1901 г.
Экспериментально установил (1887),
что осмотическое давление,
представляющее собой меру
стремления двух различных растворов
по обе стороны мембраны к
выравниванию концентрации, в
слабых растворах зависит от
концентрации и температуры и,
следовательно, подчиняется газовым
законам термодинамики.
31.
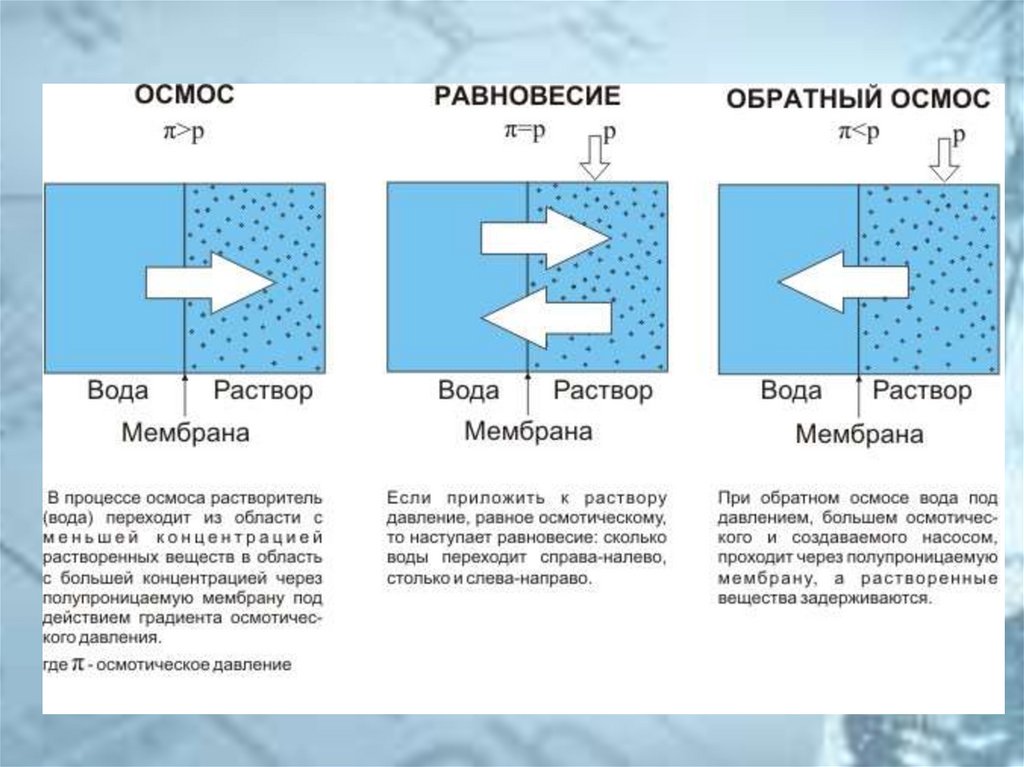
Закон Вант-Гоффа: Осмотическое давлениераствора равно тому давлению, которое
оказалось бы растворенное вещество, если
бы оно, находясь в газообразном состоянии
занимало бы объем равный объему раствора
32.
33.
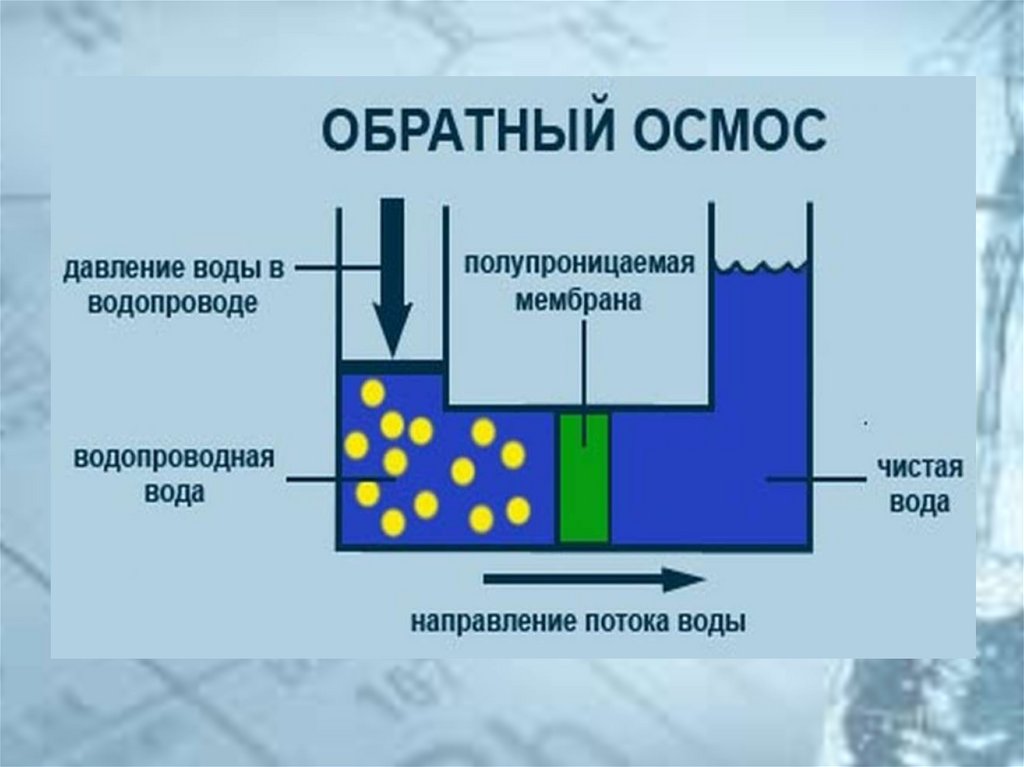
34. Осмотическое давление
• Осмотическое давление – сила, заставляющаярастворитель переходить через полупроницаемую
мембрану
• Осмотическое давление – давление, которое создавало
бы растворённое вещество в виде идеального газа,
занимая тот же объём, что и в растворе
• Осмотическое давление – давление, которое
останавливает осмос
• Сосущая сила семян 4,05·107 Па
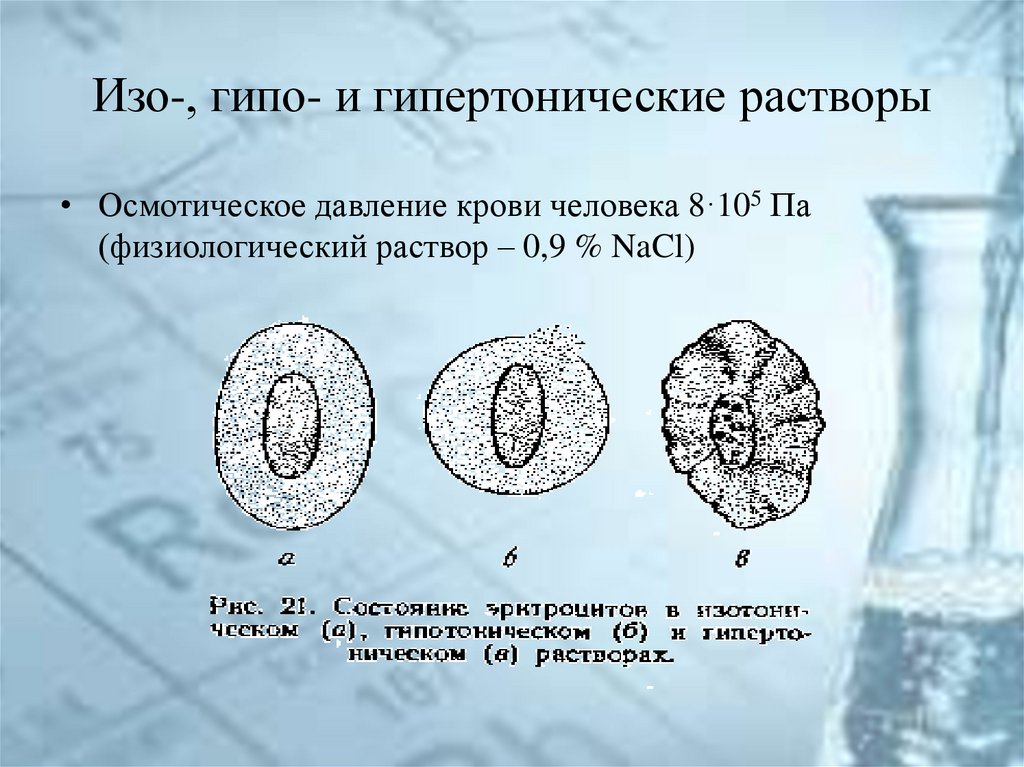
35. Изо-, гипо- и гипертонические растворы
• Осмотическое давление крови человека 8·105 Па(физиологический раствор – 0,9 % NaCl)



























 chemistry
chemistry








