Similar presentations:
Гитторф6
1. Числа переноса ионов. Метод Гитторфа. Кондуктометрия. Кондуктометрическое титрование.
2.
Одним из важнейших понятий в электрохимииявляется число переноса ионов. В электролитах
электричество переносится одновременно
положительными и отрицательными ионами,
поэтому возникает вопрос, каково участие в этом
процессе ионов каждого знака.
Количество переносимого электричества
определяется концентрацией ионов и
скоростью их движения; когда концентрации
катионов и анионов одинаковы, участие их в
переносе электричества зависит лишь от
относительной скорости их движения, т.к.
скорости движения катионов и анионов могут
быть существенно различными, потому и
числа переноса должны быть разными. Это
было установлено Гитторфом (1854).
3.
Числом переноса ионов называется доляпрошедшего через электролит электричества,
перенесенная данным родом ионов :
t
Q
Q
Q Q
; t
; t t
1
Q Q
Q Q
Q Q
где
Qi zi Fci ui S
-количество электричества, перенесенное ионами i-того
вида, с зарядом Zi и абсолютной скоростью Ui через
сечение площадью S за время T, Сi- концентрация, Fчисло Фарадея
4.
С учётом электронейтральностираствора: z c z c
При этом очевидно, что:
t
u
u
, t
u u
u u
t t 1
Между числами переноса и подвижностями ионов в сильных
электролитах существует зависимость.
Fu ; Fu
Поскольку
С учетом
; t t 1
, то
u t
u t
t
t
;
t t t t
t и t
С ростом температуры абсолютные скорости ионов и подвижности ионов
увеличиваются, но не в одинаковой мере. Поэтому числа переноса с
изменением температуры также меняются.
При этом, если, к примеру, число переноса катиона увеличивается,
то согласно t t 1 число переноса аниона уменьшается. (и наоборот)
5.
Экспериментально числа переноса определяются по изменениюконцентрации ионов у электродов (метод Гитторфа).
На рис. Приведена схема
электролиза соляной кислоты.
Электродами служат пластинки
из инертного металла(платины).
Пространство между электродами разделено двумя пористыми диафрагмами
на три отделения: катодное, среднее и анодное. Если пропустить через раствор
1 фарадей электричества, то по з.Фарадея на электродах выделится по 1 г/ моль
водорода и хлора:
При этом через раствор пройдет t+ г/моль
1
H 2 (г)
2
катионов(ионов H) от анода к катоду и t_ г/моль
анионов(ионов Cl) от катода к аноду.
(На аноде) Cl 1 Cl ( г ) е
2
Катионы перенесут через данное поперечное
сечение раствора электролита t+ фарадеев
электричества от анода к катоду, а анионы
перенесут в обратном направлении t_ фарадеев
(На катоде)
H e
2
Всего катионы и анионы перенесут через поперечное сечение электролита t+ + t_=1
фарадей, или F Кл электричества.
6.
В катодном отделении накатоде из раствора выделяется
1 г/моль ионов водорода.
Из среднего отделения через
диафрагму поступает в катодное
отделение t+ г/моль ионов
водорода. t H
Из катодного отделение в среднее уходит t_ г/моль ионов хлора t Cl
В результате получаем материальный баланс ионов H и Cl (в г/моль) в катодном
отделении:
1H t H t Cl (1 t ) H t Cl
t H t Cl или
t HCl
Таким образом, в результате протекания черех электролизер одного фарадея
электричества содержание HCl в катодном отделении уменьшилось на t_г/моль.
В анодном отделении на аноде из раствора выделяется 1 г/моль ионов хлора.
Из среднего отделения в анодное поступает t_ г/моль ионов хлора и из анодного
отделения в среднее уходит t+ г/моль ионов водорода.
7.
В результате получим материальный баланс ионов водорода и хлора в анодномотделении:
t H 1Cl t Cl t H (1 t )Cl
или
t H t Cl
, или
t HCl
Из этого материального баланса видно, что в результате протекания
через электролизер одного фарадея электричества содержание HCl в
анодном отделении уменьшилось на t+ г/моль.
В среднем отделении электролизера содержание HCl не изменится, так как через
обе его диафрагмы проходит одинаковое число г/моль ионов H⁺ в одном
направлении и соответственно ионов Cl⁻ в другом направлении:
t H t H t Cl t Cl 0
8.
Если при пропускании через электролизер Q кулонов электричества содержание HClв катодном отделении уменьшилось на ∆nk моль-экв и в анодном отделении на ∆na
моль-экв, то будут справедливы соотношения
F nx
F na t nx
t
; t
;
Q
Q t na
Таким образом, по изменению содержания электролита в катодном и анодном
отделениях можно определить числа переноса ионов.
Этот способ определения чисел переноса называется способом Гитторфа.
9.
Кондуктометрия икондуктометрическое
титрование
10.
Кондуктометричеcкий анализ основан наиспользовании зависимости между
электропроводностью растворов электролитов и их
концентрацией
Кондуктометрия от англ. сonductivity –
электропроводность и греч. metreo измеряю.
Основатель кондуктометрического
анализа - немецкий физик и физикохимик Кольрауш.
Фридрих Вильгельм Георг
Кольрауш (1840-1910)
11.
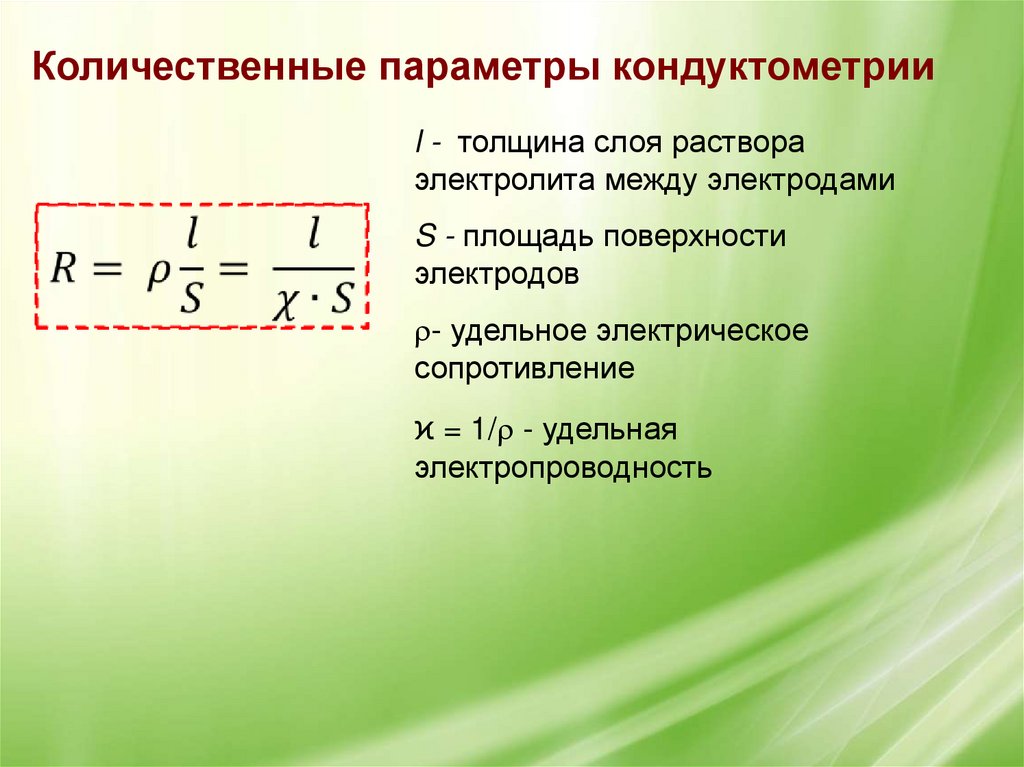
Количественные параметры кондуктометрииl - толщина слоя раствора
электролита между электродами
S - площадь поверхности
электродов
- удельное электрическое
сопротивление
ϰ = 1/ - удельная
электропроводность
12.
В электрохимической промышленности электрическая проводимостьиграет большую роль при составлении энергетических и тепловых
балансов электролизеров и химических источников тока, так как на ее
основе можно сделать рациональный выбор состава раствора
электролита, при котором электрическая проводимость раствора
достаточно велика и непроизводительные затраты электроэнергии
минимальны.
Кондуктометрия позволяет автоматизировать контроль производства в
ряде отраслей промышленности, имеющих дело с растворами
электролитов или расплавами, определить содержание солей в
различных растворах при испарении воды, что имеет, например,
значение для контроля качества воды и др.жидких сред.
При помощи кондуктометрии можно определять ряд физикохимических величин электролитов, например степень диссоциации
слабых электролитов, константу диссоциации электролита.
Изменение электрической проводимости чистой воды позволило
определить константу диссоциации воды и чрезвычайно важное в
химии ионное произваедение воды [H⁺] [OH⁻]=10 14 при 298 К (Кольрауш)
13.
Основные понятия кондуктометрииИзмеряемый аналитический сигнал в кондуктометрии –
электропроводность (электрическая проводимость)
растворов электролитов
Удельная электропроводность (ϰ – каппа) - это
электропроводность 1 м3 раствора, заключённого между
электродами площадью 1 м2 на расстоянии 1 м друг от друга.
или
Электропроводность электрического проводника площадью
сечения 1 м2 и длиной 1 м.
Единицы измерения ϰ – сименс/метр (См/м); мСм/см, мкСм/см
В справочниках - Ом-1 м-1
Ом-1 - это сименс (См)
Удельная электропроводность зависит от природы электролита
и растворителя, от концентрации раствора, от температуры.
14.
Основные понятия кондуктометрииМолярная (эквивалентная) электропроводность - это удельная
электропроводность раствора, содержащего 1 кмоль
эквивалентов растворённого вещества
= ϰ/С(f)
За молярную массу эквивалента принимается молярная масса
одинаковых частиц с единичным зарядовым числом («зарядом»),
например, Н+, Вr-, 1/2 Са2+, 1/3 Fe3+
Единицы измерения Ом-1 м2 кмоль-1, См м2 кмоль-1 мСм см2 моль-1
15.
Основные понятия кондуктометрии1. Эквивалентная электропроводность при бесконечно
большом разбавлении (т.е. когда концентрация становится
бесконечно малой) стремится к некоторому постоянному
значению, не зависящему от концентрации электролита, но
зависящему от температуры и природы электролита. Она
называется предельной электропроводностью или .
В разбавленных растворах электропроводность прямо
пропорциональна количеству заряженных частиц.
2.
Предельная
электропроводность
может
экспериментально определена из зависимости = f(C).
быть
16.
17.
Кондуктометрический метод анализа является одним из наиболееточных способов определения растворимости труднорастворимых
соединений (электролитов). Он основан на измерении электрической
проводимости раствора, находящегося в равновесии с твердым осадком
малорастворимого сильного электролита. Зная подвижность ионов и
на которые диссоциирует труднорастворимая соль в сильноразбавленном
растворе, и определив экспериментальную удельную электрическую
проводимость раствора, можно вычислить растворимость электролита по
уравнению:
С
100( H 2O )
Моль/л
18.
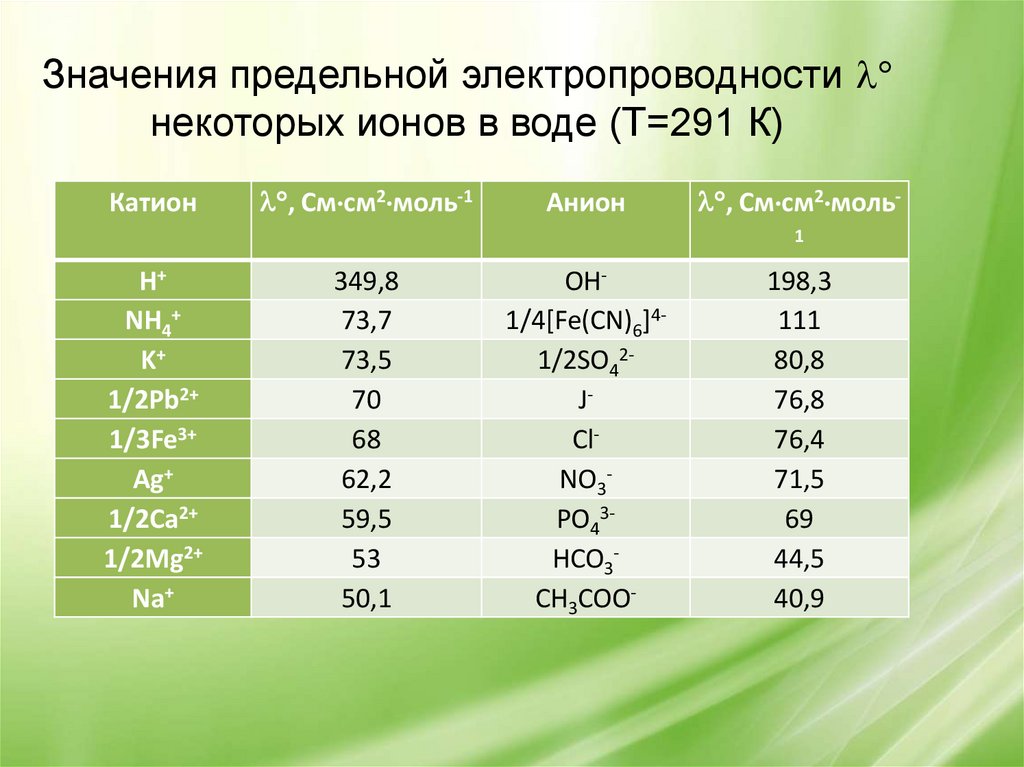
Значения предельной электропроводностинекоторых ионов в воде (Т=291 К)
Катион
, См см2 моль-1
Анион
, См см2 моль1
H+
NH4+
K+
1/2Pb2+
1/3Fe3+
Ag+
1/2Ca2+
1/2Mg2+
Na+
349,8
73,7
73,5
70
68
62,2
59,5
53
50,1
OH1/4[Fe(CN)6]41/2SO42JClNO3PO43HCO3CH3COO-
198,3
111
80,8
76,8
76,4
71,5
69
44,5
40,9
19.
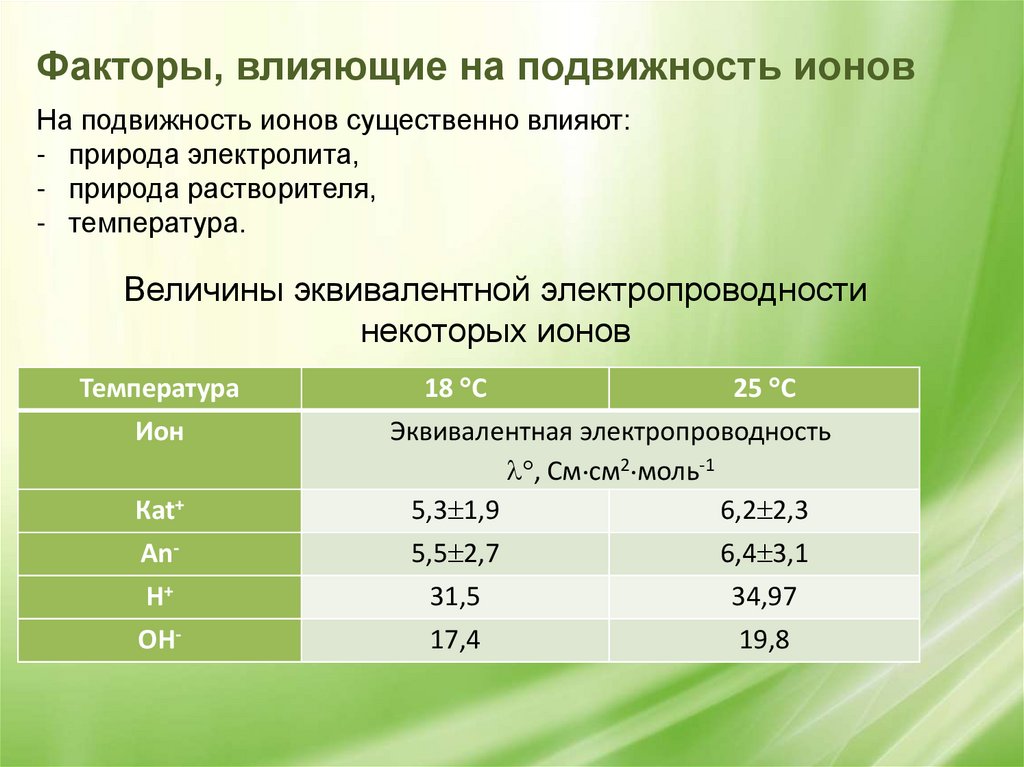
Факторы, влияющие на подвижность ионовНа подвижность ионов существенно влияют:
- природа электролита,
- природа растворителя,
- температура.
Величины эквивалентной электропроводности
некоторых ионов
Температура
Ион
Кat+
18 С
25 С
Эквивалентная электропроводность
, См см2 моль-1
5,3 1,9
6,2 2,3
Аn-
5,5 2,7
6,4 3,1
Н+
31,5
34,97
ОН-
17,4
19,8
20.
Прямая кондуктометрия1. Расчетный метод.
Концентрацию эквивалентов с электролита в растворе
рассчитывают, если известны удельная электропроводность
и молярная электропроводность :
С(f) = ϰ /
2. Метод градуировочного графика
Изучение зависимости = f(C)
Электропроводность – величина
аддитивная, т.е. равна сумме вкладов
всех электропроводящих компонентов
системы.
21.
Кондуктометрическое титрованиеКондуктометрическое титрование используется при
анализе индивидуальных веществ и смесей.
Точку эквивалентности определяют по изменению
электропроводности раствора.
Кривая
кондуктометрического
титрования
зависимость электропроводности раствора от объёма
добавленного титранта.
Излом на кривой соответствует точке эквивалентности.
Типы реакций в кондуктометрическом титровании
1) кислотно-основные
2) окислительно-восстановительные,
3) реакции осаждения,
4) реакции комплексообразования.
22.
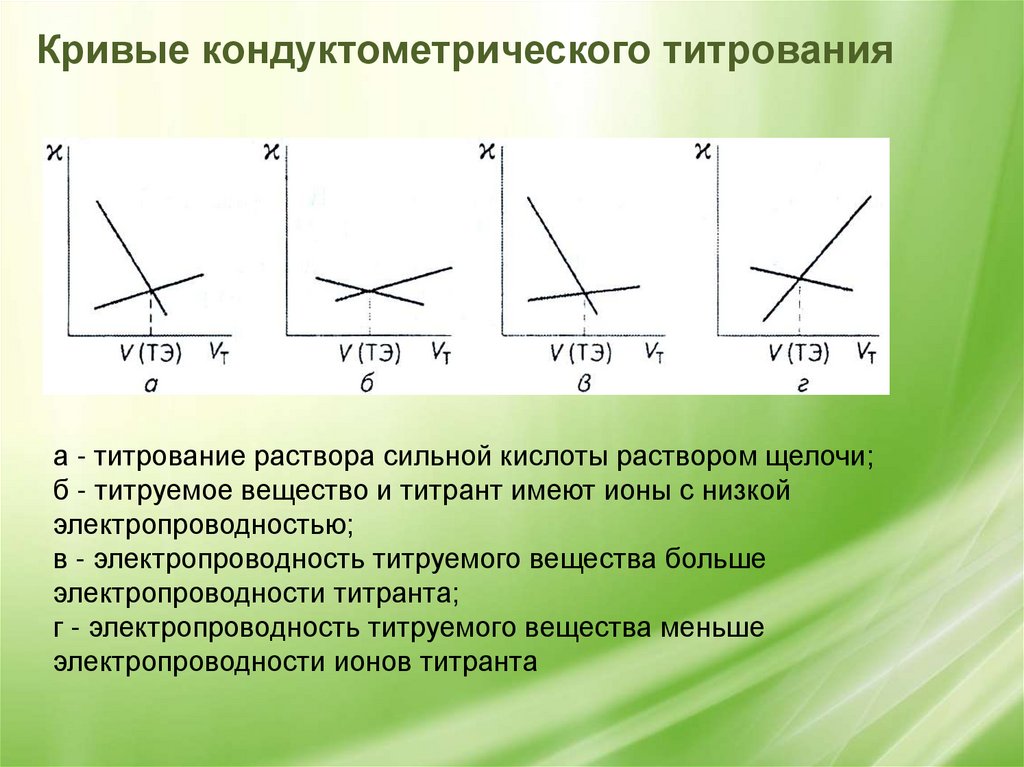
Кривые кондуктометрического титрованияа - титрование раствора сильной кислоты раствором щелочи;
б - титруемое вещество и титрант имеют ионы с низкой
электропроводностью;
в - электропроводность титруемого вещества больше
электропроводности титранта;
г - электропроводность титруемого вещества меньше
электропроводности ионов титранта
23.
Применение прямой кондуктометрииПрямая кондуктометрия используется для:
- определения растворимости малорастворимых
электролитов,
- контроля качества дистиллированной воды и жидких
пищевых продуктов (молока, напитков и др.),
- определения общего содержания солей в минеральной,
морской, речной воде, в почвенных растворах,
- определения влажности почвы, зерна и других объектов.
24.
Достоинства и недостатки кондуктометрии+
-
Высокая чувствительность – нижняя граница
определяемых содержаний 10-4 - 10-5 моль/л
Простота методик, доступность аппаратуры
Возможность титрования можно мутных, окрашенных,
непрозрачных растворов
Ошибка определения составляет от 0,1 до 2 %.
Возможность автоматизации анализа
Метод малоселективен, что ограничивает его
применение в анализе.




















 chemistry
chemistry








