Similar presentations:
Технология_презентация
1.
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕфедеральное государственное бюджетное образовательное учреждение высшего образования
"Вятский государственный университет"
(ВятГУ)
Курсовой проект по теме:
Разработка технологии производства
биоаналога амивантамаба
Автор работы: студент БТб-4101 Корчажкин Денис Аркадьевич
Научный руководитель: Дудина Любовь Геннадьевна
2.
ВведениеАктуальность: локализация производства по стандартам GMP
как замена импорту и способ сделать дорогое лечение
доступным.
Цель: разработка оптимальной технологии производства
биоаналога амивантамаба производительностью 36 кг в год.
3.
ЗадачиЗадачи:
1.Описать технологию получения высокоочищенной лекарственной субстанции
биоаналога амивантамаба.
2.Описать технологию получения готовой лекарственной формы биоаналога
амивантамаба.
3.Описать технологический процесс производства.
4.Рассчитать материальный баланс.
5.Привести характеристика сырья и основных материалов для производства.
6.Описать технологический контроль производства.
7.Разработать спецификацию на лекарственную субстанцию и готовую
лекарственную форму.
8.Разработать биологическую и технологическую схему производства.
4.
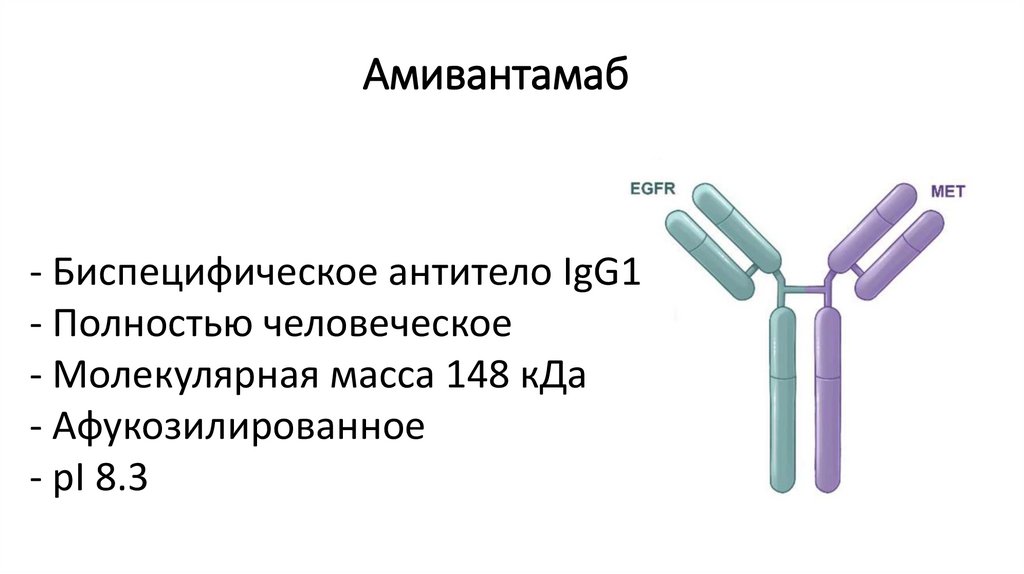
Амивантамаб- Биспецифическое антитело IgG1
- Полностью человеческое
- Молекулярная масса 148 кДа
- Афукозилированное
- pI 8.3
5.
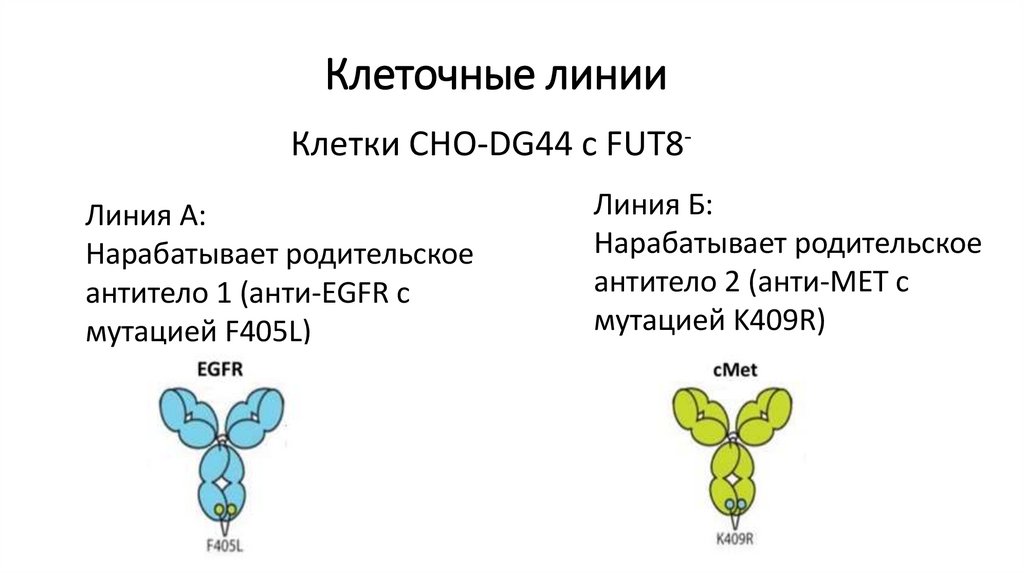
Клеточные линииКлетки СНО-DG44 с FUT8Линия А:
Нарабатывает родительское
антитело 1 (анти-EGFR с
мутацией F405L)
Линия Б:
Нарабатывает родительское
антитело 2 (анти-MET с
мутацией K409R)
6.
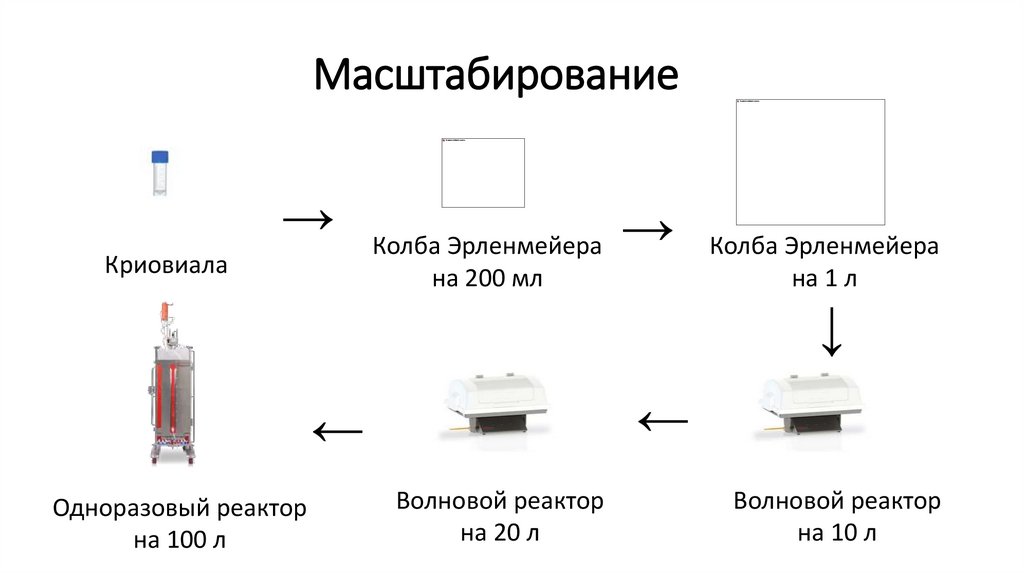
Масштабирование→
Криовиала
Колба Эрленмейера
на 200 мл
→ Колба Эрленмейера
на 1 л
→
→
→
Одноразовый реактор
на 100 л
Волновой реактор
на 20 л
Волновой реактор
на 10 л
7.
КультивированиеСпособ: Fed-Batch (периодическое культивирование с
подпиткой)
Среда: ActiPro
Подпитка: Cell Boost 7a и Cell Boost 7b с 4 дня
ежедневно в объёме 9,3 л и 0,93 л соответственно
Температура: первые 4 дня 37 °C, потом 32 °C
(температурный сдвиг)
pH 7.0
DO: 40%
СО2: 7,5%
Скорость мешалки: 60 об/мин
8.
БуферыУравнение Гендерсона-Хассельбаха
9.
ВыделениеЦель: получение прозрачной
культуральной жидкости
Глубинная фильтрация:
- Удаление клеток и клеточного
дебриса
Стерилизующая фильтрация:
- мембрана 0,2 мкм
10.
Афинная хроматография- Сорбент: MabSelect PrismA
- Ёмкость: 80 г/л
- Объём: 57 л
- Матрица: высокосшитая
агароза
- Лиганд: белок А
- Размер частиц: 50 мкм
- Уравновешивание: 5 CV 20
мМ фосфатный буфер с 150
мМ NaCl, pH 7,4
- Нанесение образца
- Промывка этим же буфером:
5 СV
- Изократическое
элюирование: 2 - 3 CV
50 мМ ацетатный буфер, pH 3.5
11.
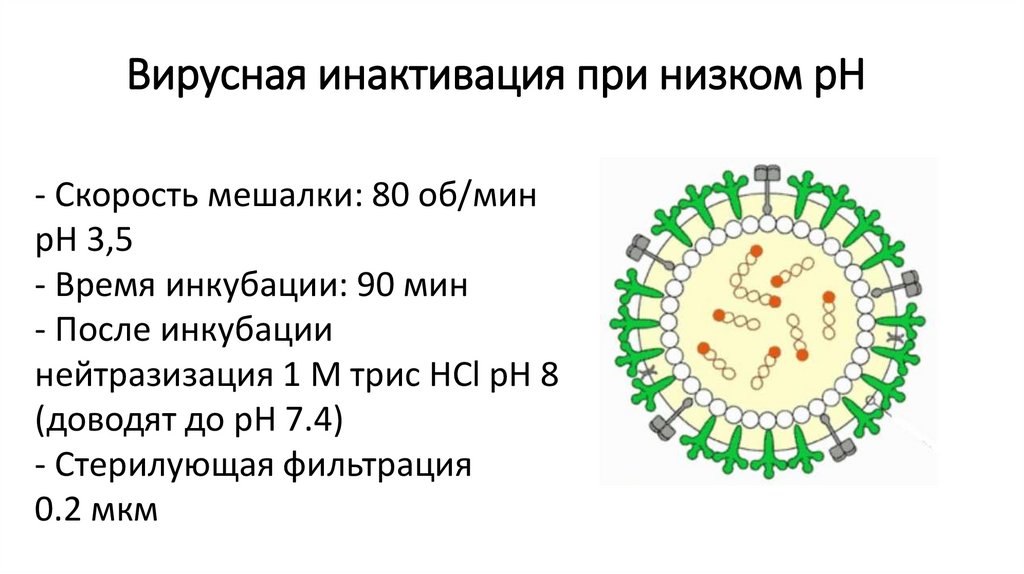
Вирусная инактивация при низком pH- Скорость мешалки: 80 об/мин
pH 3,5
- Время инкубации: 90 мин
- После инкубации
нейтразизация 1 M трис HCl pH 8
(доводят до pH 7.4)
- Стерилующая фильтрация
0.2 мкм
12.
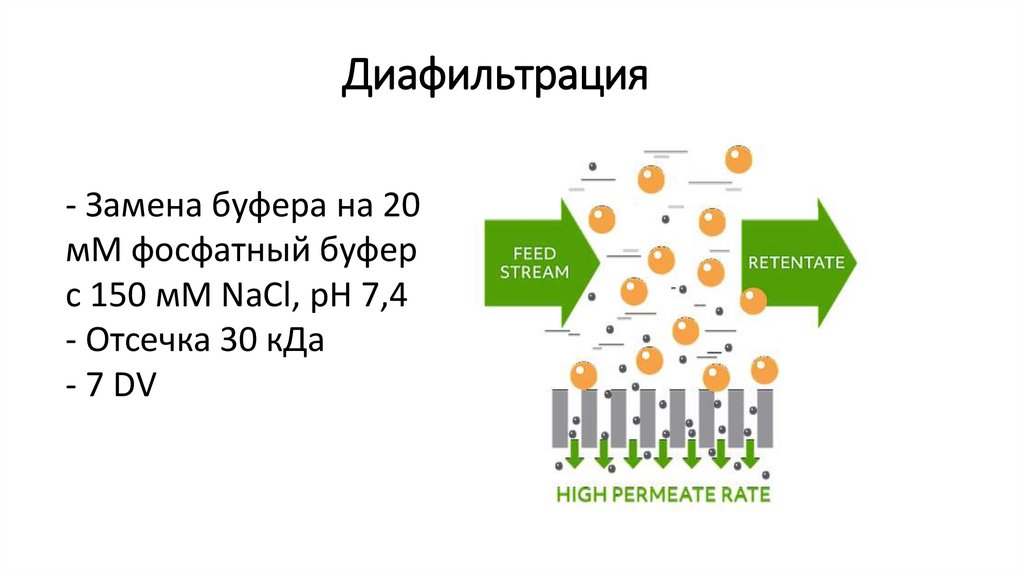
Диафильтрация- Замена буфера на 20
мМ фосфатный буфер
с 150 мМ NaCl, pH 7,4
- Отсечка 30 кДа
- 7 DV
13.
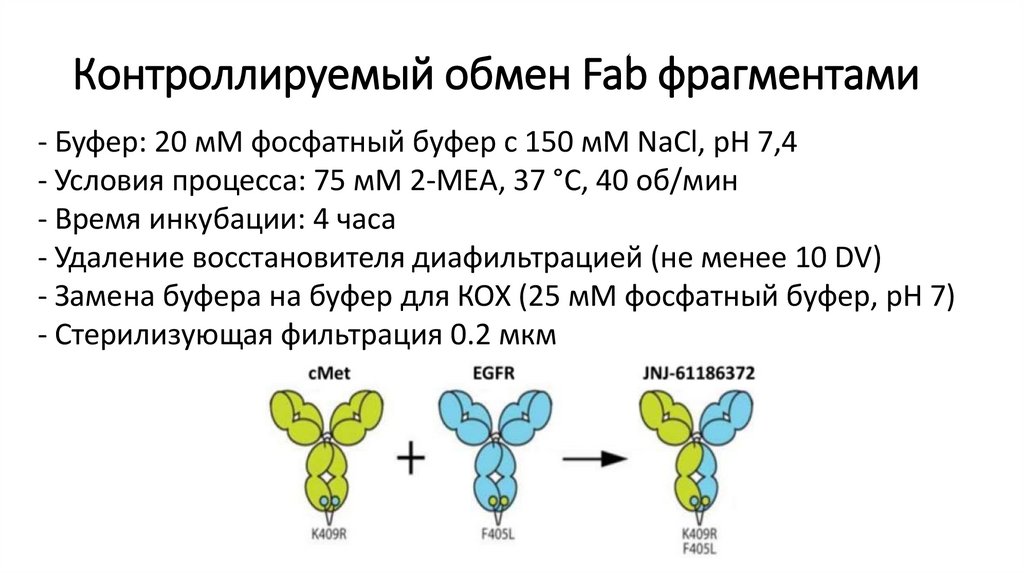
Контроллируемый обмен Fab фрагментами- Буфер: 20 мМ фосфатный буфер с 150 мМ NaCl, pH 7,4
- Условия процесса: 75 мМ 2-МЕА, 37 °C, 40 об/мин
- Время инкубации: 4 часа
- Удаление восстановителя диафильтрацией (не менее 10 DV)
- Замена буфера на буфер для КОХ (25 мМ фосфатный буфер, pH 7)
- Стерилизующая фильтрация 0.2 мкм
14.
Катионообменная хроматография- Сорбент: Capto S ImpAct
- Ёмкость: 100 г/л
- Объём: 60 л
- Матрица: высокосшитая
агароза
- Лиганд: SO3- Размер частиц: 50 мкм
- Уравновешивание: 5 CV 25 мМ
фосфатный буфер, pH 7
- Нанесение образца
- Промывка этим же буфером: 3 СV
- Градиентное элюирование: 15 CV
- От 0 до 100% 25 мМ фосфатный
буфер, 0.5 М NaCl pH 7.0.
15.
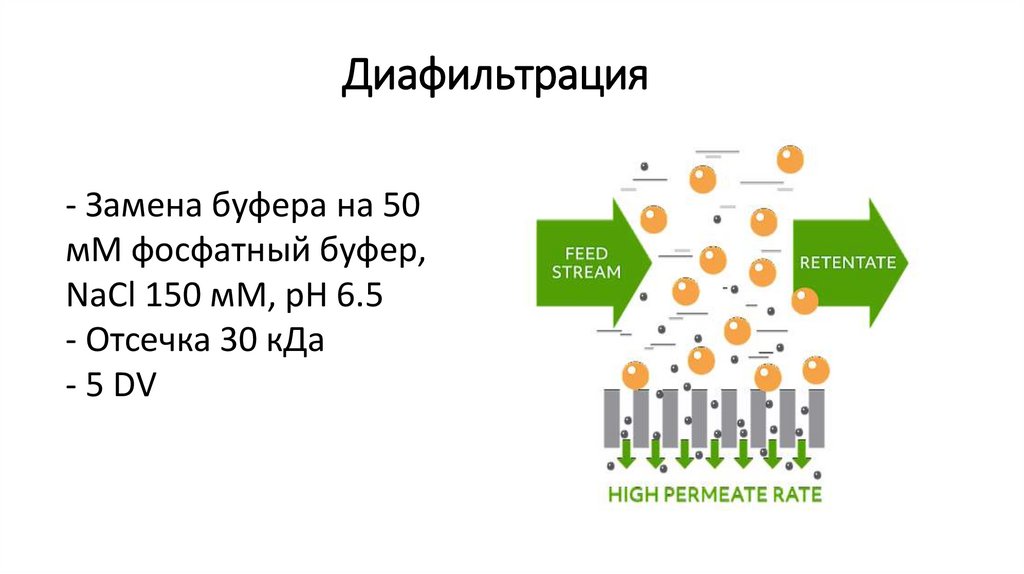
Диафильтрация- Замена буфера на 50
мМ фосфатный буфер,
NaCl 150 мМ, pH 6.5
- Отсечка 30 кДа
- 5 DV
16.
Мультимодальная хроматография- Сорбент: Capto Adhere
- Антитело в проскок
- Нагрузка: 150 г/л
- Объём: 29 л
- Матрица: высокосшитая
агароза
- Лиганд: N-бензил-Nметилэтаноламин (сильный
анионообменник)
- Размер частиц: 75 мкм
- Уравновешивание: 5 CV 50 мМ
фосфатный буфер, NaCl 150 мМ, pH
6.5
- Нанесение образца
- Промывка этим же буфером: 5 СV
- Объём фракции белка: 280 л
- Промывка: 2 CV 50 мМ ацетатный
буфер, pH 3.5
17.
Вирусная фильтрация- Вирусный фильтр Virosart HF
- Размер пор 20 нм
- Материал: полиэфирсульфон (PES)
- Площадь фильтрации 2.4 м2
18.
ФормулированиеСостав формулирующего буфера:
- 0,02 мг/мл ЭДТА
- 0,3286 мг/мл L-гистидин
- 1,2286 мг/мл L-гистидин гидрохлорид моногидрат
- 1 мг/мл L метионин
- 85 мг/мл сахароза
- вода для инъекций как растворитель
19.
ФормулированиеКонцентрирование до 55 мг/мл
↓
Пропускание 10 DV буфера
↓
Добавление стокового раствора полисорбата 80 (100 мг/мл)
до конечной концентрации 0,6 мг/мл
↓
Доведение формулирующим буфером до финального объёма
↓
Стерилизуюшая фильтрация 0.2 мкм
20.
Розлив, картонаж и укладка в гофрокороба←
Асептический розлив по 7 мл во флакон
и этикетирование
←
Картонаж флаконов, вкладывание инструкции
Укладка в гофрокороба
21.
Состав раствора во флаконе- белок (350 мг)
- L-гистидин (2,3 мг) и его гидрохлорида
моногидрат (8,6 мг)
- Сахароза (595 мг)
- Полисорбат 80 (4,2 мг)
- L-метионин (7 мг)
- ЭДТА (0,14 мг)
22.
Заключение- Спроектирована линия производства биоаналога амивантамаба
(36 кг/год).
- Использованы клеточные линии CHO-DG44 с нокаутом
фукозилтраснферазы
- Трехстадийная очистка и два метода обеспечения вирусной
безопасности гарантируют чистоту по стандартам GMP.
- Рассчитан материальный баланс и разработаны спецификации
на субстанцию и ГЛФ (флаконы 7 мл).
- Проект является основой для внедрения технологии в
промышленную практику
23.
Спасибо завнимание!