Similar presentations:
Лекция 3
1.
ЛЕКЦИЯ 3ОСНОВЫ
ЭЛЕКТРОХИМИИ
1
2.
Электрохимические потенциалыПо месту возникновения различают
Мембранные потенциалы
(возникают на поверхности мембран)
Диффузные потенциалы
(возникают на границе раздела двух неодинаковых растворов
электролита)
Электродные потенциалы
(возникают на границе
проводник 1 рода | проводник 2 рода)
Мы будем изучать электродные потенциалы
17
3.
Электрод – система, состоящая из проводника 1 родаконтакте с проводником 2 рода
Схема (условное обозначение) электрода будет показана на конкретных
примерах.
Общий принцип:
Ме|раствор или расплав электролита
Вертикальной чертой обозначают место возникновения равновесного
окислительно-восстановительного потенциала, который можно
рассчитать по уравнению Нернста.
Уравнение Нернста:
Расшифровку
см. на следующих слайдах
Ео/в Е∘
о/в
2, 3RT
окисл.форма
lg
равновесный окислительно-восстановительный потенциал окислительновосстановительной системы для разбавленных растворов.
18
4.
E°о/в – стандартный равновесный окислительно-восстановительныйпотенциал системы
(потенциал, измеренный при стандартных условиях (t = 25 °C и
концентрациях всех участников 1 моль/л) относительно стандартного
водородного электрода (см. измерение потенциалов).
Стандартный равновесный окислительно-восстановительный потенциал
системы (E°о/в) характеризует окислительную способность системы:
чем больше значение E°о/в, тем сильнее окислительная cпособность
системы
19
5.
R – универсальная газовая постоянная (8,31 Дж/(моль·К)T – абсолютная температура, К
F – постоянная Фарадея (≈96500 Кл/ моль электронов)
z – количество электронов, принимающих участие в электродном процессе
[окисл.формы] и [восст.формы] – равновесные концентрации окисленной и
восстановленной форм.
При стандартной температуре можно записать:
2,3RT 2,3 8,31 (273 25) 0,059
zF
z 96500
z
(В)
20
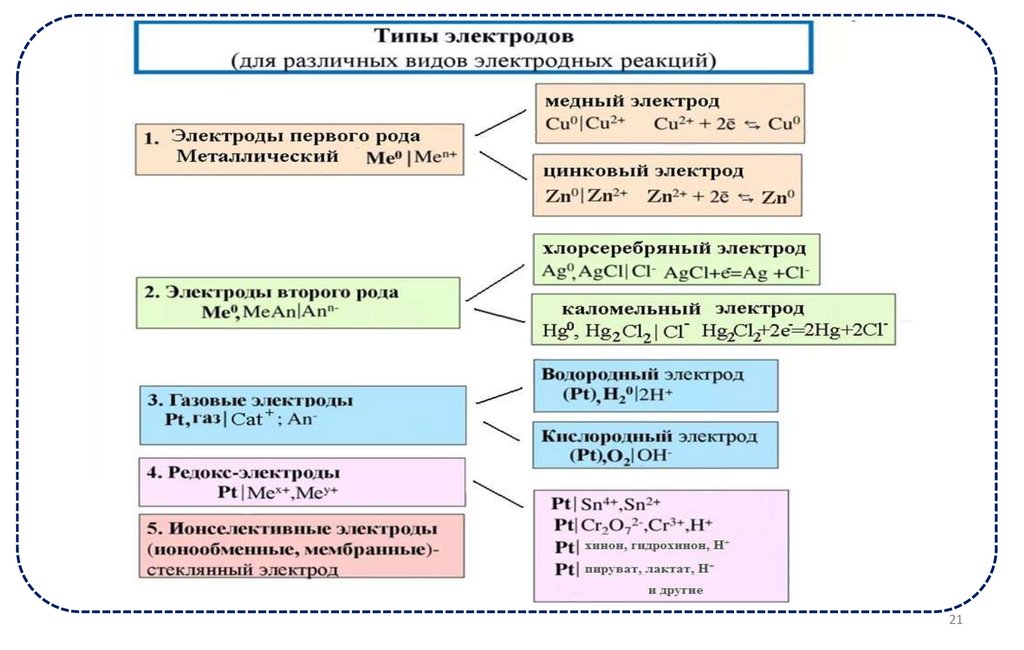
6.
217.
Электроды первого рода обратимы относительно ионовраствора.
Наиболее распространены металлические электроды.
Металлический электрод – растворимый металл, опущенный
в раствор собственной соли.
• Схема (условная запись) металлического электрода:
Ме|Mez+
например Cu|Cu2+ или Cu|CuSO4
.
22
8.
Механизм возникновения скачка потенциалаВозможно два процесса:
• Ме0 – z e- → Mez+ окисление
• Mez+ + z e- → Ме0 восстановление
Через некоторое время скорости процессов окисления и восстановления становятся
равными между собой (υокисл = υвосстановл) и устанавливается электродное равновесие,
которое принято записывать как обратимый процесс восстановления:
Mez+ + z e- ⮀ Ме0
В любом случае возникает двойной электрический слой.
Поверхность металла заряжается в зависимости от соотношения скоростей окисления и
восстановления в первый момент.
Соотношение скоростей
в первый момент
Знак заряда
металла
Пример
υокисл > υвосстановл
отрицательный
Zn|Zn2+
υокисл < υвосстановл
положительный
Cu|Cu2+
23
9.
Уравнение Нернста для металлического электродаВосстановленной формой в металлическом электроде является металл – твердое вещество,
поэтому уравнение Нернста приобретает следующий вид:
2, 3RT
z
∘
lg
Ме
ЕМе z /Ме ЕМе z /Ме
zF
24
10.
Окислительно-восстановительный электродпредставляет собой
индифферентный металл (например, платина, золото) или чистый графит,
погруженный в раствор, содержащий окисленную и восстановленную
формы одного элемента, способные переходить друг в друга в результате
переноса электронов.
Условная запись таких электродов:
Pt| Fe3+, Fe2+
Pt| Sn4+, Sn2+
Pt| MnO4-, Mn 2+, H+
31
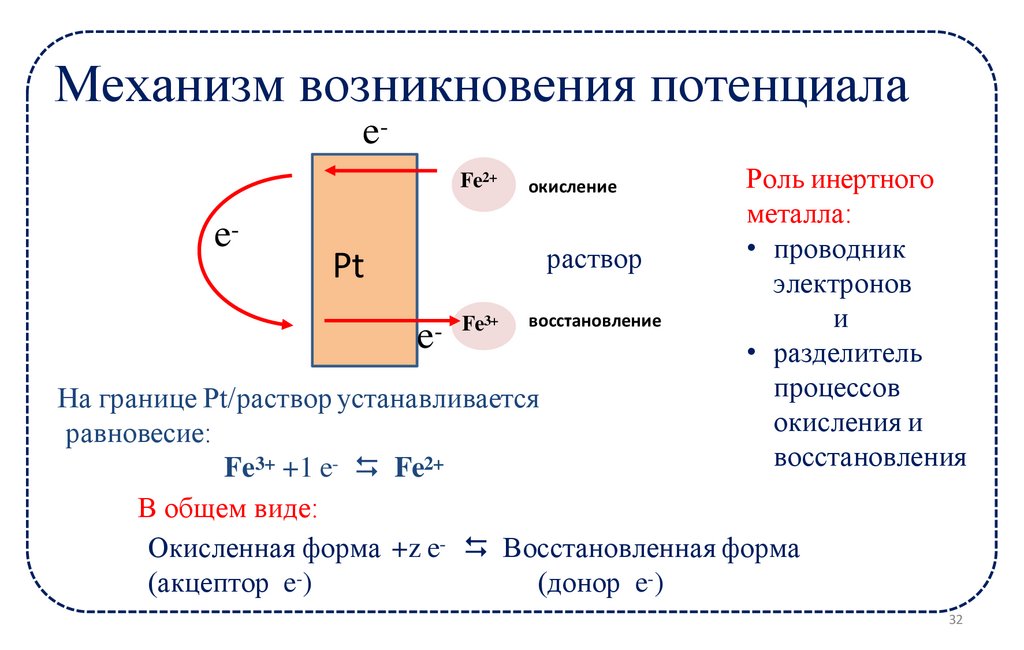
11.
Механизм возникновения потенциалаeFe2+
e-
окисление
раствор
Pt
Fe3+
e
восстановление
Роль инертного
металла:
• проводник
электронов
и
• разделитель
процессов
окисления и
восстановления
На границе Pt/раствор устанавливается
равновесие:
Fe3+ +1 e- ⮀ Fe2+
В общем виде:
Окисленная форма +z e- ⮀ Восстановленная форма
(акцептор e-)
(донор e-)
32
12.
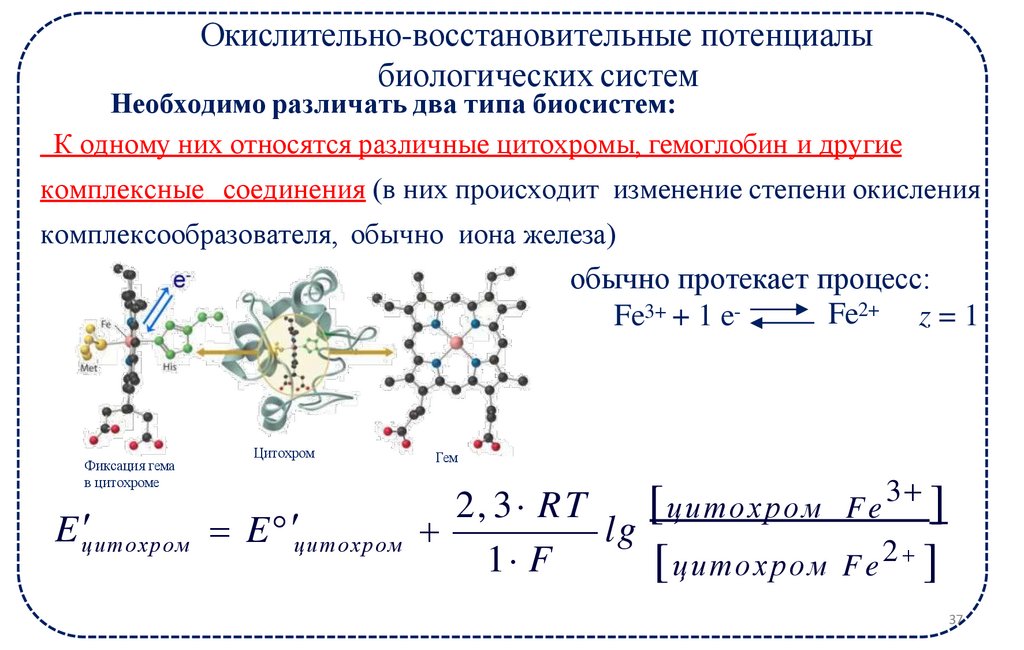
Окислительно-восстановительные потенциалыбиологических систем
Необходимо различать два типа биосистем:
К одному них относятся различные цитохромы, гемоглобин и другие
комплексные соединения (в них происходит изменение степени окисления
комплексообразователя, обычно иона железа)
обычно протекает процесс:
Fe2+ z = 1
Fe3+ + 1 e-
Фиксация гема
в цитохроме
Цитохром
Гем
2, 3 R T
[
]
цитохром Fe
E цитохром
lg
E цитохром
1 F
[ цитохром F e 2 ]
3
37
13.
Вторая группа окислительно-восстановительных биологических систем• рН-зависимые биосистемы
(в них происходит изменение степени окисления атомов углерода в результате
гидрирования двойных связей, поэтому кроме электронов в их электродных процессах
участвуют также и катионы водорода)
Окисленная + 2 Н+ + 2 еформа (Ox)
z=2
Например:
Восстановленная
форма (Red)
Н 3 С – С – С О О Н + + 2 е
Н3С – СН – СОО
О
пирув ат (окисл.ф орма)
ОН
лакт ат (восст.форма)
Сопряжение ОВР и протолитической реакции
38
14.
Вывод уравнения Нернста для рН-зависимыхокислительно-восстановительных систем
Окисленная + 2 Н+ + 2 еформа (Ox)
z=2
Восстановленная
форма(Red)
• Исходное уравнение:
2, 3 R T
[
окисл.форма ]
lg
Eо E о
в
в
z F
[ восст.форма ]
39
15.
2окисл.форма
Н
2, 3 RT
ℓg
Eо E о
в
в
2 F
восст.форма
E о E о
в
в
2, 3 R T
2 F
окисл.форма
2,
3
R
T
ℓg Н
ℓg
2 F
восст.форма
2
окисл.форма
2, 3 R T
2, 3 R T
рН
ℓg
E о E о
в
в
F
2 F
восст.форма
Уравнение Нернста для рН-зависимых окислительно-восстановительных
систем при любых значений рН и любой температуре.
окисл.форма
0, 059
ℓg
E о E о 0, 059 р Н
в
в
2
восст.форма
Для 25 С
40
16.
E о для биосистем измерить не возможно(!).в
Его значение рассчитывают по формуле:
E о E о 0, 059 7
в
в
где
E о стандартный равновесный потенциал
в
биосистемы, измеренный при рН=7.
окисл.форма
0, 059
lg
E о E о
в
в
2
восст.форма
Уравнение Нернста для рН-зависимых окислительновосстановительных биосистем при рН=7 и температуре 25 °С.
41
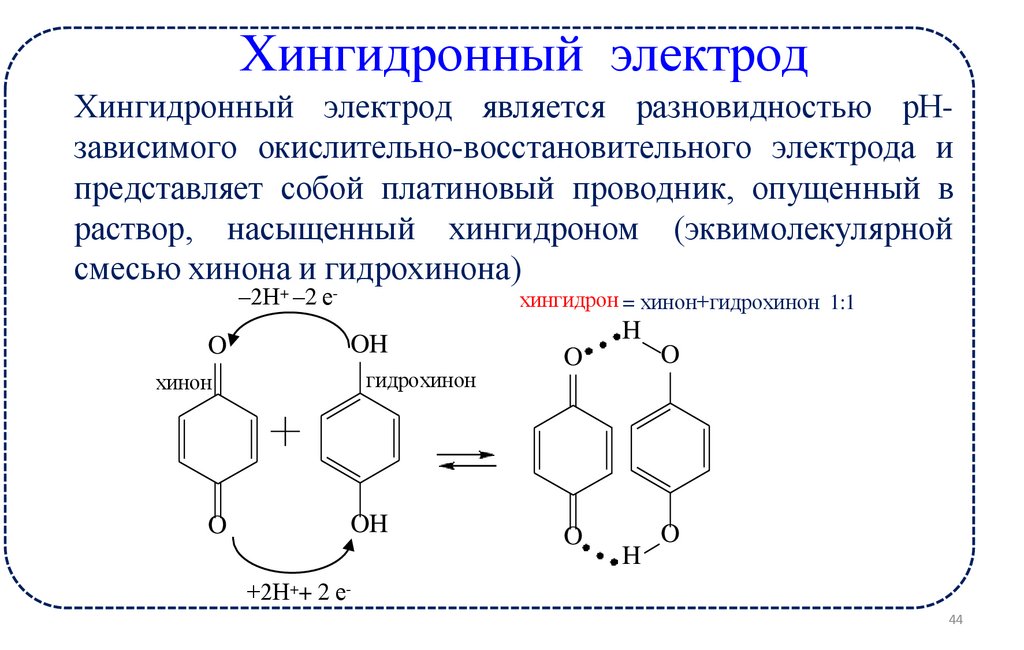
17.
Хингидронный электродХингидронный электрод является разновидностью рНзависимого окислительно-восстановительного электрода и
представляет собой платиновый проводник, опущенный в
раствор, насыщенный хингидроном (эквимолекулярной
смесью хинона и гидрохинона)
–2Н+ –2 е-
O
хингидрон = хинон+гидрохинон 1:1
OH
гидрохинон
хинон
O
OH
H
O
O
O
O
H
+2Н++ 2 е44
18.
Вывод уравнения Нернстадля хингидронного электрода.
Хингидронный электрод – разновидность рН-зависимого окислительновосстановительного электрода:
Отношение концентраций окисленной и восстановленной форм равно 1,
lg1= 0, отсюда следует:
E хг = 0,699 – 0,059 рН
(25 °С)
45
19.
ВОДОРОДНЫЙ ЭЛЕКТРОДВодородный электрод относится к электродам первого рода и является разновидностью
окислительно-восстановительных электродов с участием газов в электродной реакции,
т.е. газовым к электродам. Уравнение Нернста для водородного электрода:
E
E∘
2H / H2
2H / H2
aH2
2,3RT
lg
2 F
PH2
Условно принят за ноль
Тогда для PH 1 атм получаем:
2
2,3RT
lg a H для любой Т
2
F
0, 059 lg a = 0,059 рН для 25 С
E2 H / H
E
2 H / H2
Уравнение электродного процесса:
2Н+ + 2 е-
2Н
Н2 (газ)
H
EH 2 0,059 рН
рН принимает значения от 0 до 14, поэтому потенциал водородного электрода изменяется в пределах
от – 0,826 В до 0, то есть ЕН2 0 (потенциал водородного электрода всегда отрицателен!!!).
2
20.
Электроды второго родаЭлектродами второго рода являются электроды, в
которых металл покрыт малорастворимой солью этого
металла и находится в растворе, содержащем другую
растворимую соль с тем же анионом.
К электродам второго рода относятся
• хлорсерябряный и
• ка́ломельный электроды
53
21.
1 – корпус; 2 – асбестовая нить;3– резиновая пробка и отверстие для залива
раствора хлорида калия;
4 – насыщенный раствор хлорида калия;
5 – слой хлорида серебра;
6 – серебряная проволока;
7 – солевой мостик и асбестовый фитиль
Насыщенный хлорсеребряный электрод
Хлорсеребряный электрод (ХСЭ) представляет собой серебряный
проводник, покрытый твёрдым AgCl, который погружён в
насыщенный раствор KCl.
• Схема Ag|AgCl, KClнасыщ
54
22.
Вывод уравнения Нернстадля хлорсеребряного электрода
• Исходное уравнение:
2,3 RT
ℓga A g
E
E
Ag / Ag
Ag / Ag
1 F
где a A g — активная концентрация1 ионов серебра,
которая может быть рассчитана из произведения
растворимости (понятие «произведение
растворимости» будет рассмотрено в теме «Осадки»)
ПРAgCl
aAg a
Cl
1) активная концентрация используется в концентрированных растворах для учёта взаимодействия
ионов.
55
23.
Тогда уравнение Нернста примет вид:E
Ag / Ag
E
Обозначив
2,3 RT
2,3 RT
lgaCl
lgПР
Ag / Ag
AgCl
1 F
1 F
E
2,3 RT ℓgПР
E
хс
Ag / Ag
AgCl
1 F
Получим уравнение Нернста для хлорсеребряного
электрода
2,3 RT
ℓg a Cl E х с 0, 059ℓg a Cl
E х с E х с
1 F
Таким образом, потенциал хлорсеребряного электрода будет зависеть
от активной концентрации ионов хлора в растворе.
56
24.
Для насыщенного раствора хлорида калия при 25 °Спотенциал хлорсеребряного электрода является
постоянной величиной и равен 0,202 В
E х с 0, 202 В
(25 С )
Аналогично выводится уравнение Нернста для
каломельного электрода.
2,3 RT
ℓg a Cl E к а л 0, 059ℓg a Cl
E ка л E к а л
1 F
57
25.
Насыщенныйкаломельный электрод
Платиновая
проволока, впаянная
во внутреннюю трубку
для обеспечения
контакта с пастой
Схема:
Hg|Hg2Cl2,KCl насыщ.
каломель
Eкал. = 0,244 B (25 °С)
Паста из ртути,
каломели и
хлорида калия
Отверстие очень
малого диаметра
для обеспечивания
контакта пасты с
раствором КСl
Отверстие для
заполнения
раствором КСl
К потенциометру
Насыщенный
раствор КСl
Солевой мостик (пробка из
асбестового волокна или
пористой керамики)
58
26.
Электродвижущая сила. Определениенаправления окислительно-восстановительных
процессов.
• Электродвижущая сила (ЭДС) – это разность потенциалов. Её
обозначение
• ЭДС всегда положительна!
ε= Е -Е >0 (всегда)
2
1
59
27.
Если две окислительно-восстановительные системы привести в контакт,то возникает электродвижущая сила, равновесие нарушится, и начнётся
протекание самопроизвольной окислительно-восстановительной реакции,
направление которой зависит от значения равновесных окислительновосстановительных потенциалов этих систем.
• Система с бóльшим потенциалом становится окислителем
(акцептором электронов), в ней будет протекать процесс
восстановления.
• Система с меньшим потенциалом становится восстановителем
(донором электронов), в ней будет протекать процесс окисления.
Суммарный окислительно-восстановительный процесс может протекать как в
объёме, например, в пробирке, так и в гальваническом элементе.
В последнем случае процессы окисления и восстановления будут разделены, что
позволяет энергию химических связей превратить в электрическую энергию.
60
28.
Рассмотрим обратимую окислительновосстановительную реакцию10FeSO4 + 2KMnO4 + 8H2SO4 ⮀ 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Е°Fe / Fe =0,77 В
3+
2+
Восстановитель
окисляется
<
Е°MnO4 -, H+/ Mn
2+,
H O=1,51 В
2
Окислитель
восстанавливается
В стандартных условиях данная реакция идёт слева направо
10FeSO4 + 2KMnO4 + 8H2SO4 ⮀ 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
61
29.
Расчёт изменения энергии Гиббса (изобарноизотермического потенциала)Энергия Гиббса представляет собой часть полной энергии системы,
которая может полностью перейти в работу в изобарноизотермических условиях.
В
окислительно-восстановительных
реакциях
происходит
электрохимическая работа
по переносу электронов от
восстановителя к окислителю.
G n F (E о к и с л и т е л я E в о с с т а н о в и т е л я ) n F р е а к ц и и
G – изменение энергии Гиббса, Дж
n – количество электронов, принимающих участие в суммарном процессе
(равно наименьшему общему кратному электронов, принимающих участие в полуреакциях
или в электродных процессах), моль
F – постоянная Фарадея (96500 Кл/моль экв)
Е – окислительно-восстановительные потенциалы, В
ε°– ЭДС реакции
62
30.
Потенциометрия. Водородная шкалапотенциалов.
Абсолютное значение потенциала измерить не возможно.
Все табличные потенциалы – относительные величины!
• Для измерения потенциала электрода нужно составить
гальванический элемент из данного электрода и электрода
сравнения и замкнуть на большое сопротивление.
• Применяют водородную шкалу потенциалов, то есть
ВСЕ табличные значения потенциалов измерены или
рассчитаны относительно стандартного водородного
электрода.
63
31.
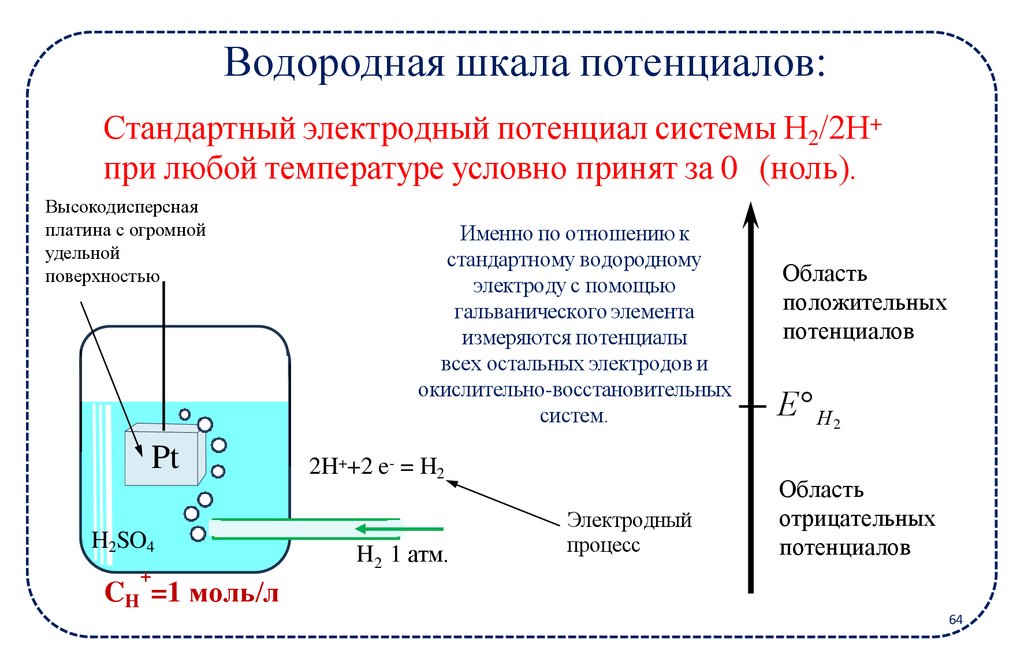
Водородная шкала потенциалов:Стандартный электродный потенциал системы Н2/2Н+
при любой температуре условно принят за 0 (ноль).
Высокодисперсная
платина с огромной
удельной
поверхностью
Pt
H2SO4
+
Именно по отношению к
стандартному водородному
электроду с помощью
гальванического элемента
измеряются потенциалы
всех остальных электродов и
окислительно-восстановительных
систем.
2H++2 e- = H2
H2 1 атм.
Электродный
процесс
Область
положительных
потенциалов
Е Н 2
Область
отрицательных
потенциалов
CH =1 моль/л
64
32.
Схема гальванического элементаСтандартная запись схемы гальванического элемента:
Ме1| раствор электролита1 || раствор электролита2 | Ме2
Справа записывают электрод с бо́льшим потенциалом,
а слева – с меньшим.
E 2 E1
Две вертикальные черты обозначают отсутствие
диффузного потенциала на границе двух растворов,
тогда ЭДС элемента может быть рассчитана как
разность электродных потенциалов.
65
33.
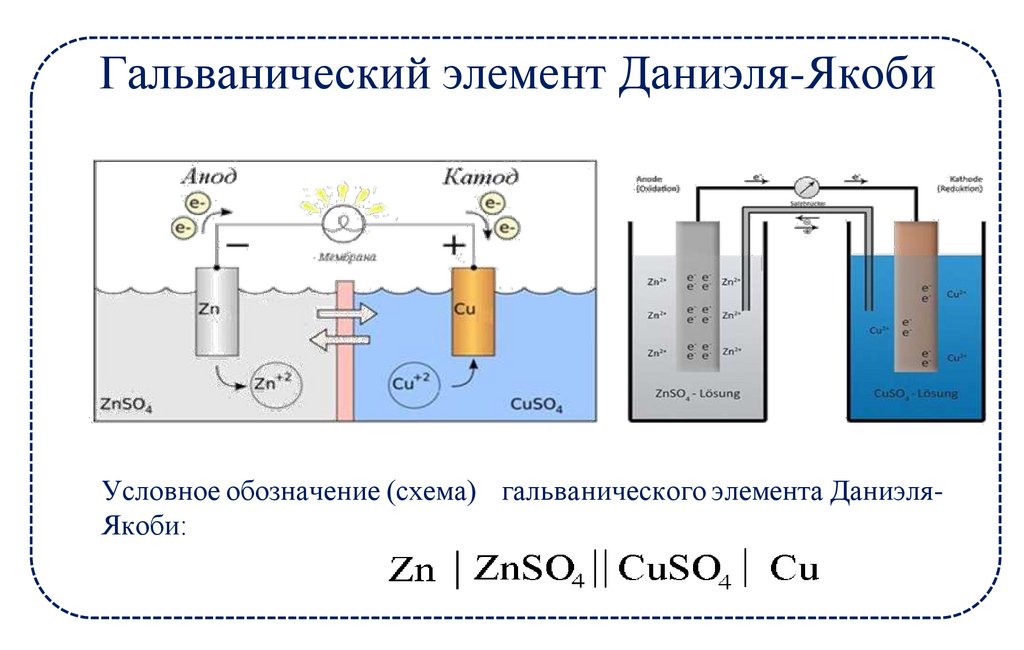
Гальванический элемент Даниэля-ЯкобиУсловное обозначение (схема) гальванического элемента ДаниэляЯкоби:
34.
Для насыщенного раствора хлорида калия при 25 °Спотенциал хлорсеребряного электрода является
постоянной величиной и равен 0,202 В
E х с 0, 202 В
(25 С )
Аналогично выводится уравнение Нернста для
каломельного электрода.
2,3 RT
ℓg a Cl E к а л 0, 059ℓg a Cl
E ка л E к а л
1 F
67
35.
Электроды сравнения:В качестве электродов сравнения используют
электроды, потенциалы которых устойчивы и
воспроизводимы, а протекающие на них
электрохимические процессы обратимы.
Чаще всего используют:
1. Стандартный водородный электрод
2. хлорсеребряный (сереброхлоридный) электрод
3. ка́ломельный электрод
(и другие)
68
36.
Электроды для определения рН1. Водородный электрод
используют при любых значениях рН
Pt (H2)|водный раствор (Н+)
Е H 2 0, 059 pH (25 C)
2. Хингидронный электрод
используют при 0≤рН<7 (т.е. в кислых растворах)
Pt (ХГ)|кислый водный раствор (Н+)
E хг = 0,699 - 0,059 рН (25 °С)
69
37.
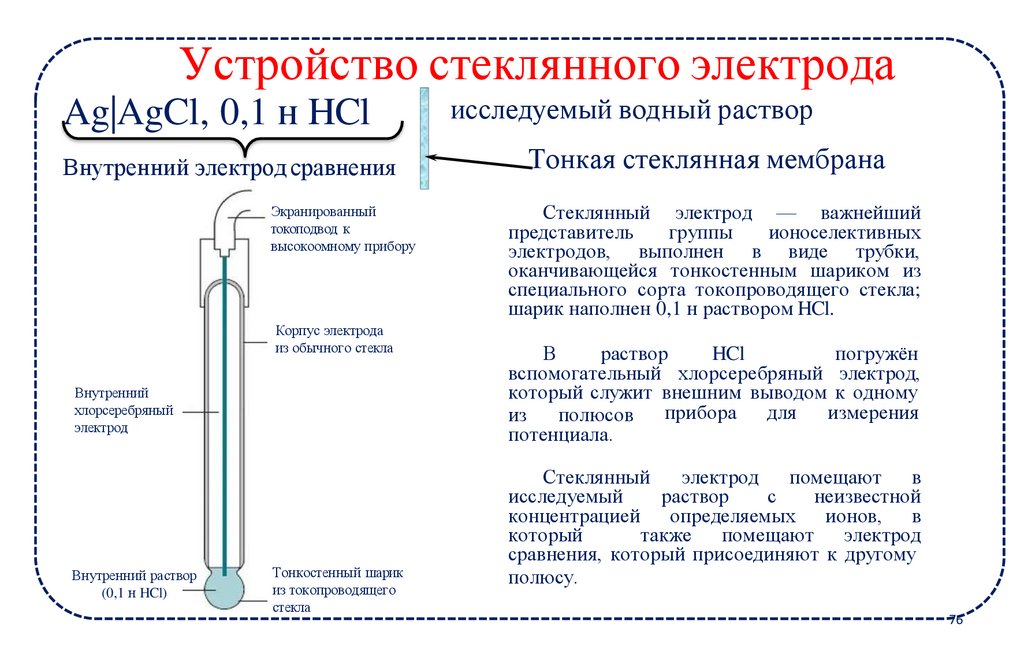
Устройство стеклянного электродаAg|AgCl, 0,1 н HCl
Внутренний электрод сравнения
Экранированный
токоподвод к
высокоомному прибору
Корпус электрода
из обычного стекла
Внутренний
хлорсеребряный
электрод
Внутренний раствор
(0,1 н HCl)
Тонкостенный шарик
из токопроводящего
стекла
исследуемый водный раствор
Тонкая стеклянная мембрана
Стеклянный электрод — важнейший
представитель
группы
ионоселективных
электродов, выполнен в виде трубки,
оканчивающейся тонкостенным шариком из
специального сорта токопроводящего стекла;
шарик наполнен 0,1 н раствором HCl.
В
раствор
HCl
погружён
вспомогательный хлорсеребряный электрод,
который служит внешним выводом к одному
прибора для
измерения
из
полюсов
потенциала.
Стеклянный
электрод помещают
в
исследуемый
раствор
с
неизвестной
концентрацией определяемых ионов, в
который
также помещают электрод
сравнения, который присоединяют к другому
полюсу.
76
38.
3. Стеклянный электрод (продолжение)Электродный процесс:
R(Na , Li ) H
R(H )
Na , Li
мембрана
мембрана
раствор
раствор
Потенциал стеклянного электрода складывается из
стекл. 1 2 3 ,
где 1 потенциал внутреннего хлорсеребрянного электрода (const);
2 потенциал внутренней поверхности стеклянной мембраны (const)
3 поненциал наружной поверхности стеклянной мембраны (переменная)
Так как 1 2 К, то
стекл. К 0,059lg aH К 0,059 pH
77
39.
Определение рН в лабораторном практикумеК измерительному прибору
ЭДС цепи:
Ецепи = Ех.с. –Ест. = Ех.с. –К+0,059 рН
Ецепи Ехс К Ецепи сonst
рН
0,059
0,059
































 chemistry
chemistry








