Similar presentations:
1_МОЙ_Положение металлов в ПС, особенности строения их атомов, физические свойства
1.
Положение металловв ПСХЭ Д.И.Менделеева
2.
Цель урока:Формирование умений устанавливать связь между
строением атомов, строением кристаллической решетки
и физическими свойствами металлов. Ознакомление со
сплавами металлов, их свойствами и применением.
Проблемный вопрос урока:
Какие химические элементы относят к металлам?
Какие физические свойства металлов и их сплавов
обусловливают их применение в промышленности,
технике, строительстве, медицине и т. д.?
3.
Этап -I. Актуализация знаний1) Какие элементы относят к металлам?
2) Какое положение в Периодической системе
занимают металлы? Где проходит условная
граница (диагональ) между атомами металлами
и атомами неметаллами?
4.
Этап -I. Актуализация знаний1) Какие элементы относят к металлам?
2) Какое положение в Периодической системе
занимают металлы? Где проходит условная граница
(диагональ) между атомами металлами и атомами неметаллами?
3) Сколько электронов содержат атомы большинства
металлов на внешнем энергетическом уровне?
5.
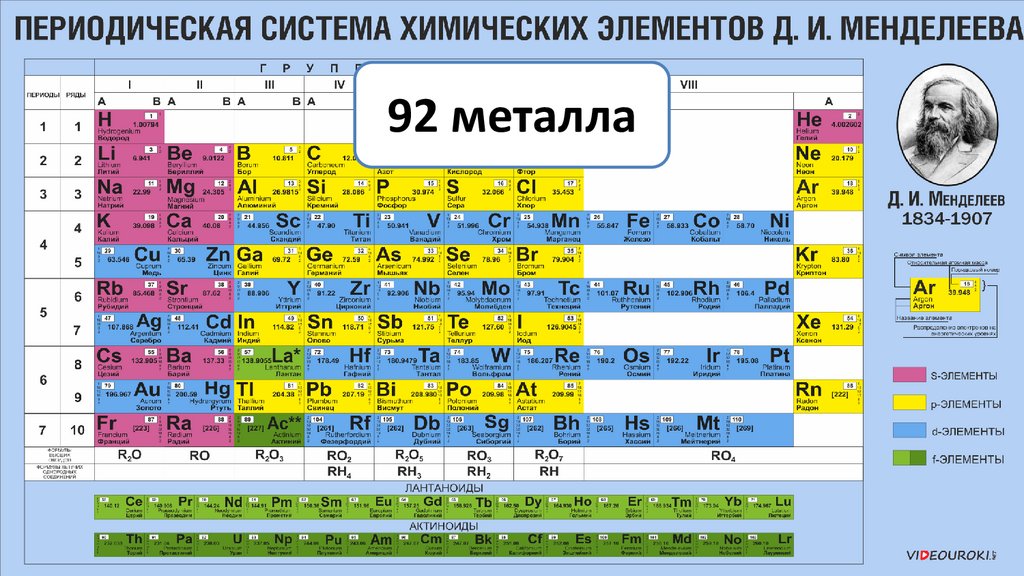
92 металла6.
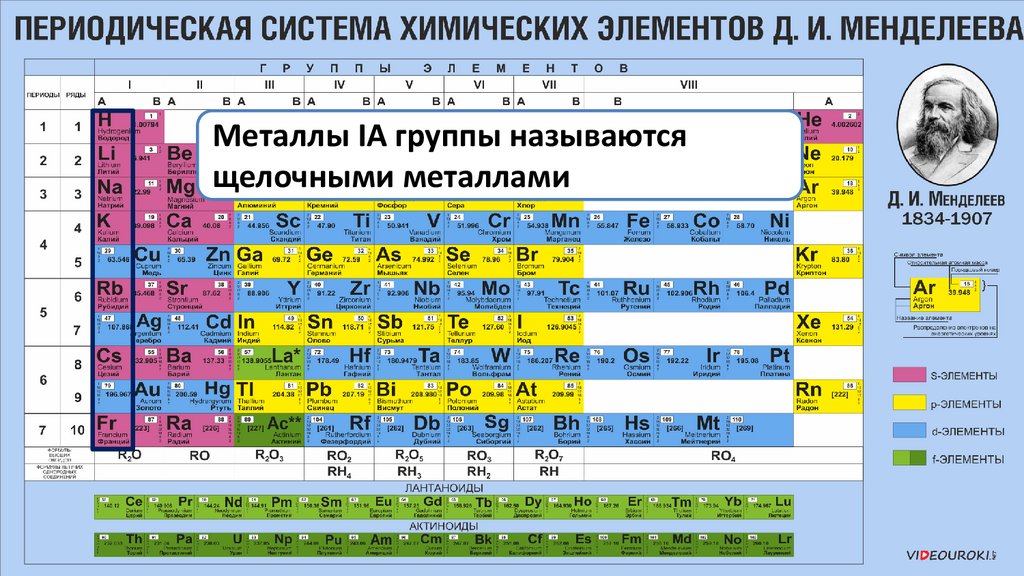
Металлы IA группы называютсящелочными металлами
7.
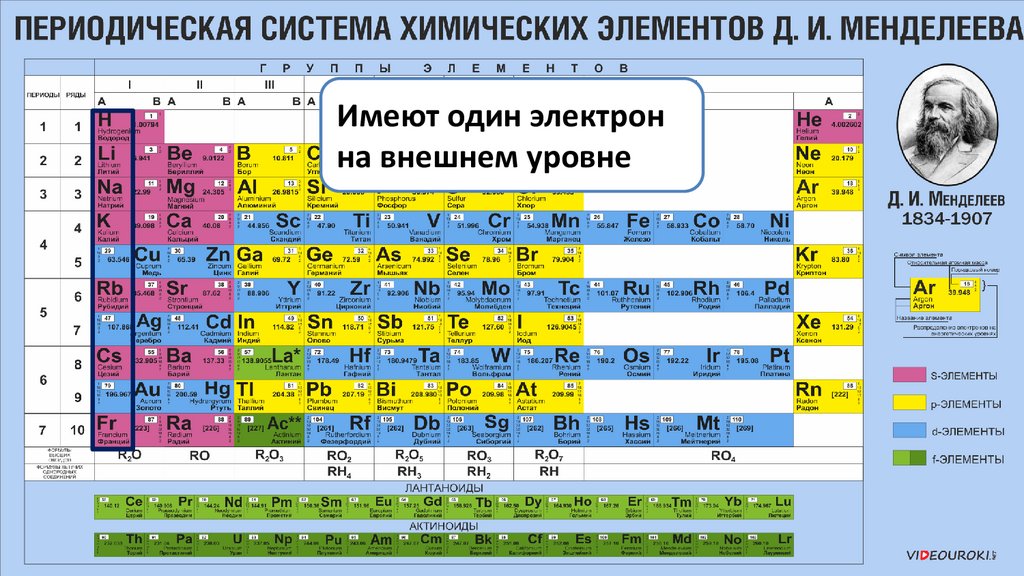
Имеют один электронна внешнем уровне
8.
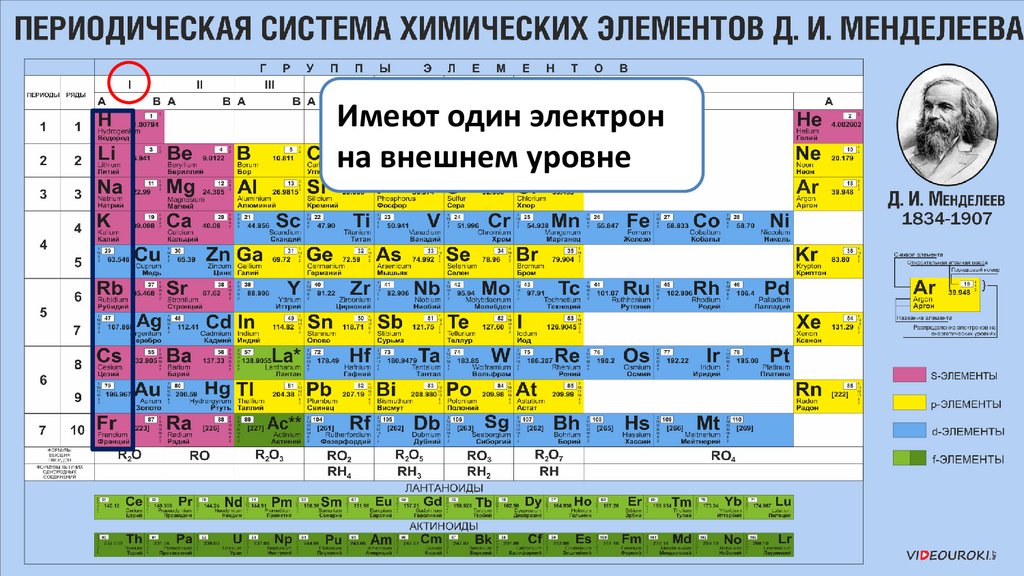
Имеют один электронна внешнем уровне
9.
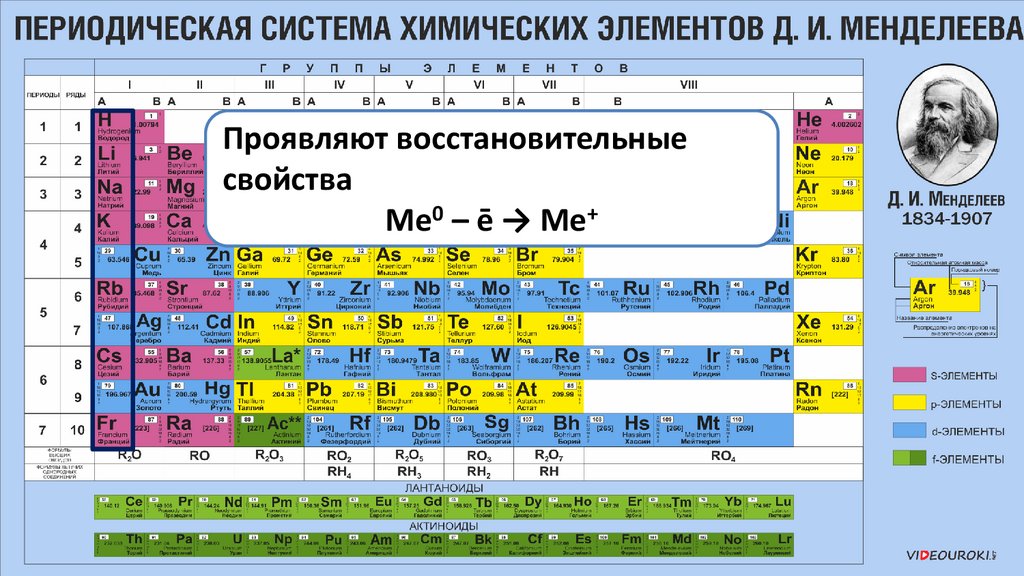
Проявляют восстановительныесвойства
Ме0 – ē → Ме+
10.
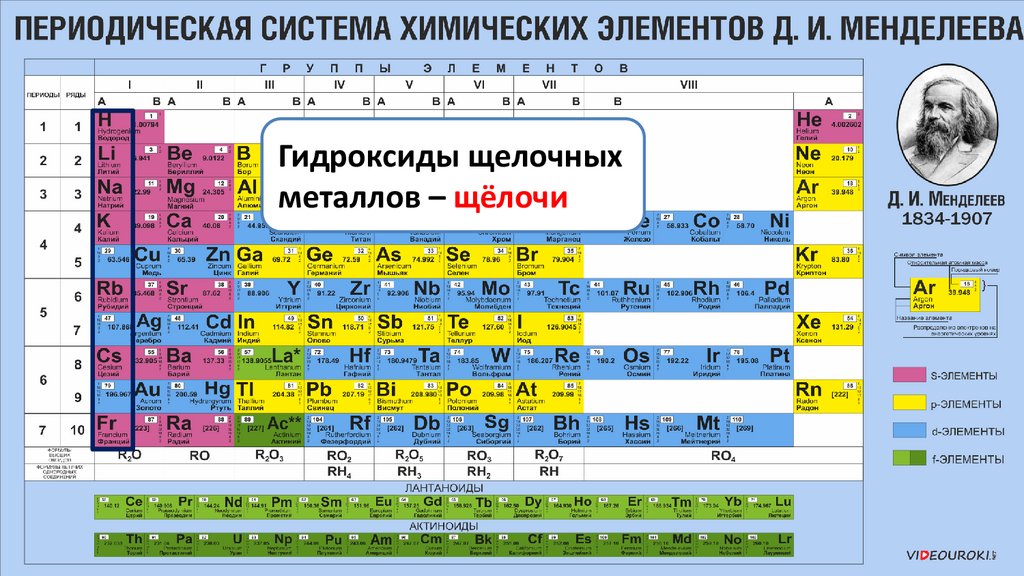
Гидроксиды щелочныхметаллов – щёлочи
11.
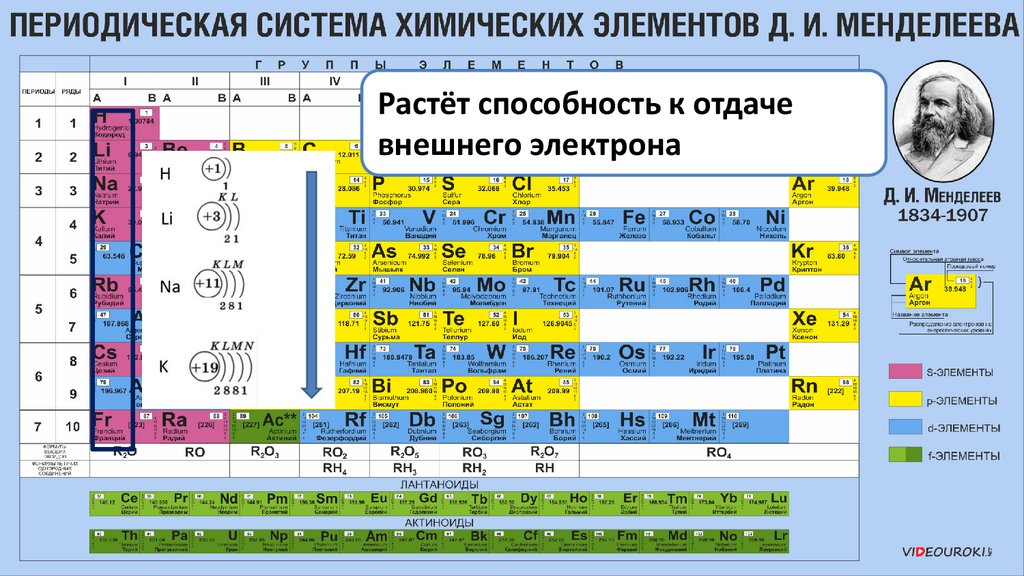
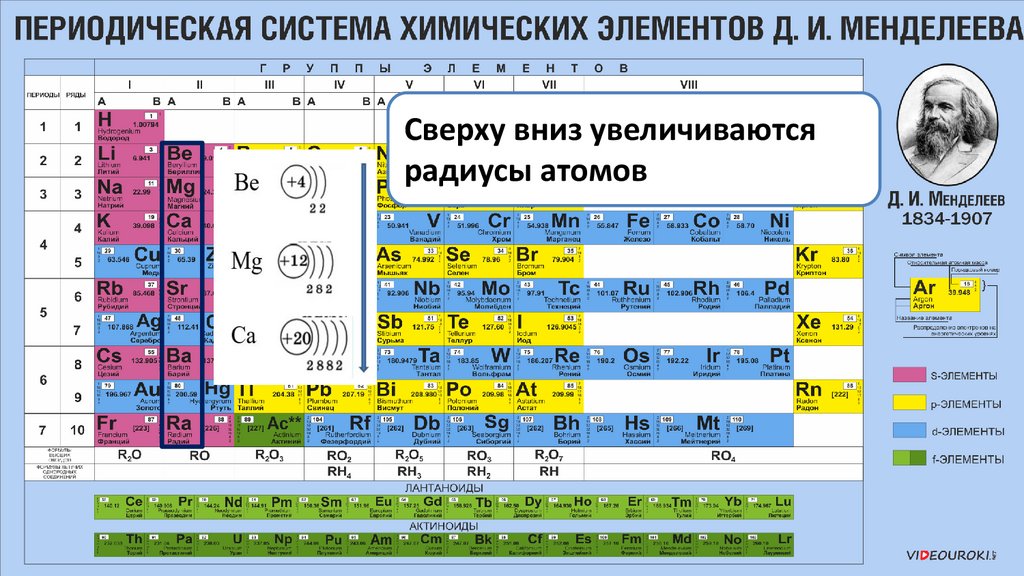
Сверху вниз увеличиваютсярадиусы атомов
12.
Растёт способность к отдачевнешнего электрона
13.
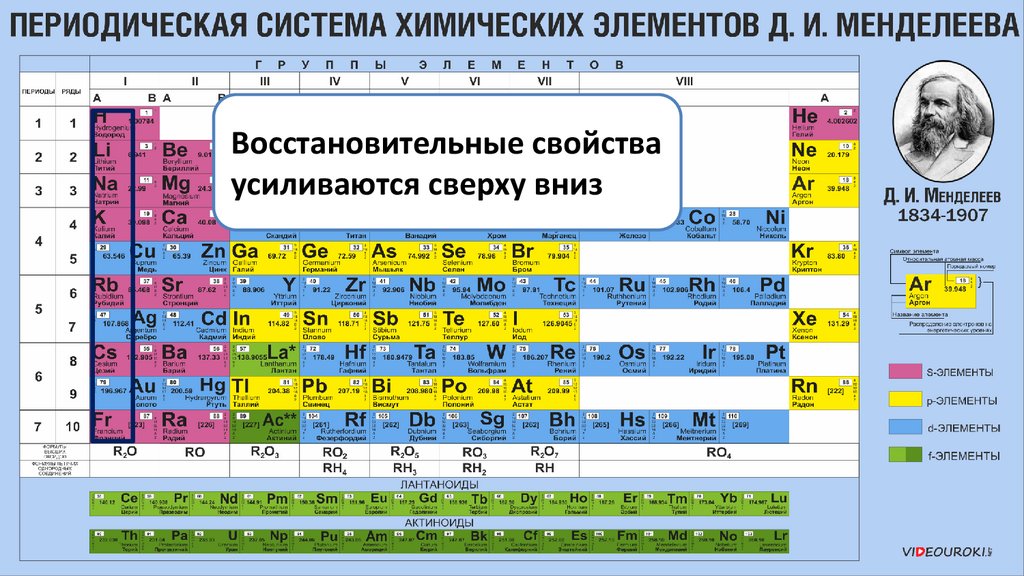
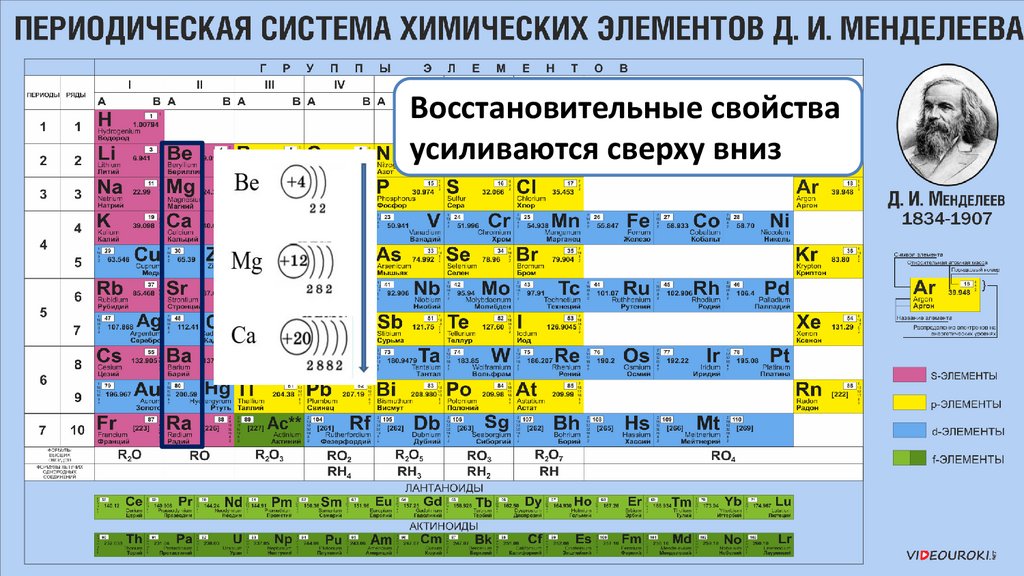
Восстановительные свойстваусиливаются сверху вниз
14.
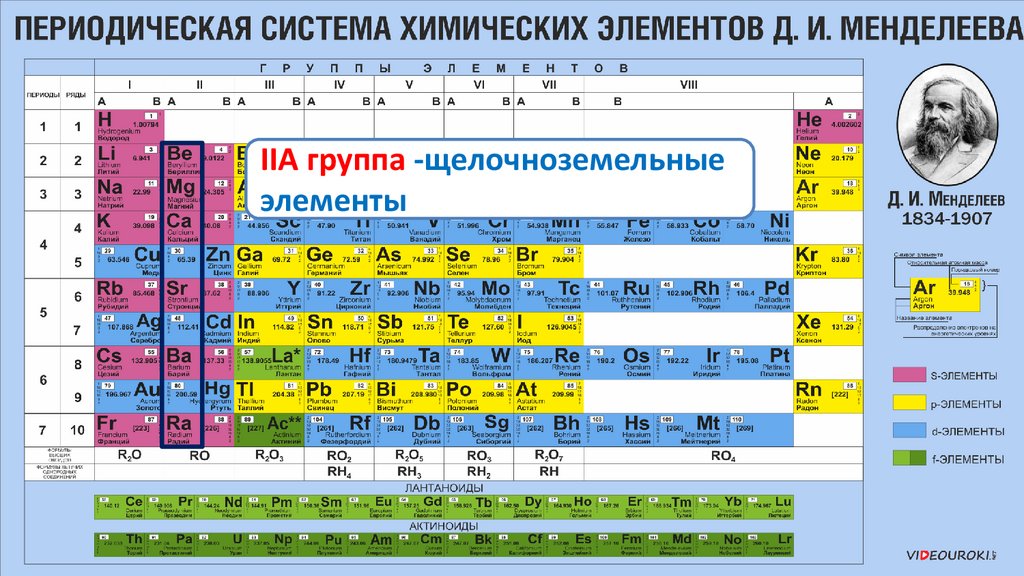
IIА группа -щелочноземельныеэлементы
15.
Сверху вниз увеличиваютсярадиусы атомов
16.
Растёт способность к отдачевнешнего электрона
17.
Восстановительные свойстваусиливаются сверху вниз
18.
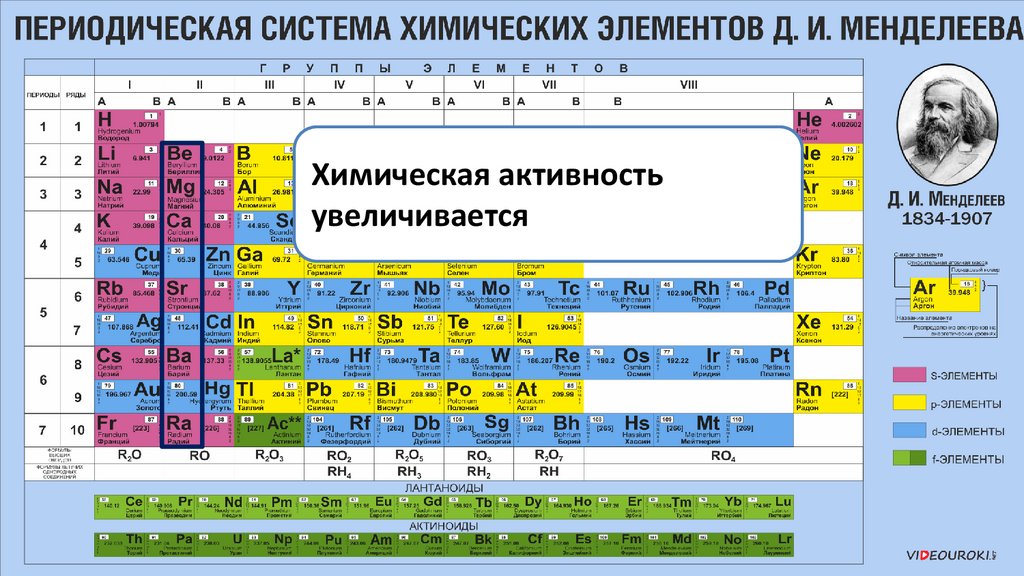
Химическая активностьувеличивается
19.
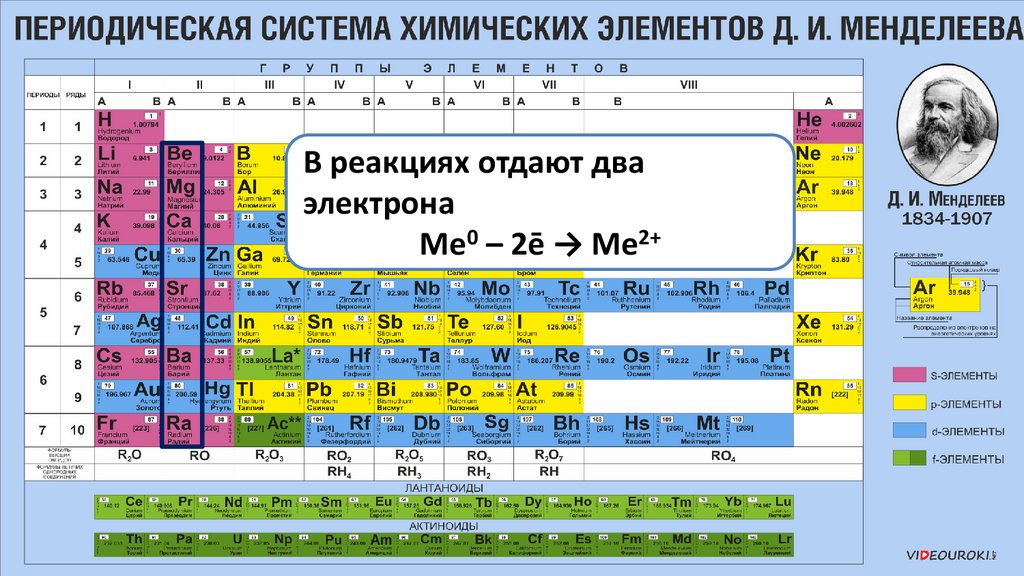
В реакциях отдают дваэлектрона
Ме0 – 2ē → Ме2+
20.
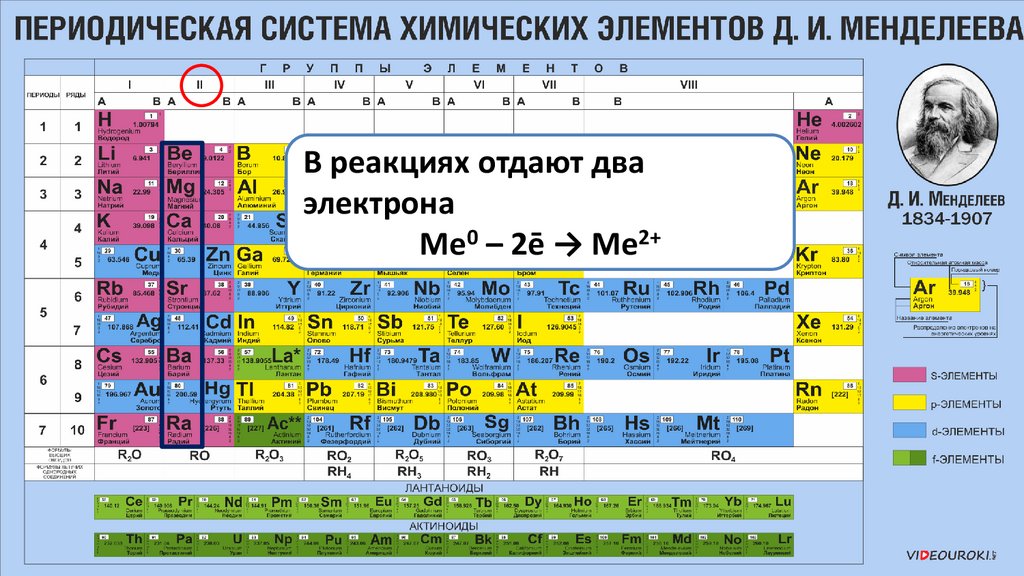
В реакциях отдают дваэлектрона
Ме0 – 2ē → Ме2+
21.
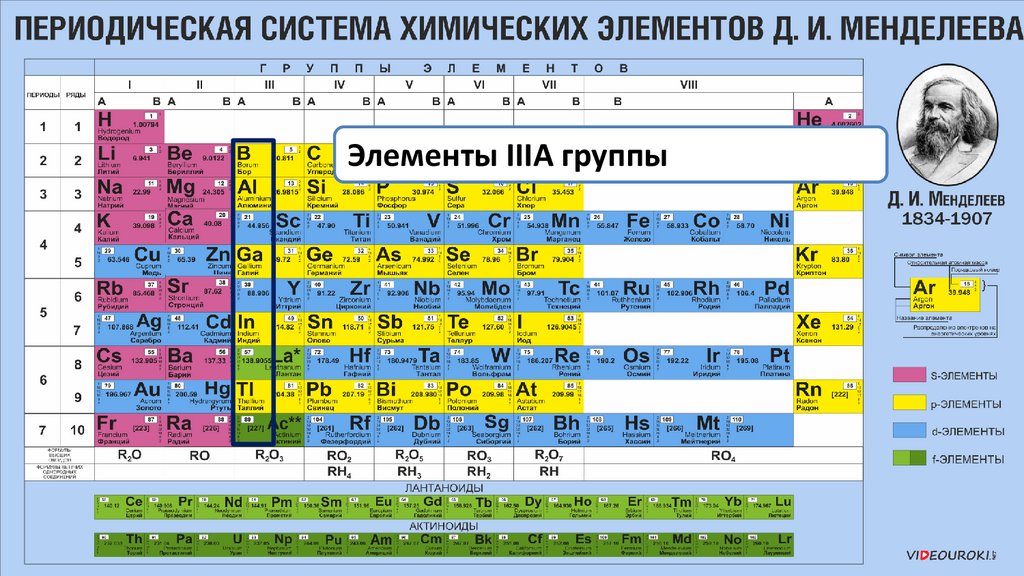
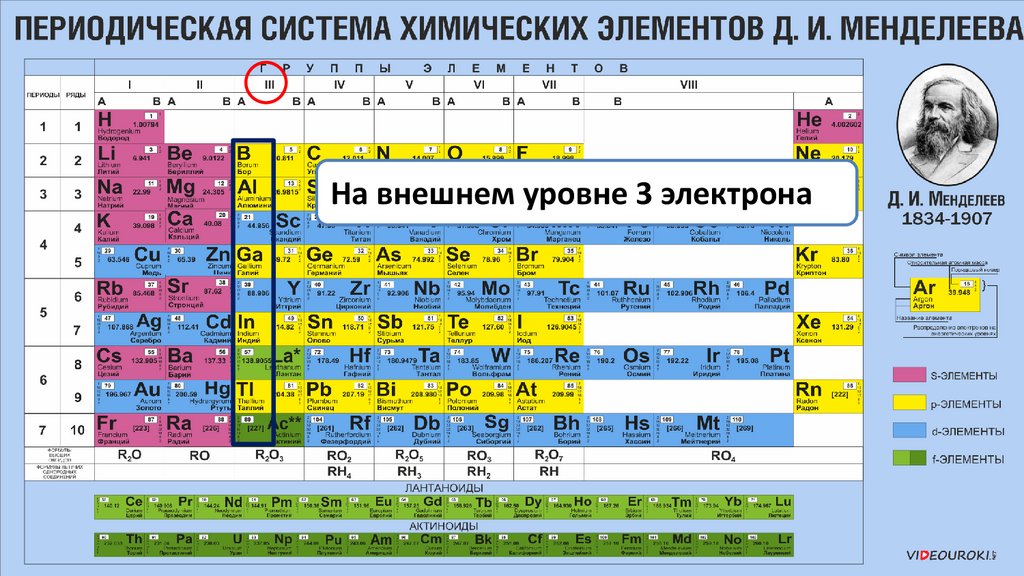
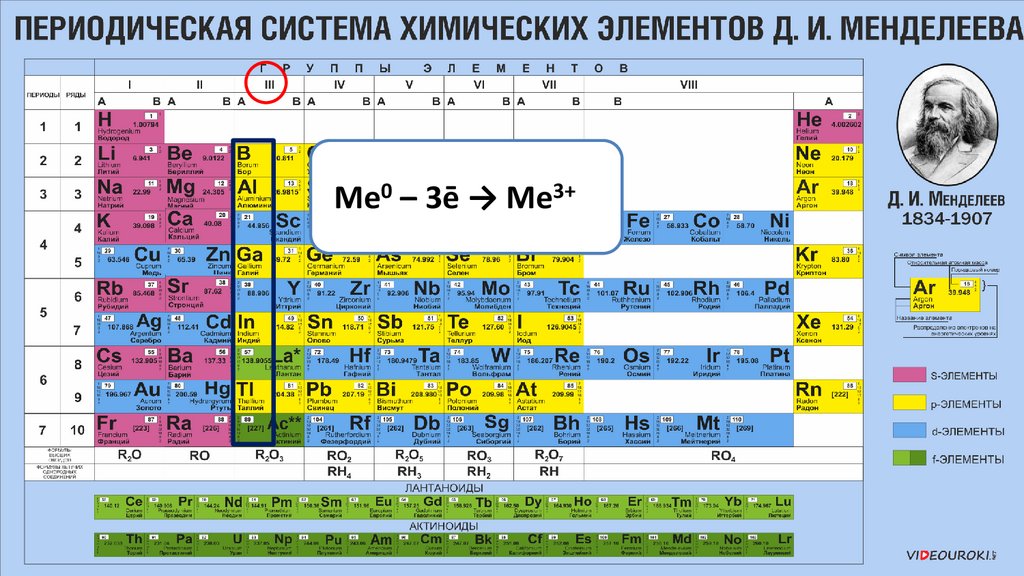
Элементы IIIА группы22.
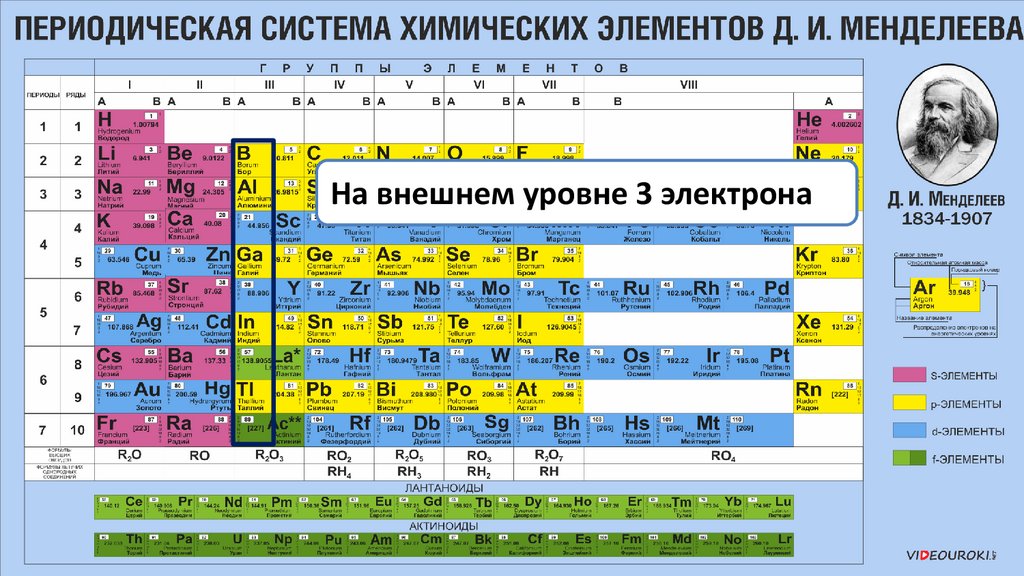
На внешнем уровне 3 электрона23.
На внешнем уровне 3 электрона24.
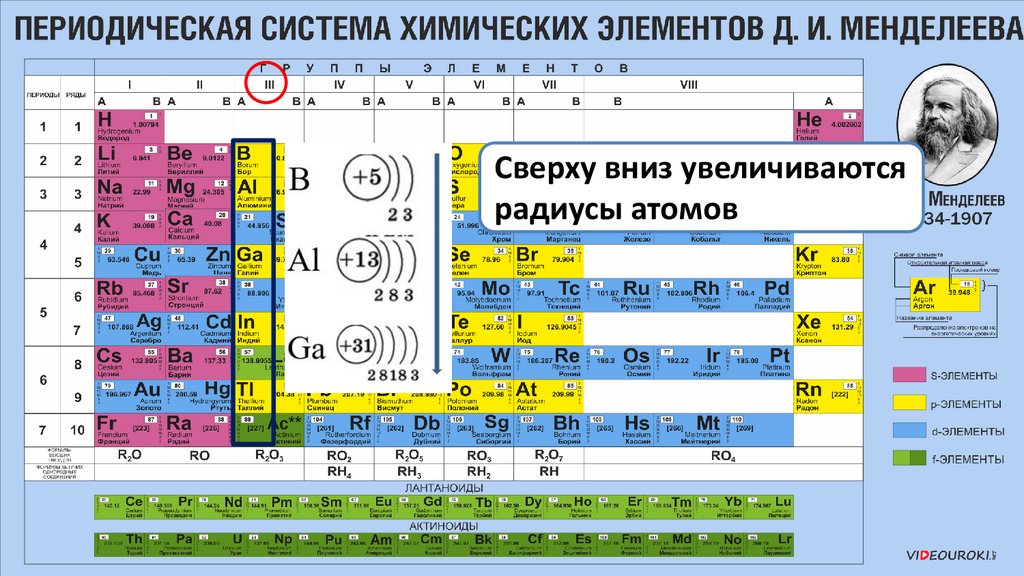
Сверху вниз увеличиваютсярадиусы атомов
25.
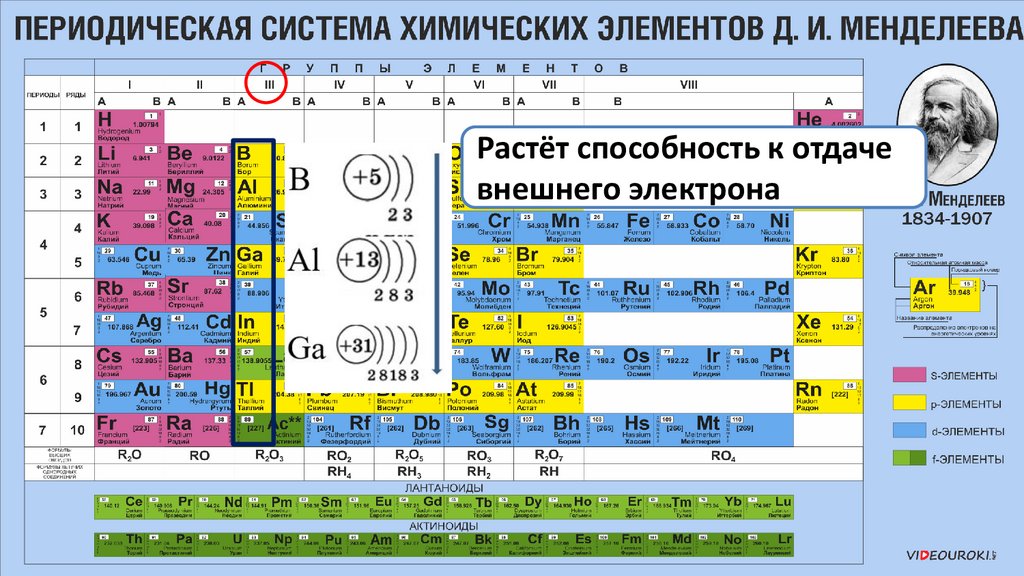
Растёт способность к отдачевнешнего электрона
26.
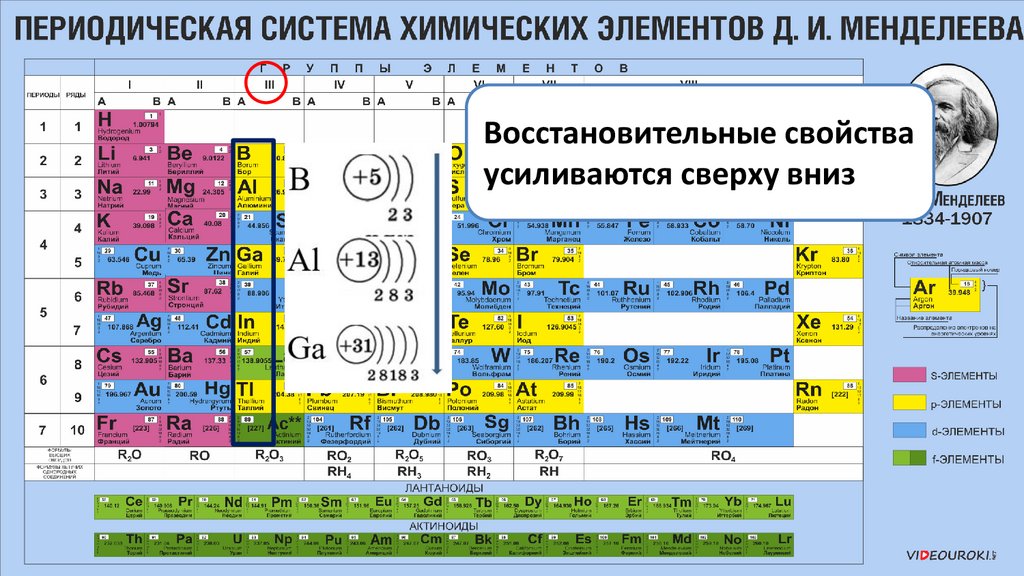
Восстановительные свойстваусиливаются сверху вниз
27.
Ме0 – 3ē → Ме3+28.
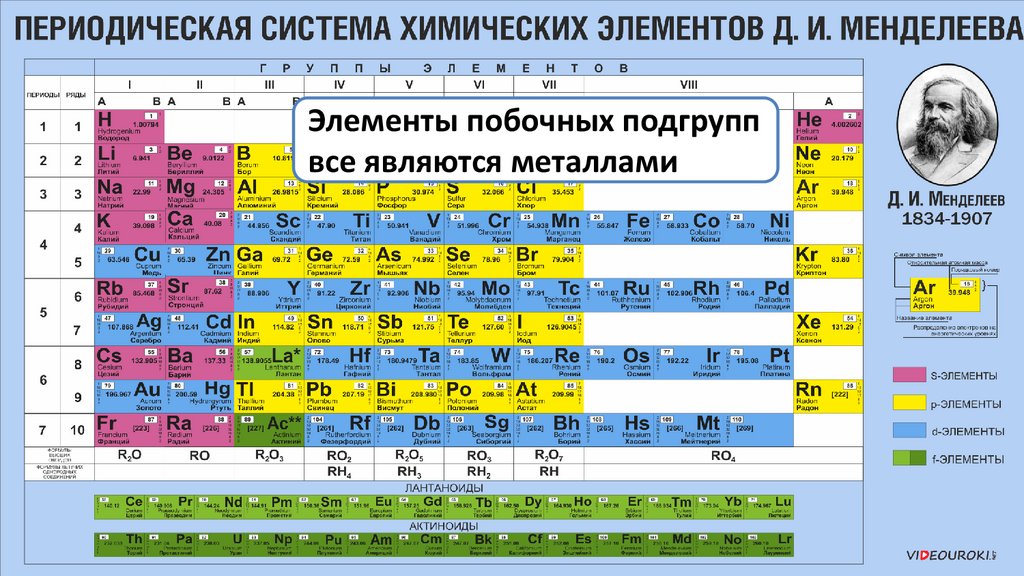
Элементы побочных подгруппвсе являются металлами
29.
На внешнем уровне 1-2 электрона,остальные –на предвнешнем
30.
У металлов сравнительно большие радиусы атомовИх внешние электроны значительно удалены от ядра и
слабо с ним связаны
Содержат на внешнем уровне от 1 до 3 электронов
31.
Они легко отдают электроны, превращаясь при этом вположительные ионы
Они являются восстановителями
Металлы не могут присоединять электроны
32.
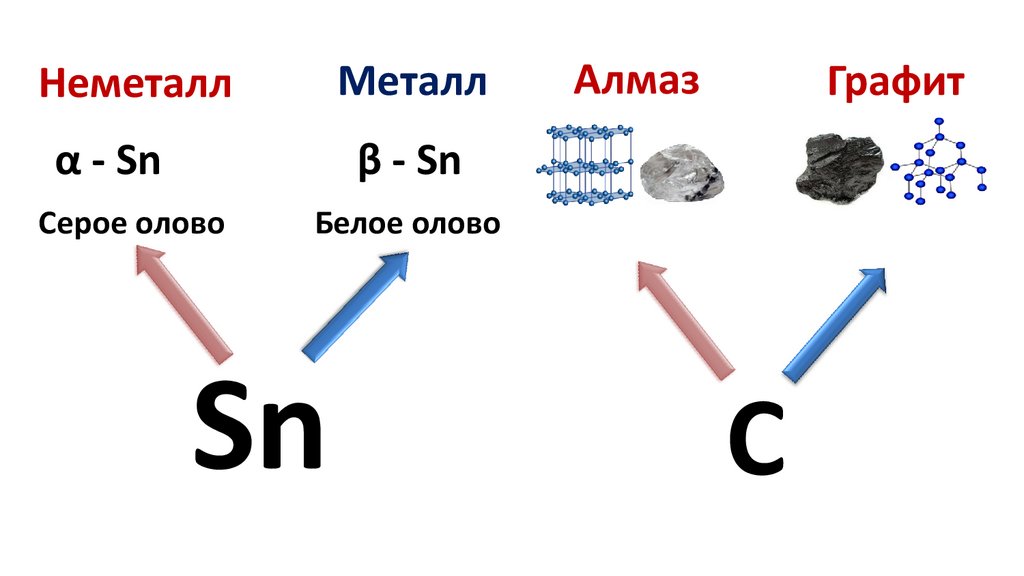
НеметаллМеталл
α - Sn
β - Sn
Серое олово
Белое олово
Sn
Алмаз
Графит
С
33.
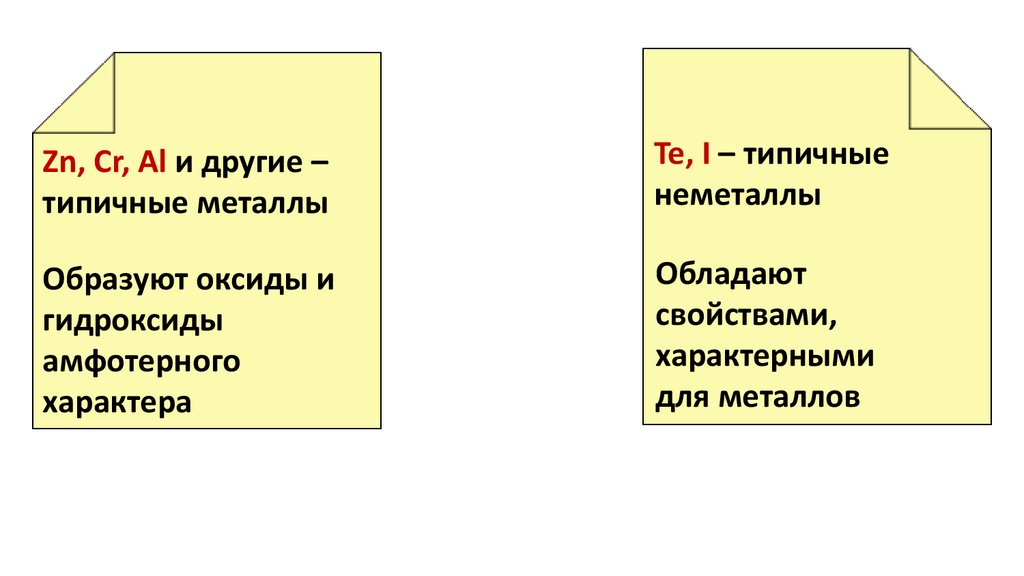
Zn, Cr, Al и другие –типичные металлы
Te, I – типичные
неметаллы
Образуют оксиды и
гидроксиды
амфотерного
характера
Обладают
свойствами,
характерными
для металлов
34.
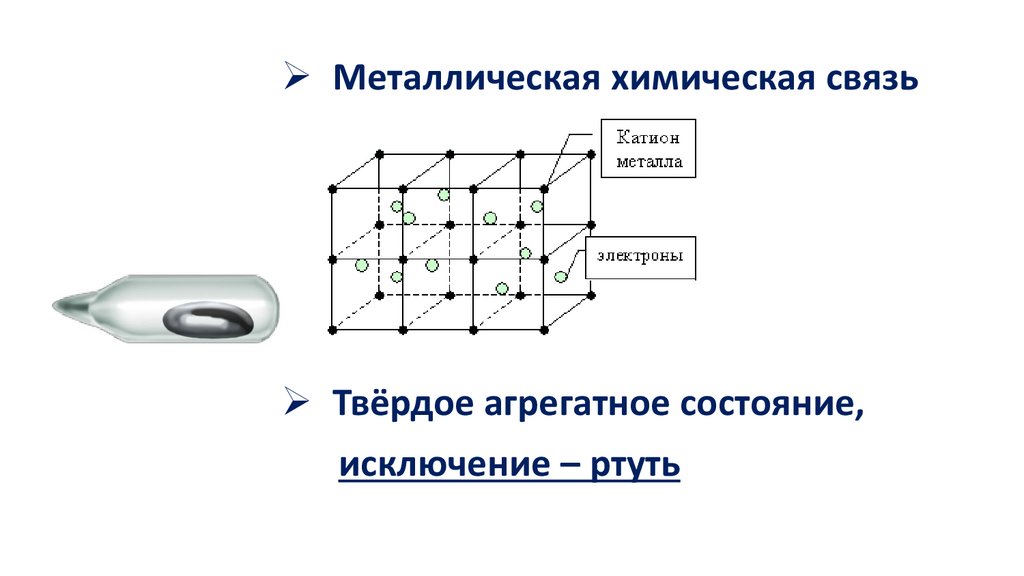
Металлическая химическая связьТвёрдое агрегатное состояние,
исключение – ртуть
35.
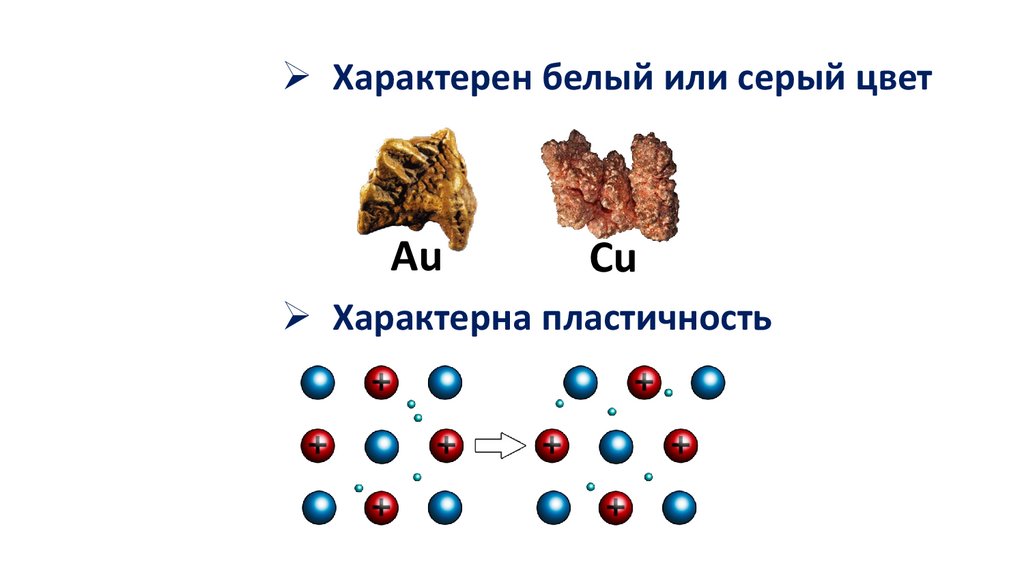
Характерен белый или серый цветAu
Cu
Характерна пластичность
36.
Характерен белый или серый цветAu
Cu
Характерна пластичность
37.
38.
39.
40.
41.
Наиболее пластичные металлы:Au
Ag
Cu
42.
43.
44.
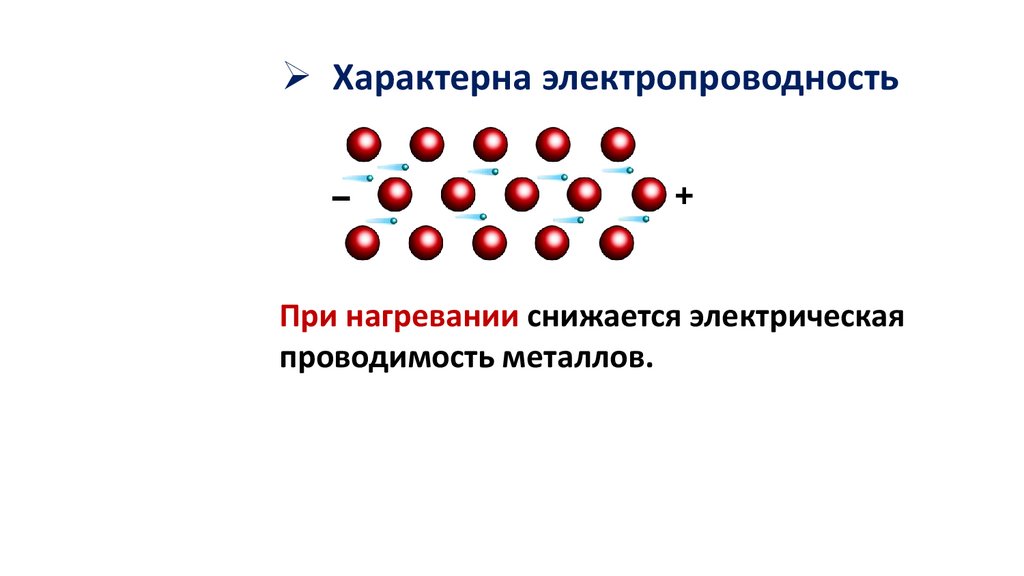
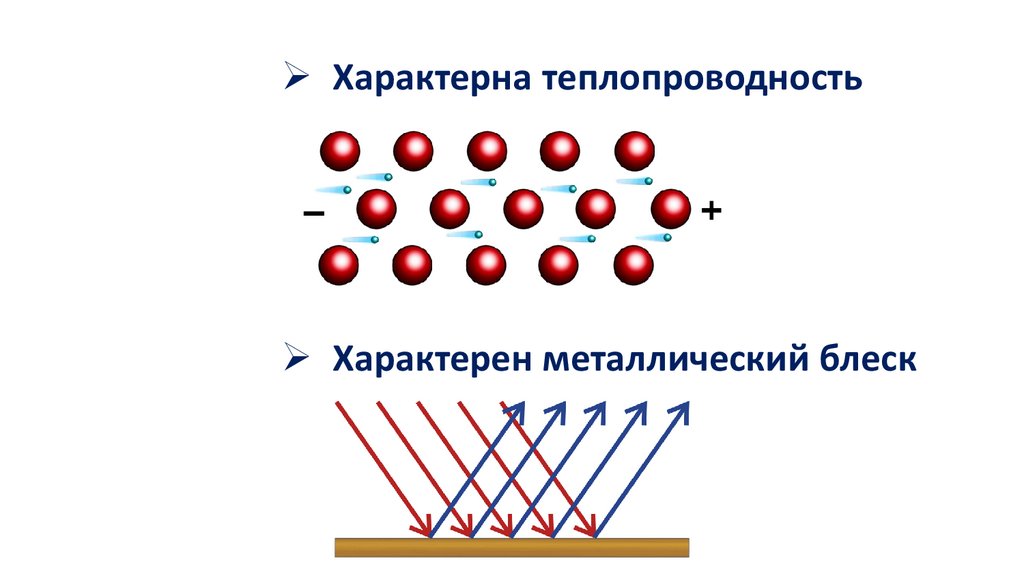
Характерна электропроводностьПри нагревании снижается электрическая
проводимость металлов.
При охлаждении, электропроводность
металлов усиливается, и близи абсолютного
нуля переходит в сверхпроводимость.
45.
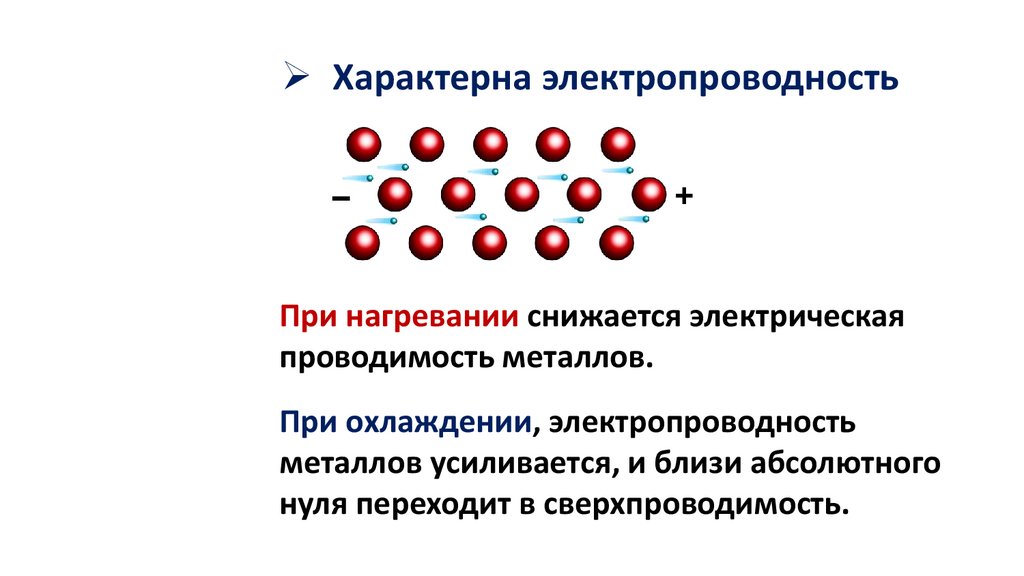
Характерна электропроводностьПри нагревании снижается электрическая
проводимость металлов.
При охлаждении, электропроводность
металлов усиливается, и близи абсолютного
нуля переходит в сверхпроводимость.
46.
Наиболее электропроводны:Ag, Cu
Наименее электропроводны:
Mn, Pb, Hg, W
47.
Характерна теплопроводностьХарактерен металлический блеск
48.
49.
50.
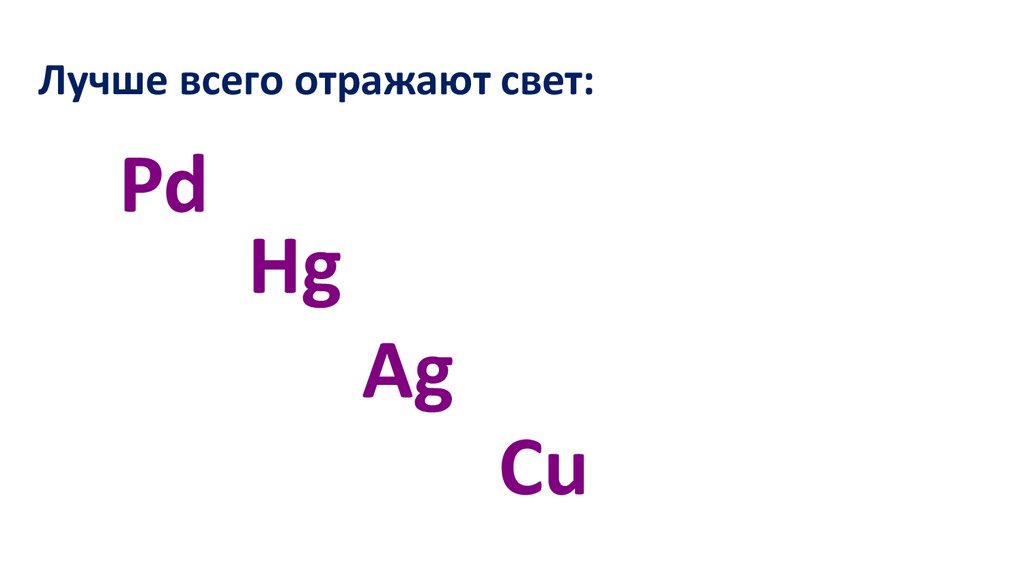
Лучше всего отражают свет:Pd
Hg
Ag
Cu
51.
Из алюминия,серебра и палладия
изготавливают
зеркала
52.
53.
41254.
Самые твёрдые металлы – это металлыпобочной подгруппы VIA группы
Хром
Титан
Молибден
55.
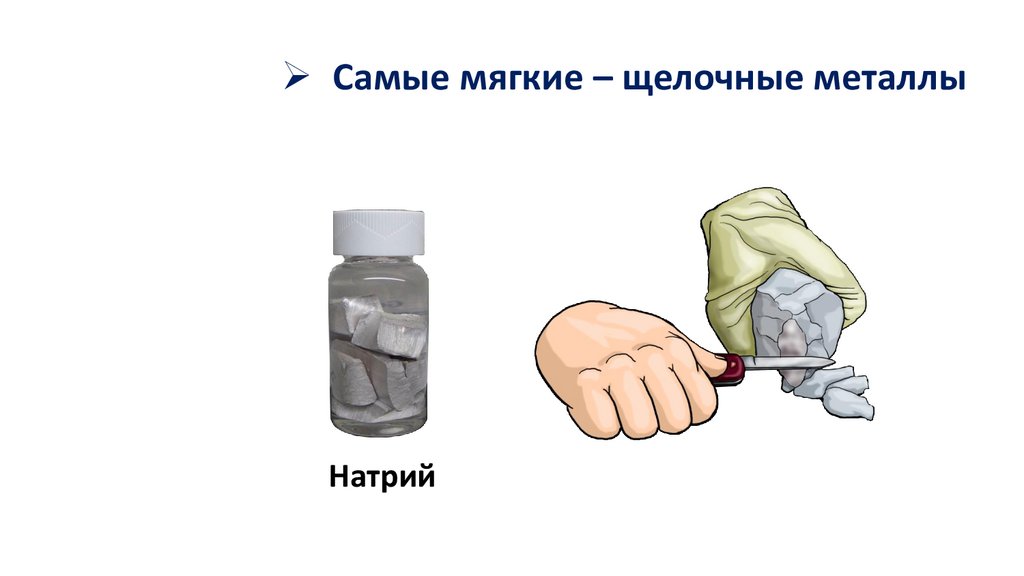
Самые мягкие – щелочные металлыНатрий
56.
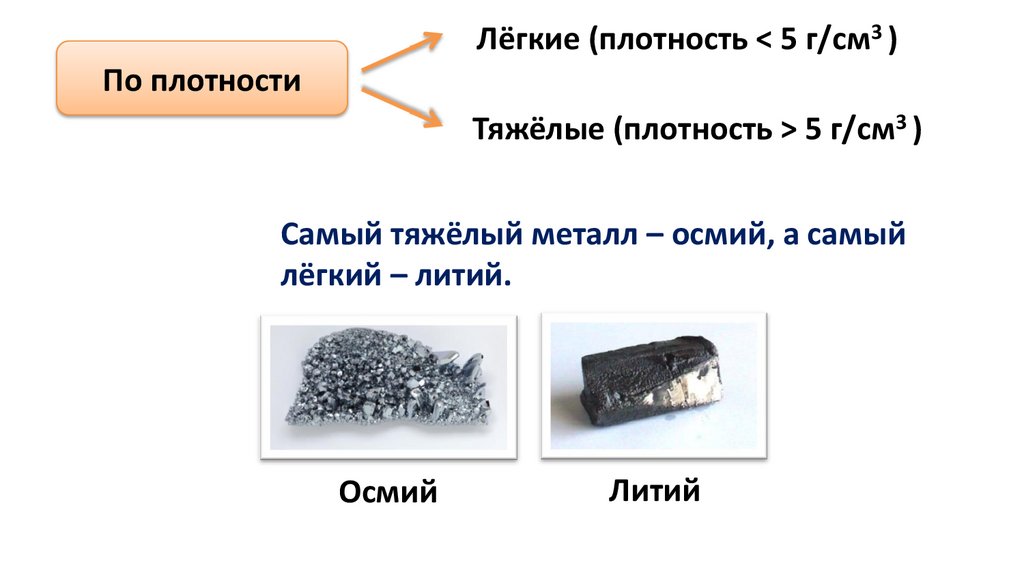
Лёгкие (плотность < 5 г/см3 )По плотности
Тяжёлые (плотность > 5 г/см3 )
Лёгкие металлы: щелочные и
щелочноземельные металлы, алюминий.
Из переходных металлов к ним относятся
скандий, иттрий и титан.
57.
Лёгкие (плотность < 5 г/см3 )По плотности
Тяжёлые (плотность > 5 г/см3 )
Самый тяжёлый металл – осмий, а самый
лёгкий – литий.
Осмий
Литий
58.
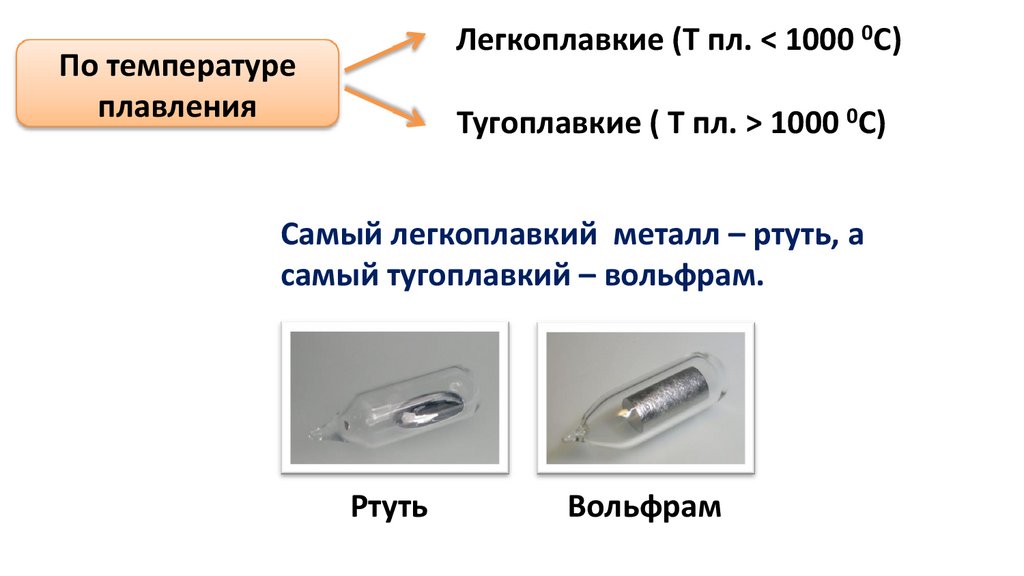
Легкоплавкие (Т пл. < 1000 0С)По температуре
плавления
Тугоплавкие ( Т пл. > 1000 0С)
Самый легкоплавкий металл – ртуть, а
самый тугоплавкий – вольфрам.
Ртуть
Вольфрам
59.
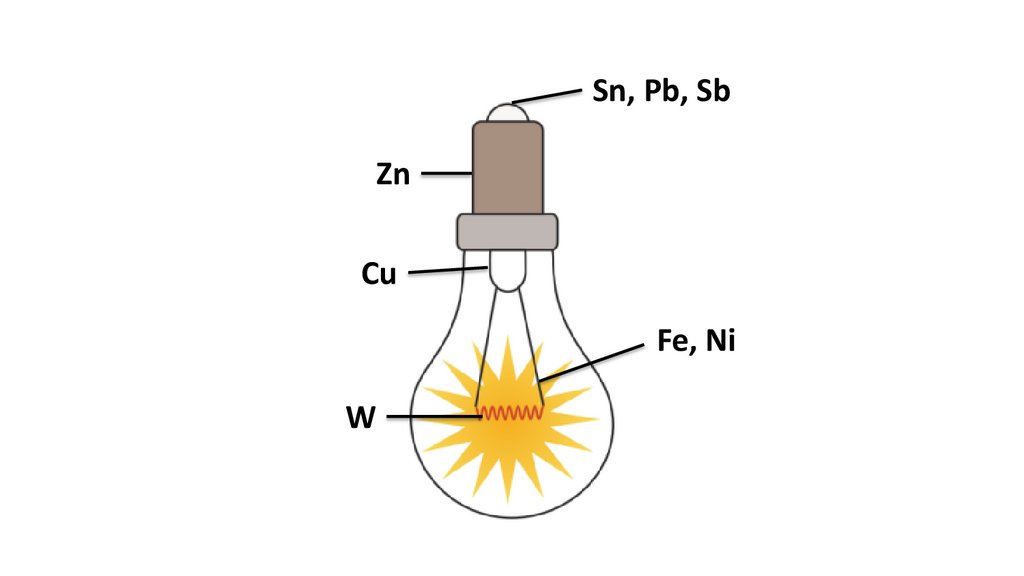
Sn, Pb, SbZn
Cu
Fe, Ni
W
60.
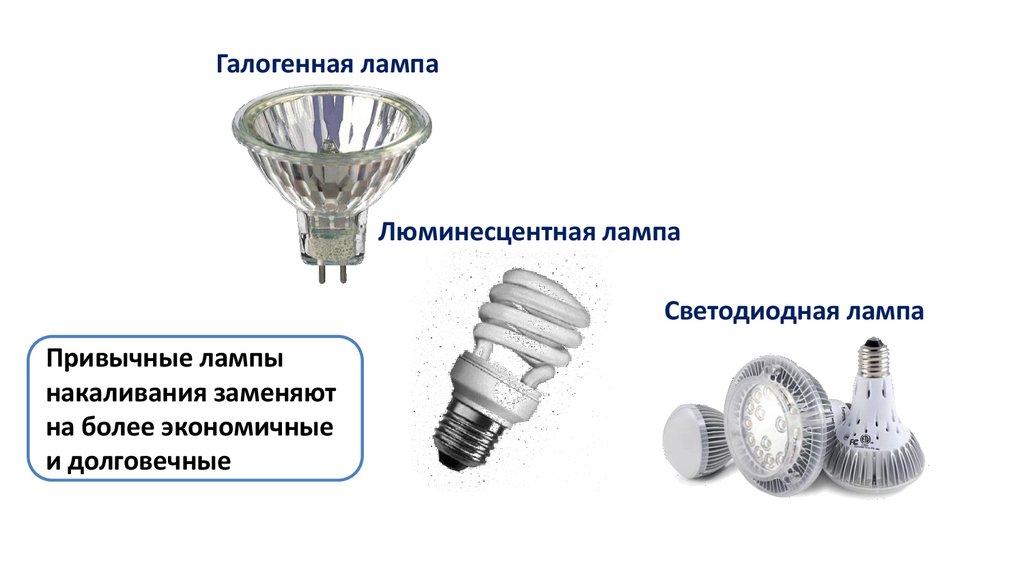
Галогенная лампаЛюминесцентная лампа
Светодиодная лампа
Привычные лампы
накаливания заменяют
на более экономичные
и долговечные
61.
Чёрные металлы – этожелезо и его сплавы
62.
Цветные – это всеостальные металлы
63.
Золото, серебро, платинаи некоторые другие металлы
относятся к драгоценным
64.
Подведем итоги65.
Большинство элементов в Периодическойсистеме относятся к металлам
66.
У металлов на внешнемэнергетическом уровне от 1 до 3
электронов
67.
Металлы проявляютвосстановительные свойства
68.
Физические свойства металлов: твёрдость,металлический блеск, ковкость и пластичность,
тепло и –электропроводность
69.
Для металлов характерна металлическаякристаллическая решётка и металлическая
химическая связь
70.
Э-3. Обобщение и систематизацияпройденного материала
1) Почему металлы в чистом виде используются
редко?
2) По каким признакам классифицируют сплавы?
Изучение текста § 28 «Общая характеристика
металлов», его анализ, структурирование и
интерпретация содержащейся в нем информации.
71.
Этап- 4. Подведение итогов1. Какие химические элементы относят к металлам? Как
особенности строения атомов металлов связаны с их
физическими свойствами? Какие физические свойства
металлов и их сплавов обусловливают их применение в
промышленности, технике, строительстве, медицине и
т. д.?
2. Домашнее задание: п.16, упр.13 с.93




































 chemistry
chemistry








