Similar presentations:
Алкены ДО
1.
2. План изучения класса
Понятие АЛКЕНЫ.2.
Общая формула АЛКЕНОВ.
3.
Гомологический ряд АЛКЕНОВ. Номенклатура
АЛКЕНОВ. Изомерия АЛКЕНОВ.
4.
Строения молекул АЛКЕНОВ.
5.
Нахождение в природе (нет).
6.
Получение в лаборатории и промышленности.
7.
Физические свойства АЛКЕНОВ.
8.
Химические свойства АЛКЕНОВ.
9.
Применение АЛКЕНОВ.
10. Генетическая связь.
Выполнение упражнений.
1.
3.
1. АЛКЕНЫ - это углеводородыс одной двойной связью в
открытой углеродной цепи.
2. Общая формула АЛКЕНОВ
CnH2n
4. 3.1. Гомологический ряд АЛКЕНОВ
С Нn
2n
Формула Название
С 2Н 4
ЭТЕН (ЭТИЛЕН)
С 3Н 6
ПРОПЕН (ПРОПИЛЕН)
С 4Н 8
БУТЕН
3.2. Номенклатура
С5Н10
ПЕНТЕН
АЛКЕНОВ
С6Н12
ГЕКСЕН
Названия алкенов
С7Н14
ГЕПТЕН
происходит от названия
С8Н16
ОКТЕН
соответствующего
С9Н18
НОНЕН
алкана, только суффикс
С10Н20
ДЕКЕН
-ан заменяется на -ен.
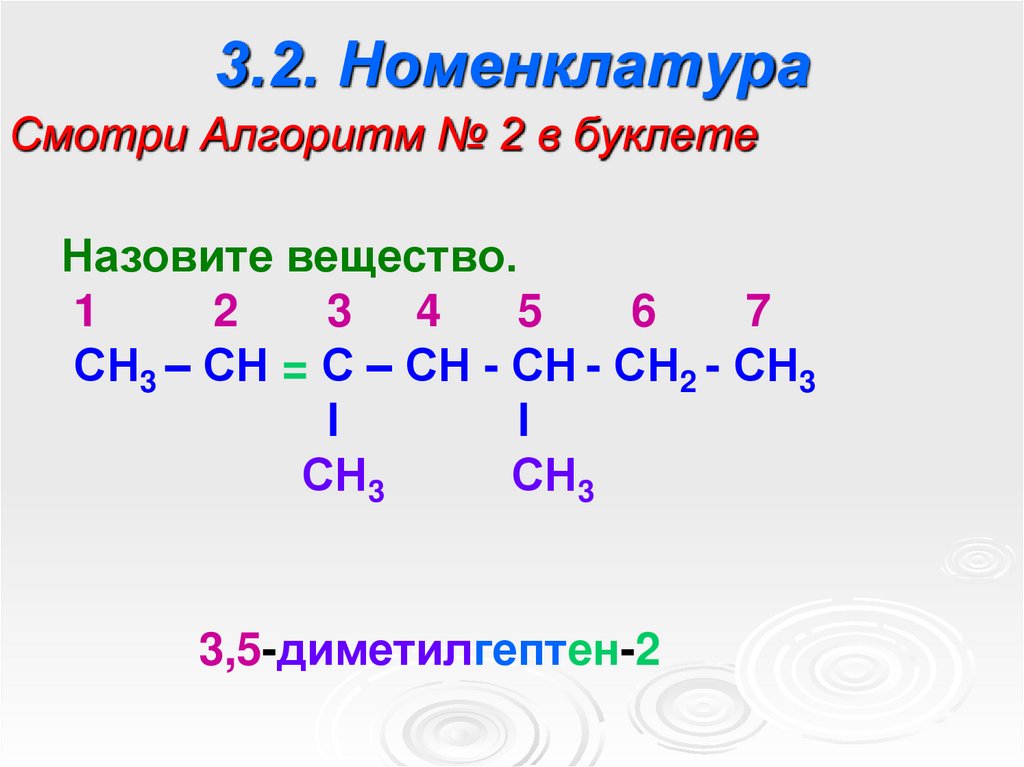
5. 3.2. Номенклатура
Смотри Алгоритм № 2 в буклетеНазовите вещество.
1
2
3 4
5
6
7
СН3 – СН = С – СН - СН - СН2 - СН3
l
l
СН3
СН3
3,5-диметилгептен-2
6. 3.3. Изомерия АЛКЕНОВ
изомерия углеродного скелета;2. изомерия, положения в цепи двойной
связи;
3. пространственная (геометрическая)
цис-, транс-изомерия положения
заместителей относительно
двойной связи;
4. межклассовая изомерия.
1.
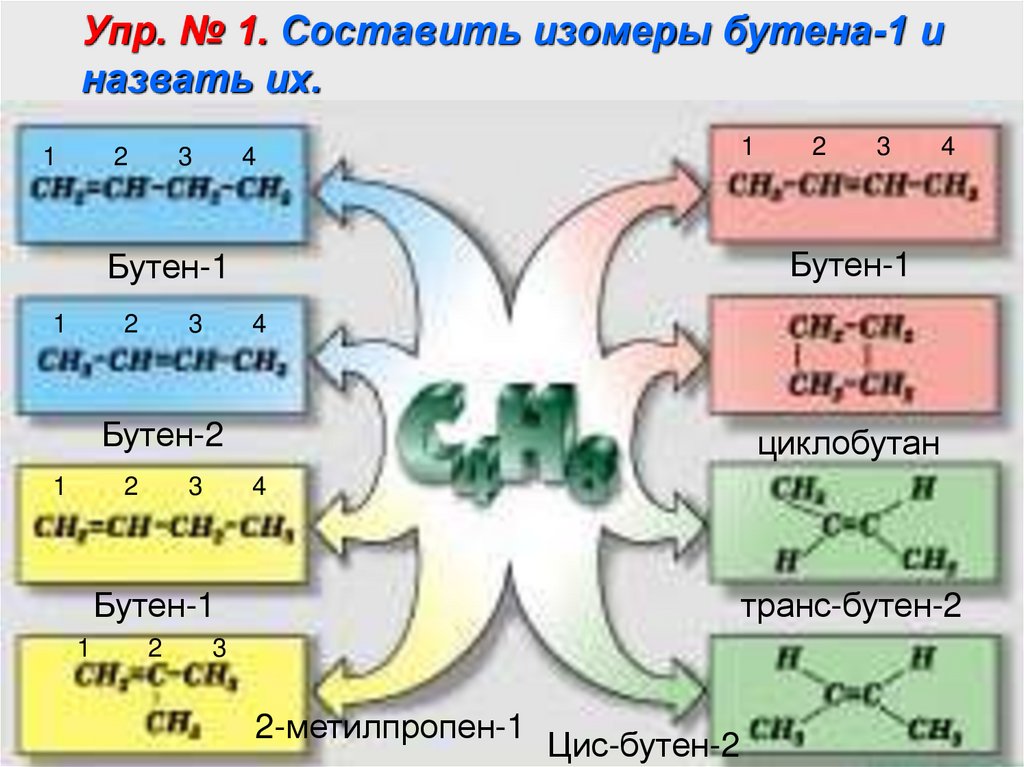
7.
Упр. № 1. Составить изомеры бутена-1 иназвать их.
1
2
3
1
4
2
3
2
3
циклобутан
4
Бутен-1
1
2
4
4
Бутен-2
1
3
Бутен-1
Бутен-1
1
2
транс-бутен-2
3
2-метилпропен-1
Цис-бутен-2
8.
Домашнее задание . Составить изомерыгексена-1 и назвать их.
9.
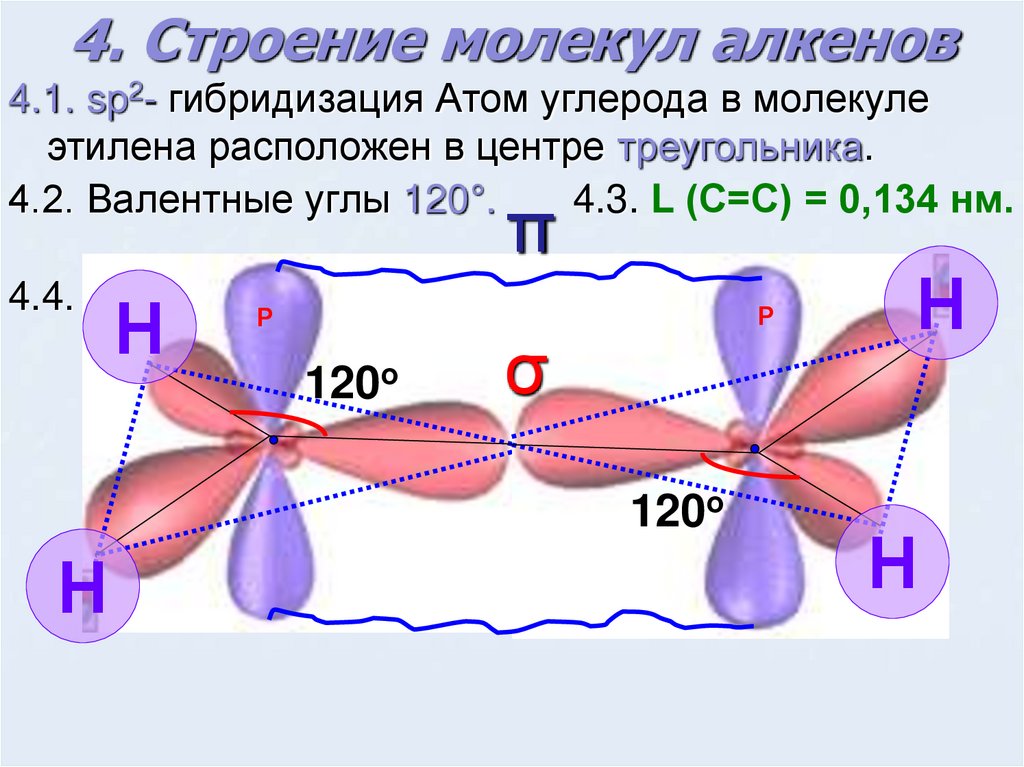
4. Строение молекул алкенов4.1. sp2- гибридизация Атом углерода в молекуле
этилена расположен в центре треугольника.
4.3. L (С=С) = 0,134 нм.
4.2. Валентные углы 120°.
π
4.4.
Н
Р
120о
Р
σ
120о
Н
Н
Н
10. 5. Нахождение в природе АЛКЕНОВ
Алкенов в природе нет, т.к. вмолекуле алкенов есть слабая
π-связь, которая определяет их хим.
активность.
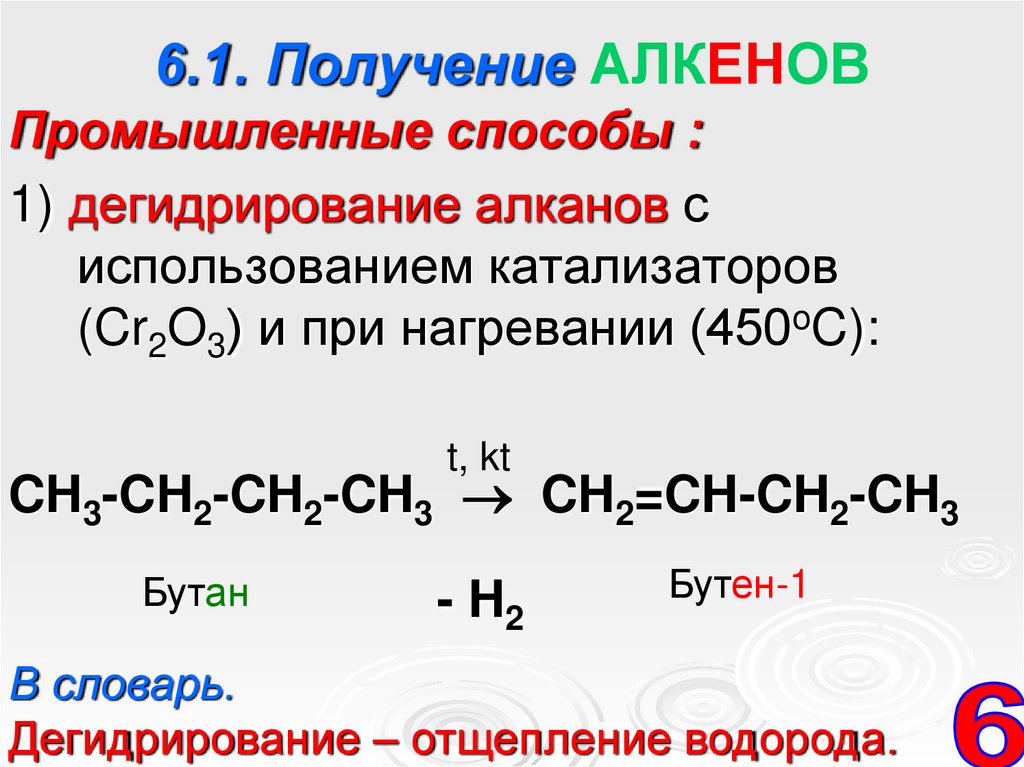
11. 6.1. Получение АЛКЕНОВ
Промышленные способы :1) дегидрирование алканов с
использованием катализаторов
(Cr2O3) и при нагревании (450oC):
t, kt
CH3-CH2-CH2-CH3 CH2=CH-CH2-CH3
Бутан
- H2
Бутен-1
В словарь.
Дегидрирование – отщепление водорода.
12.
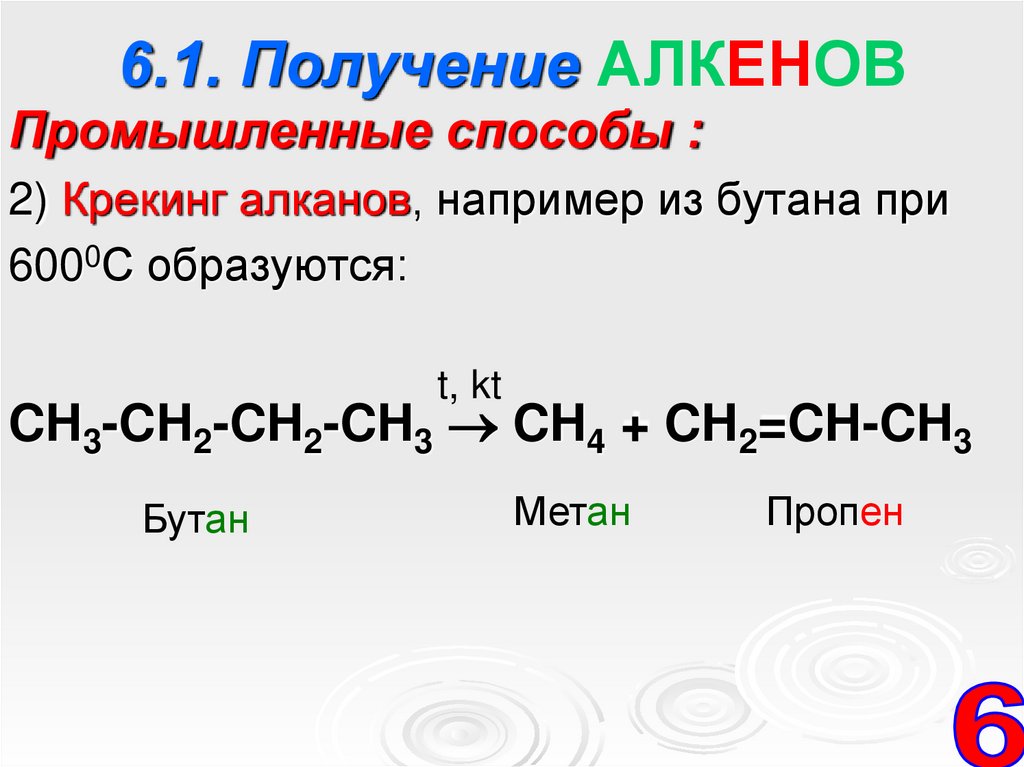
6.1. Получение АЛКЕНОВПромышленные способы :
2) Крекинг алканов, например из бутана при
6000С образуются:
t, kt
CH3-CH2-CH2-CH3 CH4 + CH2=CH-CH3
Бутан
Метан
Пропен
13.
6.2. Получение АЛКЕНОВЛабораторные способы :
3) дегидратация спиртов под
действием серной или фосфорной
кислот:
t, kt
CH3- CH2ОН H2О + CH2= CH2
Этанол
Вода
Этилен
В словарь.
Дегидратация – отщепление воды.
14.
6.2. Получение АЛКЕНОВЛабораторные способы :
4) ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ полимеров
t
(- CH2- CH2 - )n n CH2 = CH2
полиэтилен
В словарь.
Термическое
разложение – хим.
реакция расщепления
при нагревании.
Этилен
15. 7. Физические свойства АЛКЕНОВ
CH2=CH2 – газ, без цвета, с чутьсладковатым запахом, плохо растворим
в воде.
С2-С4 газы, без цвета; С5-С18 жидкости;
С 19 твёрдые, ρ<1г/см3,
мало растворимы в воде,
t кип(неразв.) t кип(разв),
t кип(цис) t кип(транс).
16. 8. Химические свойства АЛКЕНОВ
π-связь непрочная, легко разрывается идля алкенов наиболее характерны
реакции:
1) присоединения при взаимодействии:
1. с бромной водой (кач. реакция на
кратную связь):
t, kt
CH3-CH=CH2 + Br2 CH3-CHBr-CH2Br
Пропен
1,2-дибромпропан
17.
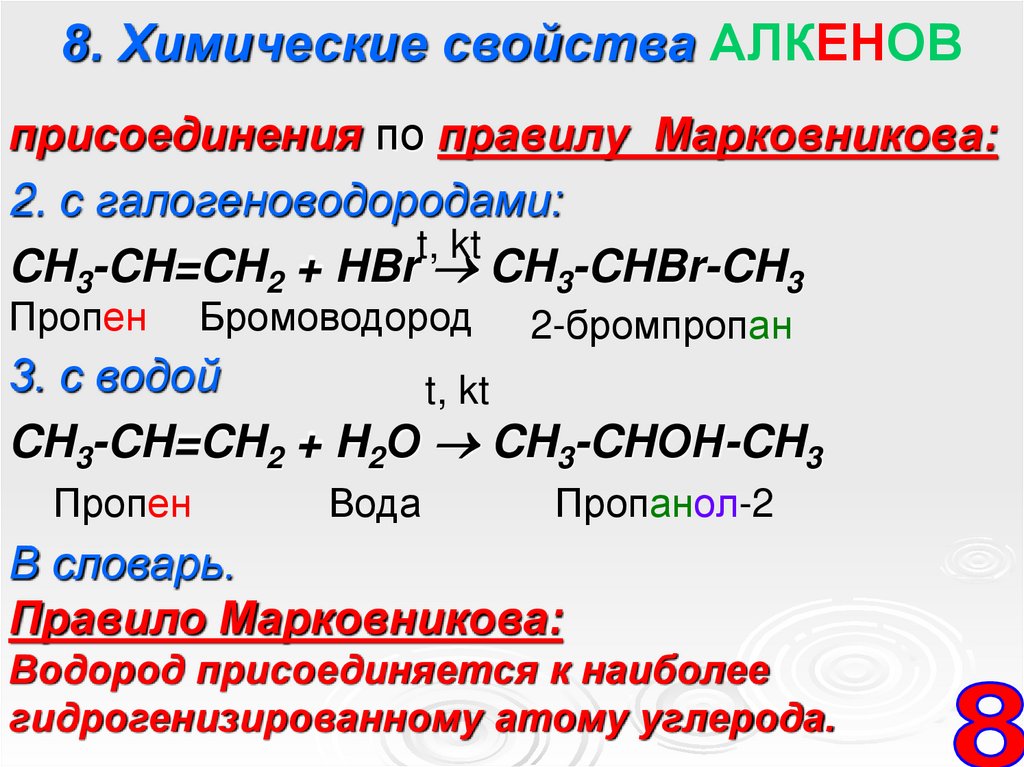
8. Химические свойства АЛКЕНОВприсоединения по правилу Марковникова:
2. с галогеноводородами:
t, kt
CH3-CH=CH2 + HBr CH3-CHBr-CH3
Пропен
Бромоводород
2-бромпропан
3. с водой
t, kt
CH3-CH=CH2 + H2О CH3-CHОН-CH3
Пропен
Вода
Пропанол-2
В словарь.
Правило Марковникова:
Водород присоединяется к наиболее
гидрогенизированному атому углерода.
18.
8. Химические свойства АЛКЕНОВ2) Реакция полимеризации .
t, kt
n CH2 = CH2 → (- CH2 - CH2 -) n
этилен
полиэтилен
В словарь.
Полимеризация – это хим. реакция с
образованием высокомолекулярных
соединений. Пластмассы, волокна, каучуки.
n (степень полимеризации) – число молекул.
19.
8. Химические свойства АЛКЕНОВ3) Алкены легко окисляются.
t
А) Горение: C2H4 + 3O2 2CO2 + 2H2O
Углекислый Вода
газ
Б) При окислении этилена перманганатом калия
Этилен
образуется этиленгликоль (реакция Вагнера):
3CH2=CH2 + 2KMnO4 + 4H2O
Этилен
Перманганат калия
2MnO2↑ + 2KOH + 3CH2OH-CH2OH
Этандиол-1,2
20. 9. Применение
21. Осуществить превращения:
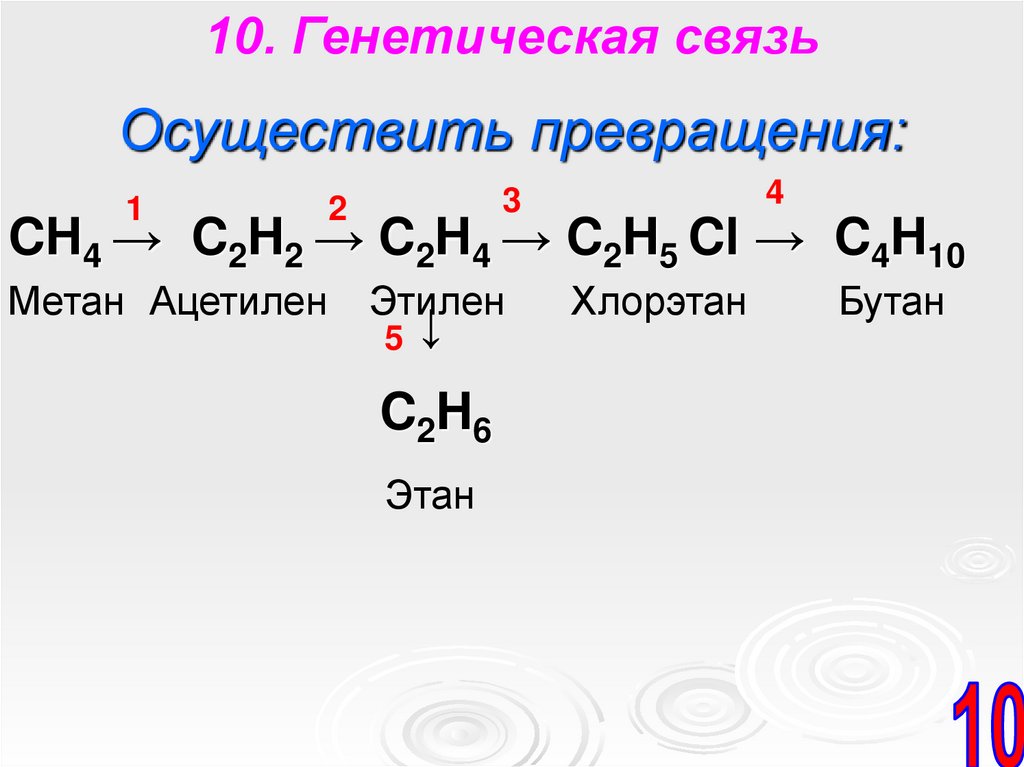
10. Генетическая связьОсуществить превращения:
1
4
3
2
CH4 → C2H2 → C2H4 → C2H5 Cl → C4H10
Метан Ацетилен
Этилен
5 ↓
C2H6
Этан
Хлорэтан
Бутан














 chemistry
chemistry








