Similar presentations:
Лекция_2_Часть_1_Гетерогенные_равновесия_Поток_2
1.
Гетерогенные равновесия2. Равновесия в водных растворах:
• кислотно-основныекислота
Н+ + основание
• окислительно-восстановительные
восстановитель
окислитель+ zē
• лигандообменные –
в растворах комплексных соединений
• гетерогенные –
в растворах малорастворимых соединений,
протекающие между веществами в различных агрегатных состояниях,
например, на границе раствора электролита и твёрдой фазы вещества
ионного типа (ВaSO4, AgCl, СaC2O4 и т.д.).
2
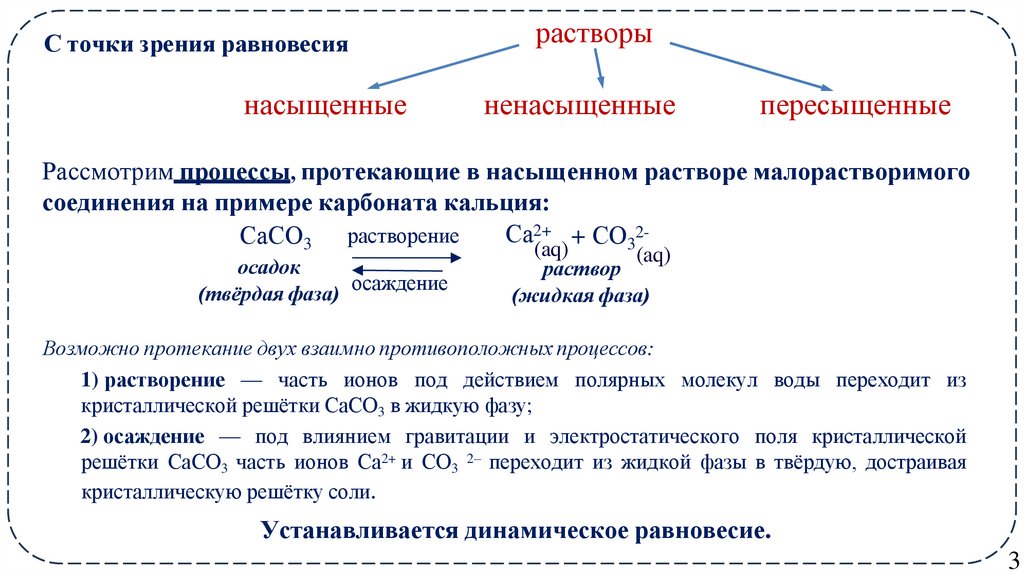
3. растворы
С точки зрения равновесиянасыщенные
растворы
ненасыщенные
пересыщенные
Рассмотрим процессы, протекающие в насыщенном растворе малорастворимого
соединения на примере карбоната кальция:
Са2+ + СО32СаСО3 растворение
(aq)
осадок
(твёрдая фаза) осаждение
(aq)
раствор
(жидкая фаза)
Возможно протекание двух взаимно противоположных процессов:
1) растворение –– часть ионов под действием полярных молекул воды переходит из
кристаллической решётки СaСO3 в жидкую фазу;
2) осаждение –– под влиянием гравитации и электростатического поля кристаллической
решётки СaСO3 часть ионов Са2+ и СO3 2– переходит из жидкой фазы в твёрдую, достраивая
кристаллическую решётку соли.
Устанавливается динамическое равновесие.
3
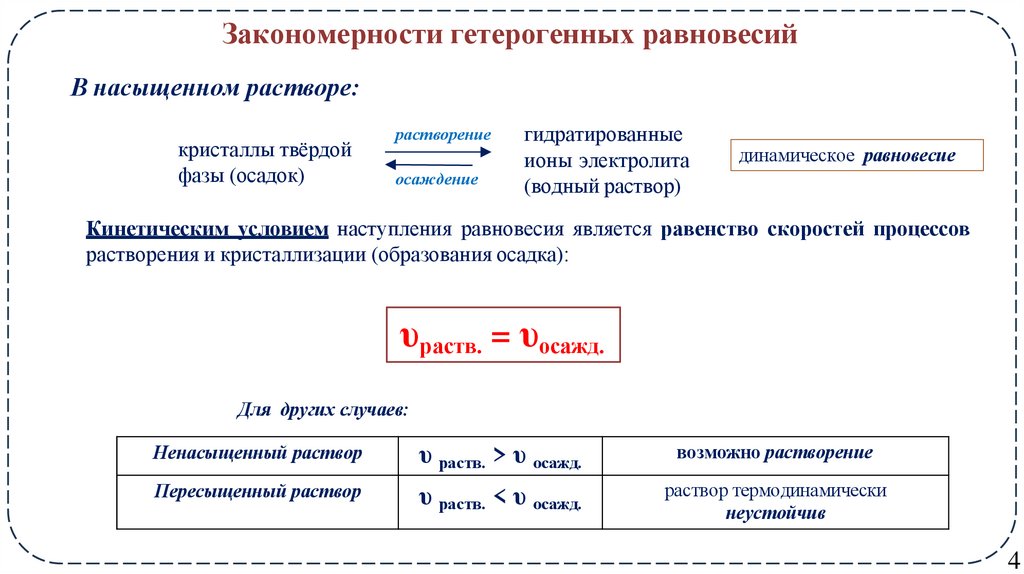
4. Закономерности гетерогенных равновесий
В насыщенном растворе:кристаллы твёрдой
фазы (осадок)
растворение
осаждение
гидратированные
ионы электролита
(водный раствор)
динамическое равновесие
Кинетическим условием наступления равновесия является равенство скоростей процессов
растворения и кристаллизации (образования осадка):
υраств. = υосажд.
Для других случаев:
Ненасыщенный раствор
υ раств. > υ осажд.
возможно растворение
Пересыщенный раствор
υ раств. < υ осажд.
раствор термодинамически
неустойчив
4
5. Константа растворимости (произведение растворимости)
МnАmРассмотрим равновесие:
малорастворимый
сильный электролит
n Мm+ + m An–
насыщенный
раствор ионов
В насыщенном растворе малорастворимого сильного электролита МnAm ионы Мm+ и An- находятся в равновесии
с твёрдой фазой, причём, произведение равновесных концентраций ионов, возведённых в степени, равные
стехиометрическим коэффициентам, есть величина постоянная при данной температуре и называется
термодинамической (концентрационной) константой растворимости (Ks).
Например для равновесия
CaCO3 (тв.)
2–
Са2+(aq) + СО3 (aq)
KS= [Са2+][СО32–] = ПР
Константа растворимости
В общем случае для МnАm:
Ks = ПР = [Мm+]n ∙[Аn–]m
Это равенство означает, что как бы не
изменялись концентрации каждого из
ионов малорастворимого электролита,
произведение этих молярных
концентраций при Т=const остаётся
постоянным.
5
6.
Покажем физический смысл константы растворимости напримере растворения хлорида серебра:
AgCl (тв.)
Ag+(aq) + Сl–(aq)
Запишем выражения для скоростей прямого (растворение) и обратного (осаждение):
обр. kобр. Ag Cl ,
процессов:
пр. kпр.
где kпр.и kобр. константы скоростей растворения и осаждения, соответственно.
В состоянии равновесия: kпр. kобр. Ag Cl , отсюда получаем
kпр.
kобр.
Ag Cl ПР K S
Таким образом, константа растворимости равна отношению
константы скорости растворения вещества к константе скорости его осаждения.
6
7. Растворимость данного вещества (S) выражается в единицах
Растворимость данного вещества (S)концентрации насыщенного раствора.
Растворимость
твёрдого
вещества
выражается
в
зависит
от:
единицах
природы вещества и растворителя;
температуры (в зависимости от теплового эффекта растворения S⭡ или S⭣);
присутствия одноимённых ионов (S⭣ по принципу Ле Шателье);
присутствия сильных электролитов с индифферентными ионами (S⭡— «солевой
эффект»).
Солевым эффектом называется повышение растворимости малорастворимых солей в системе осадок — раствор
при добавлении к ним других сильных электролитов. Установлено, что растворимость сульфата свинца
PbSO4 увеличивается при добавлении к его насыщенному раствору, находящемуся в равновесии с осадком,
растворов нитрата калия КNO3, нитрата натрия NaNO3, и притом тем сильнее, чем больше концентрация
добавляемой соли.
Вопрос: Как изменится растворимость гидрокарбоната калия при нагревании,
если известно, что это эндотермический процесс?
7
8. Использование произведения растворимости (ПР или Ks)
1. Для расчёта растворимости солей2. Для сравнения растворимости (S) веществ
чем меньше ПР, тем хуже растворимо вещество!
2. Для прогнозирования выпадения осадка:
ПИ < ПР — осадка не будет (в ненасыщенном растворе вещество растворяется)
ПИ > ПР — в пересыщенном растворе избыток вещества выпадает в осадок
3. Для установления последовательности выпадения осадка:
чем меньше ПР, тем раньше выпадает осадок!
4. Для подбора более эффективного осадителя:
чем меньше ПР образующегося осадка, тем эффективней осадитель!
8
9. Гетерогенные процессы в организме Значение произведения растворимости в медицине
Костная ткань — особый вид соединительной ткани и она является главнойсоставной частью кости.
Клеточные элементы костной ткани:
• остеобласты,
• остеоциты (зрелая костная клетка)
• остеокласты.
Состав кости: 30% органических веществ;
70% неорганических.
Дентин имеет большую твёрдость,
содержит около 75 % неорганического вещества.
Формирование костной и зубной ткани — это результат протекания процессов
осаждения (минерализации) и растворения (деминерализации) малорастворимых
фосфатов кальция.
В остеобластах, интенсивно омываемых кровью происходит конечный этап
образования костной ткани, т.е. минерализация.
9
10. 1, 6 1058
ПРСа ( РО ) ОН 1,6 10 58Образование костной ткани:
5
4 3
остеобласты (рН=8,3)
минерализация
Са5 (РО4 )3 ОН 3Н2О
5Са2 3НРО42 4ОН
деминерализация
остеокласты
Согласно принципу Ле Шателье образование гидроксиапатита — основного вещества
костной ткани происходит при смещении равновесия вправо. Этому способствует:
определённое значение щёлочности среды (8,3);
повышенная концентрация гидрофосфат–ионов (НРО42–);
Образование гидрофосфат-ионов:
сложные эфиры фосфорной кислоты
(и фосфаты углеводов)
гидролиз
НРО4
2
10
11.
Разрушение костной ткани происходит при смещении равновесия влево.Этому способствует:
Уменьшение рН.
При небольшом повышении содержания Н+ кость начинает растворяться, отдавая
вначале катионы кальция:
Са5 (РО4 ) 3 ОН 7Н 3Н 2 РО4 5Са2 Н 2О
При большей кислотности среды происходит полный распад костной ткани:
Са (РО ) ОН 2Н Са Н (РО ) Са2 Н О
5
4 3
4
4 3
2
Увеличение концентрации веществ, образующих комплексные соединения с
ионами Са2+ (лактатов, цитратов и белков) и приводящих образованию
растворимых соединений кальция.
11
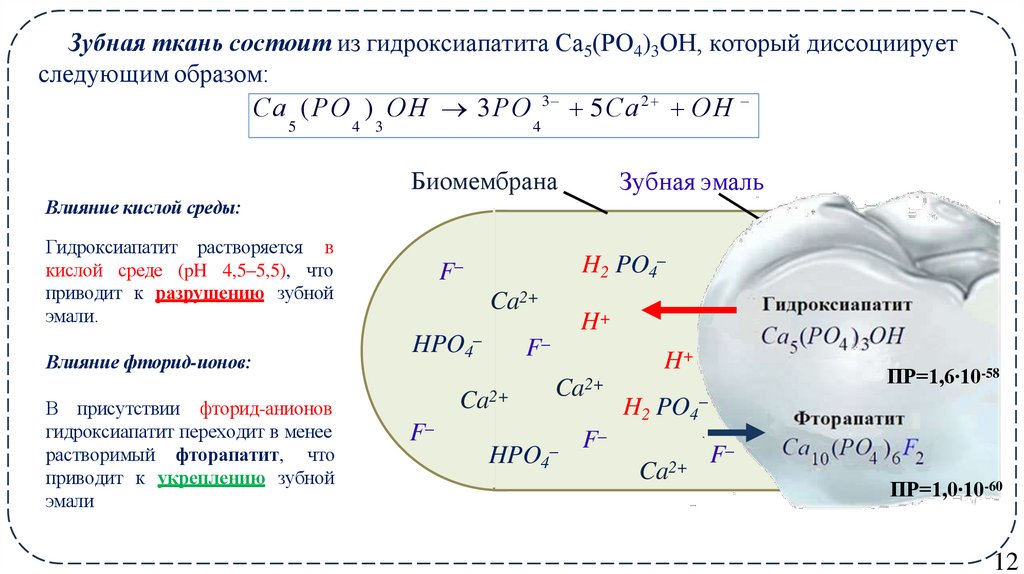
12. Зубная ткань состоит из гидроксиапатита Са5(РО4)3ОН, который диссоциирует следующим образом:
Са (РО ) О Н 3РО 3 5Са 2 О Н5
4 3
4
Биомембрана
Зубная эмаль
Влияние кислой среды:
Гидроксиапатит растворяется в
кислой среде (pH 4,5–5,5), что
приводит к разрушению зубной
эмали.
Влияние фторид-ионов:
В присутствии фторид-анионов
гидроксиапатит переходит в менее
растворимый фторапатит, что
приводит к укреплению зубной
эмали
H2 PO4–
F–
Ca2+
HPO4–
F–
Ca2+
F–
H+
H+
Ca2+
HPO4–
ПР=1,6∙10-58
H2 PO4 –
F–
Ca2+
F–
ПР=1,0∙10-60
12
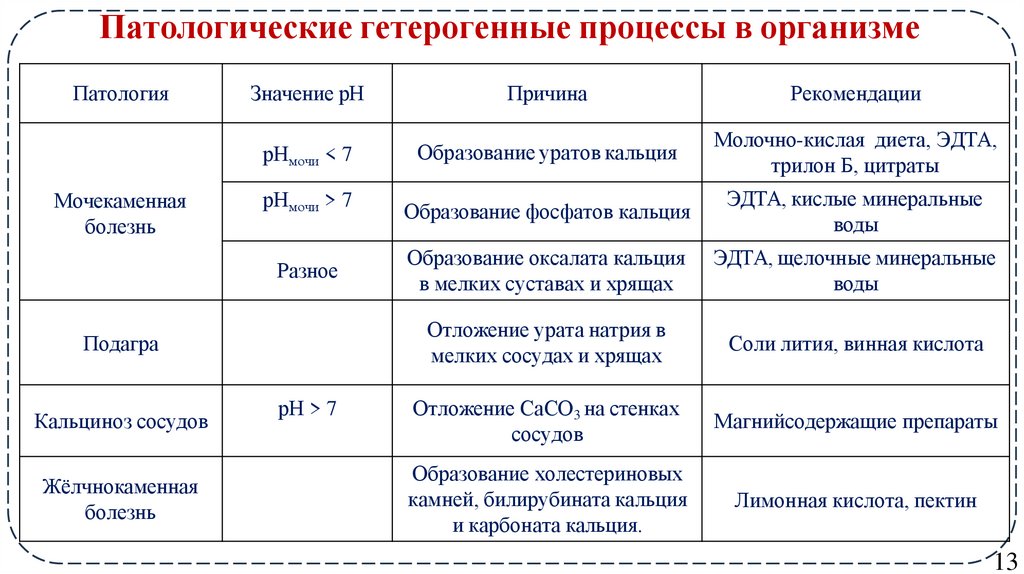
13. Патологические гетерогенные процессы в организме
ПатологияМочекаменная
болезнь
Значение рН
Причина
Рекомендации
рНмочи < 7
Образование уратов кальция
Молочно-кислая диета, ЭДТА,
трилон Б, цитраты
рНмочи > 7
Образование фосфатов кальция
ЭДТА, кислые минеральные
воды
Разное
Образование оксалата кальция
в мелких суставах и хрящах
ЭДТА, щелочные минеральные
воды
Отложение урата натрия в
мелких сосудах и хрящах
Соли лития, винная кислота
Отложение СаСО3 на стенках
сосудов
Магнийсодержащие препараты
Образование холестериновых
камней, билирубината кальция
и карбоната кальция.
Лимонная кислота, пектин
Подагра
Кальциноз сосудов
Жёлчнокаменная
болезнь
рН > 7
13
14.
Конкурирующие равновесияГетерогенные, кислотно-основные, окислительно-восстановительные,
лигандообменные равновесия могут сочетаться в одной химической
реакции.
Для определения возможности протекания прямой реакции и
преимущественно протекающей реакции в обратимом процессе нужно
сравнить соответствующие константы (Kнест., Kдисc., ПР) и, используя
их, рассчитать константу совмещённого равновесия.
Эта константа рассчитывается как отношение константы равновесия
процесса, происходящего с исходными веществами, к константе
равновесия процесса, происходящего с продуктами реакции.
14
15.
Пример конкурирующего равновесияAg(NH3 )2 Cl+KI
Ag(NH3 )2 +I
Исходный комплексный ион
диссоциирует:
Ag(NH3 )2
Ag +2NH3
Константа
нестойкости
Кн=8.10-8
AgI(тв.)+KCl+2NH3
AgI(тв.)+2NH 3
Продукт – осадок иодида серебра
растворяется:
AgI(тв.)
Ag + I
Произведение
растворимости
ПР=8,3.10-17
Константа совмещённого равновесия:
K нестойкости
8 10 8
8
K совм. равнов.
9,6
10
8,3 10 17
ПР
15
16. Анализ значения константы совмещённого равновесия
Если константа совмещённого равновесия находитсяв интервале 10–4 < Kcовм.равнов. < 104 , то процесс обратим
Направление и глубина смещения равновесия
в зависимости от значения Kcовм.равнов.
Значение
Kcовм.равнов.
Kcовм.равнов. <1
Kcовм.равнов. <104
Протекает обратная реакция
Результат
обратимо
необратимо
Kcовм.равнов. >1
Kcовм.равнов. >10–4
Протекает прямая реакция
обратимо
необратимо
16
17. В рассматриваемом примере Kcовм.равнов.>104 , следовательно, процесс протекает практически необратимо в прямом направлении
В рассматриваемом примере Kcовм.равнов.>104 , следовательно, процесспротекает практически необратимо в прямом направлении
Ag(NH3 )2 Cl+KI AgI(осадок)+KCl+2NH3
17
18. Факторы влияющие на полноту осаждения ионов
В природе нет абсолютно нерастворимых веществ. Поэтому осаждение не можетбыть совершенно полным.
Условие практически полного осаждения
концентрация осаждаемых ионов в растворе над осадком 1·10–6 моль/л
1.
2.
3.
4.
На полноту осаждения влияют
природа иона-осадителя (влияет на растворимость осаждаемого
соединения) и его количество (увеличению полноты осаждения обычно
способствует избыток осадителя (действие одноименного иона по
принципу Ле Шателье), за исключением случаев «солевого эффекта» и
комлексообразования);
природа растворителя (добавление веществ, взаимодействующих с
растворителем (соли, ацетон, спирт) способствует более полному
осаждению);
температура (в зависимости от теплового эффекта растворения);
повышенная концентрация другого вида ионов этого электролита.
18
19.
Рассмотрим эффективность использования последнего приёма на примереосаждения хлорида серебра при взаимодействии нитрата серебра с соляной
кислотой.
Во-первых следует отметить, что при смешивании (100 мл 0,1 н AgNO3) и
(100 мл 0,1 н НСl) в осадок выпадает не 0,01 моль (1,07868 г) Ag+ , а на 2,89∙10–4
меньше, так как с учётом СМ(нас.AgCl) = 1,34∙10 –5 (25 °С) остаток AgCl в растворе
будет равен:
1,34 10 5 (100 100)
2, 68 10 6 моль (или 2,89 10 4 г) Ag
1000
Увеличим концентрацию НСl в 20 раз, тогда [Сl–] станет равной 0,2 моль/л, а
[Ag+] станет равной
ПР
1,8 10 10
10
Ag
9
10
моль/л
0, 2
Cl
то есть уменьшится примерно 15 тыс. раз!
19















 chemistry
chemistry








