Similar presentations:
___Презентация по химии ПСХЭ
1.
2.
Другого ничего в природе нетНи здесь, ни там,
в космических глубинах:
Все - от песчинок малых до
планетИз элементов состоит единых.
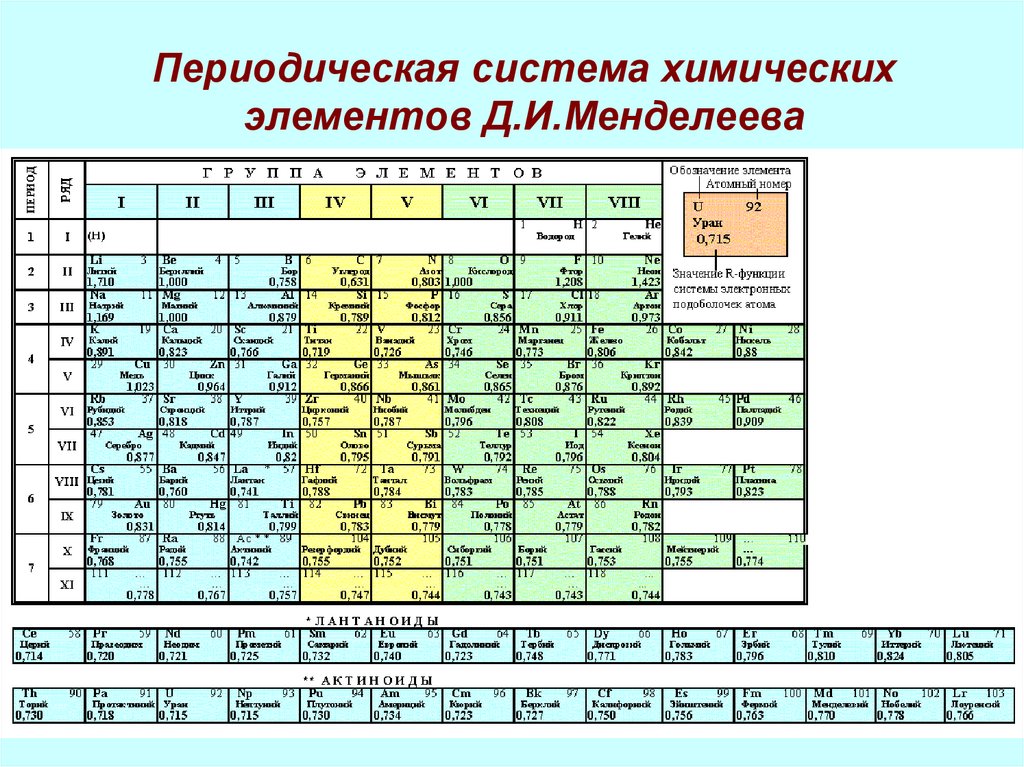
3. Периодическая система химических элементов Д.И.Менделеева
4. Мы шагаем по Периодической…
Характеристика химическогоэлемента по его положению
в периодической системе
химических элементов
Д.И. Менделеева
5. Цели урока:
• Изучить план характеристики химическогоэлемента и научиться применять его на
практике.
• Обобщить и закрепить знания учащихся об
основных закономерностях в изменении
свойств элементов и их соединений,
отраженных в периодической системе.
• Продолжить формирование умения работать
с таблицей химических элементов.
6.
Д.И.Менделеев (1834-1907)великий русский учёный.Открыл периодический закон
химических элементов. Автор
классического труда «Основы
химии», фундаментальных
исследований по химии,
физике, метрологии.
Предложил промышленный
способ фракционного
разделения нефти, изобрёл
вид бездымного пороха.
7. Периодическая система и строение атома
• Периодическая система- это….• Физический смысл номера:
• элемента
• периода
• группы
• Причины изменения свойств элементов:
• периоде, в группе
8. Закономерности
В периодах слева направо число электронов на внешнемэлектронном слое ….., число электронных слоёв ….. ,
радиус атомов …... Следовательно, металлические
свойства….., а неметаллические….
В группах сверху вниз число электронных слоёв …..,
число электронов на внешнем слое ……, радиус атомов
……... Следовательно, неметаллические свойства….., а
металлические……
9. План характеристики элемента.
• 1. Положение элемента в ПС (номер, период, группа,подгруппа).
• 2.Строение атома . Степени окисления.
• 3.Электронная формула, семейство элемента.
• 4.Характер элемента (металл, неметалл,
переходный) и простого вещества.
• 5.Состав высшего оксида, его характер.
• 6.Состав гидрата оксида, его характер.
• 7.Состав летучего водородного соединения (для
неметаллов).
• 8. Генетический ряд.
10. План сравнительной характеристики элементов
1. Радиус атома2. Количество электронов на внешнем
энергетическом уровне
3. Металличность (восстановительные
свойства)
4.Неметалличность(окислительные
свойства)
5. Степень окисления в высших оксидах
6. Число энергетических уровней
7. Кислотность или основность оксидов и
гидроксидов
10
11.
12.
13. Характеристика металла натрия
1.Натрий (Na)- элемент 3 периода, 1группы, главной подгруппы,
порядковый номер -11, относительная атомная масса – 23.
2. Строение атома: заряд ядра= +11, протонов= 11, нейтронов = 12,
электронов = 11. Распределение электронов по энергетическим
уровням: 2, 8, 1. Степень окисления = +1
3.Электронная формула: 1S22S22P63S1,
4.Простое вещество- щелочной металл, имеет металлическую
связь и металлическую кристаллическую решетку.
5.Высший оксид Na2O - основной.
6.Гидрат оксида NaOH -
7. Летучее водородное соединение не образует
8. Генетический ряд: Na→Na2O→NaOH→NaCl
s- элемент.
щелочь
14.
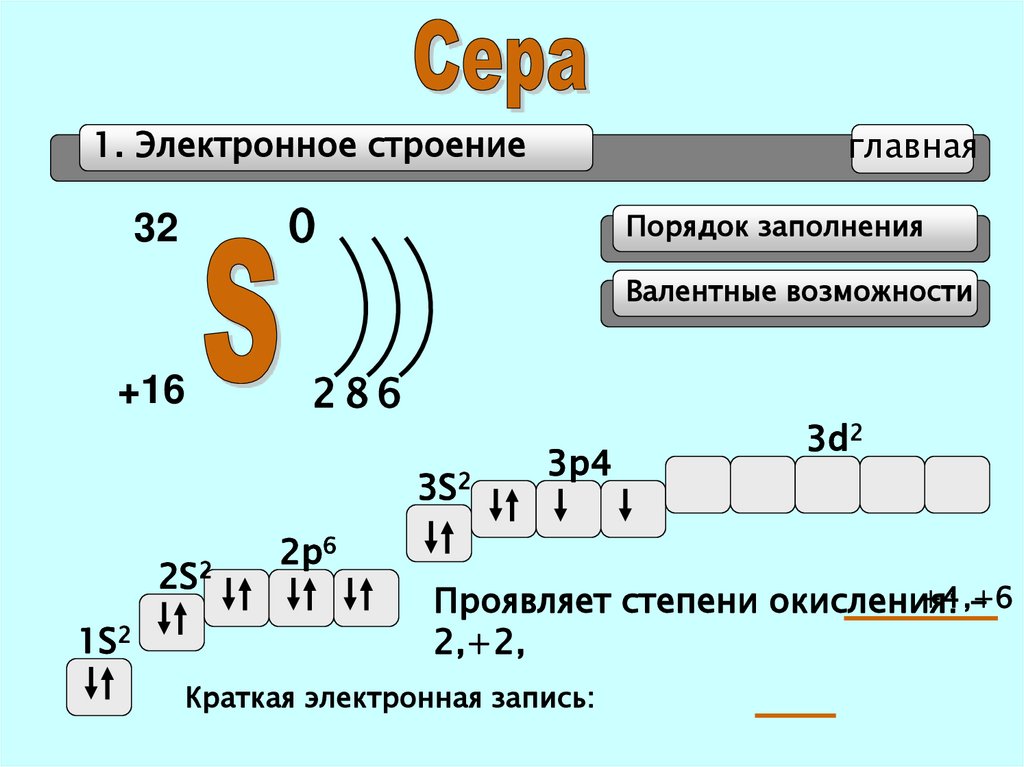
15. Характеристика неметалла серы
Сера(S)- элемент 3 периода, 6 А группы, порядковый
номер -16, относительная атомная масса 32.
Строение атома: заряд ядра =+16, протонов = 16,
нейтронов = 16, электронов = 16. Распределение
электронов по энергетическим уровням: 2, 8, 6. Высшая
степень окисления = +6, низшая степень окисления = -2.
Электронная формула: 1S22S22P63S23р4 , р-элемент
Простое вещество- неметалл, имеет молекулярную
кристаллическую решетку.
Высший оксид SО3 – кислотный.
Гидрат оксида Н2SО4– серная кислота.
Летучее водородное соединение Н2S –сероводород
Генетический ряд: S→ SО3→ Н2SО4→ВаSО4
16.
Характеристика химического элемента по положению в ПСХЭпериоды ряды
1
1
2
2
3
3
4
5
6
7
Группы элементов
I
II
III
32
IV
V
0
VI
VII
Характеристика
(16р+ + 16n0) 16e-
4
r (атома) – 0,104 нм
5
6
ЭО – 2,5
7
Неметалл
8
9
10
VIII
+16
Подробнее…
Pd
17.
1. Электронное строениеглавная
0
32
Порядок заполнения
Валентные возможности
+16
286
3S2
2S2
1S2
3p4
3d2
2p6
+4,+6
Проявляет степени окисления:
2,+2,
Краткая электронная запись:
18.
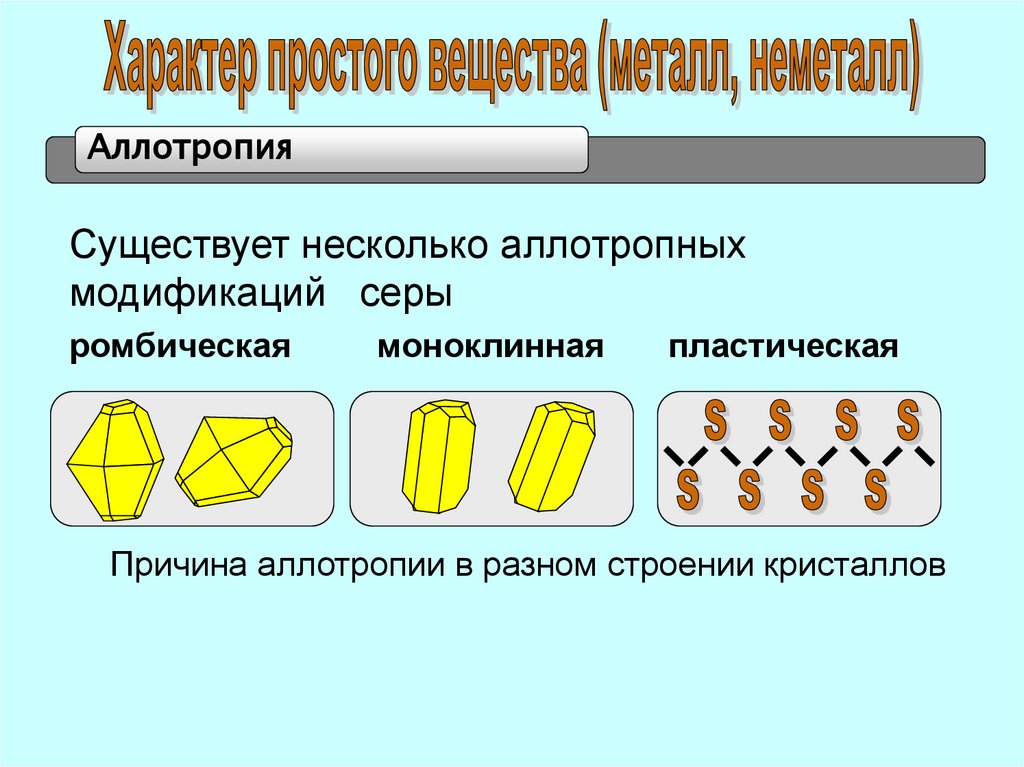
АллотропияСуществует несколько аллотропных
модификаций серы
ромбическая
моноклинная
пластическая
Причина аллотропии в разном строении кристаллов
19.
Физические свойстваСера – твердое
кристаллическое
вещество желтого цвета.
Не растворима в воде.
Мелкие кристаллы серы не
смачиваются водой, плавают
на поверхности (флотация).
Сера хорошо растворима в
сероуглероде.
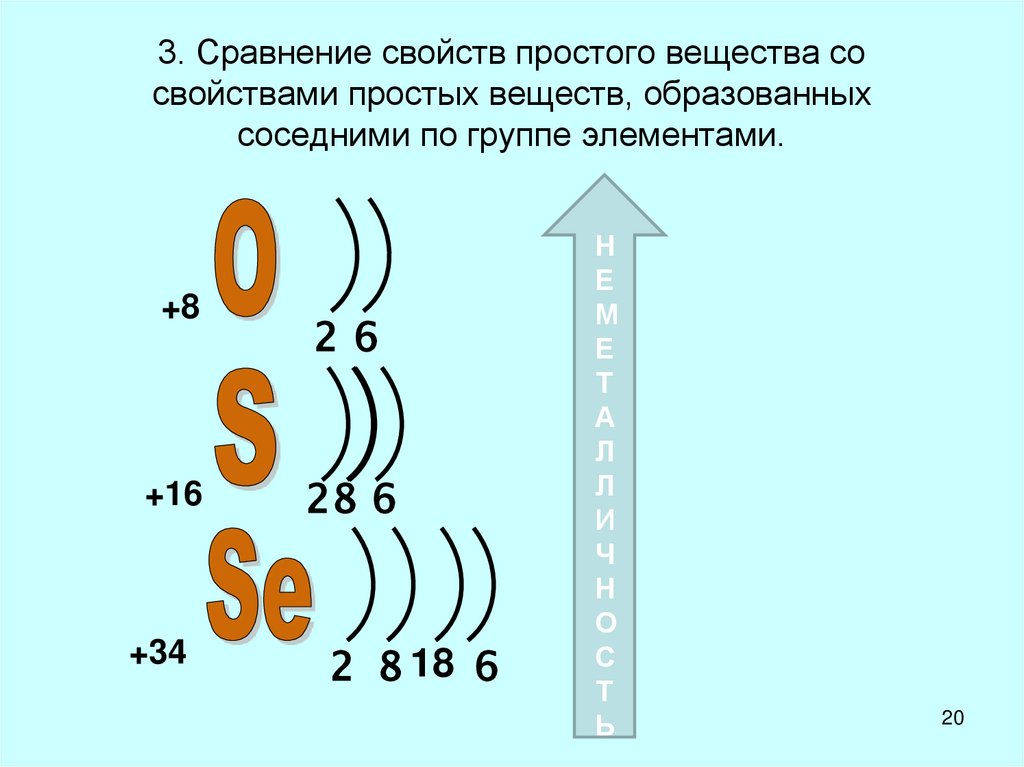
20. 3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по группе элементами.
+826
+16
28 6
+34
2 8 18 6
Н
Е
М
Е
Т
А
Л
Л
И
Ч
Н
О
С
Т
Ь
20
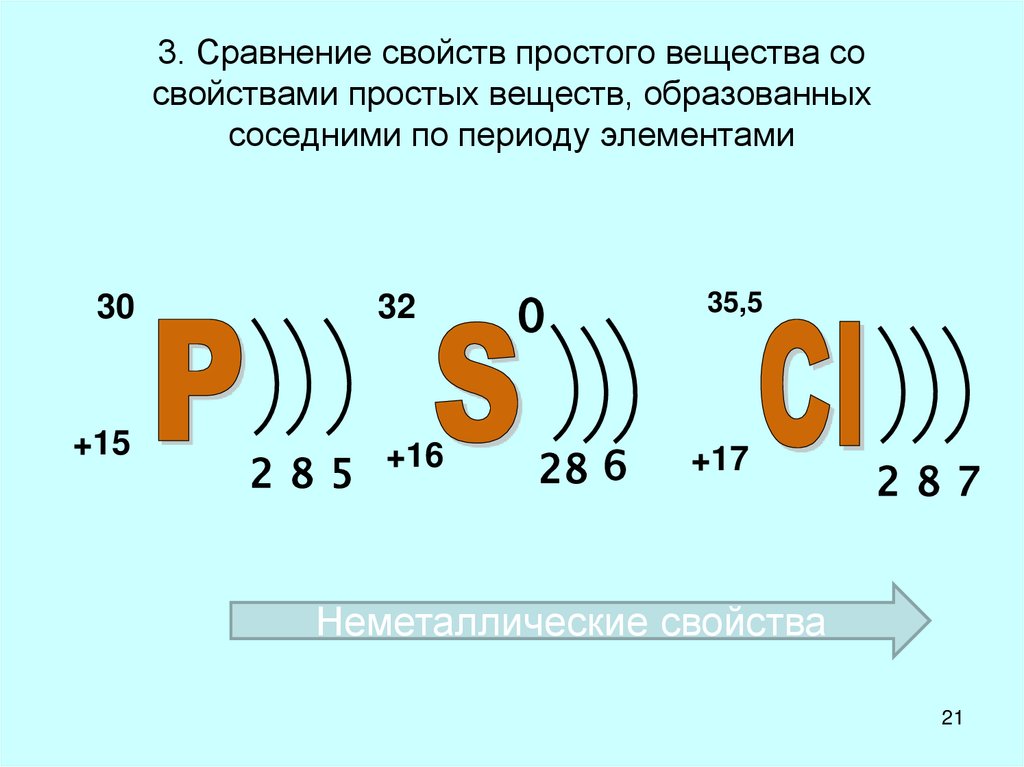
21. 3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
30+15
285
32
0
+16
28 6
35,5
+17
287
Неметаллические свойства
21
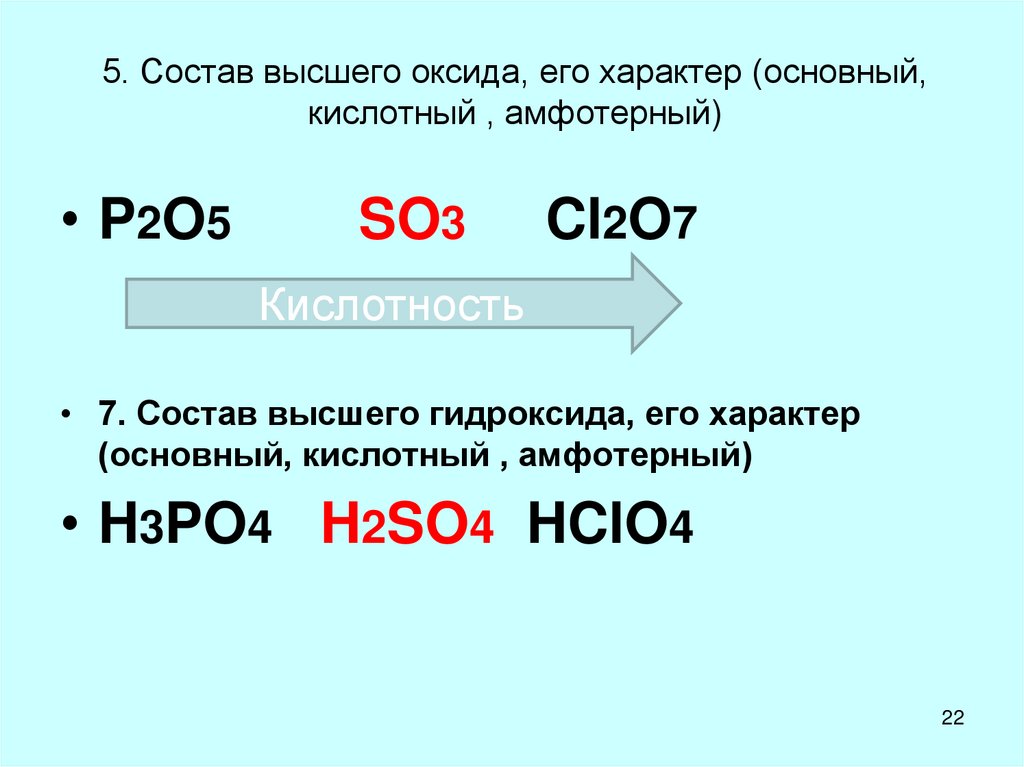
22. 5. Состав высшего оксида, его характер (основный, кислотный , амфотерный)
• P2O5SO3
Cl2O7
Кислотность
• 7. Состав высшего гидроксида, его характер
(основный, кислотный , амфотерный)
• H3PO4 H2SO4 HClO4
22
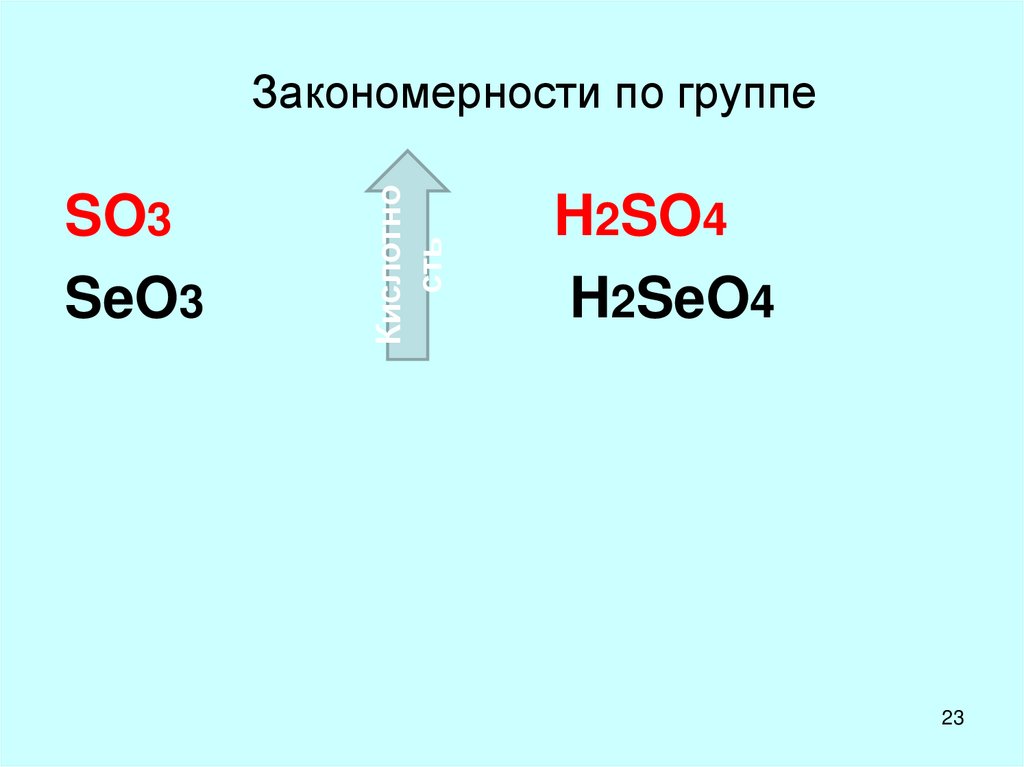
23. Закономерности по группе
SO3SeO3
Кислотно
сть
Закономерности по группе
H2SO4
H2SeO4
23
24. Водородное соединение
• H2S сероводород24
25. Генетический ряд неметалла
• Неметалл → кислотный → кислота→ соль
оксид
Генетический ряд металла
• Металл → основный →кислота → соль
оксид
25
26. Генетический ряд неметалла
• Неметалл → кислотный → кислота→ соль
оксид
Генетический ряд металла
• Металл → основный → → соль
оксид
26
27.
28. Характеристика алюминия
Алюминий ( Al)- элемент 3 периода, 3А группы,
порядковый номер -13, относительная атомная масса
равна 27
Строение атома: заряд ядра = +13, протонов = 13,
нейтронов =14, электронов =13, распределение
электронов по энергетическим уровням: 2,8,3. Степень
окисления =+3
Элемент- переходный, простое вещество – металл, имеет
металлическую кристаллическую решетку.
Электронная формула: 1S22S22P63S23р1 , р-элемент
Высший оксид Al2O3 - амфотерный.
Гидрат оксида Al(OH)3 - амфотерное основание
Летучее водородное соединение не образует
Генетический ряд: Al→ Al2O3→AlCl3→ Al(OH)3
Опыт 3
29. Выводы :
1. Химические элементы делятся на…….2. Атомы металлов на внешнем уровне
содержат……электронов. При химических
реакциях металлы способны……электроны,
т.е.проявляют …….. свойства
3. Простое вещество металл имеет
……..кристаллическую решетку и
……..химическую связь.
4. Металлу соответствует…….оксид, которому
соответствует ……
5. Основные оксиды и основания имеют общее
свойство: реагируют с…… и ……….
30.
6.Атомы неметаллов на внешнем уровнесодержат…… электронов. Атомы
неметаллов могут присоединять и
отдавать электроны, т.е. проявляют
……… и ………. свойства
7.Неметаллу соответствует……. оксид,
которому соответствует……..
8.Кислотные оксиды и кислоты имеют
общее свойство: реагируют с …… и
……..
9.Оксиды и гидроксиды переходных
элементов проявляют……..свойства, т.е.
реагируют и с …… и с…….
31. Домашнее задание
• Составить характеристику элементов:1вариант As, Co
2 вариантAg, Se
• Составить сравнительную
характеристику элементов:
1вариант Ge,Sn,Sb
2 вариант C,Si,P

























 chemistry
chemistry








