Similar presentations:
Тема 12 ОВР
1.
Важнейшие классыОкислительно-восстановительные
неорганических соединений.
реакции
КИСЛОТЫ
Составители: к.х.н. Махмутова Г.Ф.,
к.х.н. Ефимова И.Г.
2.
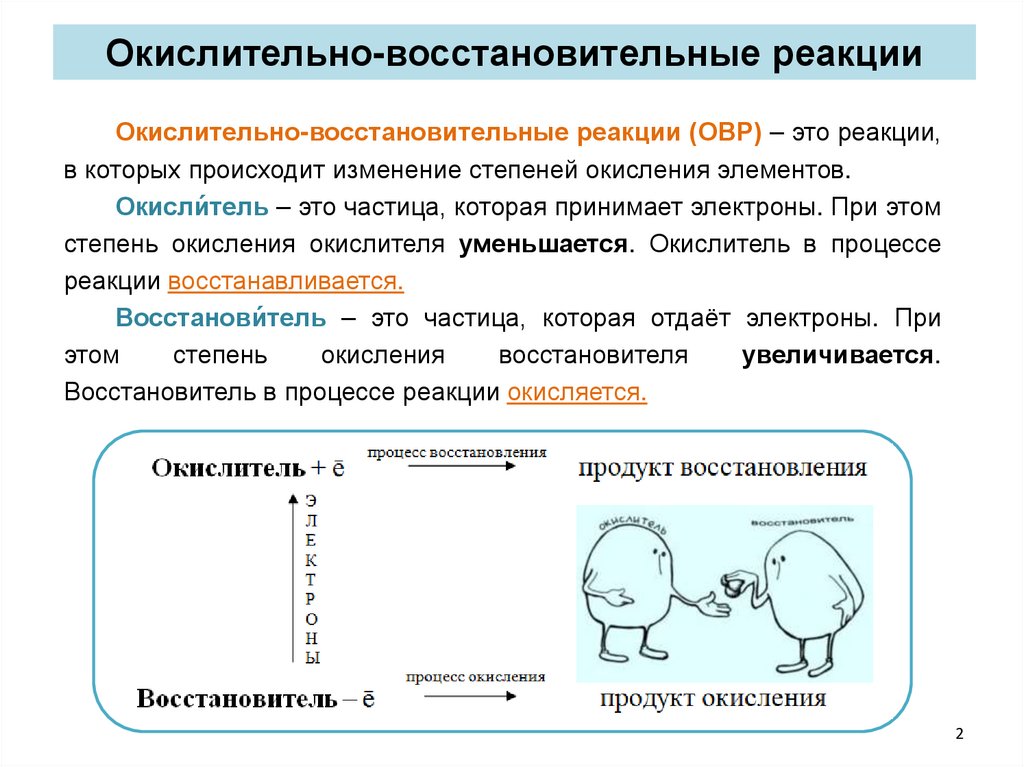
Окислительно-восстановительные реакцииОкислительно-восстановительные реакции (ОВР) – это реакции,
в которых происходит изменение степеней окисления элементов.
Окисли́тель – это частица, которая принимает электроны. При этом
степень окисления окислителя уменьшается. Окислитель в процессе
реакции восстанавливается.
Восстанови́тель – это частица, которая отдаёт электроны. При
этом
степень
окисления
восстановителя
увеличивается.
Восстановитель в процессе реакции окисляется.
2
3.
Типы восстановителяВажнейшие
восстановители
Продукт их окисления
Вещества, содержащие элемент в минимальной степени окисления, всегда
являются восстановителями, то есть могут только отдавать электроны.
Простые вещества-металлы Ме
Ме+n в составе солей
Водород Н2,
гидриды металлов IA группы
Н+ обычно в составе Н2O
С0, C+2O
С+4 обычно в составе СO2
Сероводород Н2S
S0 или SO42– в зависимости от условий
НCl, HF, HBr, HI
и их соли
Cl20, F20, Br20, I20
NH3
N20 / N2O / NO
в зависимости от условий
3
4.
Типичные окислителиВажнейшие окислители
Продукт их восстановления
Вещества, содержащие элемент в максимальной степени окисления, всегда являются
окислителями, то есть могут только принимать электроны.
Кислород О2, озон О3
О2– в составе оксидов
Галогены Х2
(Х = F, Cl, Вr)
Х– в составе солей или ковалентных галогенидов
HNO3
разбавленная
с малоактивными металлами от Cu до Ag: NО ↑
с металлами от Al до Pb: N2 или N2O↑
с активными металлами от Li до Mg: NH4NO3, NH3↑
HNO3
концентрированная
с металлами от Al до Ag: NO2
с активными металлами от Li до Mg: N2O
Н2SO4
концентрированная
с неметаллами и малоактивными металлами: SO2↑
с активными металлами: S↓
с очень активными металлами: Н2S↑
4
5.
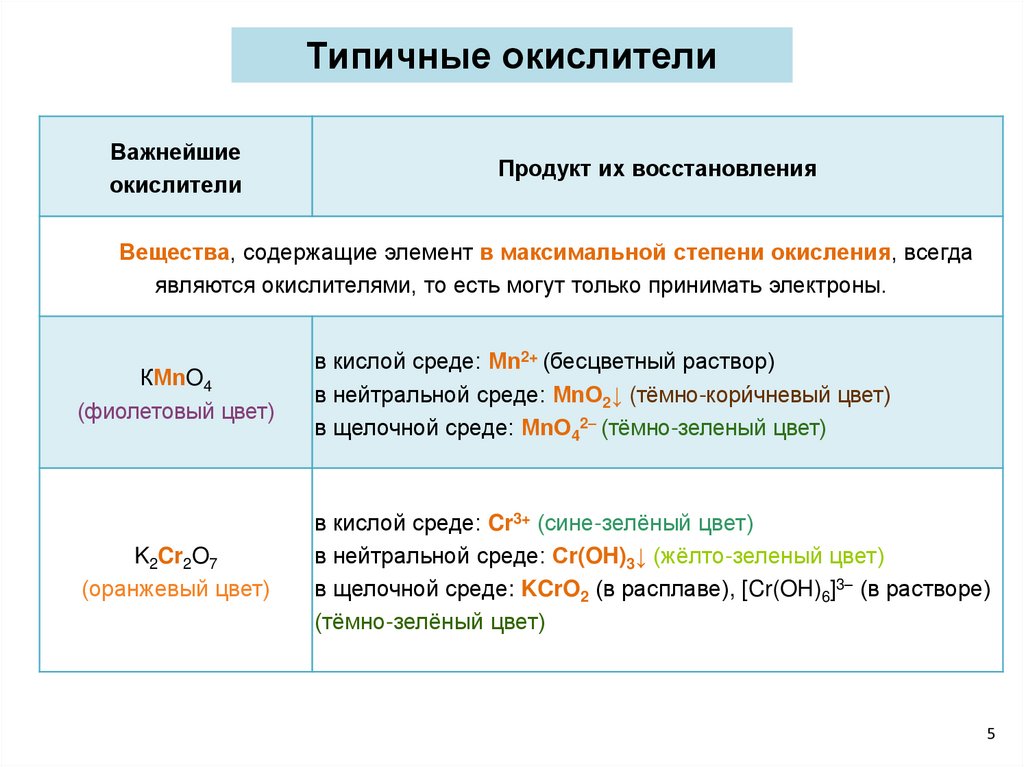
Типичные окислителиВажнейшие
окислители
Продукт их восстановления
Вещества, содержащие элемент в максимальной степени окисления, всегда
являются окислителями, то есть могут только принимать электроны.
КМnO4
(фиолетовый цвет)
в кислой среде: Мn2+ (бесцветный раствор)
в нейтральной среде: МnO2↓ (тёмно-кори́чневый цвет)
в щелочной среде: МnO42– (тёмно-зеленый цвет)
K2Cr2O7
(оранжевый цвет)
в кислой среде: Cr3+ (сине-зелёный цвет)
в нейтральной среде: Сr(OH)3↓ (жёлто-зеленый цвет)
в щелочной среде: KCrO2 (в расплаве), [Cr(OH)6]3– (в растворе)
(тёмно-зелёный цвет)
5
6.
Окислительно-восстановительная дво́йственностьВещества,
содержащие
элементы
в
промежуточной
степени
окисления, могут выступать восстановителями и / или окислителями.
Например,
+2ē
S-2 (H2S) продукт восстановления
-6ē
S+6 (H2SO4) продукт окисления
S0 + H2 = H2S-2
S0
+2ē
2I-
продукт восстановления
2I+5
продукт окисления
I20
-10ē
S0 + KMnO4 = K2S+6O4 + MnO2
I2 + H2S = S + 2HI
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
6
7.
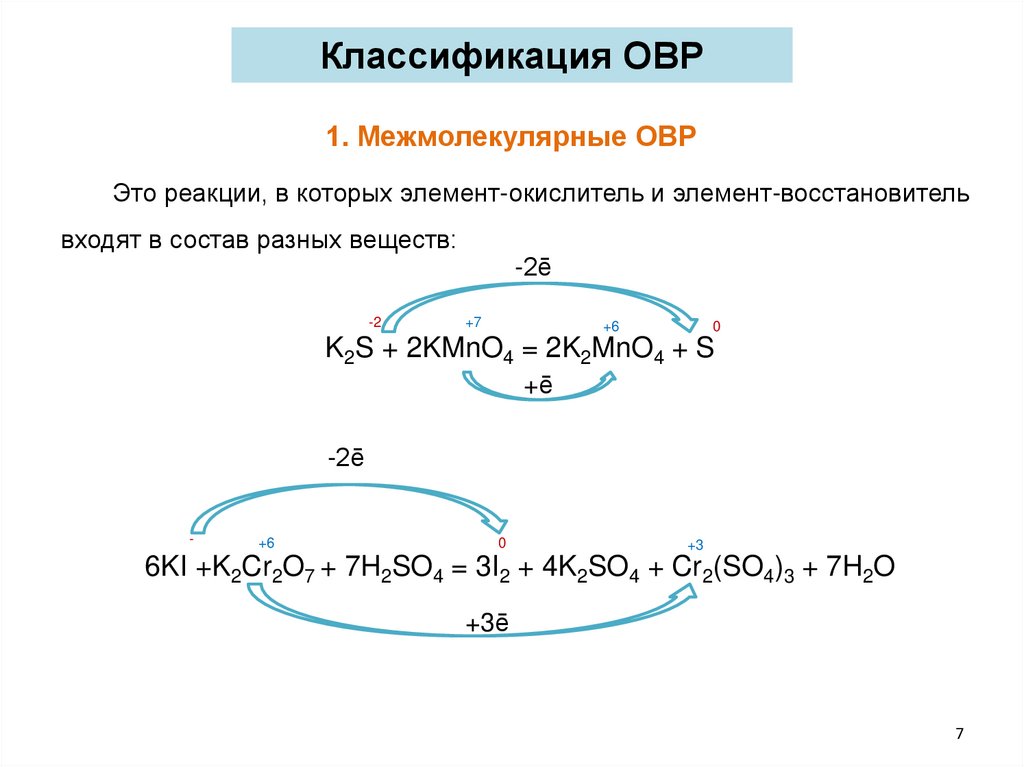
Классификация ОВР1. Межмолекулярные ОВР
Это реакции, в которых элемент-окислитель и элемент-восстановитель
входят в состав разных веществ:
-2ē
-2
+7
+6
0
K2S + 2KMnO4 = 2K2MnO4 + S
+ē
-2ē
-
+6
0
+3
6KI +K2Cr2O7 + 7H2SO4 = 3I2 + 4K2SO4 + Cr2(SO4)3 + 7H2O
+3ē
7
8.
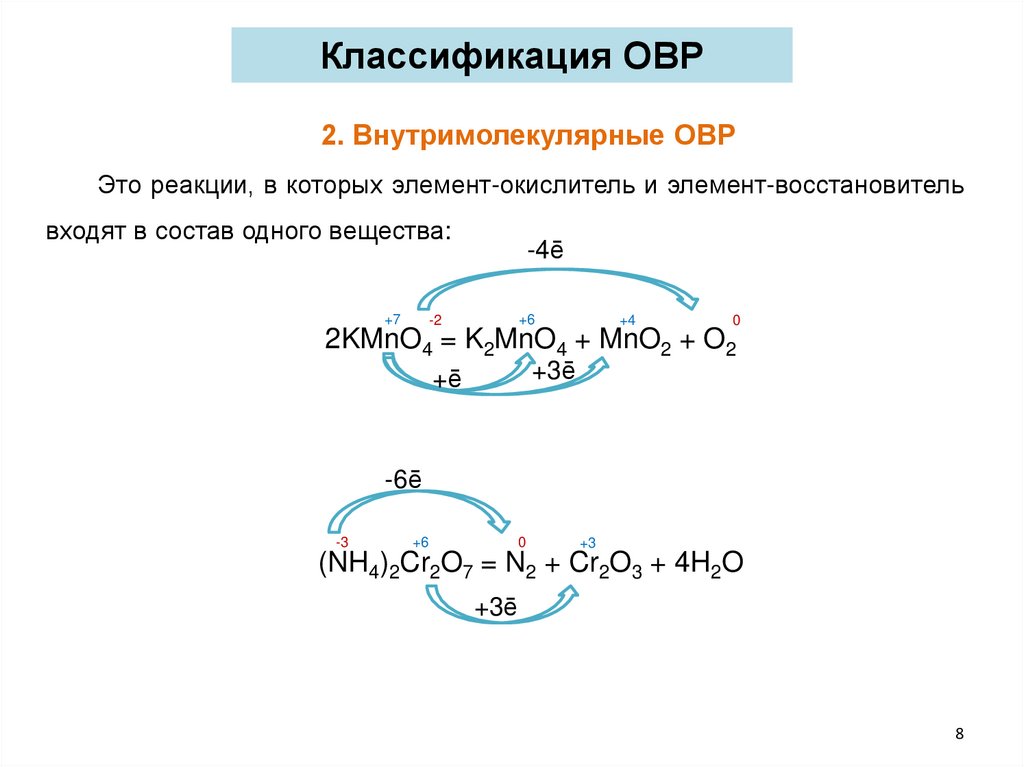
Классификация ОВР2. Внутримолекулярные ОВР
Это реакции, в которых элемент-окислитель и элемент-восстановитель
входят в состав одного вещества:
+7
-4ē
+6
-2
+4
0
2KMnO4 = K2MnO4 + MnO2 + O2
+3ē
+ē
-6ē
-3
+6
0
+3
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
+3ē
8
9.
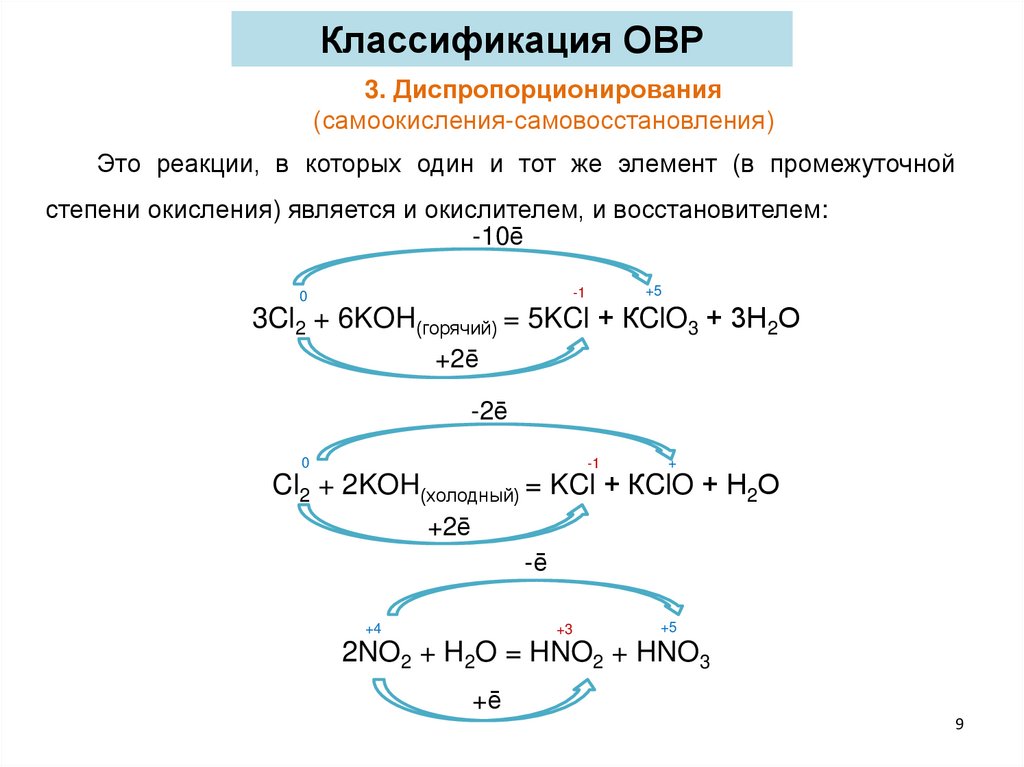
Классификация ОВР3. Диспропорционирования
(самоокисления-самовосстановления)
Это реакции, в которых один и тот же элемент (в промежуточной
степени окисления) является и окислителем, и восстановителем:
-10ē
+5
-1
0
3Cl2 + 6KOH(горячий) = 5KCl + КClO3 + 3Н2О
+2ē
-2ē
0
-1
+
Cl2 + 2KOH(холодный) = KCl + КClO + Н2О
+2ē
-ē
+4
+3
+5
2NO2 + H2O = HNO2 + HNO3
+ē
9
10.
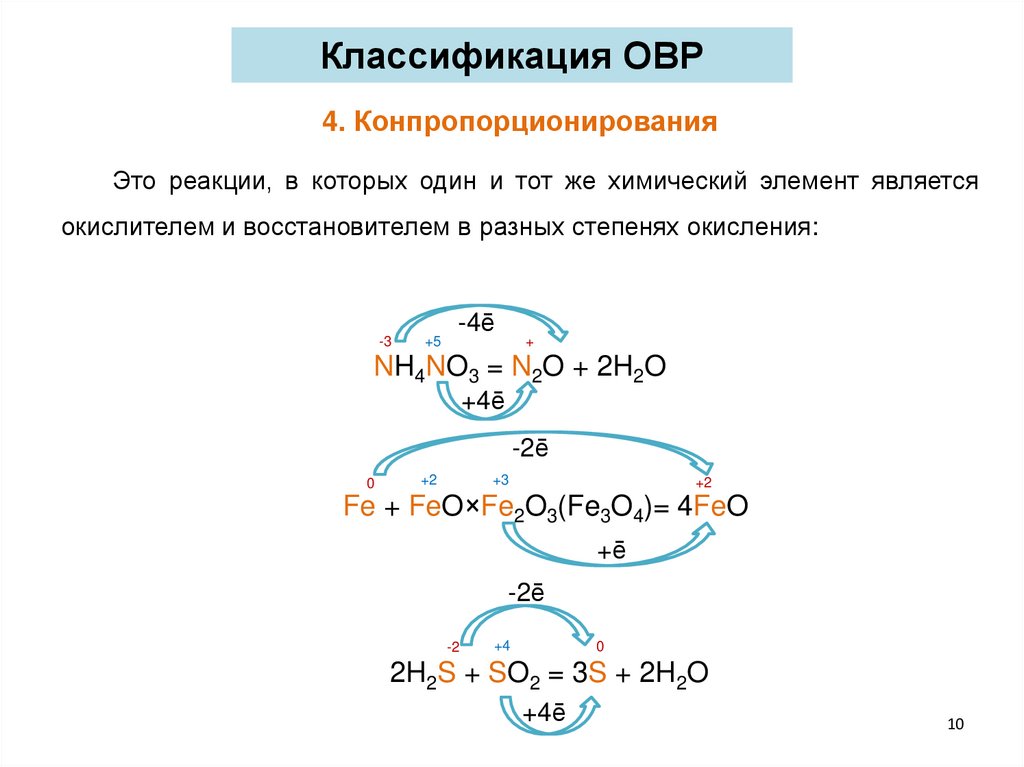
Классификация ОВР4. Конпропорционирования
Это реакции, в которых один и тот же химический элемент является
окислителем и восстановителем в разных степенях окисления:
-3
+5
-4ē
+
NH4NO3 = N2O + 2H2O
+4ē
-2ē
0
+2
+3
+2
Fe + FeO×Fe2O3(Fe3O4)= 4FeO
+ē
-2ē
-2
+4
0
2H2S + SO2 = 3S + 2H2O
+4ē
10
11.
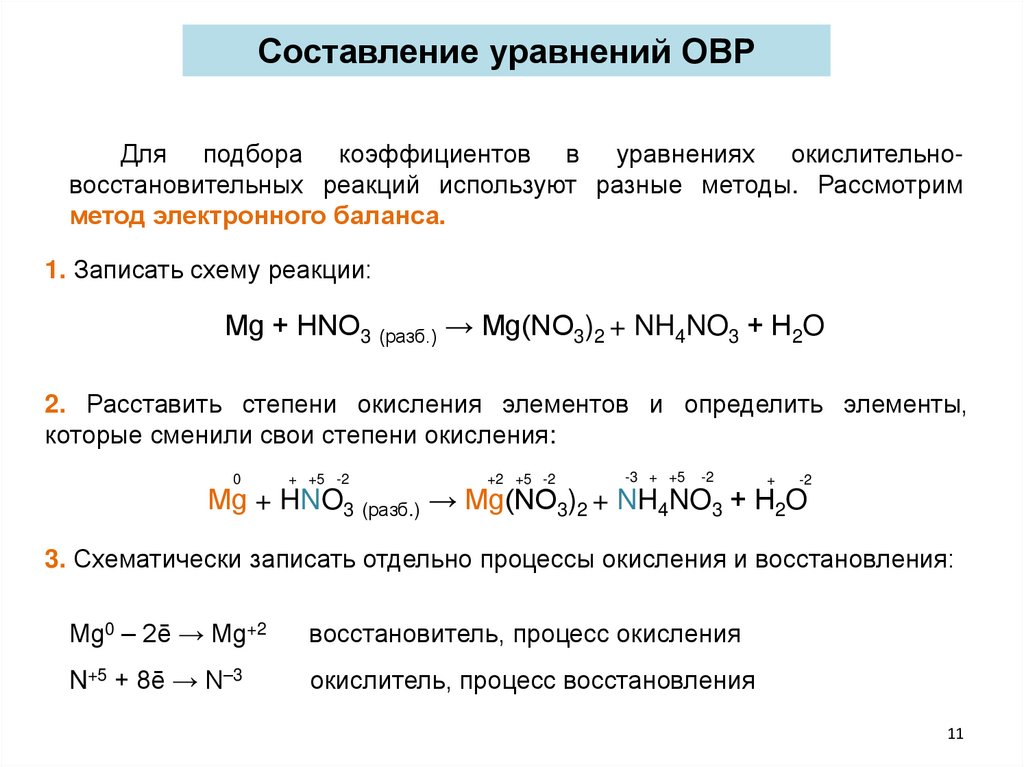
Составление уравнений ОВРДля подбора коэффициентов в уравнениях окислительновосстановительных реакций используют разные методы. Рассмотрим
метод электронного баланса.
1. Записать схему реакции:
Мg + HNO3 (разб.) → Мg(NО3)2 + NH4NO3 + Н2O
2. Расставить степени окисления элементов и определить элементы,
которые сменили свои степени окисления:
0
+ +5 -2
+2 +5 -2
-3 + +5
-2
+
-2
Мg + HNO3 (разб.) → Мg(NО3)2 + NH4NO3 + Н2O
3. Схематически записать отдельно процессы окисления и восстановления:
Мg0 – 2ē → Мg+2
восстановитель, процесс окисления
N+5 + 8ē → N–3
окислитель, процесс восстановления
11
12.
Составление уравнений ОВР4. Умножить эти схематические уравнения на такие коэффициенты, чтобы число
отданных электронов равнялось числу принятых.
Мg0 – 2ē = Мg+2
|4
Коэффициенты перед веществами
|8
N+5 + 8ē = N–3
|1
Наименьшее общее кратное число между 2 и 8
5. Расставим полученные коэффициенты в исходном уравнении:
4Мg + HNO3 (разб.) → 4Мg(NО3)2 + 1NH4NO3 + Н2O
6. Определим остальные коэффициенты с помощью подбора:
4Мg + 10HNO3 (разб.) = 4Мg(NО3)2 + NH4NO3 + 3Н2O
Порядок уравнивания атомов:
1)
2)
3)
4)
5)
расставить коэффициенты из электронного баланса (пункт 4);
уравнять металлы;
уравнять неметаллы;
уравнять водород;
уравнять кислород.
12
13.
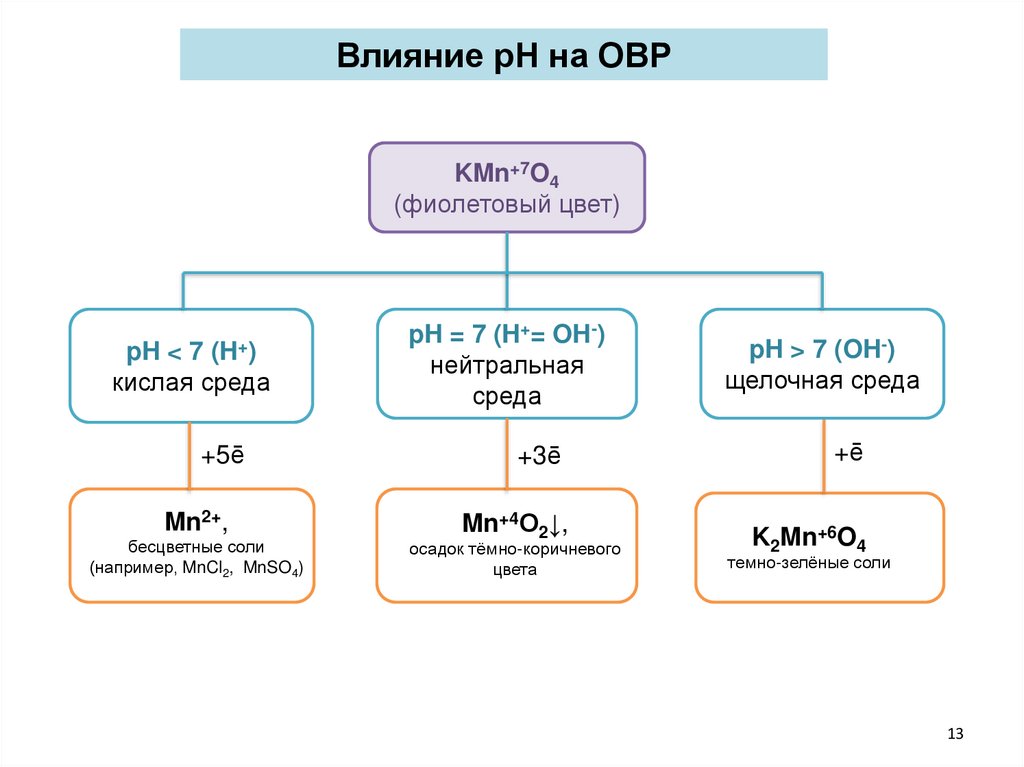
Влияние рН на ОВРKMn+7O4
(фиолетовый цвет)
pH < 7 (H+)
кислая среда
pH = 7 (H+= OH-)
нейтральная
среда
+5ē
+3ē
Mn2+,
Mn+4О2↓,
бесцветные соли
(например, MnCl2, MnSO4)
осадок тёмно-коричневого
цвета
pH > 7 (OH-)
щелочная среда
+ē
K2Mn+6O4
темно-зелёные соли
13
14.
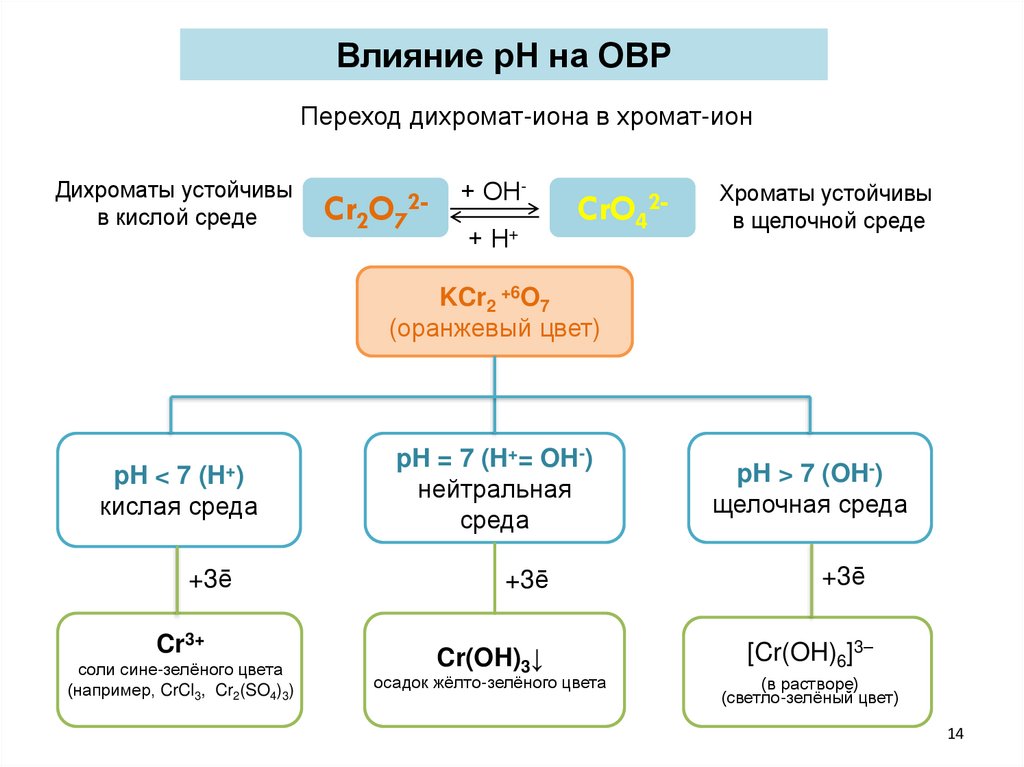
Влияние рН на ОВРПереход дихромат-иона в хромат-ион
Дихроматы устойчивы
в кислой среде
Cr2O72-
+ ОН+ Н+
CrO42-
Хроматы устойчивы
в щелочной среде
KCr2 +6O7
(оранжевый цвет)
pH < 7 (H+)
кислая среда
+3ē
Cr3+
соли сине-зелёного цвета
(например, CrCl3, Cr2(SO4)3)
pH = 7 (H+= OH-)
нейтральная
среда
pH > 7 (OH-)
щелочная среда
+3ē
+3ē
Cr(OH)3↓
[Cr(OH)6]3–
осадок жёлто-зелёного цвета
(в растворе)
(светло-зелёный цвет)
14
15.
Влияние рН на ОВР10Fe+2SO4 + 2KMn+7O4 + 8H2SO4 = 5Fe2+3(SO4)3 + 2Mn+2SO4 + K2SO4 + 8H2O
2Fe+2 -2ē → 2Fe+3
Mn+7 +5ē → Mn+2
10
5 восстановитель, процесс окисления
2 окислитель, процесс восстановления
3Na2S+4O3 + 2KMn+7O4 + H2O = 3Na2S+6O4 + 2Mn+4O2 + 2KOH
Na2S+4O3 + 2KMn+7O4 + 2KOH = Na2S+6O4 + 2K2Mn+6O4 + H2O
K2Cr2+6O7 + 3H2S-2 + 4H2SO4 → K2SO4 + Cr2+3(SO4)3 + 3S0 + 7 H2O
K2Cr2+6O7 + 3H2S-2 + H2O → 2 Cr+3(OH)3↓ + 3S0 + 2KOH
K2Cr2+6O7 + 3K2S-2 + 7H2O → 2K3[Cr+3(OH)6] + 3S0 + 2KOH
При гидролизе соли будет щелочная среда
15
16.
Влияние рН на ОВРВ пероксиде водорода H2O2 (перекись водорода) кислород имеет
промежуточную степень окисления «–1», поэтому H2O2 проявляет
окислительные и восстановительные свойства.
Среда
H2O2 - окислитель
H2O2 - восстановитель
Кислая
H2O2– + 2H+ + 2ē → 2H2O
H2O2– – 2ē → O2↑ + 2H+
Нейтральная
H2O2– + 2ē → 2OH–
H2O2– – 2ē → O2↑ + 2H+
Щелочная
H2O2– + 2ē → 2OH–
H2O2– – 2OH– → O2↑ + 2H2O
H2O2 – окислитель в кислой среде:
H2O2- + 2KI- + H2SO4 = 2H2O-2 + I20 + K2SO4
H2O2 – восстановитель в кислой среде:
2KMn+7O4 + 3H2SO4 + 5H2O2- = 2Mn+2SO4 + 8H2O + 5O20↑ + K2SO4
16
17.
Домашнее заданиеВ приведённых уравнениях окислительно-восстановительных реакций
определите окислитель и восстановитель, составьте уравнения электронного
баланса, расставьте коэффициенты:
1) NaOH + S = Na2S + Na2SO3 + Н2О
2) BaCrO4 = BaO + Cr2O3 + O2
3) Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
4) Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH
5) H2S + K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 + S + H2O
17









 chemistry
chemistry








