Similar presentations:
Reshenie_zadach_na_vyvod_formuly_OV
1. Алгоритм решения задач на вывод формул органических веществ.
2. Обозначить формулу вещества с помощью индексов х, у, z и т. д. по числу элементов в молекуле. Если продуктами горения являются
СО2и Н2О, то вещество может содержать 3
элемента (CxHуOz). Частный случай:
продуктом горения кроме СО2 и Н2О
является азот (N2) для азотсодержащих
веществ (CxHуOzNm)
3. Пример. При сжигании органического вещества массой 0,46 г, было получено 0,88 г оксида углерода (IV) и 0,54 г воды. Плотность
паров веществапо водороду равна 23. Определите
его молекулярную формулу.
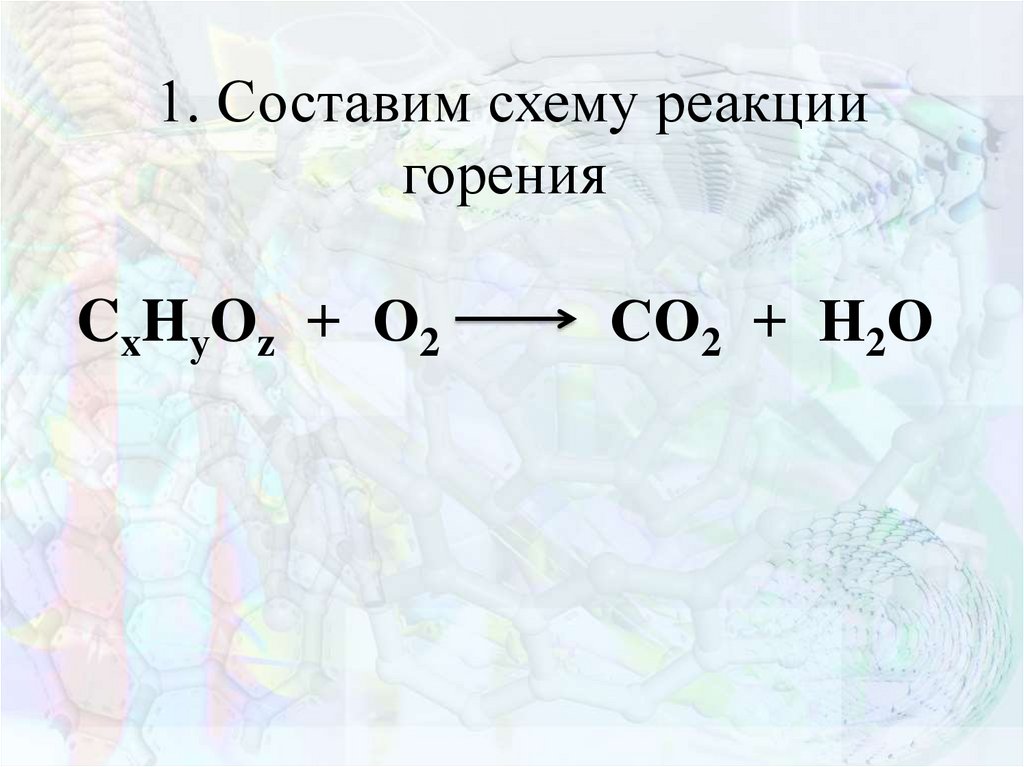
4. 1. Составим схему реакции горения CxHуOz + О2 СО2 + Н2О
5. 2. Истинную относительную молярную массу вещества вычисляем по его плотности по водороду: М (в-ва) = D(н2) ∙ М(н2) М (в-ва) =
23 · 2 = 46 г/моль6. 3. Найдем количество атомов углерода и водорода в соединении: n(C) = n(CО2) = m (CО2)/M(CО2) n(C) = 0,88/44 = 0,02 моль n(Н) =
2*n(Н2О) = m(Н2О)/M(Н2О) =n(Н) = 2*0,54/18 = 0,06 моль
7. 4. Определим массу кислорода в веществе: m(O) = m(в-ва) – (m(С) + m(Н))= 0,46 г – (12*0,02 + 1*0,06) = 0,16 г 4. Вычислим
количества веществакислорода в соединении:
n(О) = m/M = 0,16/16 = 0,01 моль
8. 5. Найдем отношение индексов х:y:z х:y:z = n(C):n(Н):n(O) = 0,02:0,06:0,01= = 2: 6 : 1 Эмпирическая (простейшая) формула
вещества С2Н6О9. 6. По дополнительному условию задачи определим истинную формулу вещества. Молярная масса простейшей формулы: М(С2Н6О) =
12*2+1*6+16*1= 46 г/мольСледовательно, найденная
эмпирическая формула вещества является
истинной.
Ответ: С2Н6О
10. Задача 1. При сжигании 19,8 г органического вещества было получено 39,6 г оксида углерода (IV) и 16,2 г воды. Плотность паров
вещества поазоту равна 1,57. Определите
его молекулярную формулу.









 chemistry
chemistry








