Similar presentations:
сера (1)
1.
Урок химии в 9 классеПодготовила:
Язрикова Л.М.
учитель химии
МБОУ СОШ № 79
г.о. Самара
Размещено на http://www.nashashcola.ru/
2.
O2
S
Se
Te
Увеличивается
атомный радиус
+8
6
Ослабевают
неметаллические и
усиливаются
металлические
свойства.
+ 16
2
8
2
8 18 6
2
8 18 18
6
+ 34
+ 52
6
3.
Сера…
3s
3p
С.о.
-2, +2
3d
+4
+6
4. Определите степени окисления элементов в соединениях:
Н2SSO2
Н2SO3
SO3
Н2SO4
5.
Физические свойства серыСера – твердое
кристаллическое
вещество
Плохо проводит тепло
и электричество.
Она типичный
диэлектрик (изолятор)
Не растворяется
в воде. Хорошо
растворяется в
сероуглероде
6. Аллотропия серы. Кристаллическая, пластическая и моноклинная
7.
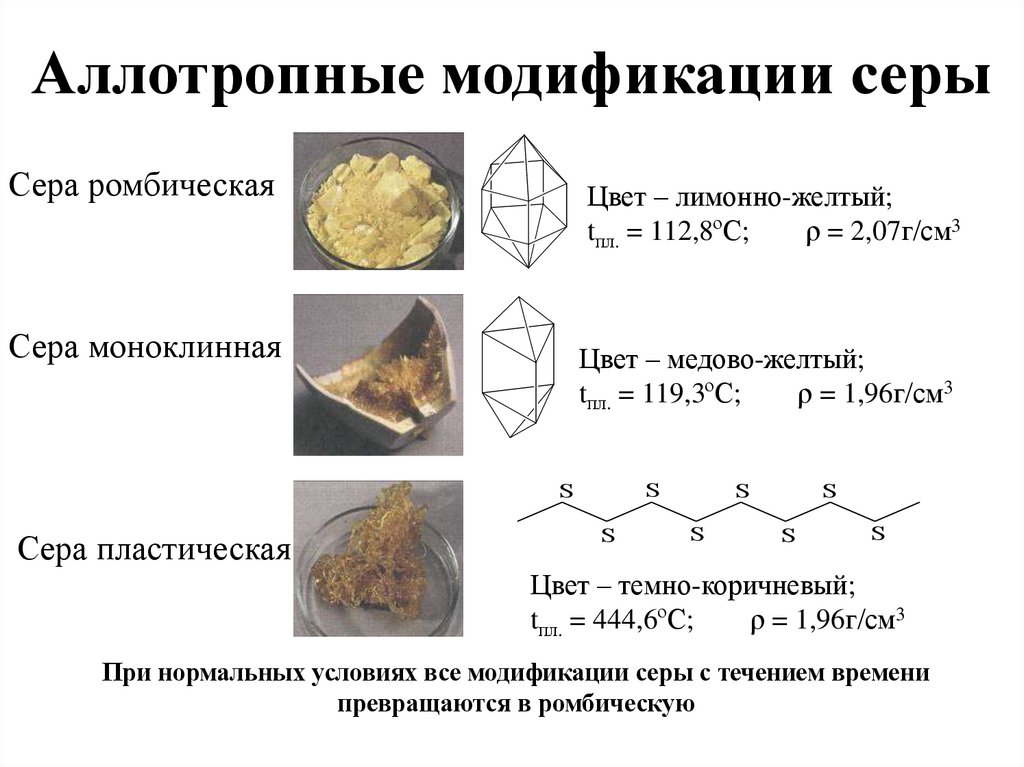
Аллотропные модификации серыСера ромбическая
Цвет – лимонно-желтый;
tпл. = 112,8ºС;
ρ = 2,07г/см3
Сера моноклинная
Цвет – медово-желтый;
tпл. = 119,3ºС;
ρ = 1,96г/см3
S
S
Сера пластическая
S
S
S
S
S
S
Цвет – темно-коричневый;
tпл. = 444,6ºС;
ρ = 1,96г/см3
При нормальных условиях все модификации серы с течением времени
превращаются в ромбическую
8.
Серныйколчедан
(пирит) – FeS2
Медный колчедан
(халькоперит)
– CuFeS3
9.
Свинцовыйблеск
(галенит) – PbS
Киноварь - HgS
10.
Гипс – CaSO4•2H2O
Глауберова соль
(мирабилит) – Na2SO4
•10H2O
11. Химические свойства серы
ОкислительСо всеми Ме, кроме Au и
Pt
А) S + Cu→
Б) S + Zn→
В) S + H2 →
Восстановитель
А) S + O2→для
религиозных обрядов
Б) S + KClO3→основа
«работы» спички
В) 2KNO3 + 3C + S → K2S +
3CO2↑ + N2
12.
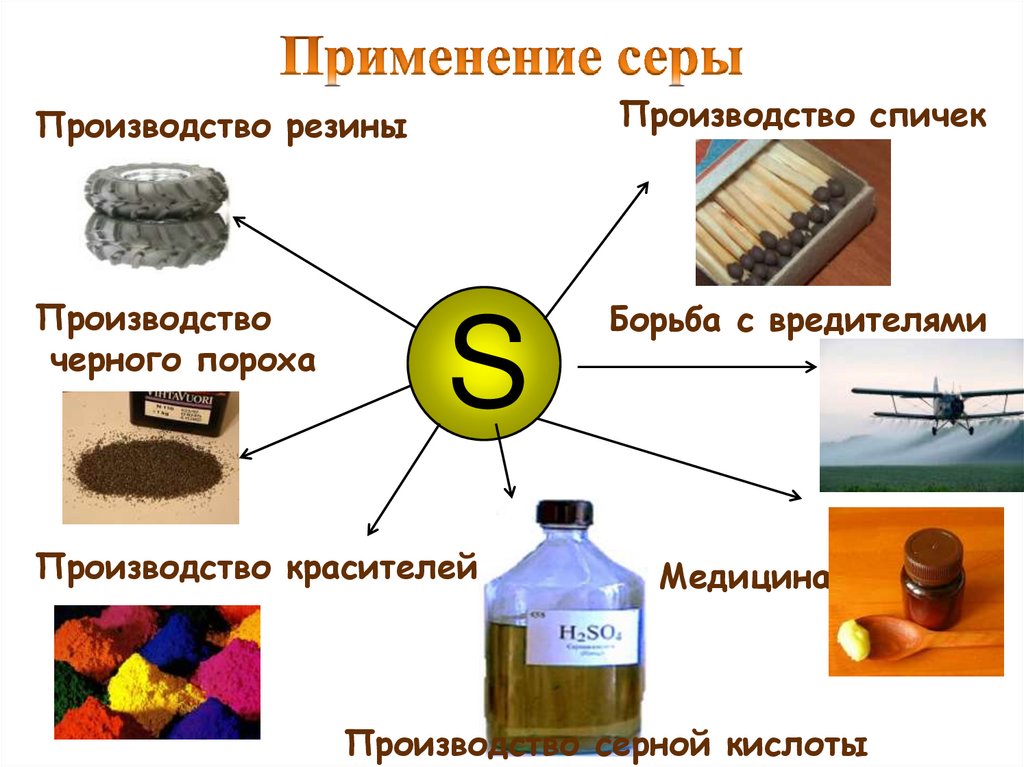
Производство резиныПроизводство спичек
Производство
черного пороха
Борьба с вредителями
S
Производство красителей
Медицина
Производство серной кислоты
13. Биологическое значение серы
• Входит в состав белков (белки волос, рогов, шерсти)• Составная часть витаминов, ферментов и гормонов (инсулин)
• Принимает участие в окислительно – восстановительных
процессах ( при недостатке хрупкость и ломкость костей и
выпадение волос)
• Серой богаты бобовые растения (горох, чечевица), овсяные
хлопья, яйца.











 chemistry
chemistry








