Similar presentations:
Скорость химических реакций
1.
1Скорость химических
реакций
Лектор:
Колядо Александр Владимирович
2.
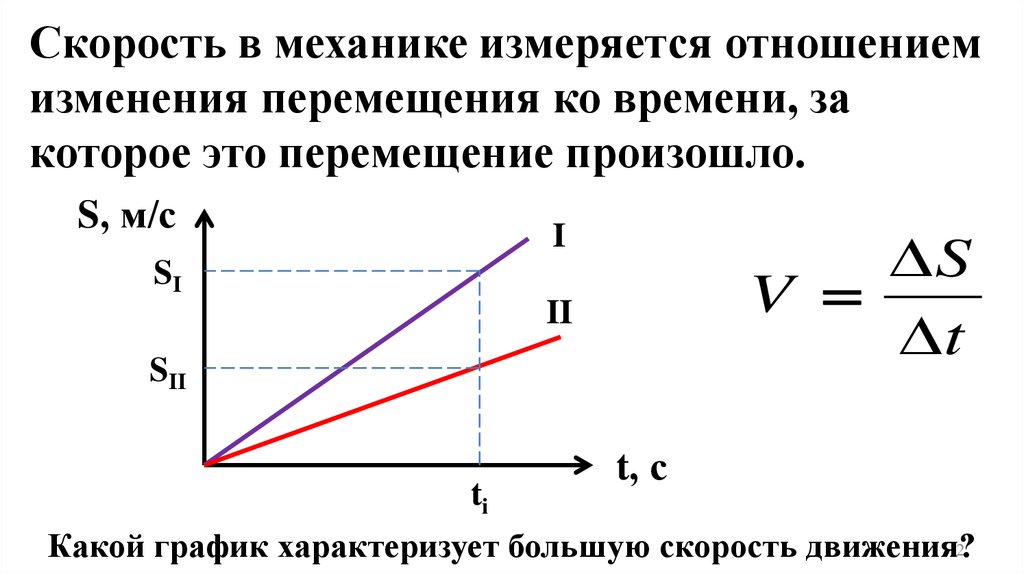
Скорость в механике измеряется отношениемизменения перемещения ко времени, за
которое это перемещение произошло.
S, м/с
S
V
t
I
SI
II
SII
ti
t, с
2
Какой график характеризует большую скорость движения?
3.
VV
V2
V1
V
V4
V6
V3
V5
t
t
t
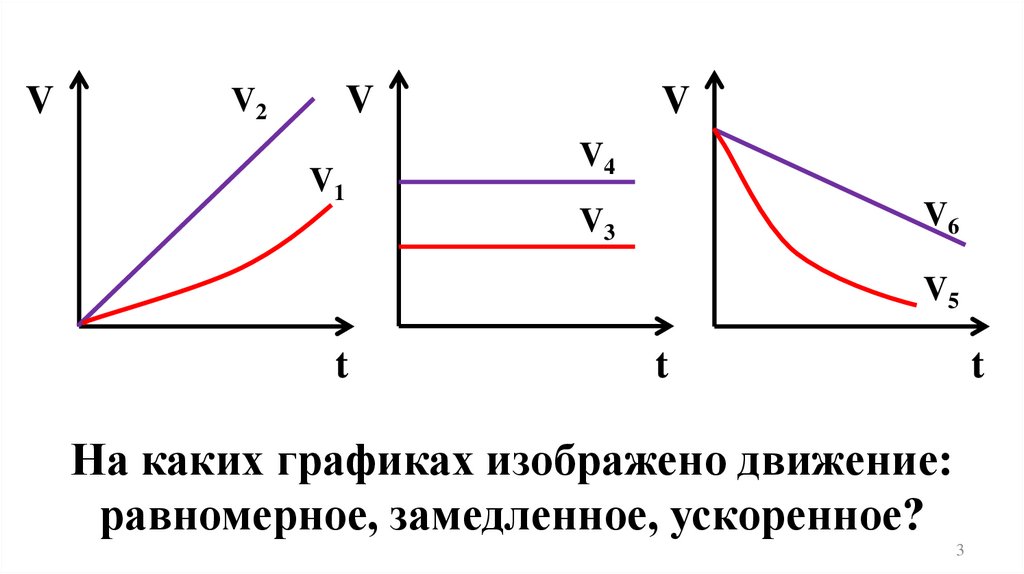
На каких графиках изображено движение:
равномерное, замедленное, ускоренное?
3
4.
Как определить скорость химическойреакции?
4
5.
Скорость химической реакции равнаизменению концентраций реагентов или
продуктов реакций в единицу времени.
С2 С1
С моль
V
л
сек
2 1
Знак «–», если расчет идёт по концентрации исходных
веществ С 0
Знак «+», если расчет идёт по концентрации продуктов
5
С 0
6.
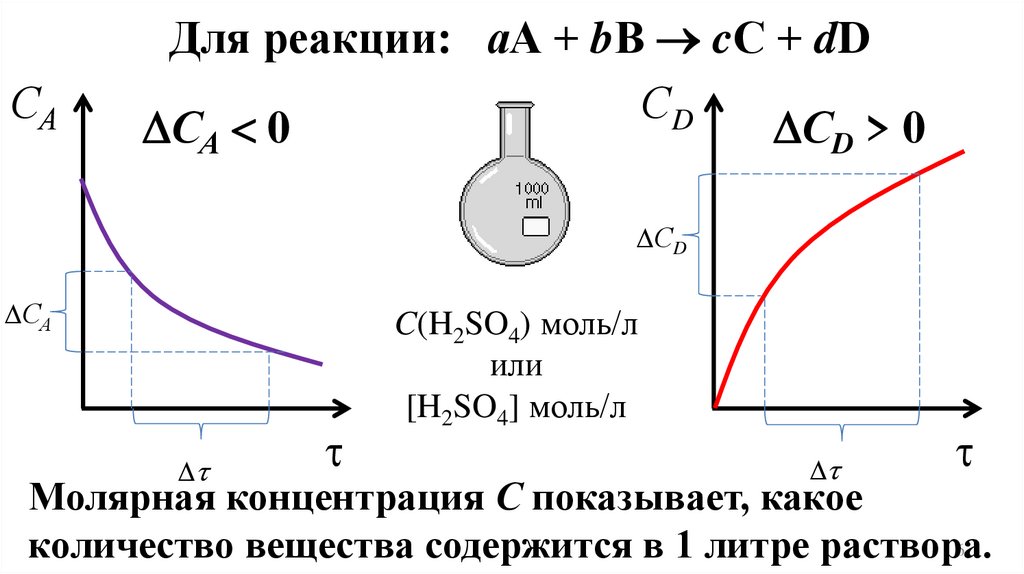
САДля реакции: аА + bВ cС + dD
СD
СА 0
СD > 0
СD
СА
C(H2SO4) моль/л
или
[H2SO4] моль/л
Молярная концентрация С показывает, какое
6
количество вещества содержится в 1 литре раствора.
7.
С1
Сi
2
3
3 2
1
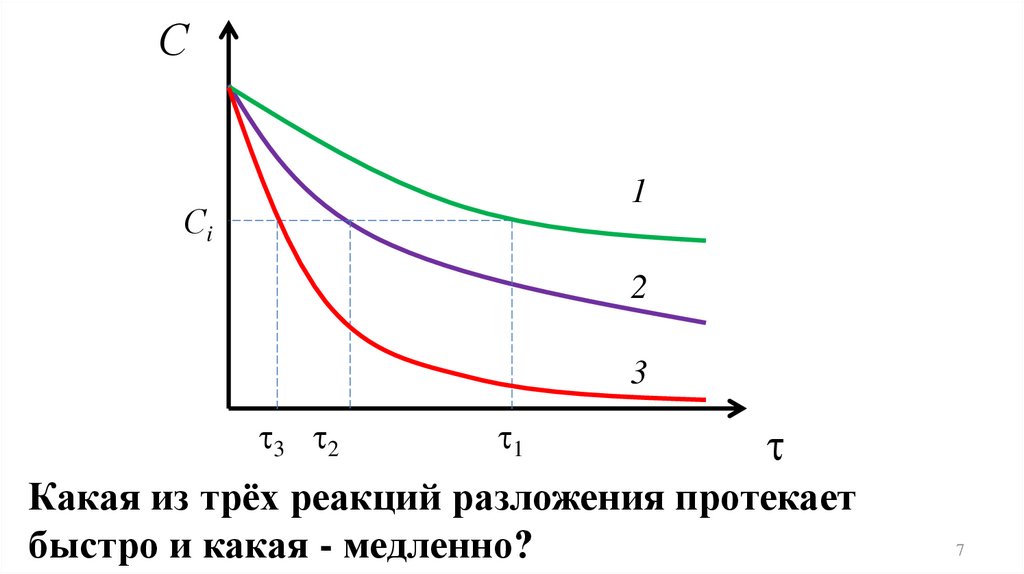
Какая из трёх реакций разложения протекает
быстро и какая - медленно?
7
8.
1.2.
3.
4.
5.
Скорость химической реакции
зависит от:
Природы реагирующих веществ
Концентрации реагирующих
веществ
Температуры
Поверхности раздела
Наличия катализатора
8
9.
Влияние природы реагирующих веществH2 + F2 = 2HF – протекает очень
быстро, со взрывом при комнатной t.
H2 + Br2 = 2HBr – протекает медленно,
даже при нагревании.
9
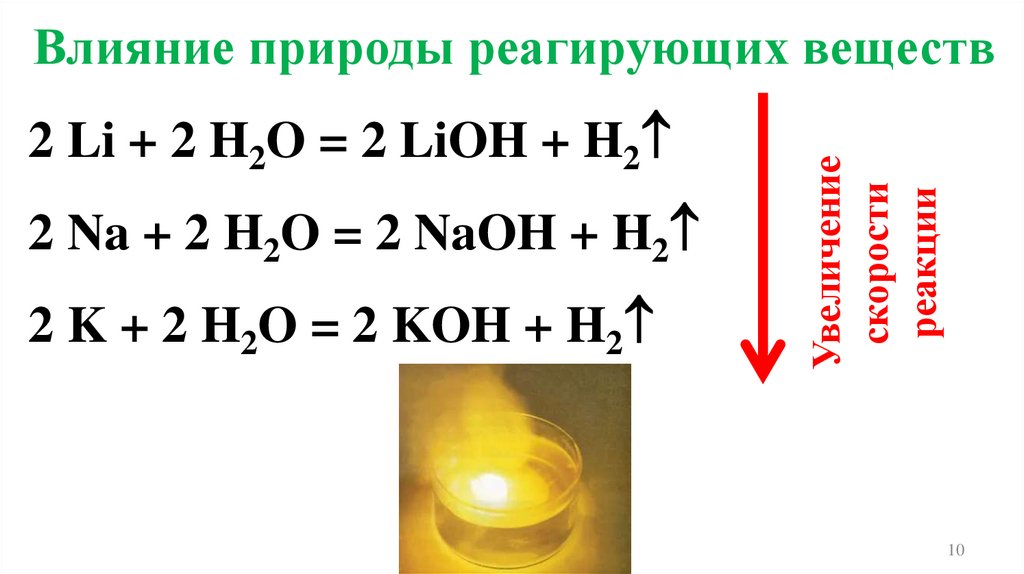
10.
2 Li + 2 H2O = 2 LiOH + H22 Na + 2 H2O = 2 NaOH + H2
2 K + 2 H2O = 2 KOH + H2
Увеличение
скорости
реакции
Влияние природы реагирующих веществ
10
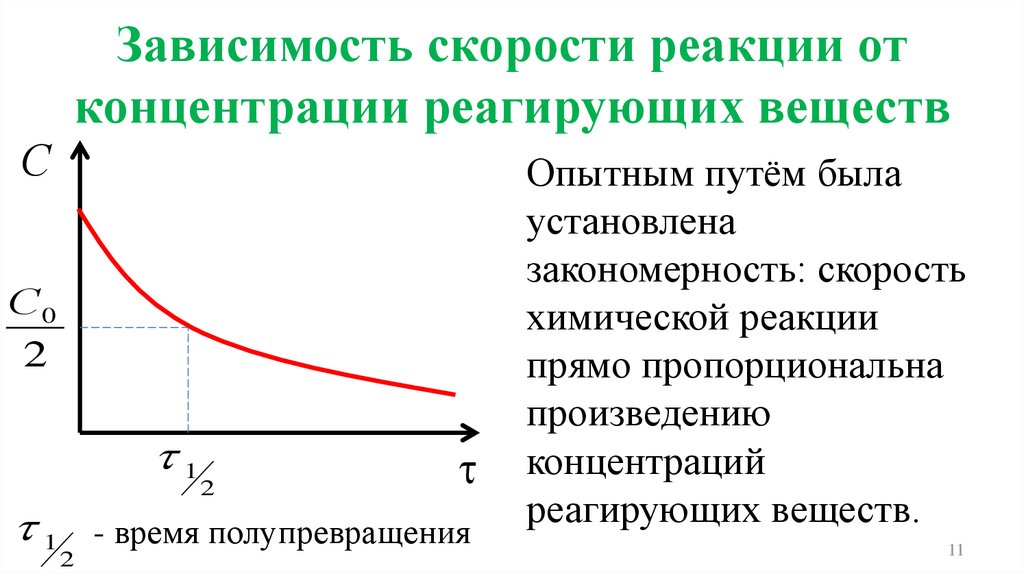
11.
Зависимость скорости реакции отконцентрации реагирующих веществ
С
С0
2
1
2
1 - время полупревращения
2
Опытным путём была
установлена
закономерность: скорость
химической реакции
прямо пропорциональна
произведению
концентраций
реагирующих веществ.
11
12.
Зависимость скорости реакции отконцентрации реагирующих веществ
Закон действия масс
(1867, Гильдберг, Вааге)
aА + bВ cС + dD
V = k A a B b
k – константа скорости реакции;
A и [B] – концентрации исходных веществ А и В.
Если A = [B] = 1 моль/л, то k = V
12
13.
Зависимость скорости реакции отконцентрации реагирующих веществ
Примеры.
N2 (г) + 3H2 (г) = 2NH3 (г)
V = k[N2][H2]3
Fe2O3 (к) + 3H2 (г) = 2Fe + 3H2O (г)
V = k[H2]3
13
14.
Зависимость скорости реакции отконцентрации реагирующих веществ
Как измениться скорость химической реакции от
разбавления реагирующей смеси в два раза?
Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + S
2С
С
Решение
V = k [Na2S2O3] [H2SO4]
До разбавления:[Na2S2O3] = 2а; [H2SO4] = 2b
V1 = k 2a 2b = 4k a b
После разбавления:[Na2S2O3] = а; [H2SO4] = b
V2 = k a b
Следовательно V1 = 4 V2
14
15.
Зависимость скорости реакции отконцентрации реагирующих веществ
Простейший способ определения зависимости скорости
реакции от концентрации реагирующих веществ.
Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + S
№
а мм
пп раствора
Na2S2O3
b мл
d мл
Конц-ция
Время появление
воды раствора
Na2S2O3
опалесценции
H2SO4 C=a/(a+b+d)
t, сек
Ск. х. р.
V = 40 / t
1
10
20
30
1/6
40
1
2
20
10
30
2/6
20
2
3
30
0
30
3/6
10
4
15
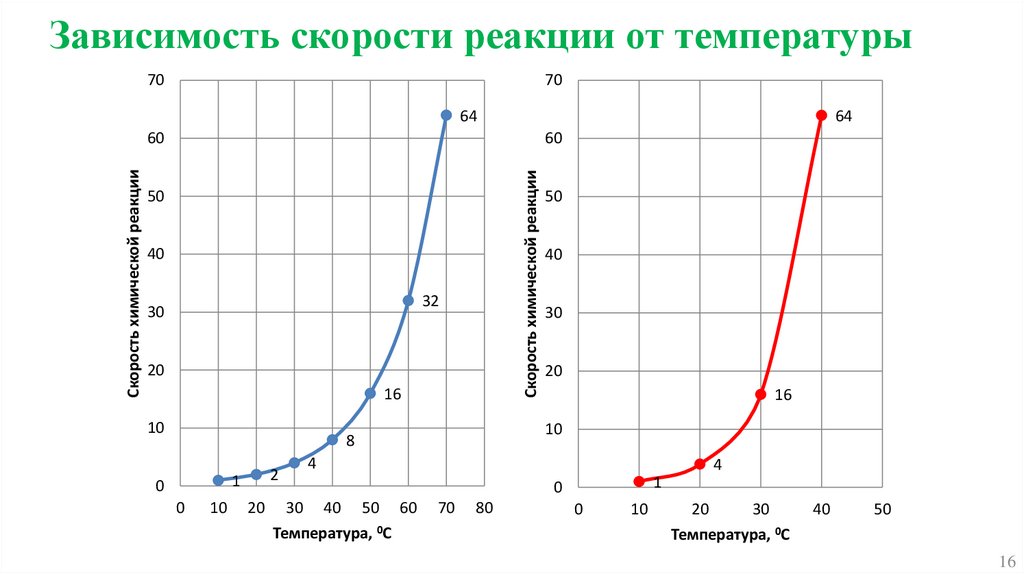
16.
Зависимость скорости реакции от температуры70
70
64
64
60
Скорость химической реакции
Скорость химической реакции
60
50
40
32
30
20
16
10
2
0
0
10
20
40
30
20
16
10
8
1
50
4
30 40 50 60
Температура, 0С
4
1
0
70
80
0
10
20
30
Температура, 0С
40
50
16
17.
Зависимость скорости реакции от температурыПравило Вант-Гоффа
При увеличении температуры на 10 С скорость
химической реакции увеличивается в 2 – 4 раза (в
среднем в 3 раза)
Vt 2 Vt 1
t 2 t1
10
Vt1 и Vt2 – скорость реакции при температуре t1 и t2 (t2 t1);
– температурный коэффициент скорости реакции. 17
18.
ПримерВо сколько раз увеличится скорость химической
реакции, при повышении температуры от 10 оС
до 40 оС, если температурный коэффициент
равен 3.
Решение:
Vt 2
Vt 1
t 2 t1
10
3
40 10
10
27 раз
18
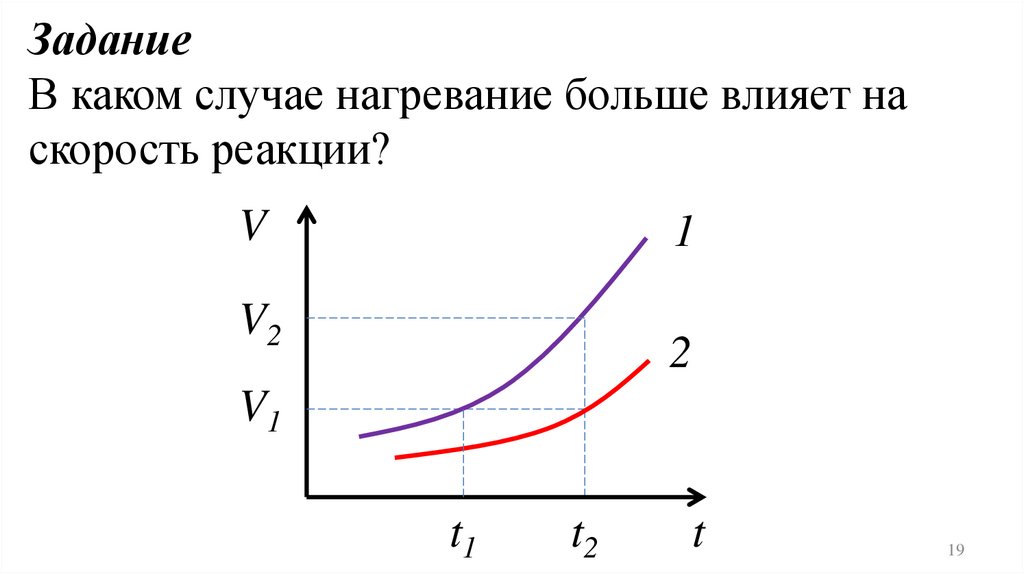
19.
ЗаданиеВ каком случае нагревание больше влияет на
скорость реакции?
V
1
V2
2
V1
t1
t2
t
19
20.
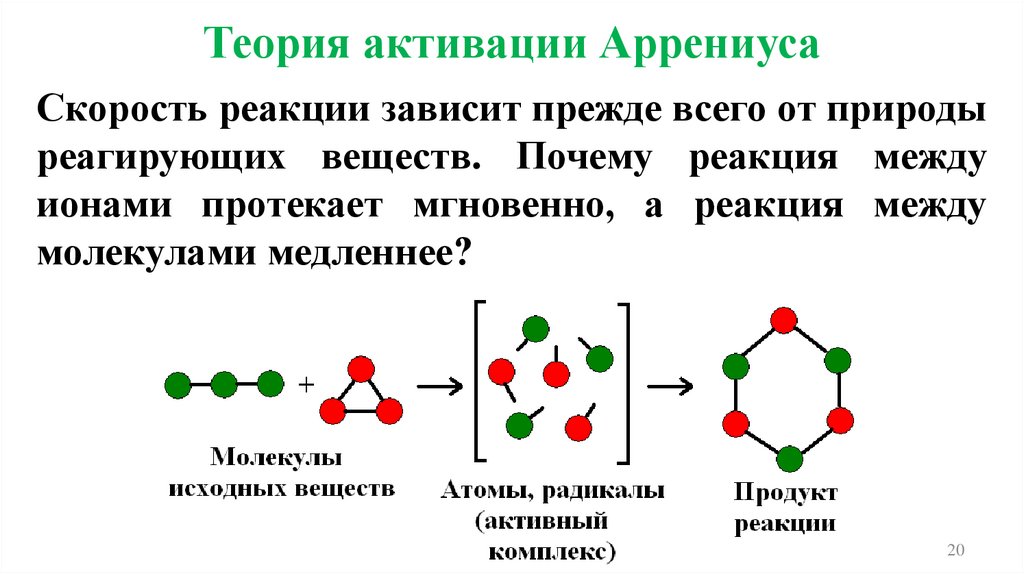
Теория активации АррениусаСкорость реакции зависит прежде всего от природы
реагирующих веществ. Почему реакция между
ионами протекает мгновенно, а реакция между
молекулами медленнее?
20
21.
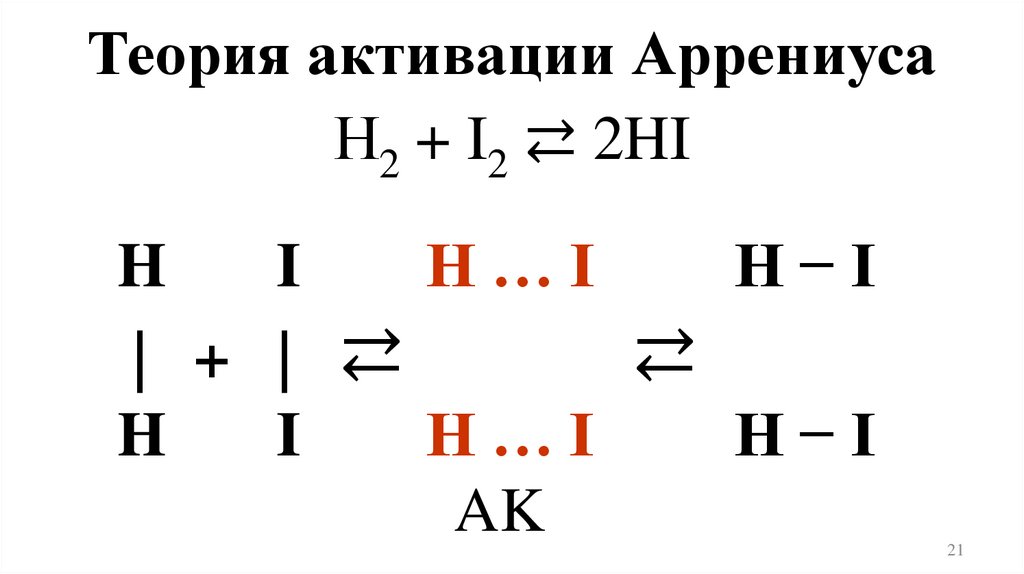
Теория активации АррениусаН2 + I2 ⇄ 2HI
H
I
H…I
H−I
| + | ⇄
⇄
H
I
H…I
H−I
AK
21
22.
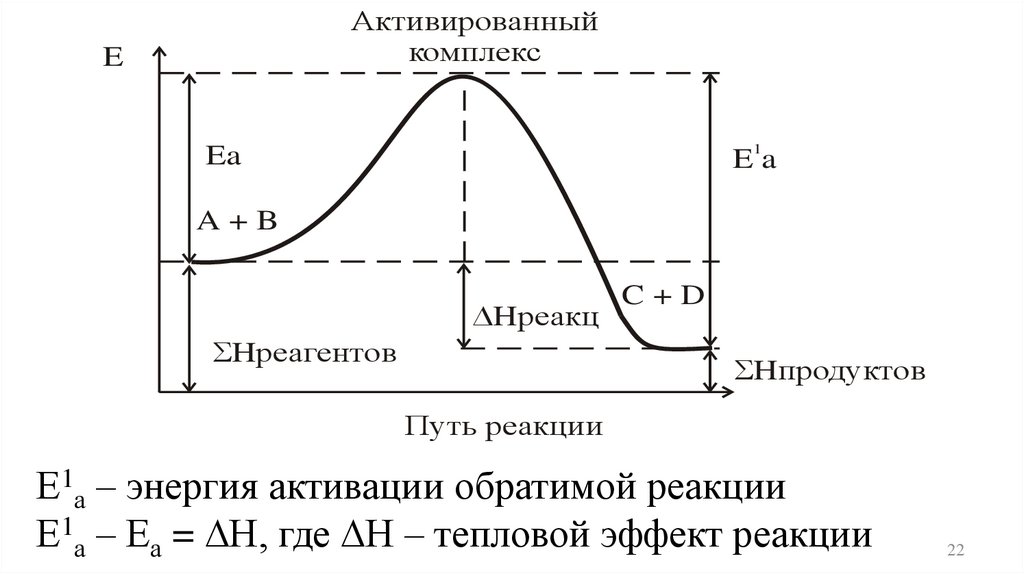
Активированныйкомплекс
E
1
Ea
Ea
A+B
Hреакц
Hреагентов
C+D
Hпродуктов
Путь реакции
Е1а – энергия активации обратимой реакции
Е1а – Еа = Н, где Н – тепловой эффект реакции
22
23.
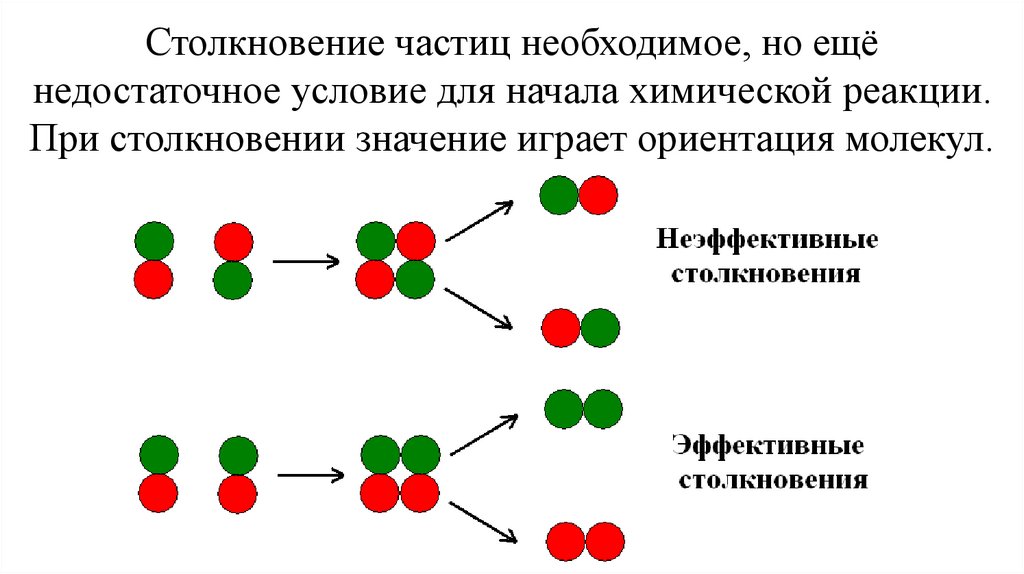
Столкновение частиц необходимое, но ещёнедостаточное условие для начала химической реакции.
При столкновении значение играет ориентация молекул.
24.
Формула Аррениусаk A e
Eа
RT
А – постоянный множитель, не зависящий от
температуры;
Еа – энергия активации;
R – универсальная газовая постоянная.
25.
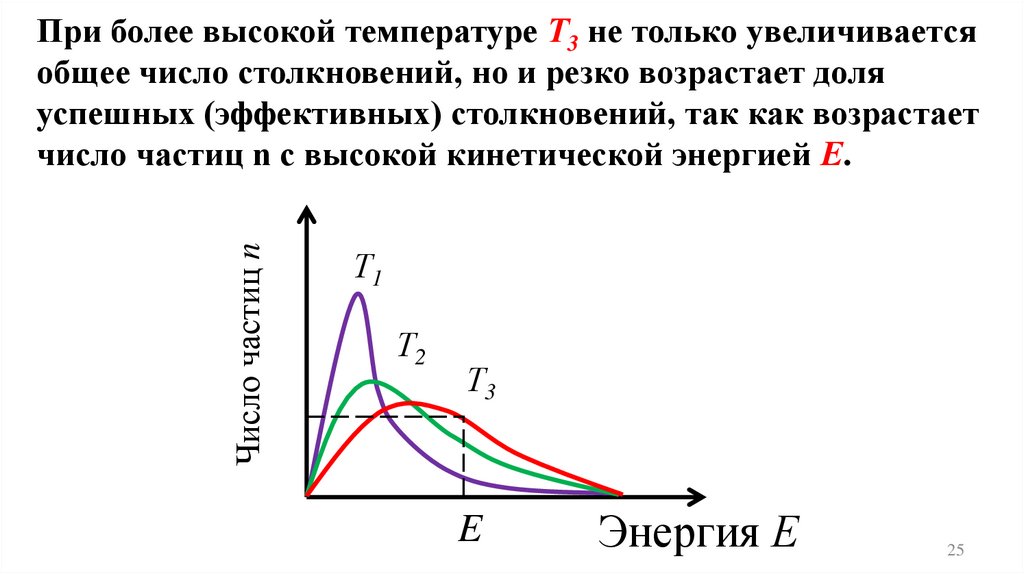
Число частиц nПри более высокой температуре Т3 не только увеличивается
общее число столкновений, но и резко возрастает доля
успешных (эффективных) столкновений, так как возрастает
число частиц n с высокой кинетической энергией Е.
Т1
Т2
Т3
E
Энергия Е
25
26.
Влияние поверхности реагирующих веществна скорость гетерогенной реакции
Гомогенные реакции
N2(газ) + O2(газ) = 2 NO(газ)
Гетерогенные реакции
Zn(тв) + 2 HCl(ж) = ZnCl2(ж) + Н2(газ)
26
27.
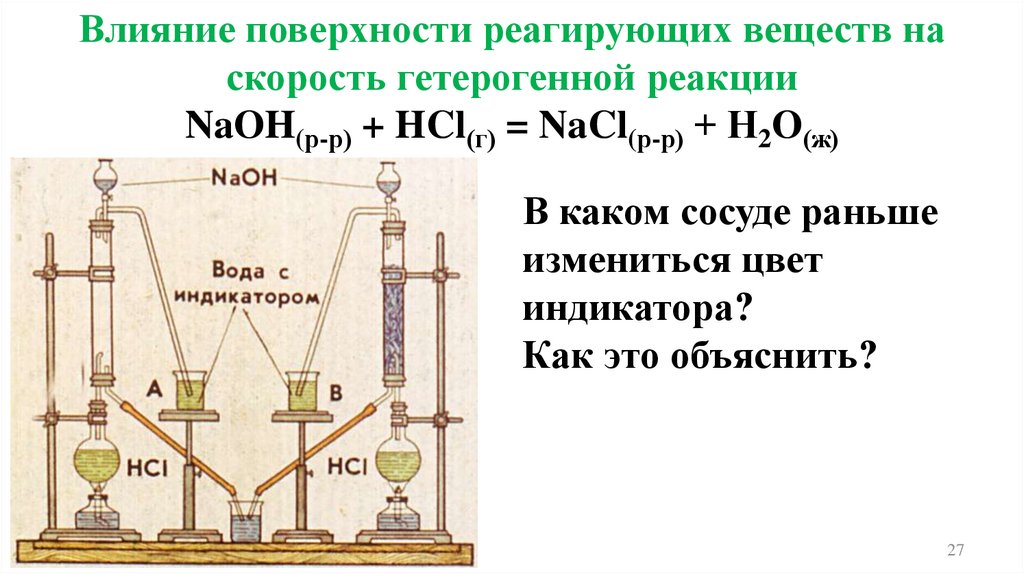
Влияние поверхности реагирующих веществ наскорость гетерогенной реакции
NaOH(р-р) + HCl(г) = NaCl(р-р) + Н2O(ж)
В каком сосуде раньше
измениться цвет
индикатора?
Как это объяснить?
27
28.
Влияние катализатора на скоростьхимической реакции
гомогенный катализ
NO
SO2 + 0,5O2 = SO3
0,5 O2 + NO = NO2
NO2 + SO2 = SO3 + NO
гетерогенный катализ
2 H O + O
2H2O2 MnO
2
2
2
28
29.
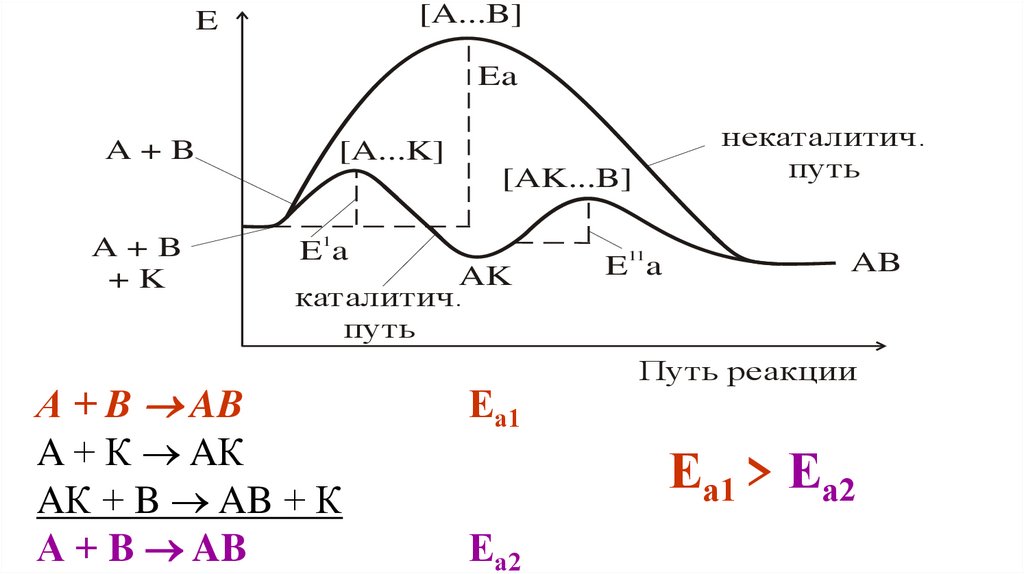
[A...B]E
Ea
A+B
некаталитич.
путь
[A...K]
[AK...B]
A+B
+K
E1a
AK
каталитич.
путь
А + B AB
A + К AК
AК + B AB + К
А + B AB
Еа1
E11a
AB
Путь реакции
Еа1 > Еа2
Еа2
30.
Механизм химических реакций• простые (молекулярные) реакции
Еа = 120 – 440 кДж/моль
Одномолекулярная (мономолекулярная)
СаСО3 СаО + СО2
Двухмолекулярная (бимолекулярная)
2HI H2 + I2
30
31.
• ионные реакцииCl– + Ag+ = AgCl
Еакт = 0 – 80 кДж/моль
31
32.
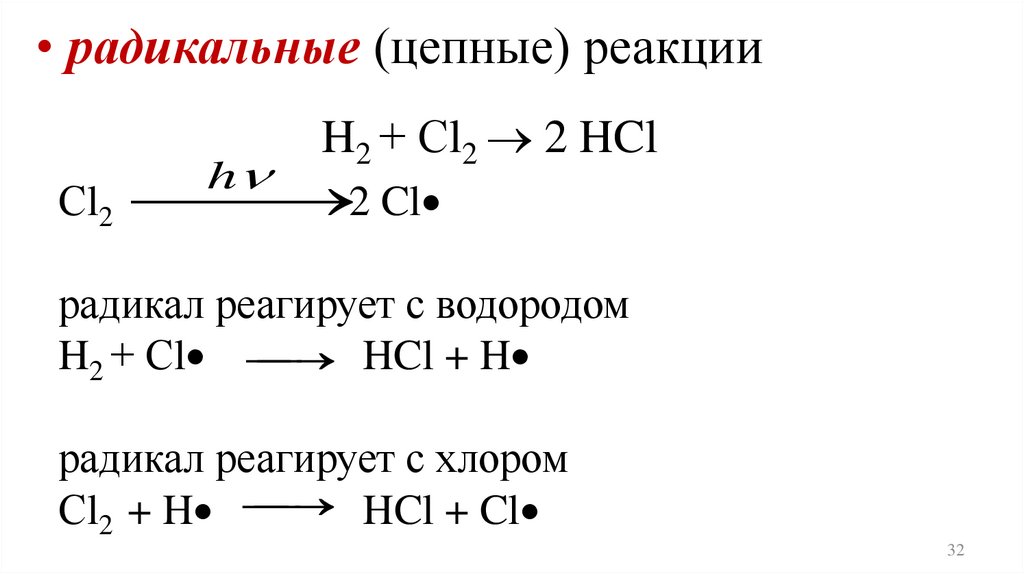
• радикальные (цепные) реакцииh
H2 + Сl2 2 HCl
Сl2 2 Cl
радикал реагирует с водородом
HCl + H
H2 + Сl
радикал реагирует с хлором
HCl + Cl
Сl2 + H
32
33.
Химическое равновесиеНеобратимые реакции
BaCl2 + H2SO4 BaSO4 + 2HCl
Обратимые реакции
3H2 + N2 ⇄ 2NH3
прямая реакция
обратная реакция
34.
аА + вВсС + dD
V = k [A]a [B]b
c [D]d
[C]
V= k
В условиях равновесия скорости
прямой и обратной
реакции
равны:
V = V
a [B]b =
c [D]d
[A]
[C]
k
k
35.
Константа равновесия:k
[C ] [ D]
c
d
КР
a
b
[ A] [ B]
k
36.
Принцип Ле Шателье (1884)Если на систему, находящуюся в
равновесии, оказывается воздействие, то
равновесие данной системы смещается в
сторону той реакции, которая это
воздействие ослабевает.
37.
Влияние концентрации веществ наравновесие
BiCl3 + H2O BiOCl + 2 HCl
оксихлорид
висмута
1) +H2O равновесие смещается (образуется BiOCl)
2) +HCl равновесие смещается (образуется BiCl3)
38.
Влияние температуры3 H2 + N2 ⇄ 2 NH3
Hо = –92 кДж/моль
реакция экзотермическая
Для экзотермической реакции Hо 0
При tо равновесие смещается
При tо равновесие смещается
39.
Для эндотермической реакций Hо 0При tо равновесие смещается
При tо равновесие смещается
40.
Влияние давления3 H2(г) + N2(г) ⇄ 2 NH3(г)
4 моля газа > 2 моля газа
объем газа V1 > объем газа V2
При P равновесие смещается в сторону
уменьшения объема газа
При P равновесие смещается в сторону
увеличения объема газа
41.
Пример.В каком направлении должно смещаться равновесие в
реакции:
N2O4 (г)
2 NO2 (г)
1 моль газа
2 моль газа
при
а) добавлении N2O4 →
б) удалении NO2 →
в) повышении давления ←
г) увеличении объема →
д) понижении температуры ←
Hо 0
реакция
эндотермическая
42.
Выполните задания1. Смешали 1 л раствора уксусной кислоты с 2 л раствора
этилового спирта. До смешивания концентрация уксусной
кислоты и этилового спирта были равны 0,6 моль/л.
Определите концентрации спирта и кислоты в первый
момент после смешения.
2. Напишите математические выражения для скоростей
следующих реакций:
2 Al + 3 Cl2 = 2 AlCl3
2 CO + O2 = 2 CO2.
3. Как измениться скорость реакции между оксидом серы
(IV) и кислородом, если уменьшить объём газовой смеси в
три раза?
43.
Выполните задания4. Газовая смесь состоит из водорода и хлора. Реакция
идёт по уравнению
H2 + Cl2 = 2 HCl.
Как изменится скорость реакции, если увеличить давление
в три раза?
5. Как изменится скорость реакции
2 NO + O2 = 2 NO2
протекающей в закрытом сосуде, если увеличить давление в
четыре раза?
44.
Выполните задания6. Взаимодействие между оксидом углерода (II) и хлором
идёт по уравнению
CO + Cl2 ⇄ COCl2.
Начальные концентрации оксида углерода (II) и хлора
равны соответственно 0,3 моль/л и 0,2 моль/л. Как
изменится скорость прямой реакции, если увеличить
концентрацию хлора до 0,6 моль/л, а концентрацию оксида
углерода (II) до 1,2 моль/л?
7. Как изменится скорость реакции при увеличении
температуры на 50 С, если температурный коэффициент
равен 2.
45.
Выполните задания8. При 150 С некоторая реакция заканчивается в 16 мин.
Принимая температурный коэффициент реакции равным
2,5 рассчитайте, через сколько минут закончилась бы эта же
реакция при 200 С и при 80 С.
9. Обратимая реакция выражается уравнением
А+2В⇄С
При установившемся равновесии концентрации
участвующих в нём веществ равнялись [А] = 0,6 моль,
[В] = 1,2 моль/л, [С] = 2,16 моль/л. Вычислите константу
равновесия и исходные концентрации веществ.
46.
Выполните задания10. Константа равновесия для реакции
CO2 + H2 ⇄ СO + H2O
При 850 С равна единице. Исходные концентрации
углекислого газа и водорода равны соответственно
0,2 моль/л и 0,8 моль/л. Определите, при каких
концентрациях всех четырёх веществ установится
равновесие.
11. В какую стороны сместится равновесие реакции
CO + H2O ⇄ CO2 + H2 + 42,7 кДж
а) при понижении температуры; б) при повышении
давления?






























 chemistry
chemistry








