Similar presentations:
2025г_лекция_5_Физико_химия_поверхостных_явлений_в_функционировании
1.
Физико-химияповерхностных
явлений в
функционировании
живых систем
2.
Поверхностные явления –процессы, протекающие на
границе раздела фаз и
обусловленные
особенностями состава и
структуры поверхностей.
3.
Поверхностное натяжениеG
S P ,T ,n
[Дж/м2]
Физический смысл :
1) Энергия
(Дж/м2)
2) Сила
(Н/м)
Н2О
= 72,75 10-3 Дж/м2 при 298о К
4.
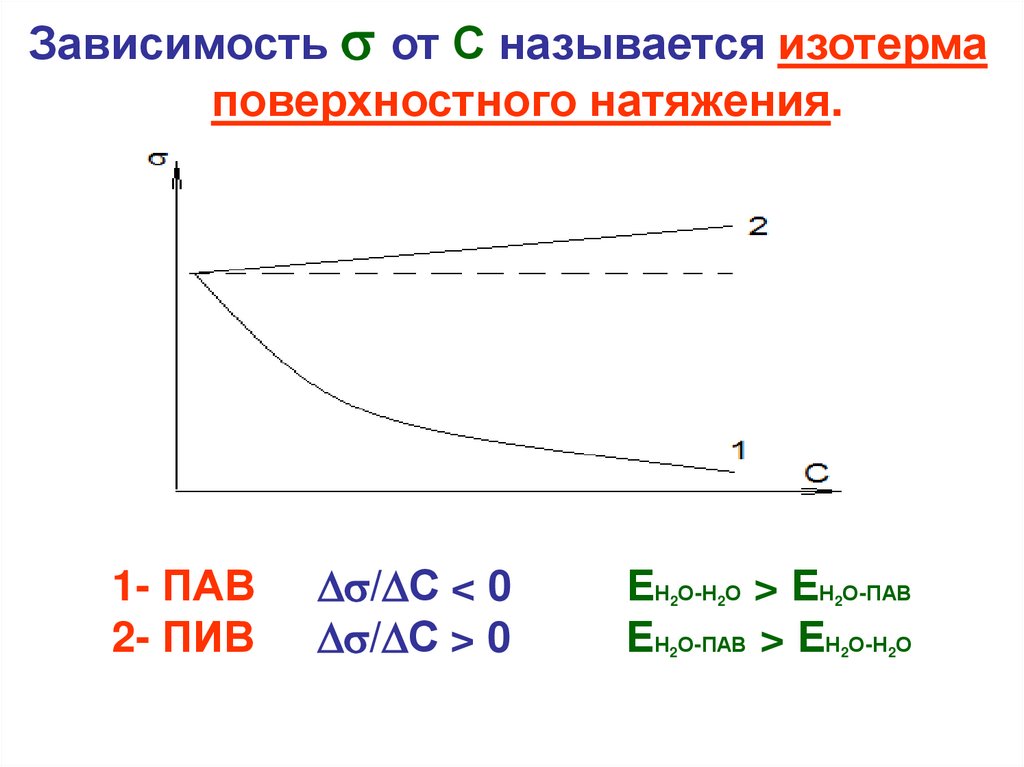
Зависимость от С называется изотермаповерхностного натяжения.
1- ПАВ
2- ПИВ
/ С < 0
/ С > 0
ЕН О-Н О > ЕН О-ПАВ
ЕН О-ПАВ > ЕН О-Н О
2
2
2
2
2
2
5.
Поверхностная активность –способность растворенных
веществ изменять
поверхностное натяжение.
Мера поверхностной активности
G=-(d /dC) или G=-( δ/ C)
6.
Уравнение Шишковского= о – В ln(1+AC),
С – концентрация ПАВ, A,B - const
Определение
:
1) статические
2) полустатические
3)динамические
7.
Правило Дюкло-Траубе:= Gn+1 / Gn = 3 3,5
(для спиртов и карбоновых
кислот)
8.
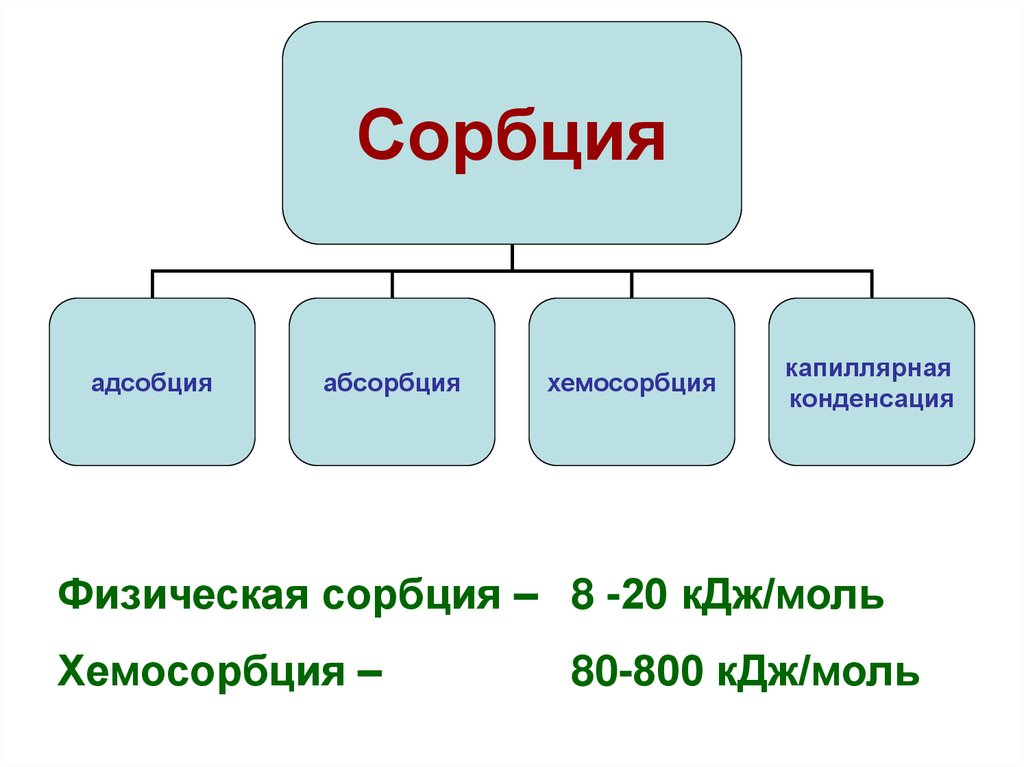
Сорбцияадсобция
абсорбция
хемосорбция
капиллярная
конденсация
Физическая сорбция – 8 -20 кДж/моль
Хемосорбция –
80-800 кДж/моль
9.
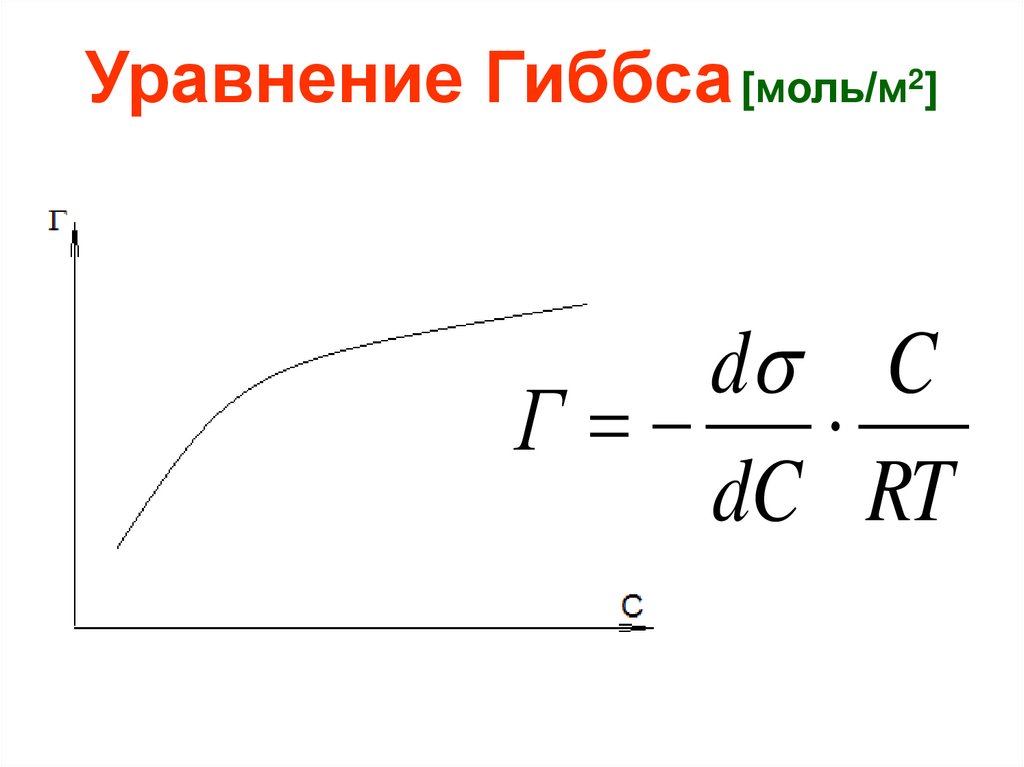
Уравнение Гиббса [моль/м2]d C
Г
dC RT
10.
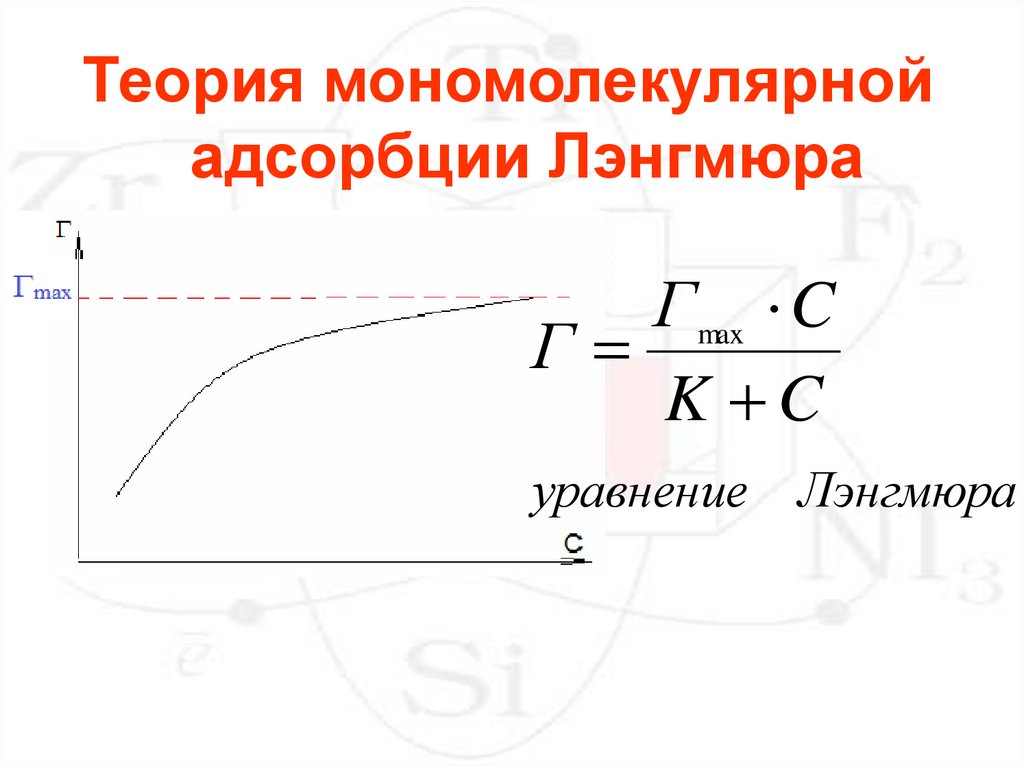
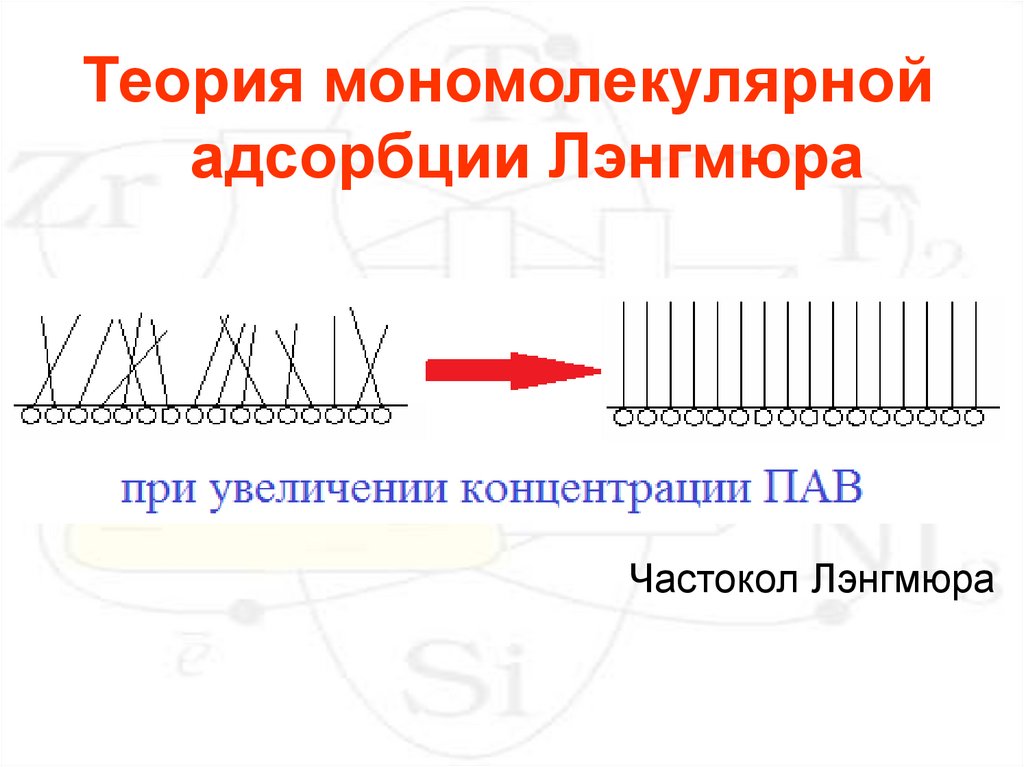
Теория мономолекулярнойадсорбции Лэнгмюра
Г max C
Г
K C
уравнение Лэнгмюра
11.
Теория мономолекулярнойадсорбции Лэнгмюра
Частокол Лэнгмюра
12.
Линеаризация уравненияЛэнгмюра
1
1
k 1
Г Г max Г max C
( y a bx)
13.
По величине Гmax можнорассчитать So и l молекул ПАВ
в мономолекулярном слое
1
So
;
Г max N A
l
Г max M
M – молярная масса, ρ - плотность
14.
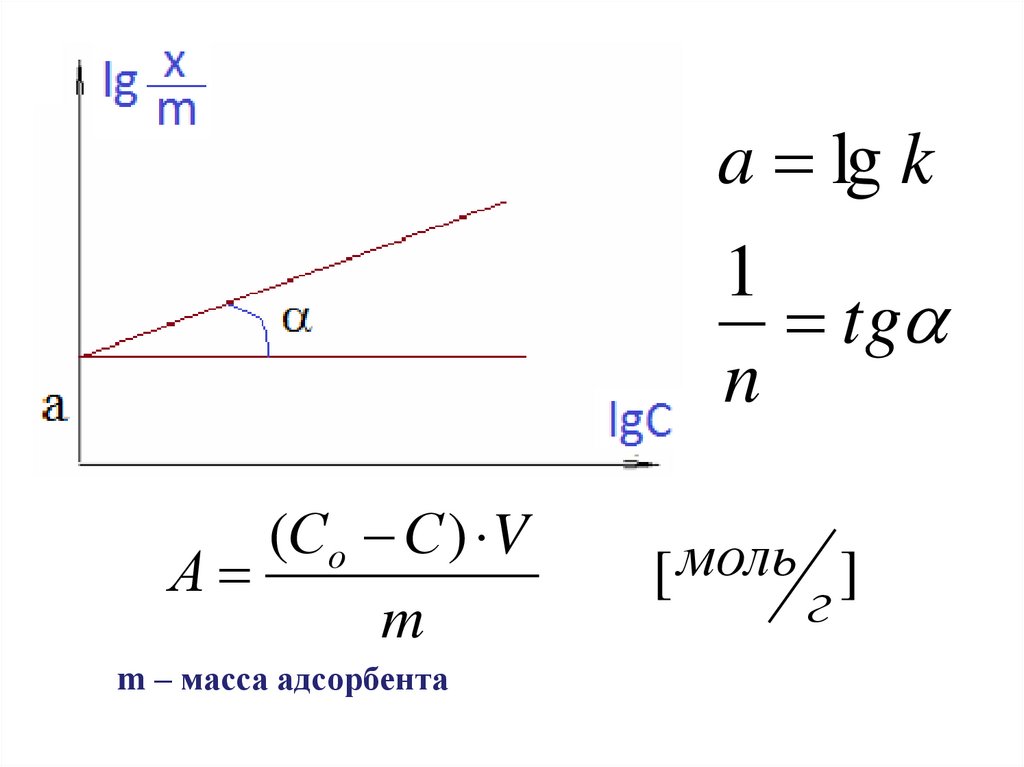
Адсорбция на твердых сорбентахУравнение Фрейндлиха
1
х
n
А k C ,
m
n 0,1 1;
x
[ A] [ моль ]; lg lg k 1 lg C
г
n
m
K,n – const; C – молярная концентрация
15.
a lg k1
tg
n
(Со С ) V
А
m
m – масса адсорбента
[ моль ]
г
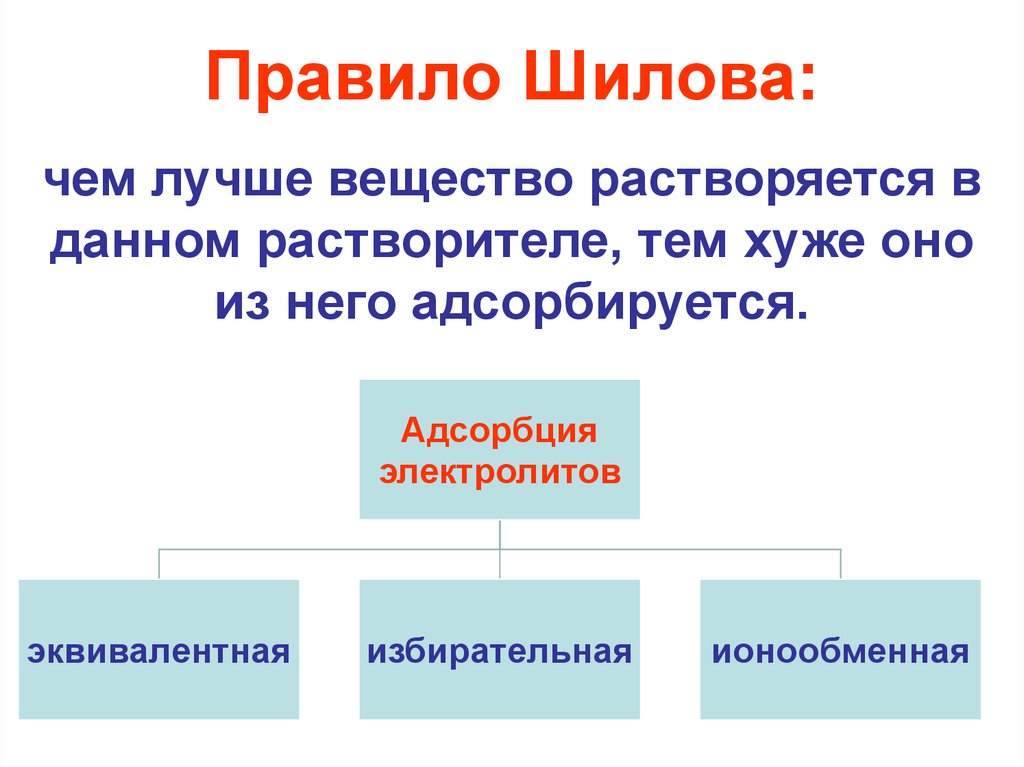
16.
Правило Шилова:чем лучше вещество растворяется в
данном растворителе, тем хуже оно
из него адсорбируется.
Адсорбция
электролитов
эквивалентная
избирательная
ионообменная
17.
Правило Панета-Фаянса:из всех ионов в растворе
в первую очередь
адсорбируются те, которые
входят в состав сорбента, или
имеют с ним общие группы.
18.
33
R SO H M R SO M H
на катионите
3 3
3 3
R N (CH ) OH A R N (CH ) A OH
на анионите
ИОНИТЫ
катиониты
аниониты
амфолиты
Обменная емкость ионита - ммоль ионов
на 1 г сухого и 1 мл набухшего ионита
19.
Адсорбция лежит в основеважнейших биологических
процессов:
1) с адсорбции начинается поглощение
различных веществ клетками и тканями
организма
2) взаимодействие ферментов с субстратами
для протекания ферментативных реакций
3) адсорбция является основным физикохимическим механизмом работы иммунной
системы (образование комплекса «антигенантитело»)
20.
4) удаление из крови различныхтоксических веществ, вирусов, бактерий
(гемосорбция)
5) удаление токсинов из ЖКТ (альмагель,
фосфолюголь и др.)
6) ПАВ вводится в лекарственные
препараты для улучшения всасывания
(конферон)
21.
Типы сорбентов, использующихсядля удаления различных веществ
Вещество
Сорбент
Фенол, гепарин
Аниониты с четвертичными и
фосфониевыми основаниями
Билирубин
Активные угли
Креатинин
Алюмосиликаты
Холестерин
Макропористые и
биоспецифические сорбенты
22.
Для очистки крови больныхспидом применяют силикатную
матрицу с введенными в ее
структуру амино- или
карбоксильными группами.
Явление адсорбции лежит в
основе хроматографии
(М.С. Цвет, 1904 г.)
23. Хроматография – область науки, изучающая процессы, основанные на перемещении зоны вещества вдоль слоя сорбента в потоке
подвижнойфазы и связанные с
многократным повторением
сорбционных и десорбционных
актов
24. «Хроматография – цветозапись» 1903 г. М.С. Цвет
г. Воронеж. Экскурсия у могилы основателя хроматографии М.С. Цвета25.
Эксперимент М.С. Цвета поразделению хлорофилла
(адсорбент СаСО3)
1 – бесцветная зона (коллоидное примеси)
2 – желтая зона (ксантофилл )
3 – желто-зеленая зона (хлорофиллин )
4 – Зелено-синяя зона (хлорофиллин )
5 – желтая зона (ксантофилл)
6 – желтая зона (ксантофилл )
7 – желтая зона (ксантофилл )
8 – серо-стальная зона (хлорофиллин)
26. Подвижная фаза (ПФ) – газ или жидкость. Неподвижная фаза (стационарная фаза) (НФ) – твердое тело, жидкость (сорбент).
Необходимые условия:1. Наличие ПФ и НФ.
2. Многократные повторения актов
сорбции и десорбции.
3. Равновесие «сорбция ↔десорбция»
должно устанавливаться быстро
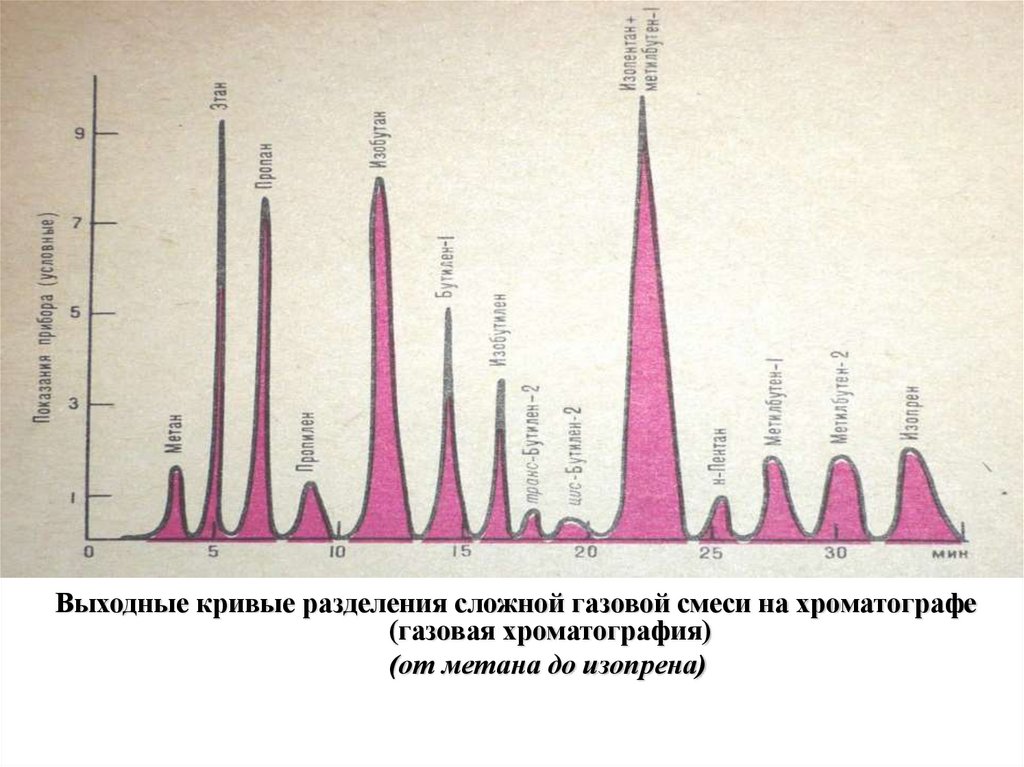
27.
Выходные кривые разделения сложной газовой смеси на хроматографе(газовая хроматография)
(от метана до изопрена)
28.
Хроматограмма образцов героинаа- и б- идентичные образцы, в- другой источник приобретения
1 – кофеин,
2 – фенобарбитон,
3 – метаквалон,
4 – ацетилморфин,
5 – деаморфин,
6 – папаверин,
7 - наркотин
29.
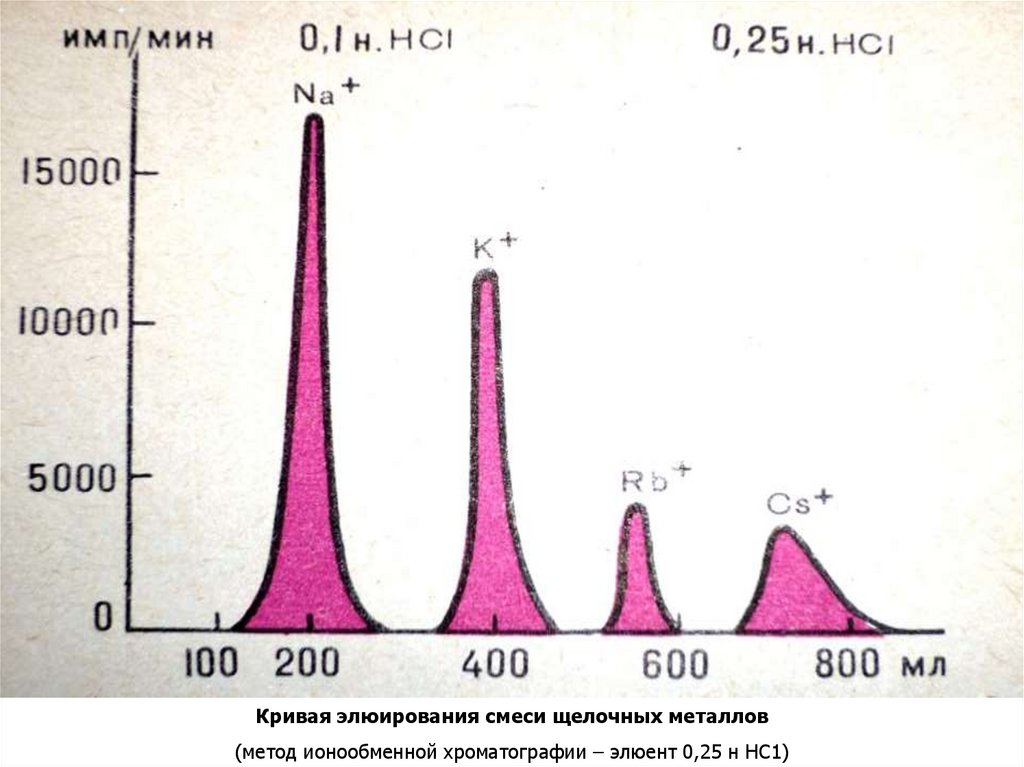
Кривая элюирования смеси щелочных металлов(метод ионообменной хроматографии – элюент 0,25 н НС1)
30.
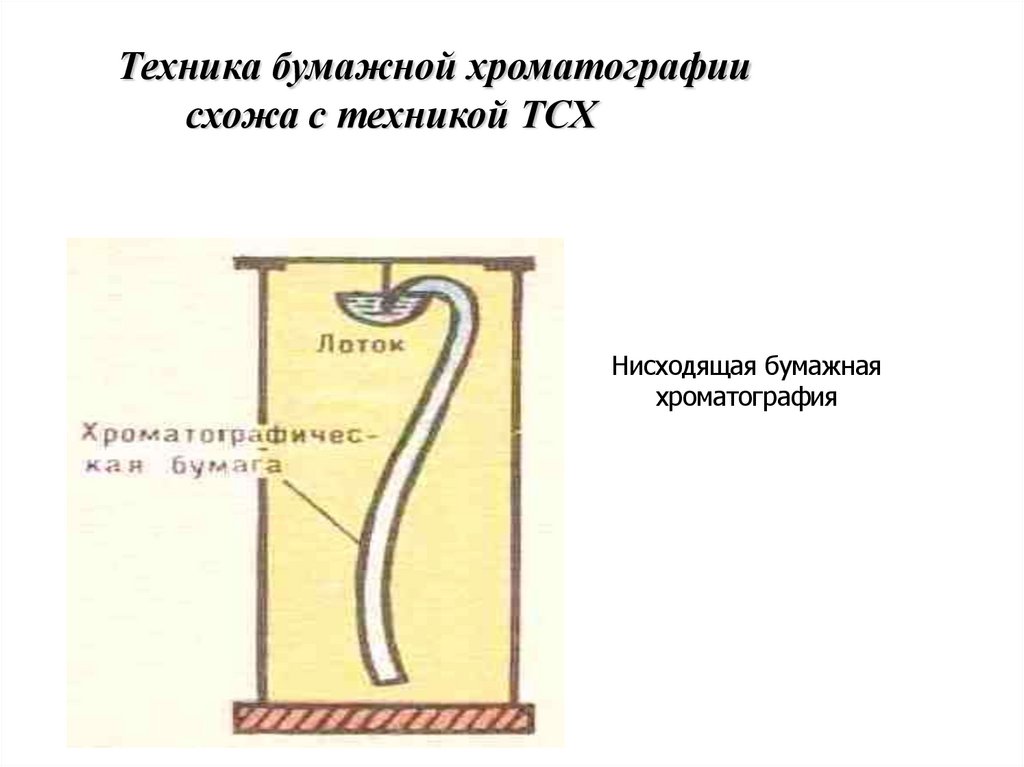
Техника бумажной хроматографиисхожа с техникой ТСХ
Нисходящая бумажная
хроматография
31.
Высочайшая чувствительностьДиапазон рабочих температур
Температура источника ионов - до 350 °C
Температура переходной линии ГХ-МС - до 400 °C
Производитель
Хроматэк, Россия





















 chemistry
chemistry








