Similar presentations:
практикум по решению задач № 8
1. Физика
ГранкинаЛюдмила Михайловна
2.
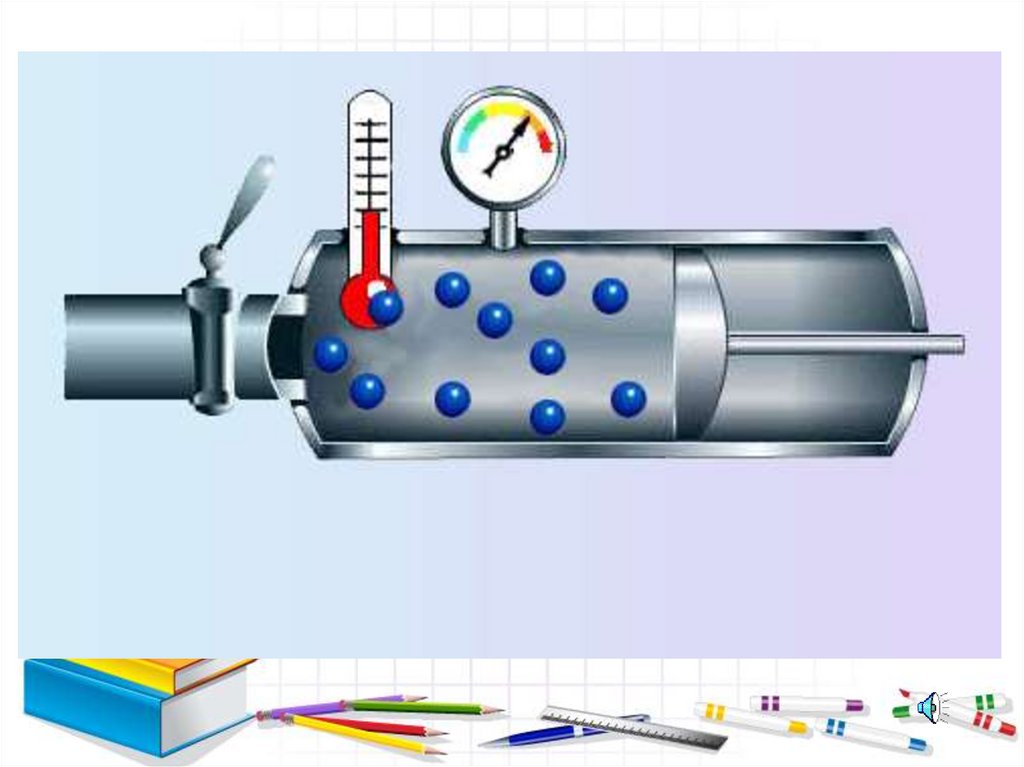
Идеальный газИзвестно, что частицы в газах, в отличие от
жидкостей и твердых тел, располагаются друг
относительно друга на расстояниях, существенно
превышающих их собственные размеры. В этом
случае
взаимодействие
между
молекулами
пренебрежимо мало и кинетическая энергия
молекул много больше энергии межмолекулярного
взаимодействия. Для выяснения наиболее общих
свойств, присущих всем газам, используют
упрощенную модель реальных газов – идеальный
газ
3. Идеальный газ-(модель)-газ, взаимодействие между молекулами которого пренебрежимо мало
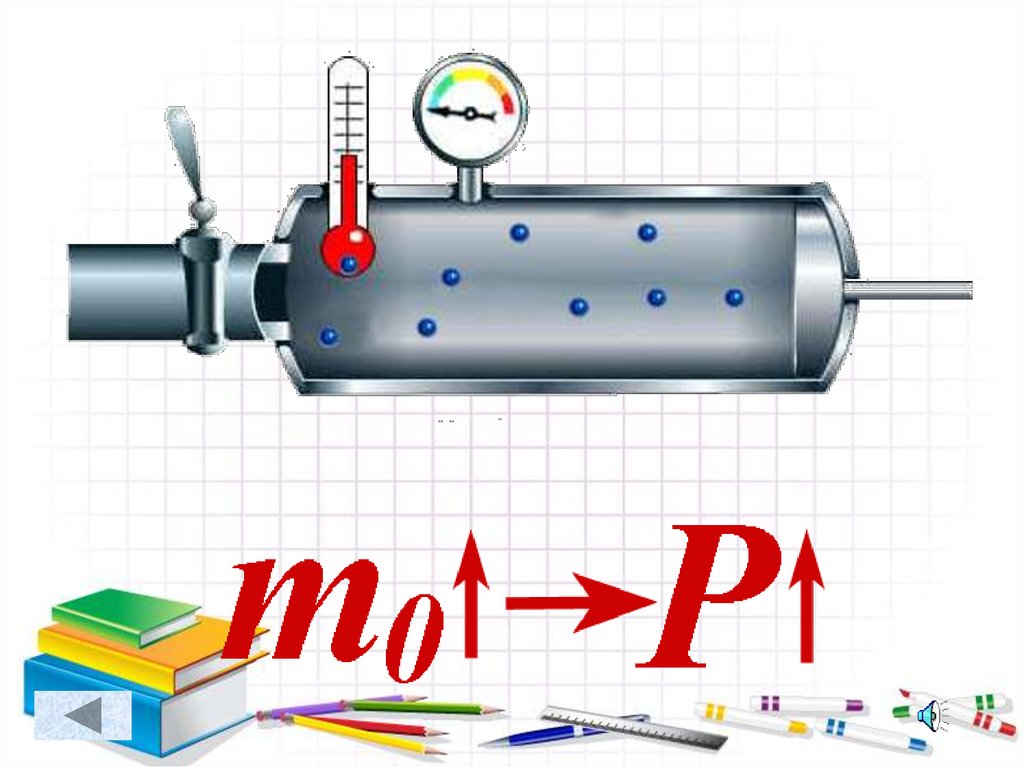
1. Совокупность большого числа молекул массой m0,размерами молекул пренебрегают (принимают молекулы
за материальные точки).
2. Молекулы находятся на больших расстояниях друг от
друга и движутся хаотически.
3. Молекулы взаимодействуют по законам упругих
столкновений , силами притяжения между молекулами
пренебрегают.
4. Скорости молекул разнообразны, но при определенной
температуре средняя скорость молекул остается
постоянной.
4.
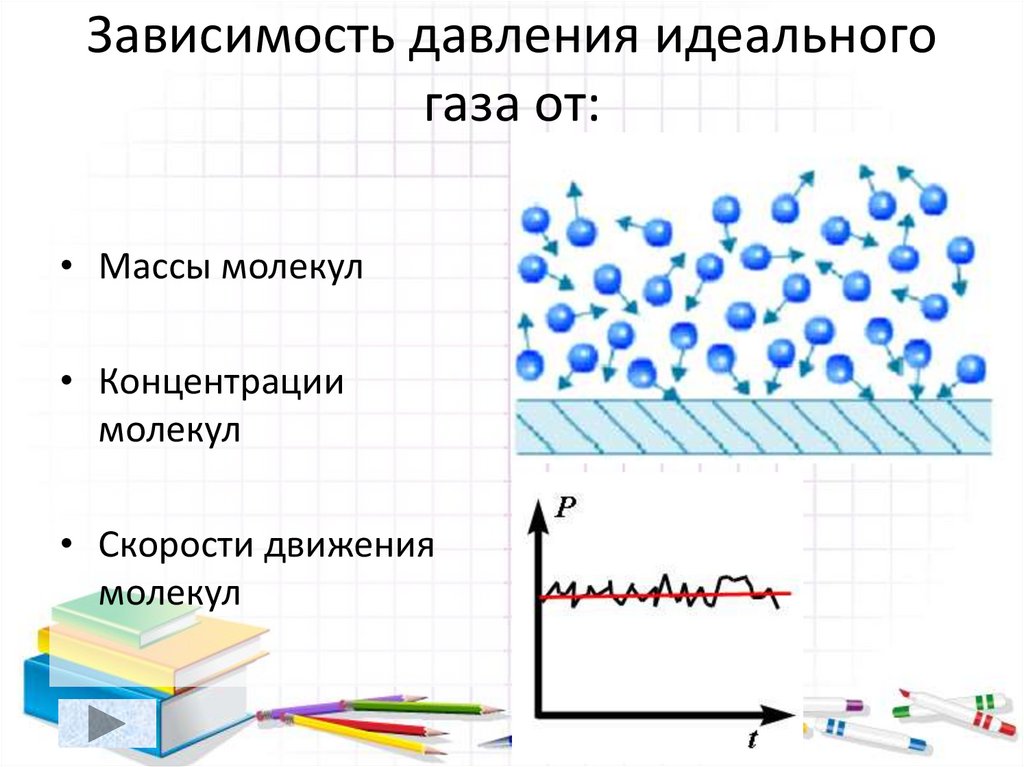
5. Зависимость давления идеального газа от:
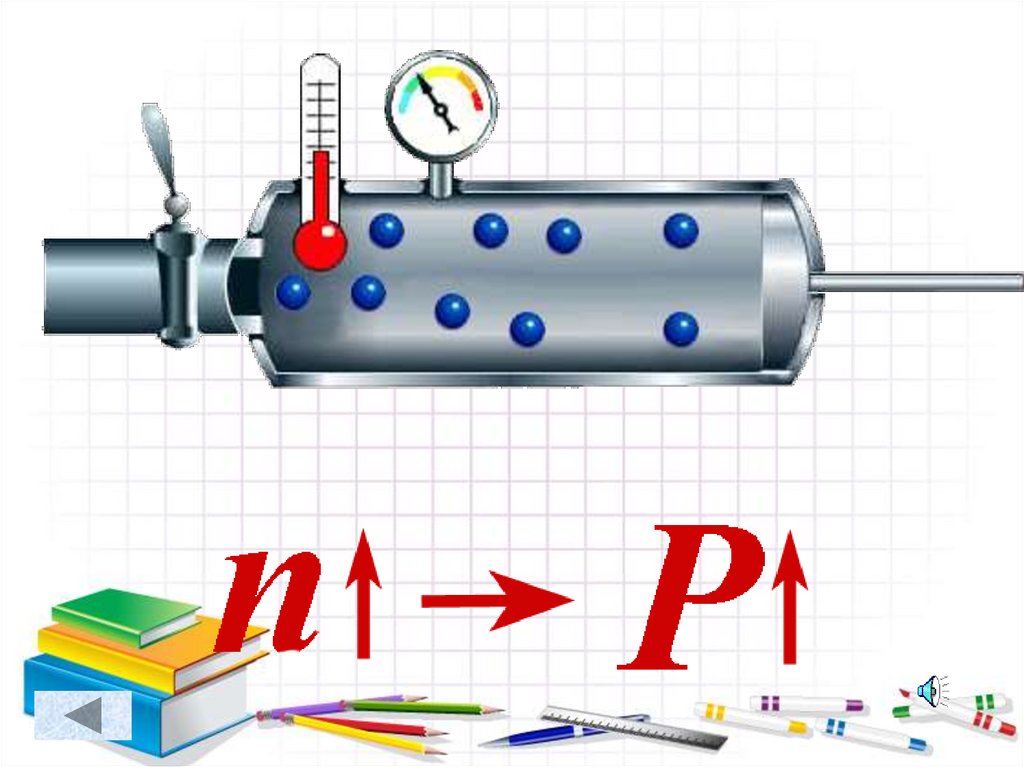
• Массы молекул• Концентрации
молекул
• Скорости движения
молекул
6.
7.
8.
9.
10.
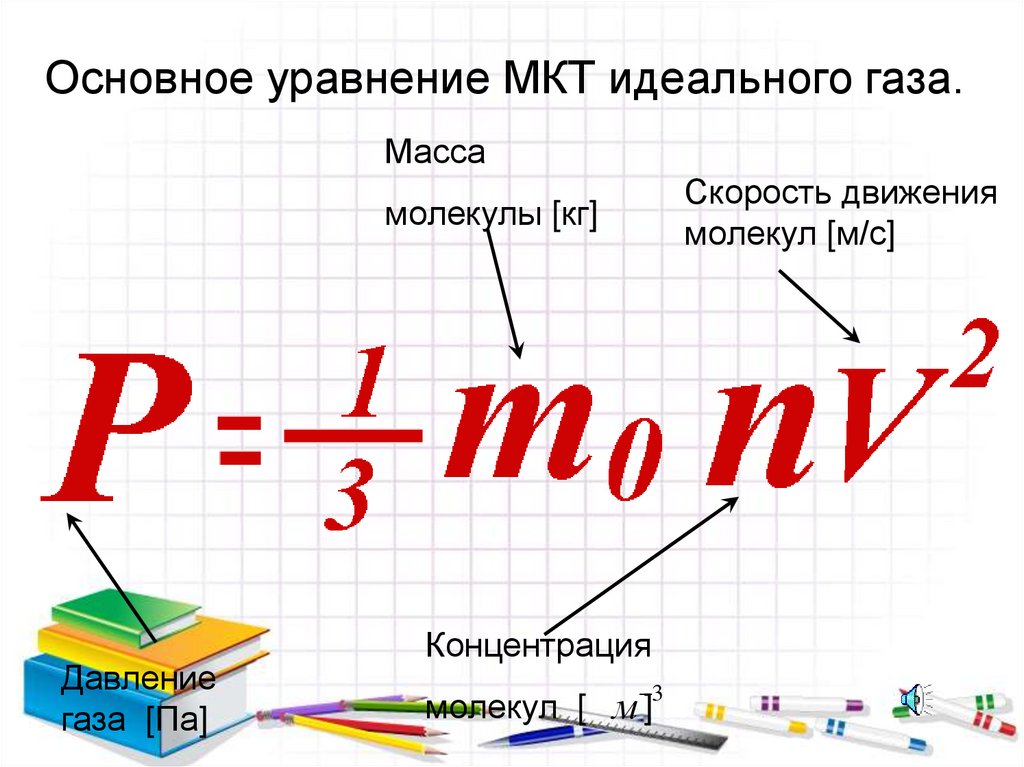
Основное уравнение МКТ идеального газа.Масса
Скорость движения
молекул [м/с]
молекулы [кг]
Давление
газа [Па]
Концентрация
3
молекул [ м ]
11. Как изменится давление газа на стенки сосуда, если:
• масса молекулы увеличится в 3 раза• концентрация молекул уменьшится в 4 раза
• скорость движения молекул увеличится в 2 раза
• объем увеличится в 5 раз
• масса молекулы уменьшится в 4 раза, а концентрация
увеличится в 2 раза
• масса молекулы увеличится в 2 раза, а скорость
движения молекул увеличится в 3 раза
• концентрация молекул увеличится в 3 раза, скорость
движения молекул уменьшится в 3 раза
12. Связь давления со средней кинетической энергией
13.
m0 VЕ
2
2
Средняя кинетическая
энергия
поступательного
движения молекулы
m
V
2
2
1
0
2
n
P m0 nV 3 nE
2
2
3
2
14.
Связь давления с плотностью газа.m0 n
Масса молекулы
Плотность газа
2
1
P m0 n V
3
Концентрация
молекул
15. Температура и тепловое равновесие
• Макроскопические параметры (макропараметры)– величины, характеризующие состояние
макроскопических тел без учета молекулярного
строения. (V, p, t ).
• Тепловым равновесием называют такое
состояние, при котором все макроскопические
параметры всех тел системы остаются
неизменными сколь угодно долго.
16. Температура и тепловое равновесие
• Любое макроскопическое тело или группамакроскопических тел при неизменных внешних
условиях самопроизвольно переходит в состояние
теплового равновесия.
• Все тела системы, находящиеся друг с другом в
тепловом равновесии имеют одну и ту же
температуру.
17. Температура и тепловое равновесие
• Термометр – прибор для измерения температурытела.
• Термометр входит в состояние теплового
равновесия с исследуемым телом и показывает
свою температуру.
18. Температура и тепловое равновесие
• Основная деталь термометра – термометрическоетело, то есть тело, макропараметры которого
изменяются при изменении температуры.
(Например, в ртутных термометрах
термометрическим телом является ртуть – при
изменении температуры изменяется ее объем.)
19. Температура и тепловое равновесие
• Изобретателем термометра является Галилео Галилей(ок. 1600 г.)
• Термометрическим телом в его термометре являлся
газ – при повышении температуры его объем
увеличивался, вытесняя жидкость.
• Недостатком термометра Галилея являлось
отсутствие температурной шкалы.
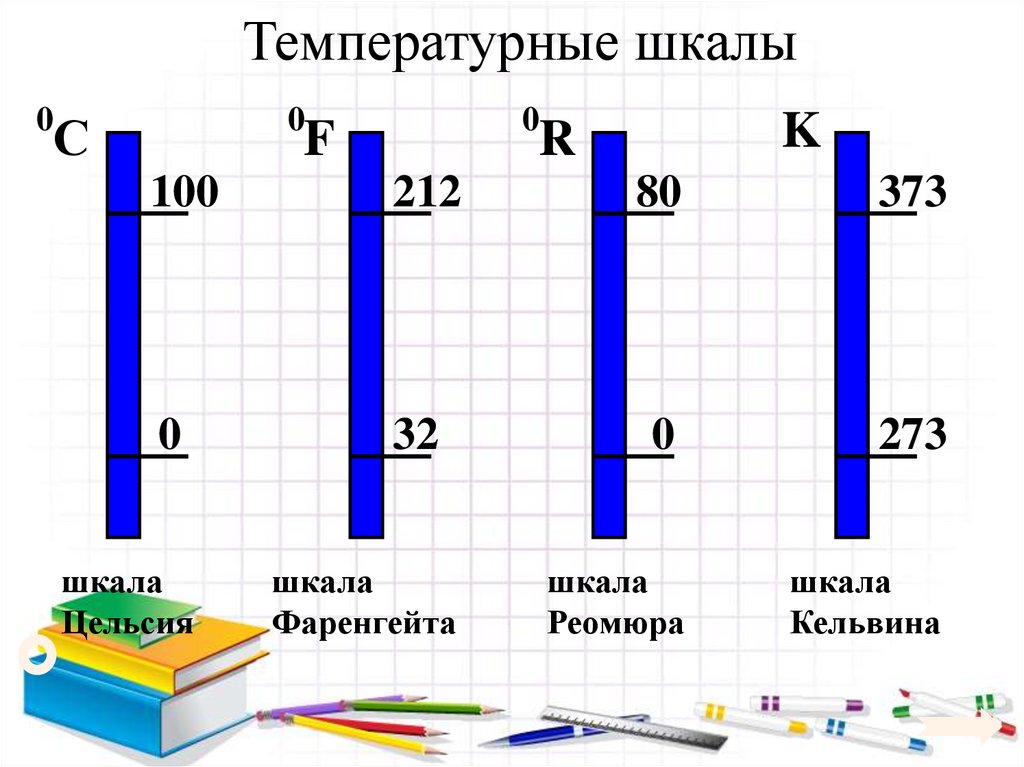
20. Температурные шкалы
00
С
0
F
K
R
100
212
80
373
0
32
0
273
шкала
Цельсия
шкала
Фаренгейта
шкала
Реомюра
шкала
Кельвина
21. Температура – мера средней кинетической энергии молекул
kT3
2
Ek kT
2
Ek
3
T K кельвин
T t 273
t T 273
t T
22. Зависимость давления газа от температуры и концентрации молекул газа
3Ek kT
2
p nkT
2
p nE k
-23 Дж/К
k
=
1,38·10
3
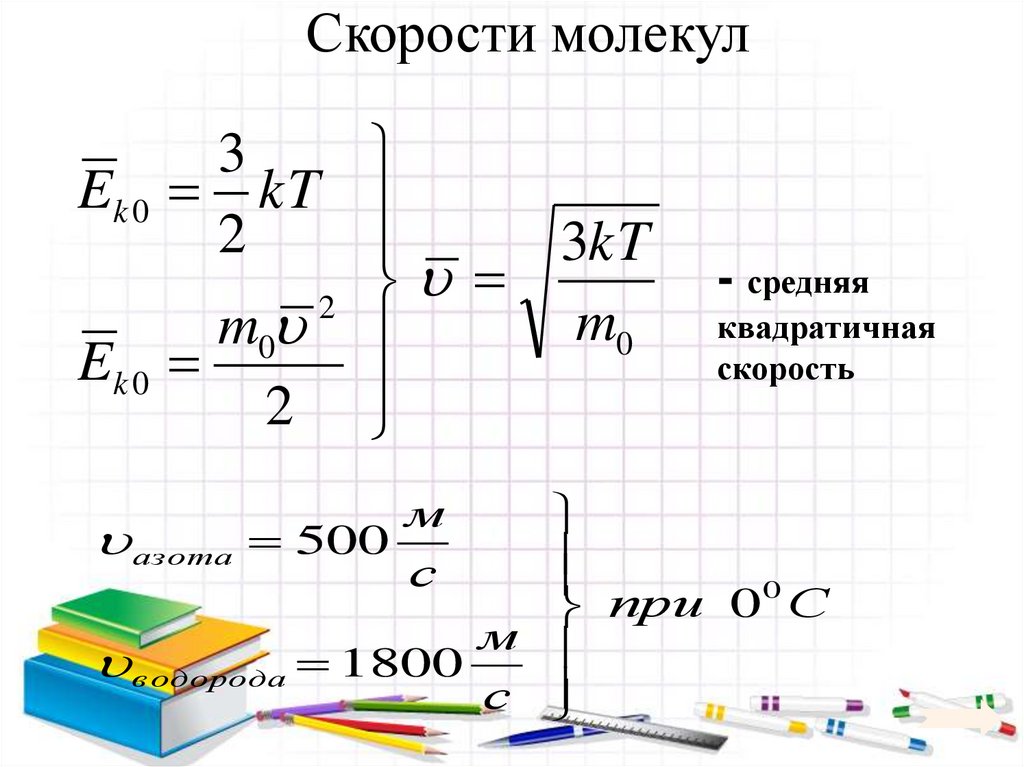
23. Скорости молекул
3Ek 0 kT
2
3kT
2
m0
m0
Ek 0
2
- средняя
квадратичная
скорость
0
при
0
С
м
в одорода 1800
с
м
азота 500
с
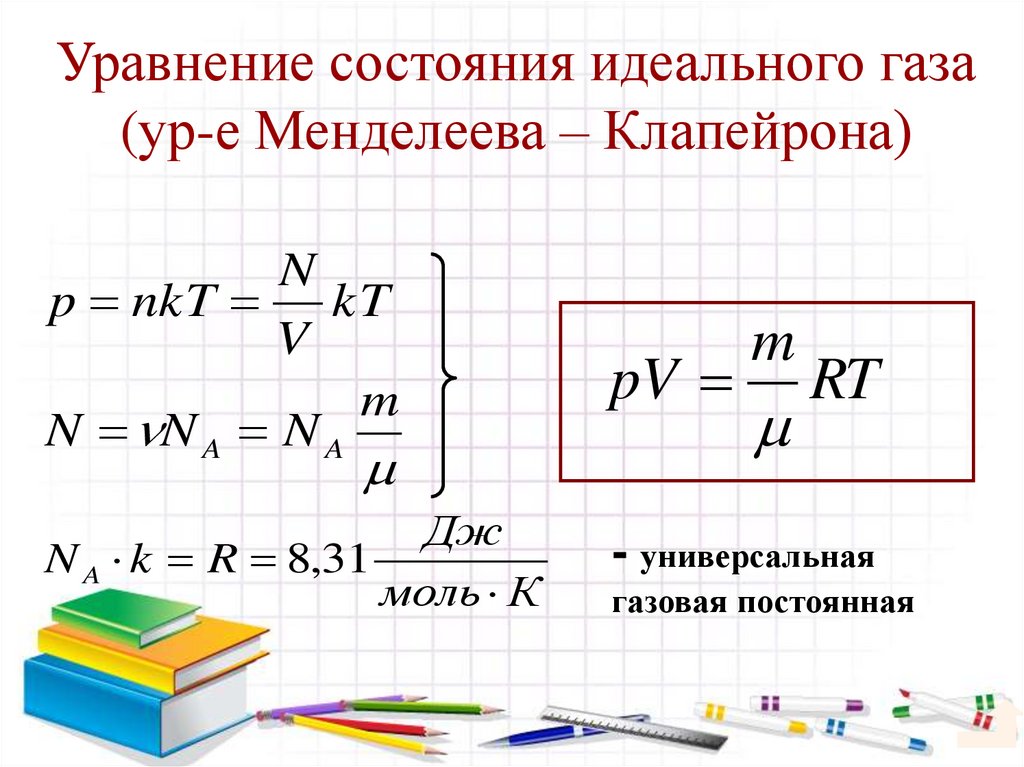
24. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона)
Np nkT kT
V
m
N N A N A
pV
Дж
N A k R 8,31
моль К
- универсальная
m
RT
газовая постоянная
25. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона)
Если в ходе процесса масса газаостается неизменной, то
pV m
R const
T
p1V1 p2V2 p3V3
...
T1
T2
T3
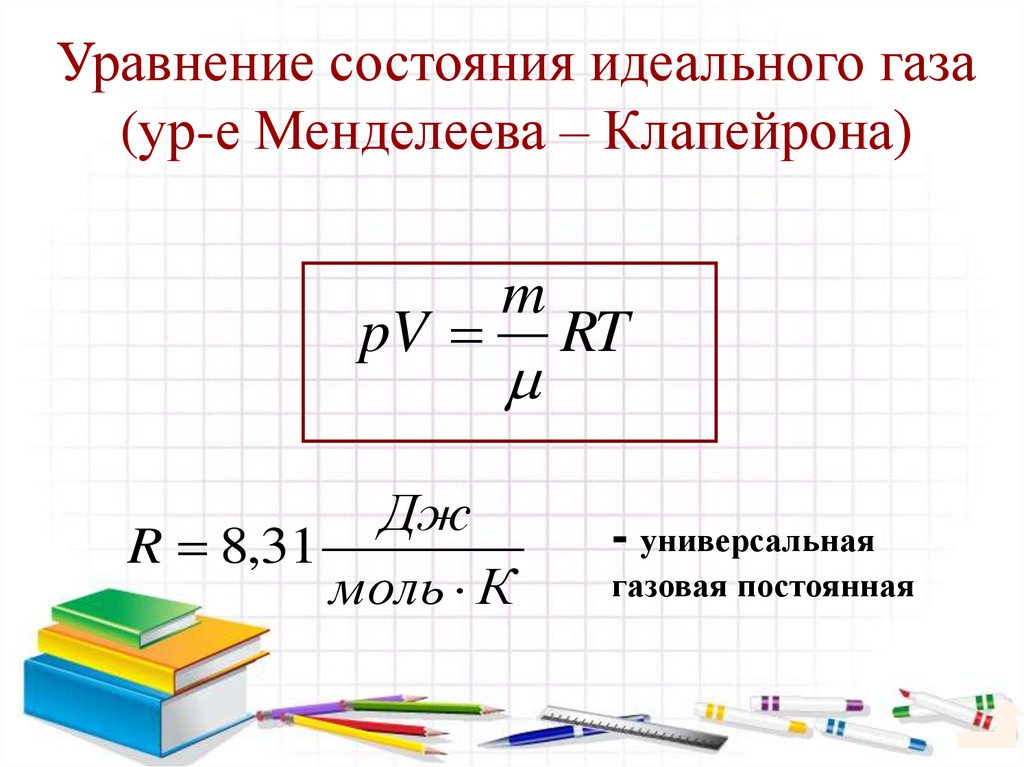
26. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона)
pVm
Дж
R 8,31
моль К
RT
- универсальная
газовая постоянная
27. Практикум по решению задач № 8. Уравнение Менделеева-Клапейрона.
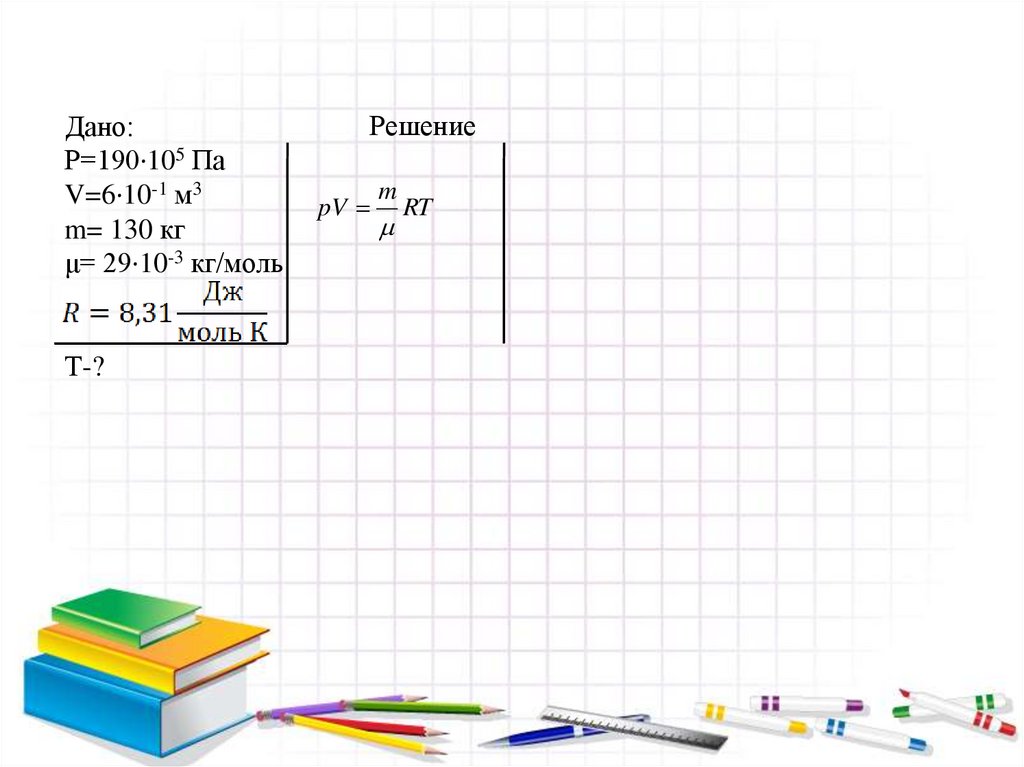
№1. Для приведения в движение гребныхвинтов применяют воздух, сжатый до
190·105Па, в баллонах вместимостью 6·10-1 м3
При какой температуре находится воздух, если
его масса 130 кг? Молярная масса воздуха
29·10-3 кг/моль
28.
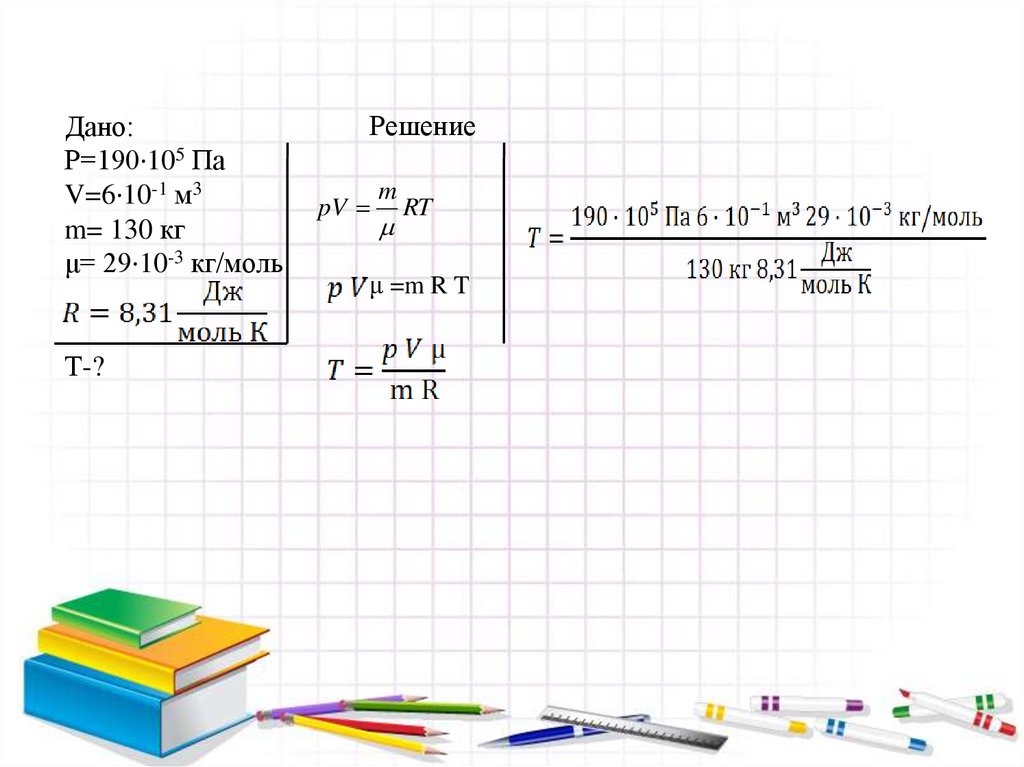
Дано:Р=190·105 Па
V=6·10-1 м3
m= 130 кг
μ= 29·10-3 кг/моль
Т-?
Решение
pV
m
RT
29.
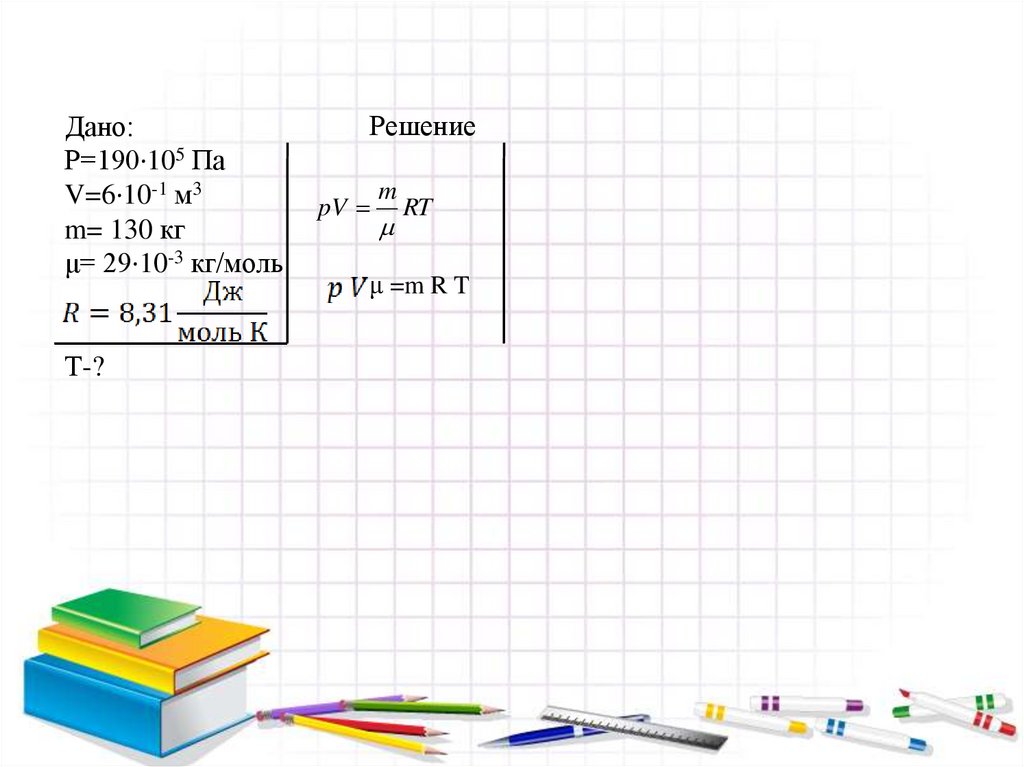
Дано:Р=190·105 Па
V=6·10-1 м3
m= 130 кг
μ= 29·10-3 кг/моль
Т-?
Решение
pV
m
RT
μ =m R T
30.
Дано:Р=190·105 Па
V=6·10-1 м3
m= 130 кг
μ= 29·10-3 кг/моль
Т-?
Решение
pV
m
RT
μ =m R T
31.
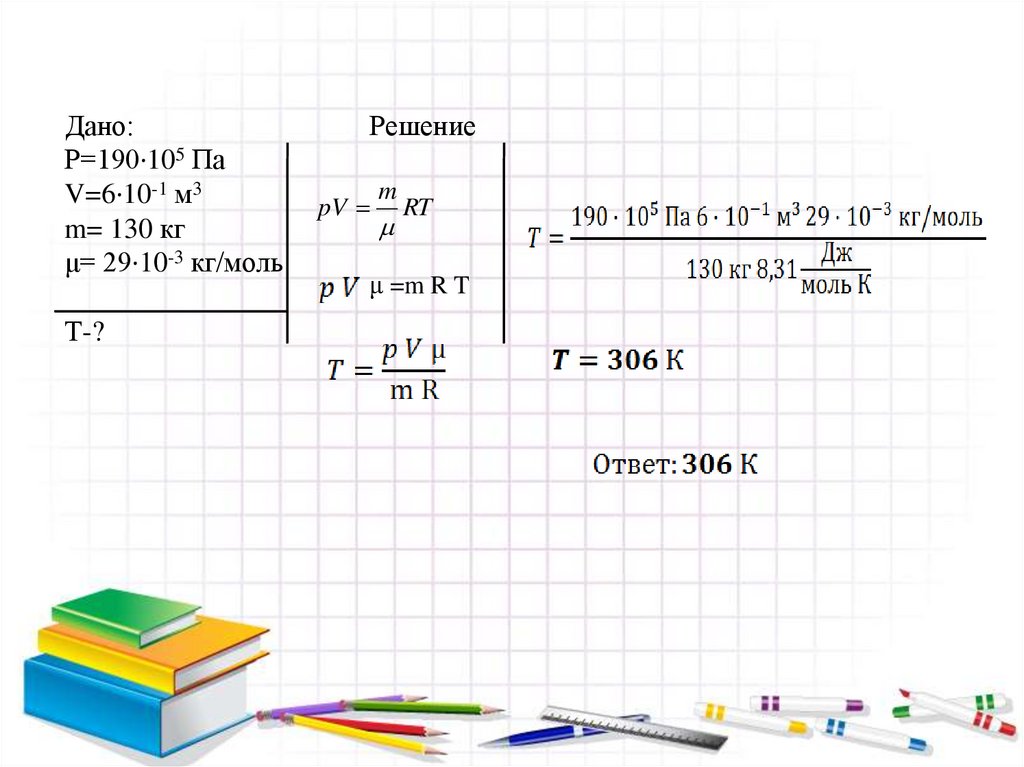
Дано:Р=190·105 Па
V=6·10-1 м3
m= 130 кг
μ= 29·10-3 кг/моль
Т-?
Решение
pV
m
RT
μ =m R T
32.
№3. Какой объем занимает газ в количестве103 моль при давлении 106 Па и
температуре 100 º С ?
Дано:
ν= 103 моль
Р=106 Па
t = 100º C
V- ?
Решение
pV
m
RT
33.
№3. Какой объем занимает газ в количестве103 моль при давлении 106 Па и
температуре 100 º С ?
Дано:
ν= 103 моль
Р=106 Па
t = 100º C
V- ?
Решение
pV
m
RT
34.
№3. Какой объем занимает газ в количестве103 моль при давлении 106 Па и
температуре 100 º С ?
Дано:
ν= 103 моль
Р=106 Па
t = 100º C
V- ?
Решение
pV
m
RT
35.
№3. Какой объем занимает газ в количестве103 моль при давлении 106 Па и
температуре 100 º С ?
Дано:
ν= 103 моль
Р=106 Па
t = 100º C
V- ?
Решение
pV
m
RT
36.
№3. Какой объем занимает газ в количестве103 моль при давлении 106 Па и
температуре 100 º С ?
Дано:
ν= 103 моль
Р=106 Па
t = 100º C
V- ?
Решение
pV
m
RT
37.
№8. При нормальных условиях масса газа738,6 мг, а объем 8,205 л. Какой это газ?
Дано:
Р=105 Па
t = 0º C
m= 738,6 мг
V=8,205 л
μ-?
СИ
Решение
pV
738,6 · 10 -6 кг
8,205 · 10 -3
m
RT
38.
№8. При нормальных условиях масса газа738,6 мг, а объем 8,205 л. Какой это газ?
Дано:
Р=105 Па
t = 0º C
m= 738,6 мг
V=8,205 л
μ-?
СИ
Решение
pV
738,6 · 10 -6 кг
8,205 · 10 -3
m
RT
39.
№8. При нормальных условиях масса газа738,6 мг, а объем 8,205 л. Какой это газ?
Дано:
Р=105 Па
t = 0º C
m= 738,6 мг
V=8,205 л
μ-?
СИ
Решение
pV
738,6 · 10 -6 кг
8,205 · 10 -3
m
RT
40.
№8. При нормальных условиях масса газа738,6 мг, а объем 8,205 л. Какой это газ?
Дано:
Р=105 Па
t = 0º C
m= 738,6 мг
V=8,205 л
μ-?
СИ
Решение
pV
738,6 · 10 -6 кг
8,205 · 10 -3
m
RT
41. Домашнее задание
Практикум по решению задач № 8 (решитьлюбые 5 задач)
Выполнить тест № 4



























 physics
physics








