Similar presentations:
ПР_Пол кисл
1.
В состоянии свободномГазом он бывает,
С водородом и азотом
Воздух составляет.
Дышат птицы им и звери,
и растения.
Его много в атмосфере,
В этом нет сомнения.
2.
Получениекислорода
3.
Цель урока:Научиться получать кислород и доказывать его наличие;
Продолжить формирование умений по составлению уравнений
химических реакций, расстановке коэффициентов в уравнениях
химических реакций.
Развивать практические умения и навыки в ходе выполнения
лабораторных опытов
4.
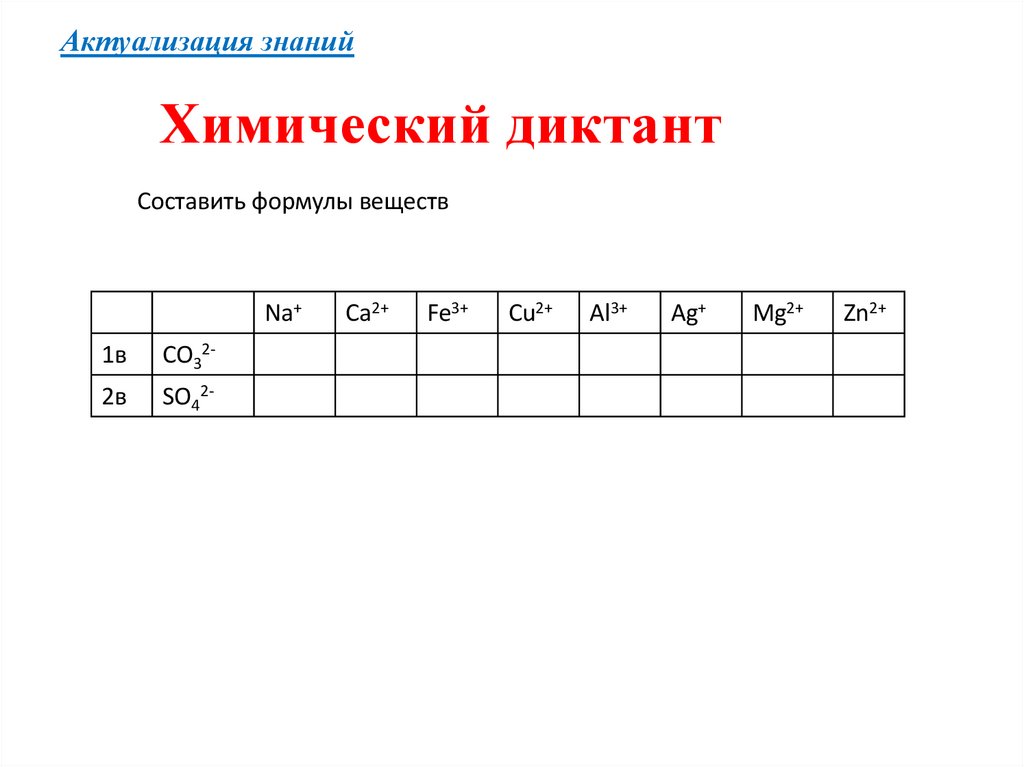
Актуализация знанийХимический диктант
Составить формулы веществ
Na+
1в
CO32-
2в
SO42-
Ca2+
Fe3+
Cu2+
Al3+
Ag+
Mg2+
Zn2+
5.
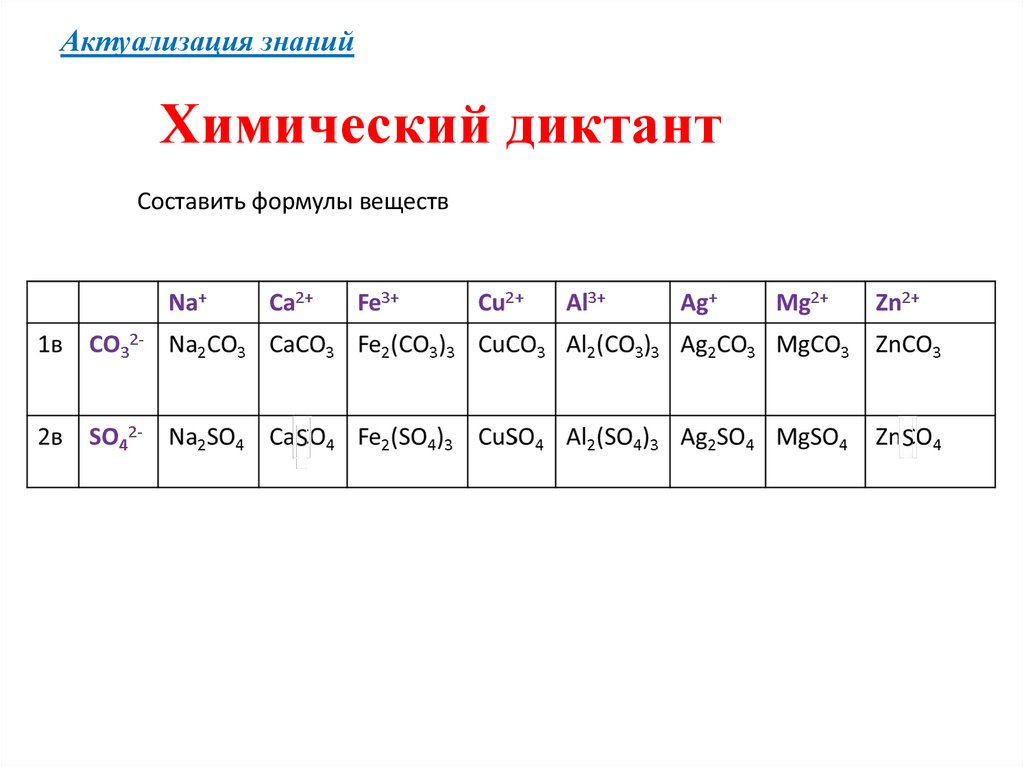
Проверка6.
Актуализация знанийХимический диктант
Составить формулы веществ
7.
Кислород.Характеристика.
8.
9.
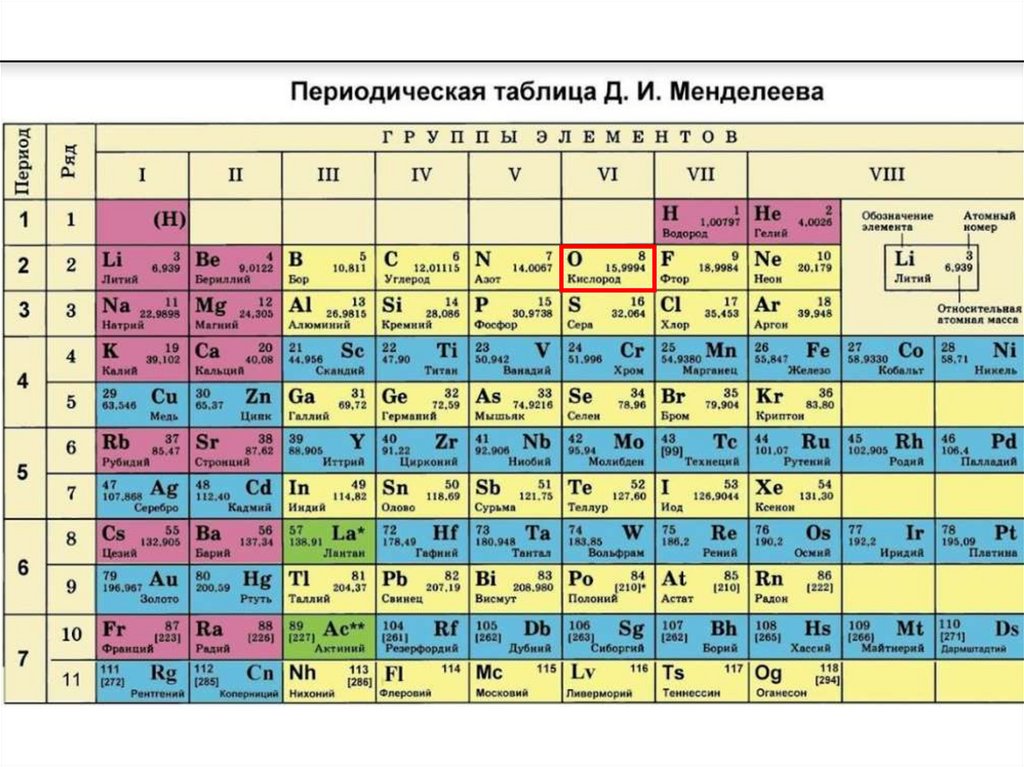
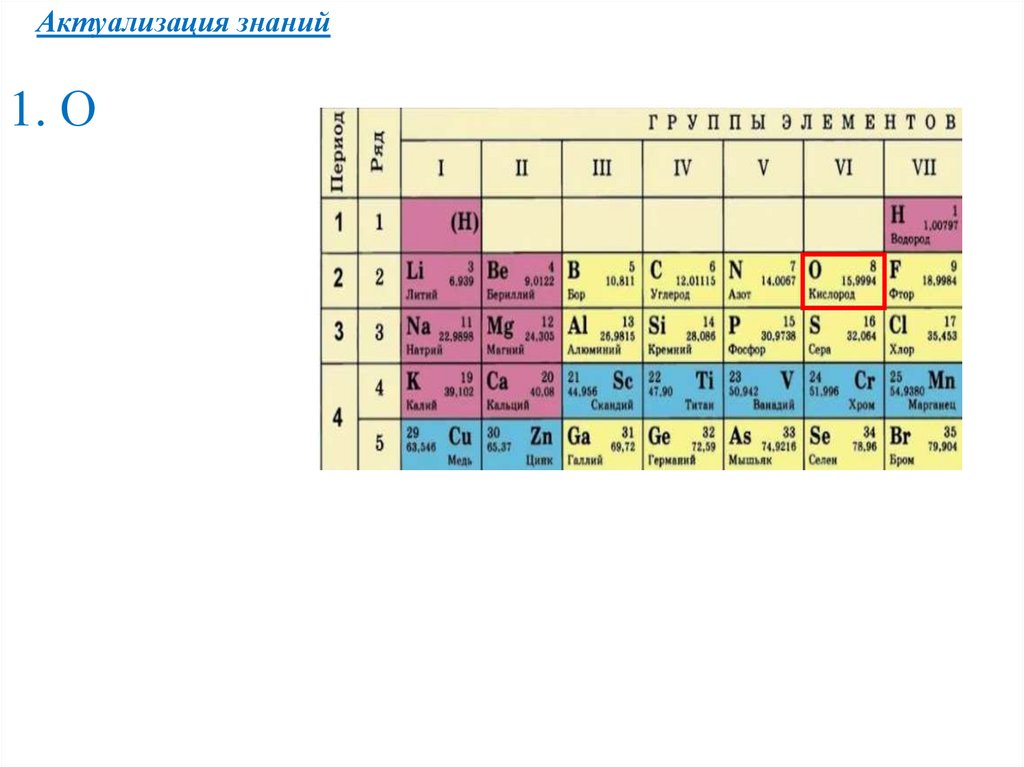
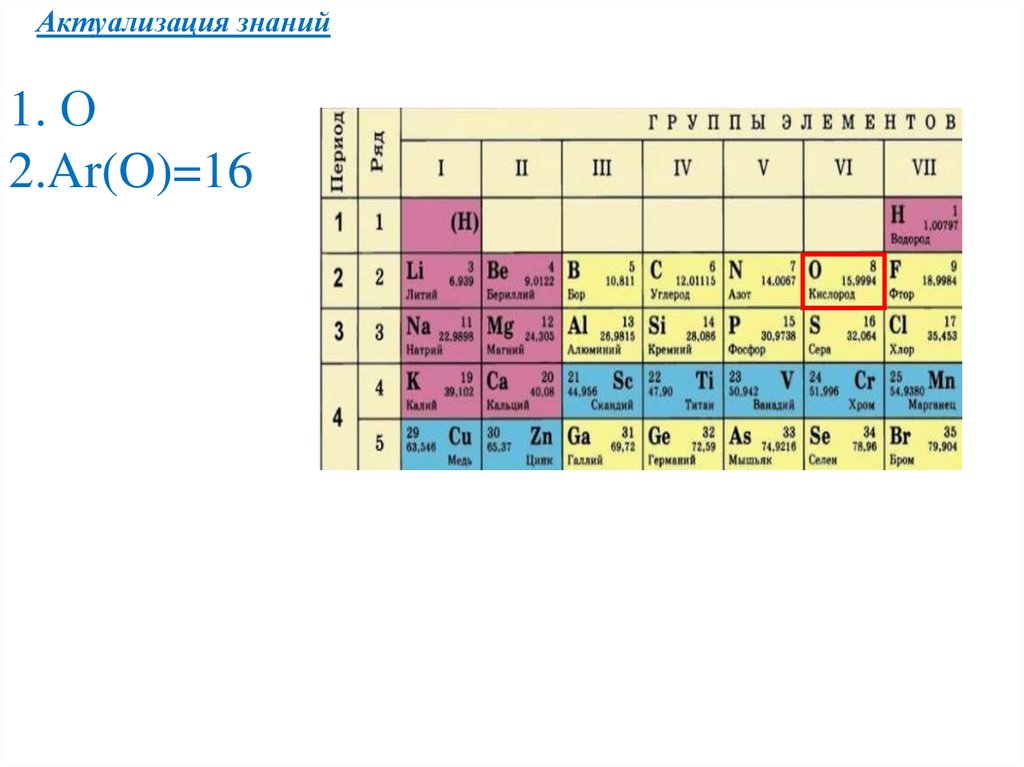
Актуализация знаний1. О
10.
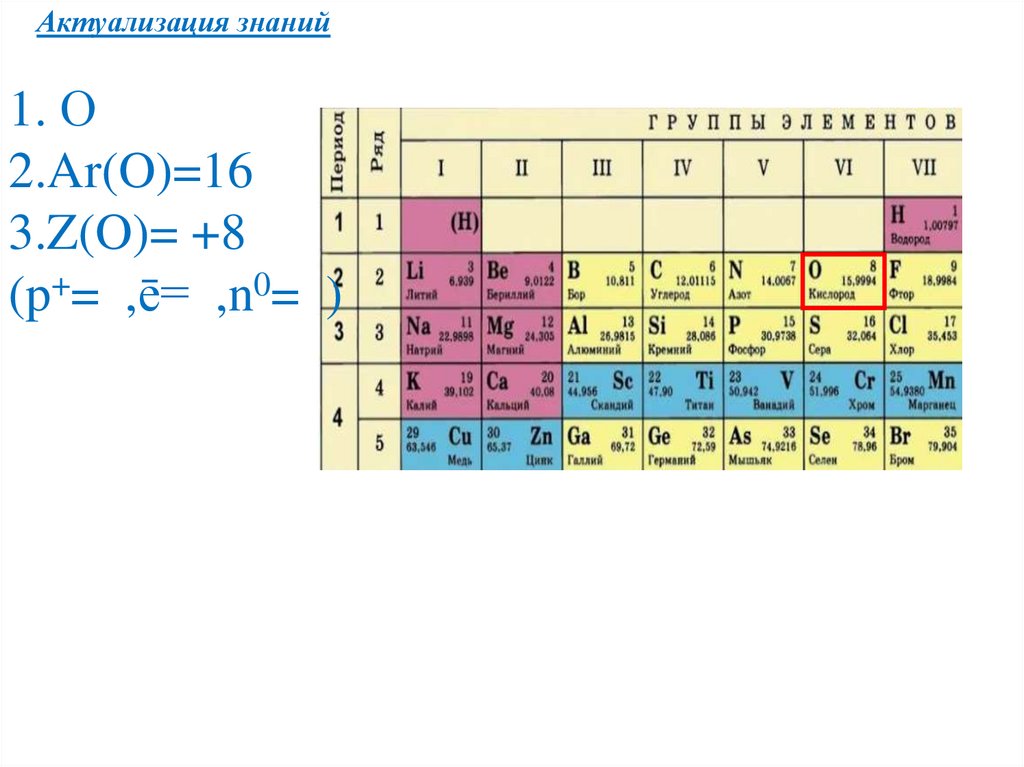
Актуализация знаний1. О
2.Ar(O)=16
11.
Актуализация знаний1. О
2.Ar(O)=16
3.Z(O)= +8
(p+= ,ē= ,n0= )
12.
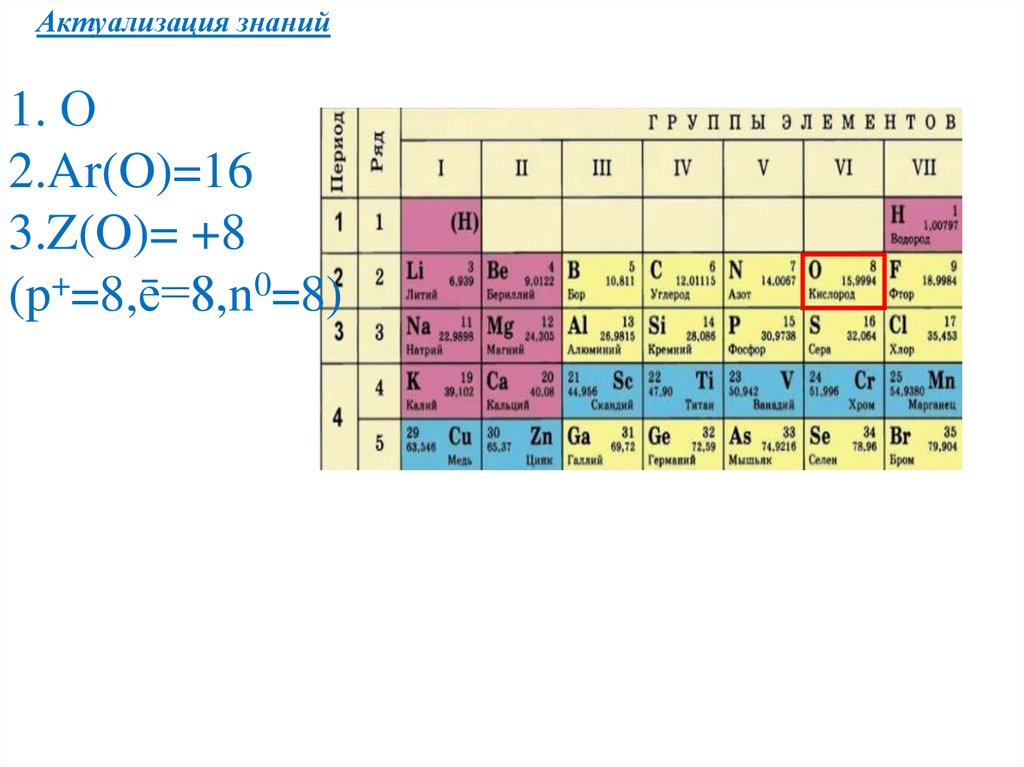
Актуализация знаний1. О
2.Ar(O)=16
3.Z(O)= +8
(p+=8,ē=8,n0=8)
13.
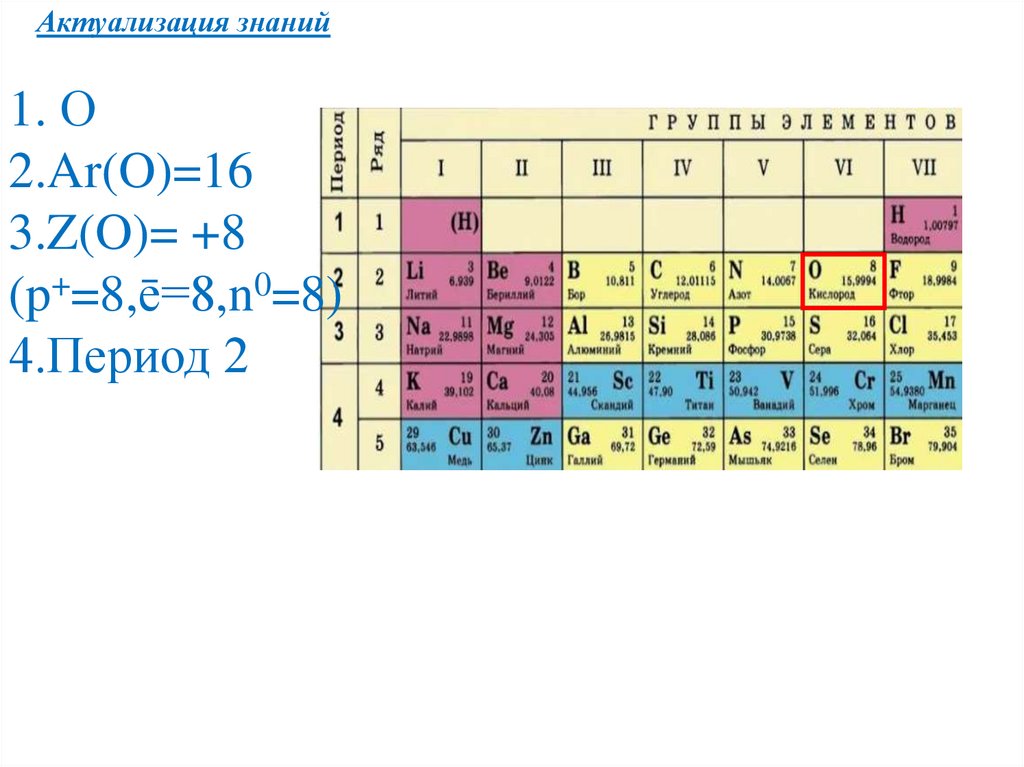
Актуализация знаний1. О
2.Ar(O)=16
3.Z(O)= +8
(p+=8,ē=8,n0=8)
4.Период 2
14.
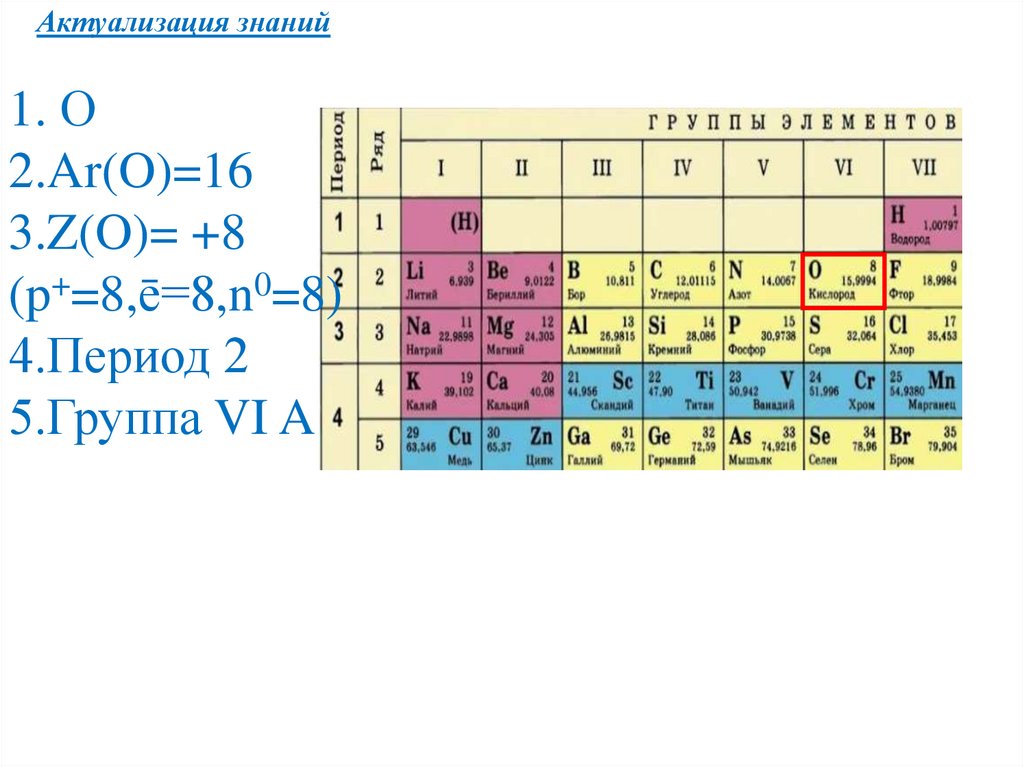
Актуализация знаний1. О
2.Ar(O)=16
3.Z(O)= +8
(p+=8,ē=8,n0=8)
4.Период 2
5.Группа VI A
15.
Актуализация знанийПеред вами записи, характеризующие кислород. Распределите их
на две группы:
газ, простое вещество, жидкость голубого цвета,
кристаллы синего цвета, окисление, без запаха, без вкуса,
горение
1 группа
Физические свойства
2 группа
Химические свойства
16.
Актуализация знанийПеред вами записи, характеризующие кислород. Распределите их
на две группы:
газ, простое вещество, жидкость голубого цвета,
кристаллы синего цвета, окисление, без запаха, без вкуса,
горение
1 группа
Физические свойства
2 группа
Химические свойства
газ, простое вещество,
жидкость голубого цвета,
кристаллы синего цвета,
без запаха, без вкуса
Горение
окисление
17.
Правилатехники безопасности
18.
19.
20.
Практическая работа«Получение, собирание
и обнаружение кислорода»
21.
Получение, собирание и распознавание кислорода1. Перед вами находятся пробирки с оксидом марганца.
2. Добавьте в пробирку несколько капель перекиси H2O2.Реакция бурная,
пробирки не брать в руки, не наклоняться над пробирками.
3. Приготовьте тлеющую лучинку. Проверьте наличие кислорода в сосуде.
Для этого тлеющую лучинку опустите в пробирку. Что наблюдаете?
4. По окончании опыта оформите отчёт в тетради.
При оформлении отчета оценивается следующее:
рисунок -1б
наблюдения-1б
уравнение реакции -1б
вывод-1б
аккуратность-1б
22.
Получение, собирание и распознавание кислородаMnO2
H2O2
При добавлении к перекиси оксида
марганца происходит___________
происходит бурное
выделение кислорода. Кислород
______________________________
обнаруживаем
Кислород
обнаруживаем
тлеющей лучинкой.
_________
_______________________________
23.
Получение, собирание и распознавание кислородаMnO2
H2O2
При добавлении к перекиси оксида
марганца происходит___________
происходит бурное
выделение кислорода. Кислород
______________________________
обнаруживаем
Кислород
обнаруживаем
тлеющей лучинкой.
_________
_______________________________
2H2O2=2H2O+0,5O2
24.
Получение, собирание и распознавание кислородаMnO2
H2O2
При добавлении к перекиси оксида
марганца происходит___________
происходит бурное
выделение кислорода. Кислород
______________________________
обнаруживаем
Кислород
обнаруживаем
тлеющей лучинкой.
_________
_______________________________
2H2O2=2H2O+0,5O2
25.
Получение, собирание и распознавание кислородаMnO2
H2O2
При добавлении к перекиси оксида
марганца происходит___________
происходит бурное
выделение кислорода. Кислород
______________________________
обнаруживаем
Кислород
обнаруживаем
тлеющей лучинкой.
_________
_______________________________
2H2O2=2H2O+0,5O2
Почему кислород не улетучивается?
26.
Свойства кислорода27.
Укажите сумму коэффициентов в реакцияхFe + O2= Fe3O4
Р + O2= Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
28.
Укажите сумму коэффициентов в реакцияхFe + O2= Fe3O4
Р + O2= Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
29.
Укажите сумму коэффициентов в реакциях3Fe + O2= Fe3O4
Р + O2= Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
30.
Укажите сумму коэффициентов в реакциях3Fe + O2= Fe3O4
Р + O2= Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
31.
Этап первичной проверки понимания изученногоУкажите сумму коэффициентов в реакциях
3Fe +2O2= Fe3O4
Р + O2= Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
32.
Укажите сумму коэффициентов в реакциях3Fe + 2O2= 1Fe3O4 (6)
Р + O2= Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
33.
Укажите сумму коэффициентов в реакциях3Fe + 2O2= Fe3O4 (6)
Р + O2= Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
34.
Укажите сумму коэффициентов в реакциях3Fe + 2O2= Fe3O4 (6)
Р + O2= Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
35.
Укажите сумму коэффициентов в реакциях3Fe + 2O2= Fe3O4 (6)
10
Р + O2= Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
36.
Укажите сумму коэффициентов в реакциях3Fe + 2O2= Fe3O4 (6)
10
Р +5O2= Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
37.
Укажите сумму коэффициентов в реакциях3Fe + 2O2= Fe3O4 (6)
Р +5O2=2Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
38.
Укажите сумму коэффициентов в реакциях3Fe + 2O2= Fe3O4 (6)
4Р +5O2=2Р2O5
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
39.
Этап первичной проверки понимания изученногоУкажите сумму коэффициентов в реакциях
3Fe + 2O2= Fe3O4 (6)
4Р + 2O2= 2Р2O5 (8)
S + O2 = SO2↑
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
40.
Этап первичной проверки понимания изученногоУкажите сумму коэффициентов в реакциях
3Fe + 2O2= Fe3O4 (6)
4Р + 2O2= 2Р2O5 (8)
1S + 1O2 = 1SO2↑ (3)
С + O2 = СO2↑
СН4+ O2= СО2↑ + Н2O
41.
Укажите сумму коэффициентов в реакциях3Fe + 2O2= Fe3O4 (6)
4Р + 2O2= 2Р2O5 (8)
1S + 1O2 = 1SO2↑ (3)
1С + 1O2 = 1СO2↑(3)
СН4+ O2= СО2↑ + Н2O
42.
Укажите сумму коэффициентов в реакциях3Fe + 2O2= Fe3O4 (6)
4Р + 2O2= 2Р2O5 (8)
1S + 1O2 = 1SO2↑ (3)
1С + 1O2 = 1СO2↑(3)
1СН4+2O2=1СО2↑ +2Н2O (6)
43.
Оцените свою деятельность по лестнице знанийВсе
понимаю, все
получится
5
Понимаю, но
нужно еще
доработать
4
Плохо понимаю
материал
3
44.
Видео1.Получение кислорода
2.Горение фосфора в кислороде
3.Получение кислорода из перекиси
45.
III. Подведение итоговКак можно получить кислород в лаборатории?
Какую роль выполняет в реакции разложения пероксида
водорода оксид марганца (IV)?
Домашнее задание: § 14, выполнить задания № 1—5 после § 14




































 chemistry
chemistry








