Similar presentations:
строение атома
1. Тема урока : "Строение атома".
Тема урока :"Строение атома".
8 класс
2.
Атом – сложная частица.Понятие "атом" пришло к нам из далекой античности
( в переводе с греческого "атом" означает " неделимый ").
Этимология названия "неделимый" отражает сущность
атома с точностью до наоборот.
3. I. Доказательства сложности строения атома.
1891г. - ирландский физик Стони ввёл понятие"электрон" для обозначения частиц, электризующих
янтарь и вследствие этого притягивающих кусочки
бумаги.
1895г. - открытие рентгеновских лучей
К.Рентгеном.
1896г. - открытие радиоактивности А.Беккерелем.
1897г. - открытие катодных лучей Д.Томсоном.
4.
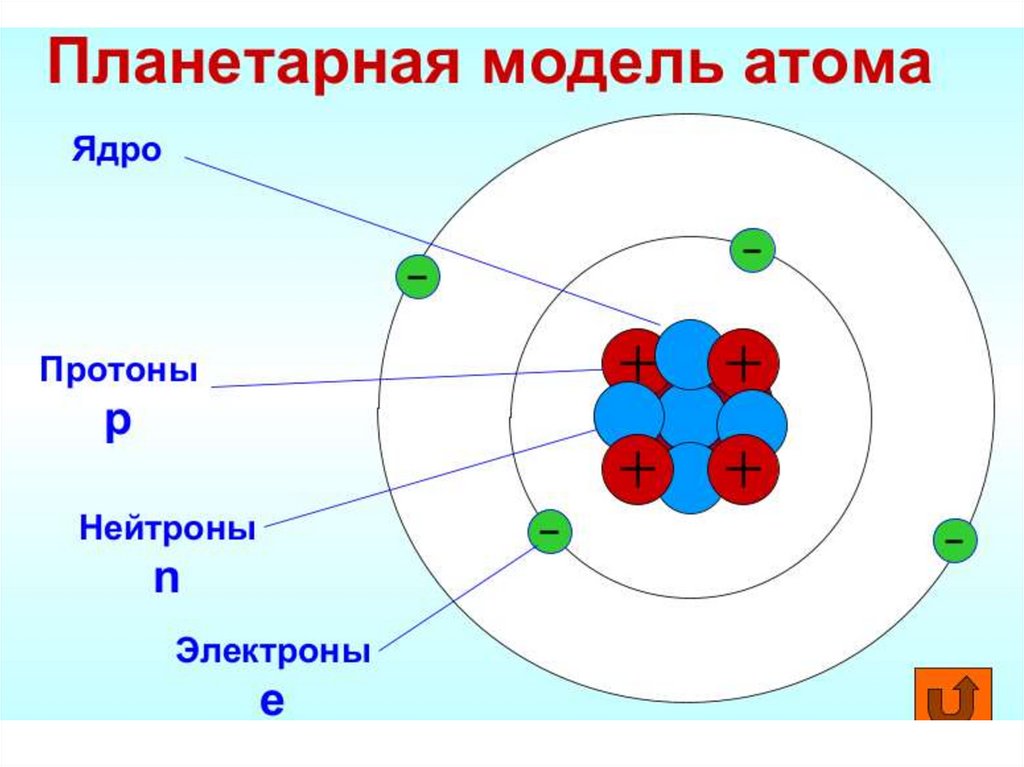
II. Модели строения атома."Сливовый пудинг" Дж. Томсона.
+
+
-
- +
+ - +
+ +
- +
+
-
+
Атом уподоблен сферической
капле пудинга с положительным
зарядом.
Внутрь сферы вкраплены
отрицательно заряженные
"сливины" – электроны.
5.
6.
7.
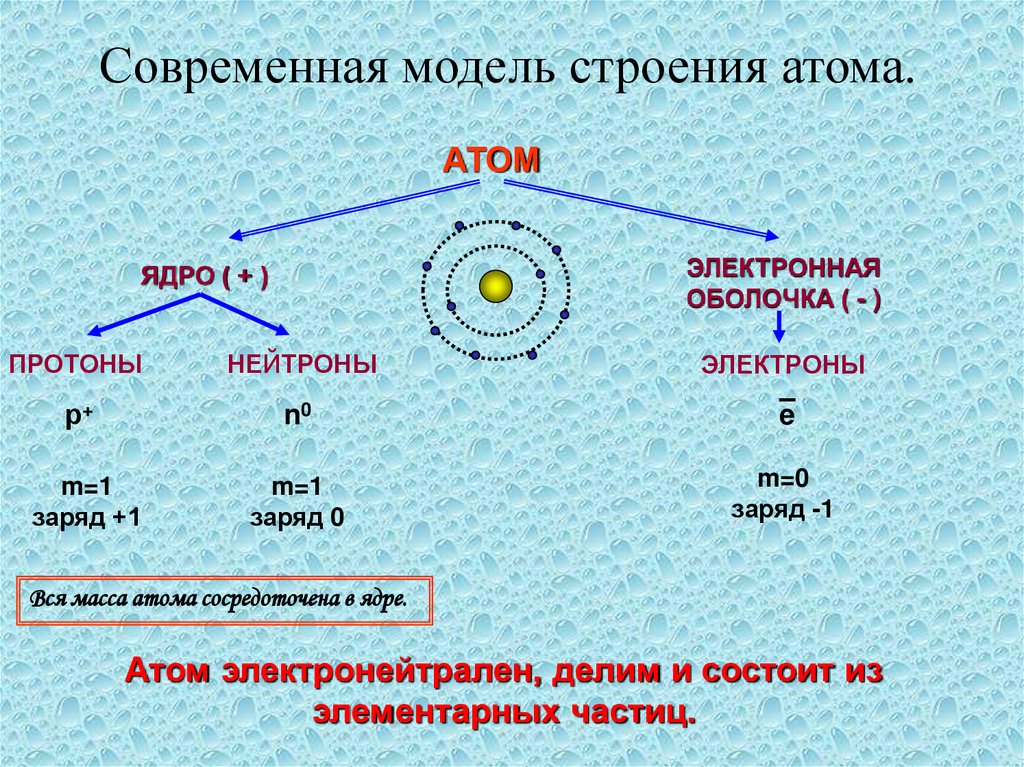
Современная модель строения атома.АТОМ
ЭЛЕКТРОННАЯ
ОБОЛОЧКА ( - )
ЯДРО ( + )
ПРОТОНЫ
НЕЙТРОНЫ
ЭЛЕКТРОНЫ
р+
n0
e
m=1
заряд +1
m=1
заряд 0
m=0
заряд -1
Вся масса атома сосредоточена в ядре.
Атом электронейтрален, делим и состоит из
элементарных частиц.
8.
9.
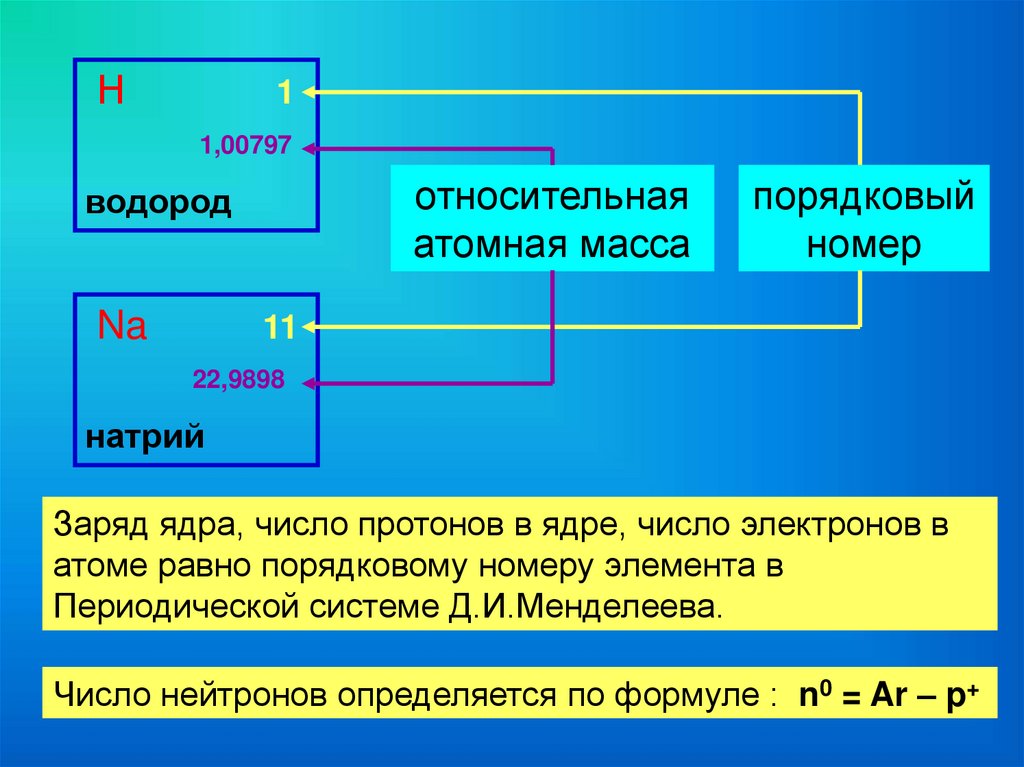
Н1
1,00797
относительная
атомная масса
водород
Na
порядковый
номер
11
22,9898
натрий
Заряд ядра, число протонов в ядре, число электронов в
атоме равно порядковому номеру элемента в
Периодической системе Д.И.Менделеева.
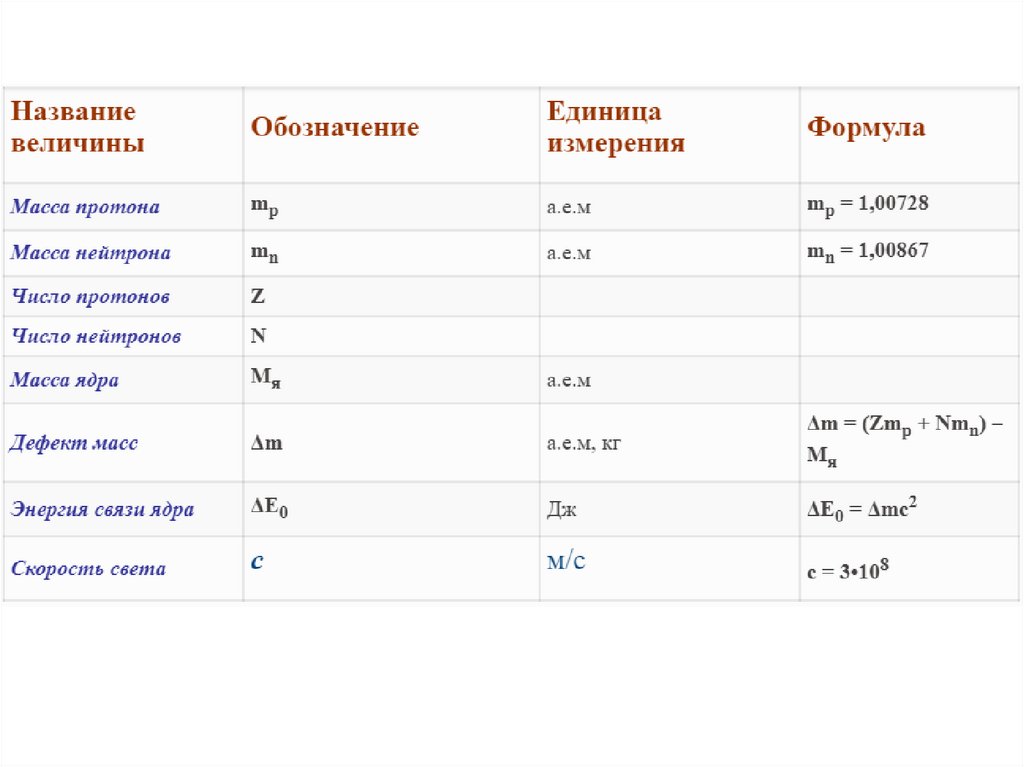
Число нейтронов определяется по формуле : n0 = Ar – p+
10.
11.
p+ 1H
p+ 11
Na
ē 1
n0
0
ē 11
n0 12
Определите число протонов, нейтронов и электронов для
атомов:
О
p+ 8
ē
8
n0
8
p+ 13
Al
ē 13
n0 14
p+ 35
Br
ē 35
n0 46
12.
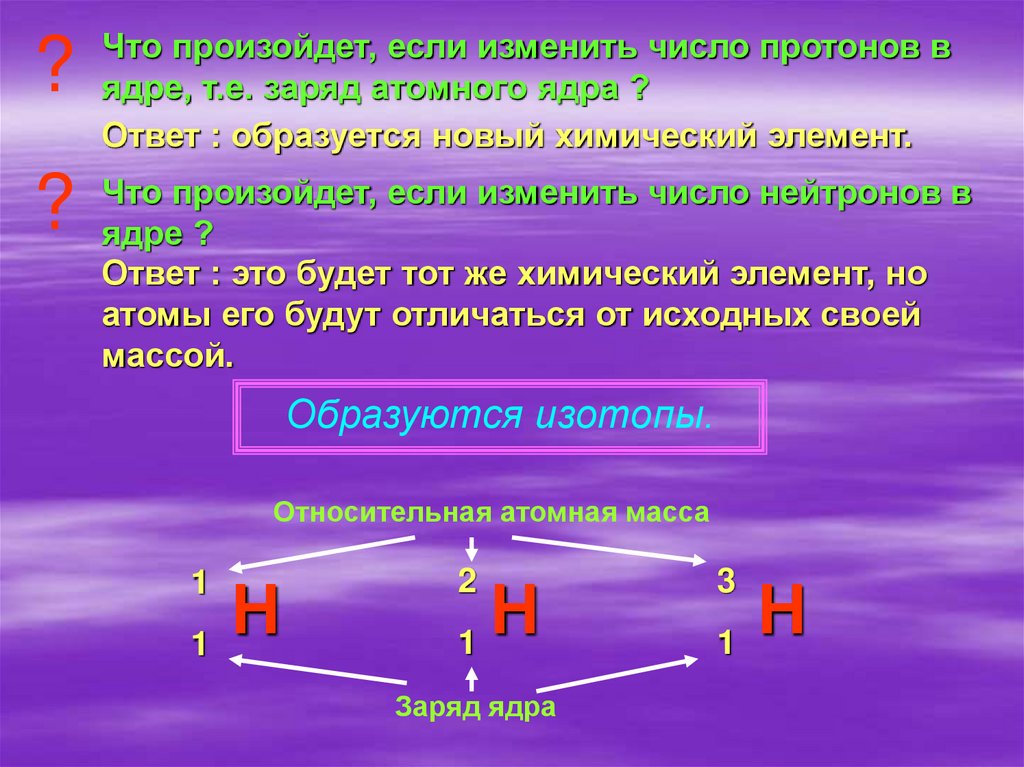
?Что произойдет, если изменить число протонов в
ядре, т.е. заряд атомного ядра ?
Ответ : образуется новый химический элемент.
?
Что произойдет, если изменить число нейтронов в
ядре ?
Ответ : это будет тот же химический элемент, но
атомы его будут отличаться от исходных своей
массой.
Образуются изотопы.
Относительная атомная масса
1
Н
1
2
1
Н
Заряд ядра
3
1
Н
13.
14.
15.
Строение электронных оболочек атомов.Каждый электрон в атоме обладает запасом
энергии ( Е связи).
Электроны, имеющие близкие значения Е связи,
образуют энергетические уровни.
энергетические уровни
+
2ē 8ē 18ē 32ē
Число энергетических уровней в
атоме определяется по номеру
периода.
Максимальное число электронов,
находящихся на энергетическом
уровне, определяется по формуле:
2n2, где n – номер уровня.
16.
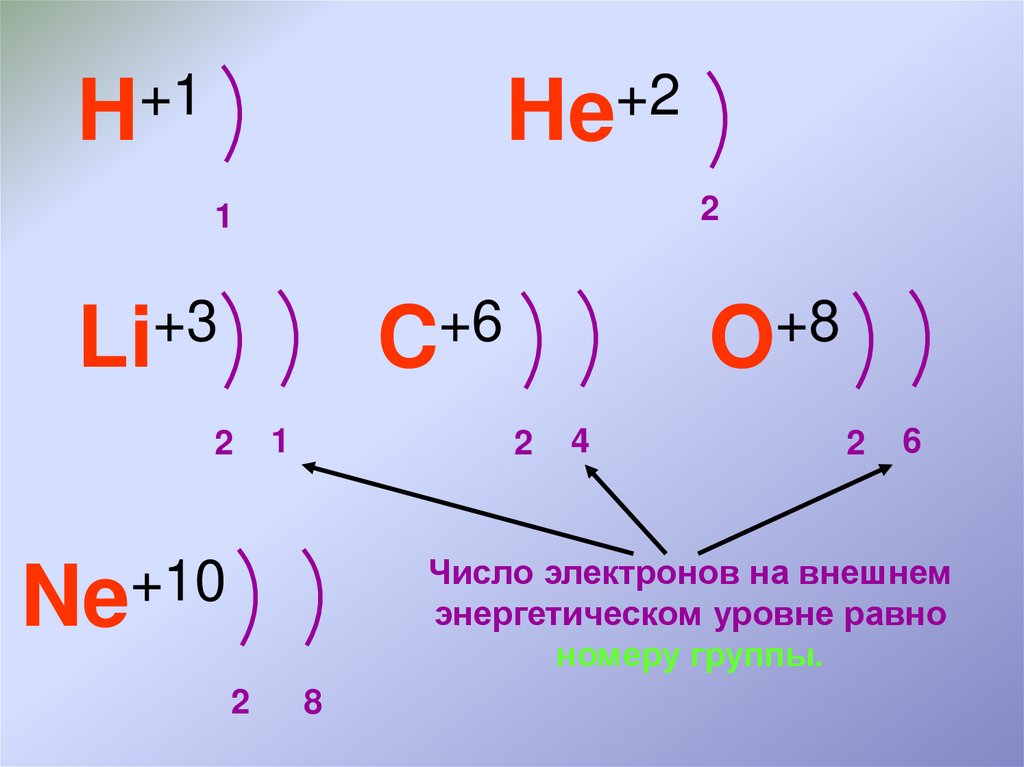
+1H
+2
He
2
1
+3
Li
+6
C
2
1
+8
O
2
4
2
6
Число электронов на внешнем
энергетическом уровне равно
номеру группы.
+10
Ne
2
8
17.
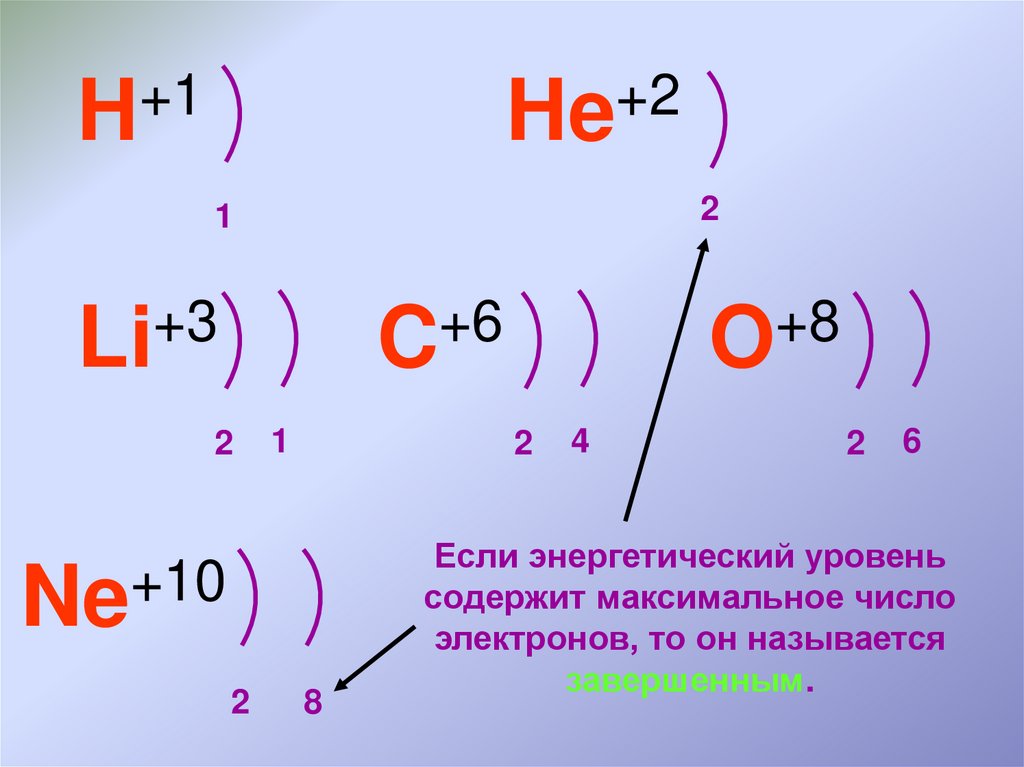
+1H
+2
He
2
1
+3
Li
+6
C
2
1
2
+10
Ne
2
+8
O
8
4
2
6
Если энергетический уровень
содержит максимальное число
электронов, то он называется
завершенным.
18.
Пространство вокруг ядра атома, гденаиболее вероятно нахождение данного
электрона, называется орбиталью этого
электрона.
Форма орбиталей
∞
∞
∞
S – орбиталь
P – орбиталь
На любой орбитали может быть не более 2ē.
19. Электронные формулы.
+1H
1
1S
№ эн. уровня
1
+2
He
число ē на данной орбитали
форма орбитали
1S2
2
+8
O
1S2 2S2 2p4
2
6
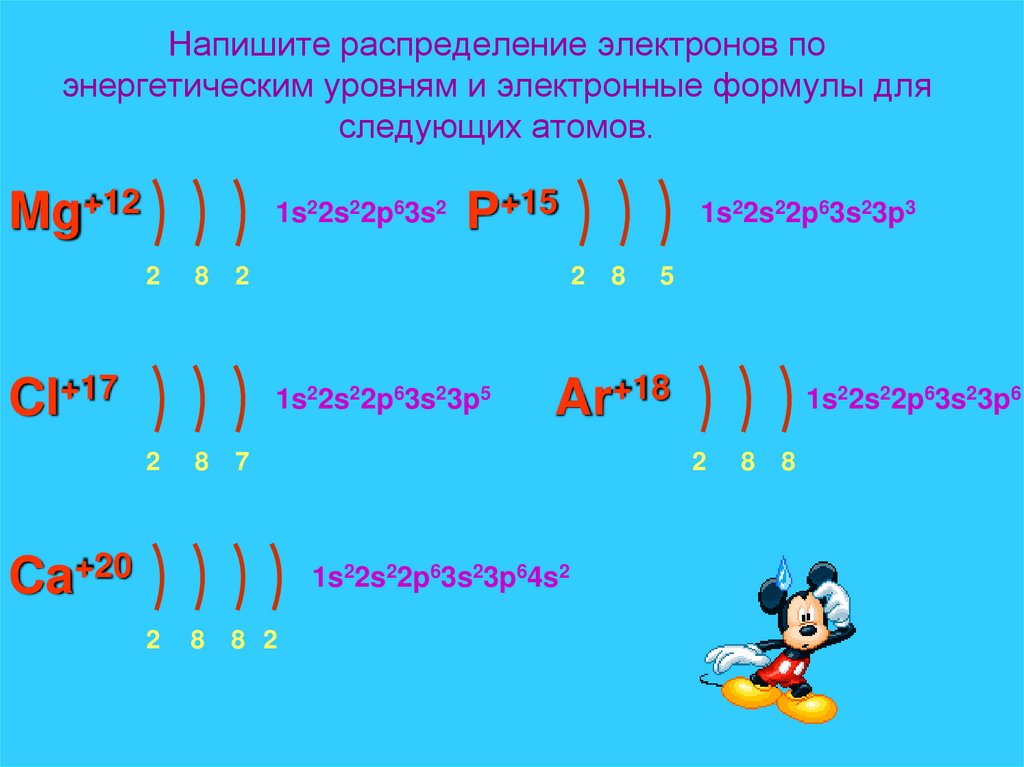
20. Напишите распределение электронов по энергетическим уровням и электронные формулы для следующих атомов.
Mg+121s22s22p63s2
2
8
P+15
2
Cl+17
2
1s22s22p63s23p5
2
8
8 2
5
1s22s22p63s23p6
2
1s22s22p63s23p64s2
8
8
Ar+18
7
Ca+20
2
1s22s22p63s23p3
8
8
21. Тест
1. Главная характеристика химического элемента – этоКоличество электронов в атоме;
Заряд ядра атома;
Масса ядра атома.
2. Ядро атома содержит
Только протоны;
Только нейтроны;
Протоны и нейтроны.
3. Заряд протона –
Нейтральный;
Отрицательный, равный заряду электрона;
Положительный, численно равный заряду электрона.
22. Задачи
• Определите число электронов, протонов и нейтроновв атоме кислорода 8O17.
• В результате α-pacnada ядро некоторого элемента
превратилось в ядро радона 86Rn222. Что это был за
элемент?
• В какое ядро превращается торий 90 Th 230 после
трех последовательных α-распадов?
• В какое ядро превращается сурьма после четырех βраспадов?













 chemistry
chemistry








