Similar presentations:
Лекция 2
1. Химизм процесса горения. Расход воздуха при горении
Лекция 22.
Горение и взрыв в большинстве случаевпредставляют собой окислительновосстановительные реакции. Под этим понимаются
процессы изменения степени окисления (СО –
степень окисления) элементов.
Есть окислитель (например, кислород в обычном
процессе горении топлива), который
восстанавливается и снижает свою степень
окисления. С ним взаимодействует восстановитель,
который окисляется и увеличивает свою степень
окисления.
3. Горение водорода
Н2(г) + О2(г) = Н2О(ж) илиН20 + О20 = Н2+1О-2.
Степень окисления водорода и кислорода в
простых веществах принята равной нулю. После
реакции степень окисления кислорода стала – 2,
а водорода +1.
4. Горение оксида углерода
2С+2 О-2 + О20 = 2С+4О2-2.В этом процессе окисляется углерод и
восстанавливается кислород. Таким образом,
горением может называться любая реакция, в
которой выделяется теплота и образуется пламя.
Это может быть и реакция двух веществ между
собой. Например, горение водорода в атмосфере
хлора:
Н2(г) + Cl2(г) = 2НCl(г)
или реакция разложения (горения взрывчатых
веществ).
5. Процессы горения в основном протекают по цепному механизму.
Цепные реакции - сложные реакции, протекающие внесколько стадий, представляющих собой:
зарождение цепей (инициирование), при котором
образуются активные частицы;
продолжение цепей, при которой активные
частицы вступают в химическое взаимодействие с
исходными веществами, в результате чего
образуются новые активные частицы;
обрыв цепей, при котором происходит «гибель»
активных частиц с образованием конечных
продуктов реакции
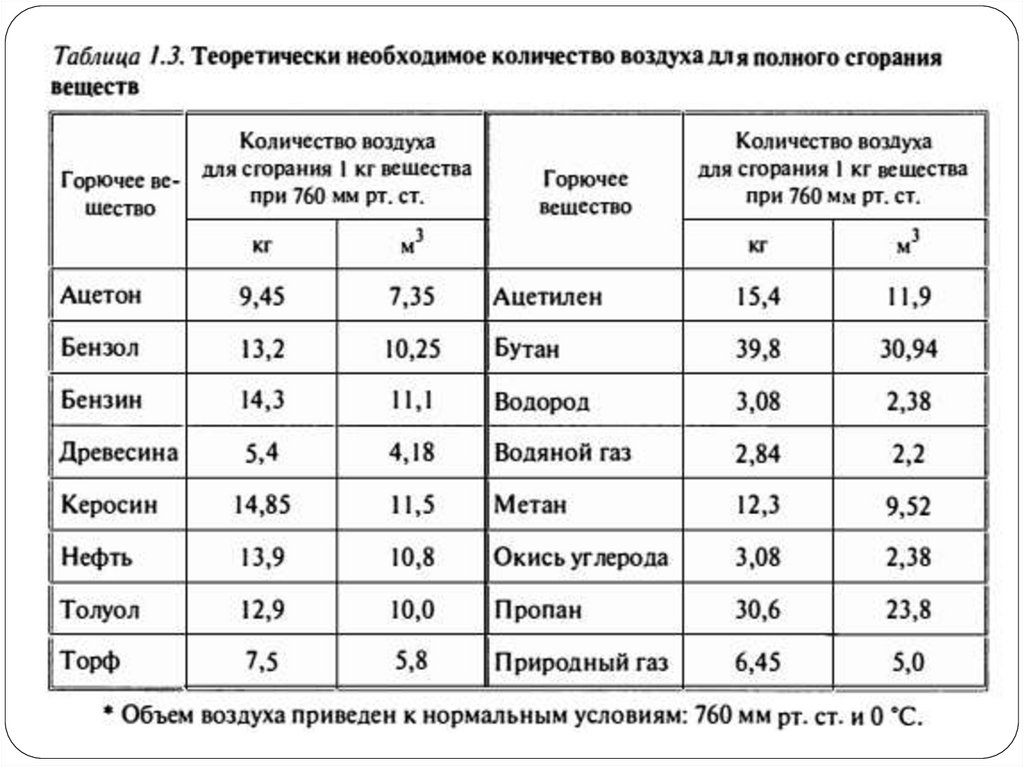
6. Расход воздуха при горении
Под теоретически необходимым количествомвоздуха понимается минимальное количество
воздуха, необходимое для полного сгорания
единицы массы (кг) или объема (м3) горючего
вещества. Теоретически необходимое
количество воздуха обозначается VB°.
Расход кислорода и количество образующихся
продуктов сгорания определяют из уравнения
горения, записанного для одного моля
горючего вещества.
7.
8.
Для практических расчётов принимают, что состав воздуха состоит из21%кислорода и 79% азота. Таким образом, объёмное соотношение азота и
кислорода в воздухе составит:
N 79
3.76
O 21
2
2
где
N , o - соответственно объёмное (% об.) содержание азота и кислорода
2
2
в окислительной среде.
Следовательно, на 1 м3 (кмоль) кислорода в воздухе приходится 3,76 м3
(кмоль) азота.
Для удобства расчётов горючие вещества
разделяют на три типа:
1) индивидуальные химические соединения
(метан, уксусная кислота и т.п.),
2) вещества сложного состава (древесина, торф,
сланцы, нефть, и т.п.),
3) смесь газов (генераторный газ и т.п.).
9.
Тип горючеговещества
VВ
0
Индивидуальное
вещество
Вещество
сложного состава
Смесь газов
VВ
0
VВ
0
VВ
0
Расчётные формулы
Размерность
nO2 n N 2
кмоль м 3
;
кмоль м 3
м3
м3
nГ
(nO2 n N 2 ) V0
nГ M
S O
С
0.269 Р
3
8
м3
кг
n
м 3 кмоль
;
м 3 кмоль
Гi
O2 i
21
O2
10.
Здесь VВ0
-теоретическое количество воздуха; nГ , nO ,
2
nN 2 -количество горючего, кислорода и азота, получаемого из
уравнения химической реакции горения, кмоль; М –
молекулярная масса горючего; V0 – объем 1 кмоля газа при
нормальных условиях (22,4 м3); C, H, S, O - весовое
содержание соответствующих элементов в составе горючего,
%, Гi - концентрация I - го горючего компонента, % об.; O концентрация кислорода в составе горючего газа, % об.; nO2 i 2
количество кислорода, необходимое для окисления одного
кмоля i- го горючего компонента, кмоль.
11.
Для определения объёма воздуха при горении в условиях,отличных от нормальных, пользуются уравнением состояния
идеальных газов
p0V0
p1V1
T0
T1 ,
где p0 - нормальное давление, Па;
Т0 - нормальная температура, К;
V0 - объём воздуха при нормальных условиях, м3;
p1 - заданное давление, Па;
T1 - заданная температура, К;
V1 - заданный объём газа, м3.
12.
Практический объём воздуха Vв, поступивший в зонугорения. Отношение практического объёма воздуха к
теоретическому называется коэффициентом избытка воздуха
:
VВ
VВ
0
Разность между практическим и теоретическим объёмами
воздуха называется избытком воздуха VВ :
VВ VВ V
О
В
Из уравнений следует, что
VВ VВ ( 1)
0
13.
Если известно содержание кислорода впродуктах горения, то коэффициент избытка
воздуха определяется по формуле:
O Vпг
1 0
VВ (21 O )
2
2
где O2 - содержание кислорода в продуктах
горения, % об.;
0
VВ - теоретический объём продуктов
горения.
14.
Для веществ у которых объём продуктов горенияравен объёму исходного воздуха (например, углерод),
формула упрощается:
21
21 О2
15.
В случае образования продуктов неполногосгорания (CO, H2, CH4, и др.) формула приобретает
вид:
21
21 O2 0,5 CO2 0,5 H 2 2 CH 4
где O , CO , H , CH
содержание
соответствующих веществ в продуктах горения, %
об.
2
2
2
4
16.
Часто в пожарно-технических расчётах требуетсяопределить массу воздуха, пошедшего на горение
M В VВ В
В - плотность воздуха, кг/м3.
17. Количество воздуха, необходимого для горения
18.
Расчет объема газообразных продуктовсгорания позволяет правильно подбирать
устройства для сжигания топлив (топки, печи и
т.д.)
Общий объем продуктов сгорания горючего
вещества рассчитывается с учетом объемов
газообразных продуктов, выделяющихся при
сгорании; объема азота, а также объема
водяного пара, образующегося в процессе
горения.
19.
Расчет объема продуктов сгорания зависит отсостава горючего вещества или состава смеси
горючих веществ. В каждом конкретном случае
объем продуктов сгорания рассчитывается с
учетом этих особенностей.
Состав продуктов сгорания (в объемных %),
возникающих во время пожара в различных
помещениях, показывает, что в них всегда
содержится значительное количество
кислорода.
20.
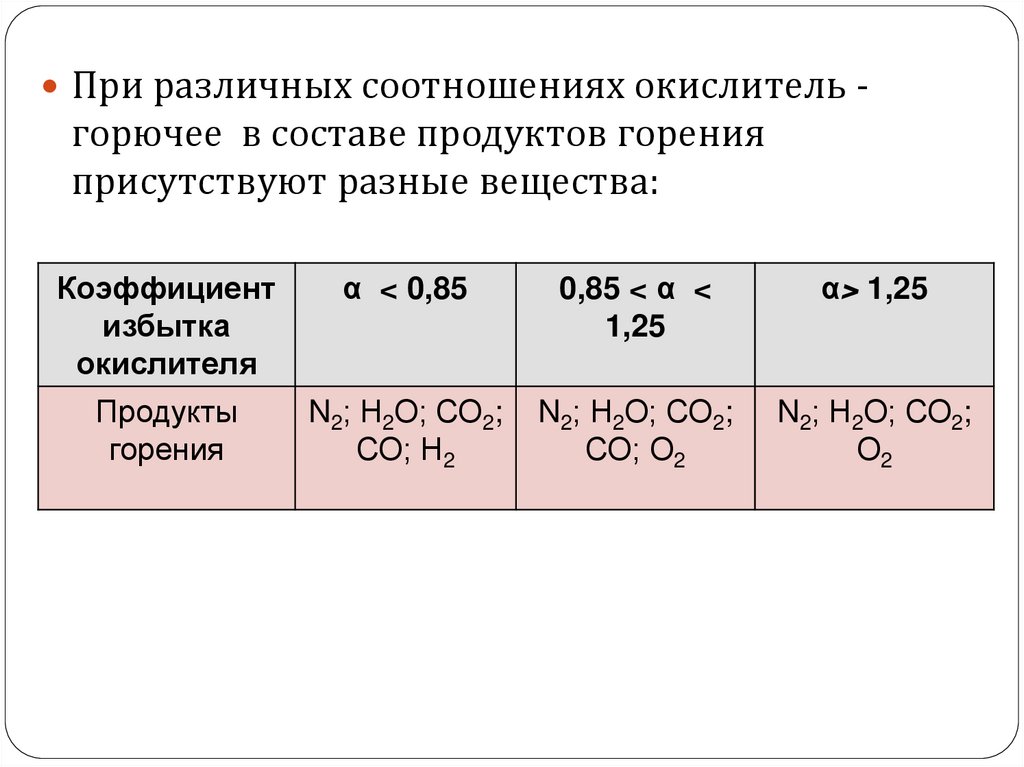
При различных соотношениях окислитель -горючее в составе продуктов горения
присутствуют разные вещества:
Коэффициент
избытка
окислителя
α < 0,85
0,85 < α <
1,25
α> 1,25
Продукты
горения
N2; Н2О; СО2;
СО; Н2
N2; Н2О; СО2;
СО; О2
N2; Н2О; СО2;
О2
21. При необходимости получения точных данных о составе продуктов горения составляют систему уравнений
уравнения констант равновесия реакцийдиссоциации;
уравнения баланса элементов, входящих в
горючую смесь;
уравнения полного давления продуктов горения.
При горении веществ, молекулы которых состоят из
атомов углерода, водорода, кислорода и азота, в
воздухе или кислороде образуются продукты
сгорания, содержащие только четыре элемента: С,
Н, О и N.
22.
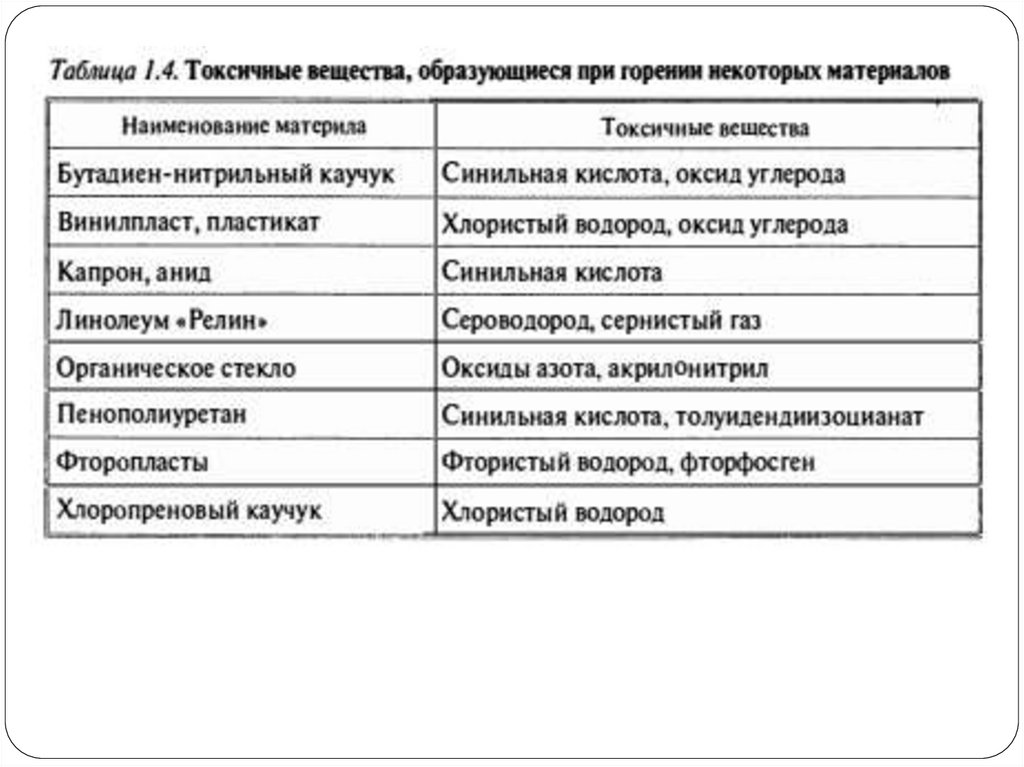
Наличие кислорода в продуктах сгоранияуказывает на то, что горение в условиях
пожара происходит всегда при избытке
воздуха.
В продуктах сгорания могут содержаться
самые разные вещества, в том числе и
токсичные, например, хлористый водород,
сероводород, оксиды азота, синильная кислота
и др.
23.
24.
Тип горючего веществаРасчетные формулы
0
V ПГ
Индивидуальное
вещество
V
0
n
nГ
V0 n ПГi
nГ M
VCO2 1.86
VH 2O 11.2
Вещество сложного
состава
C
100
H
W
1.24
100
100
VSO2 0.7
VN 2
ПГi
S
100
1
O
7
C
21
H
2
.
63
S
0
.
8
N
100
8
0
VПГ
VПГi
Смесь газов
1 n ПГi Гi
НДi
VПГi 100 n
Г
25.
0Здесь VПГ
-теоретический объём продуктов горения;
nПГi -количество
i-го
продукта
горения
в
уравнении
0
V
n
реакции, кмоль;
Г -количество горючего, кмоль;
объём 1 кмоля газа;
M -молекулярная масса горючего;
VПГi -объём i-го продукта реакции; C, H, S, O, N –
содержание
соответствующих
элементов
(углерода,
водорода, серы, кислорода и азота) в горючем веществе, %
вес; Гi -содержание i-го горючего компонента в газовой
смеси, %об.; nПГi - содержание i-го негорючего компонента
в составе газовой смеси, % об.
26.
Практический (полный) объём продуктов горениясостоит из теоретического объёма продуктов горения и
избытка воздуха
0
VПГ VПГ
VВ
или
0
VПГ VПГ
VВ0 1
27.
Состав продуктов горения, т.е. содержание i-гокомпонента определяется по формуле
VПГi
ПГi
100
VПГi
где ПГi - содержание I - го компонента в продуктах
сгорания, % об.;
VПГi - объём I - го компонента, м , кмоль;
VПГi - полный объём продуктов горения, м ,
3
3
кмоль.
28.
При горении в избытке воздуха в продуктахгорения содержится кислород и азот
VO 0.21 VB
2
VN V 0.79 VB
0
N2
2
0
N 2 -теоретический
где V
горения, м3, кмоль.
объём азота в продуктах
VN02 0.79VB0

























 chemistry
chemistry








