Similar presentations:
-124378
1. ТРАНСЛЯЦИЯ. ПОСТ-ТРАНСЛЯЦИОННЫЕ ИЗМЕНЕНИЯ БЕЛКА.
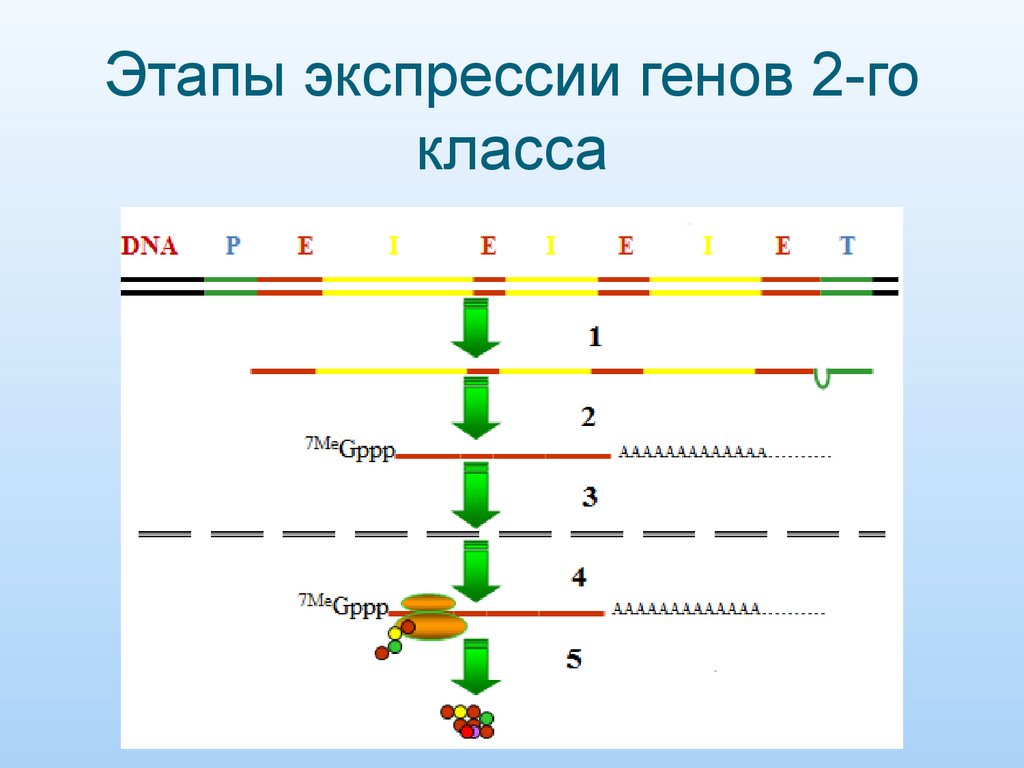
2. Этапы экспрессии генов 2-го класса
3.
https://www.youtube.com/watch?v=NDIJexTT9j0https://www.youtube.com/watch?v=gG7uCskUOrA
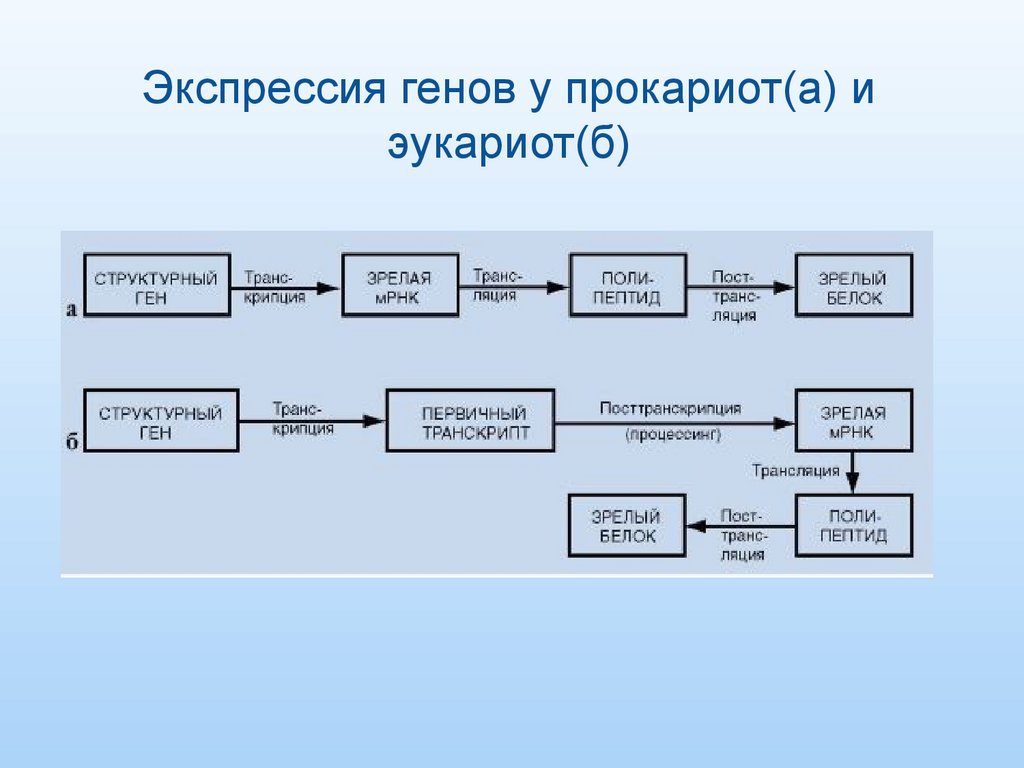
4. Экспрессия генов у прокариот(a) и эукариот(б)
5.
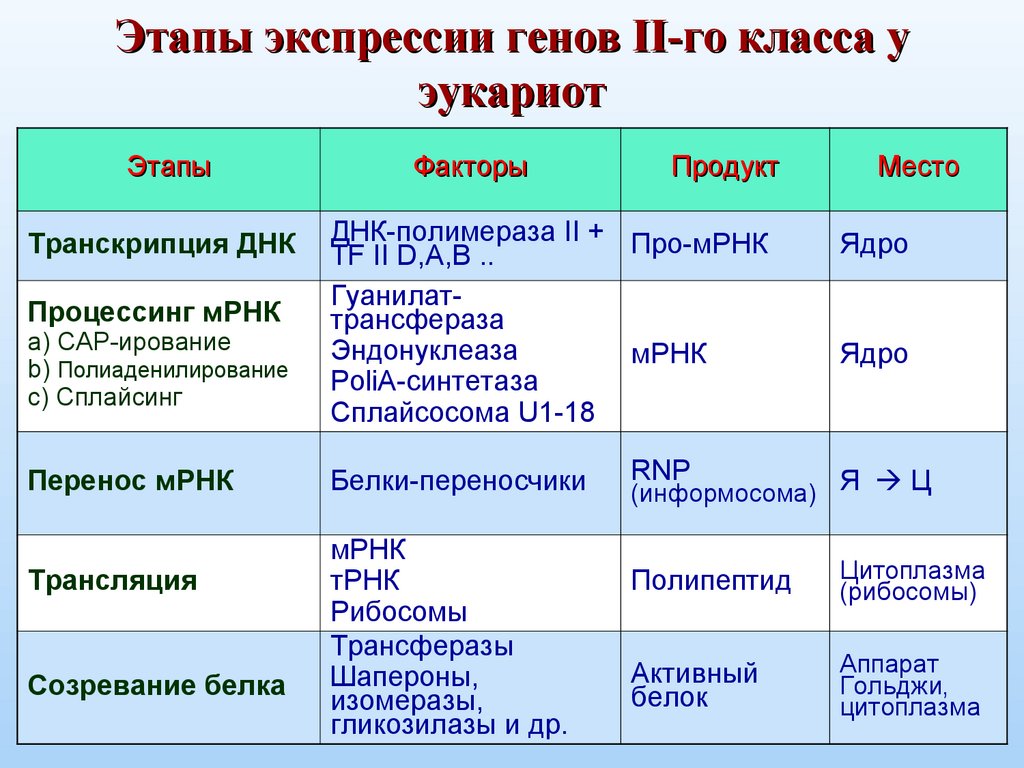
Этапы экспрессии генов II-го класса уэукариот
Этапы
Транскрипция ДНК
Процессинг мРНК
a) CAP-ирование
b) Полиаденилирование
c) Сплайсинг
Перенос мРНК
Трансляция
Созревание белка
Факторы
Продукт
ДНК-полимераза II + Про-мРНК
TF II D,A,B ..
Гуанилаттрансфераза
Эндонуклеаза
мРНК
PoliA-синтетаза
Сплайсосома U1-18
Белки-переносчики
мРНК
тРНК
Рибосомы
Трансферазы
Шапероны,
изомеразы,
гликозилазы и др.
Место
Ядро
Ядро
RNP
(информосома) Я Ц
Полипептид
Цитоплазма
(рибосомы)
Активный
белок
Аппарат
Гольджи,
цитоплазма
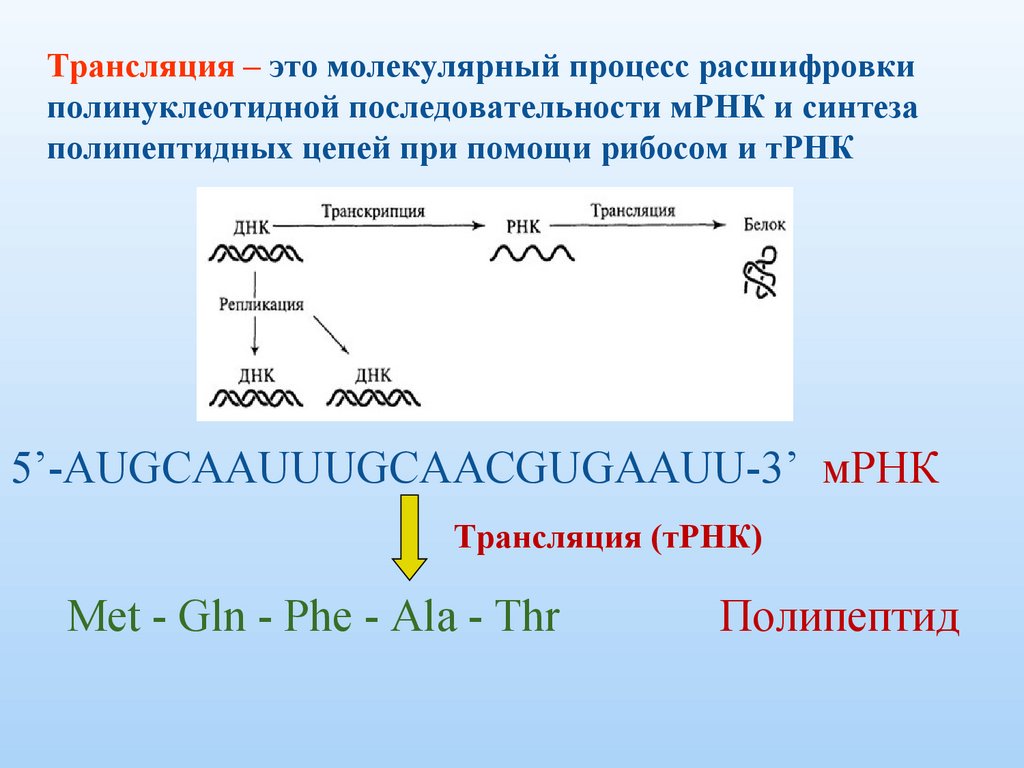
6.
Трансляция – это молекулярный процесс расшифровкиполинуклеотидной последовательности мРНК и синтеза
полипептидных цепей при помощи рибосом и тРНК
5’-AUGCAAUUUGCAACGUGAAUU-3’ мРНК
Трансляция (тРНК)
Met - Gln - Phe - Ala - Thr
Полипептид
7.
Принципы трансляции•Матричный синтез
•Комплементарный и колинеарный синтез
•Расшифровка генетического кода в
направлении 5’ – 3’
• Однонаправленный синтез полипептида: в
направлении +NH3…..COO-,
• AUG – кодон инициации
•UAG или UGA или UAA – кодоны STOP
• Происходит в рибосомах
8.
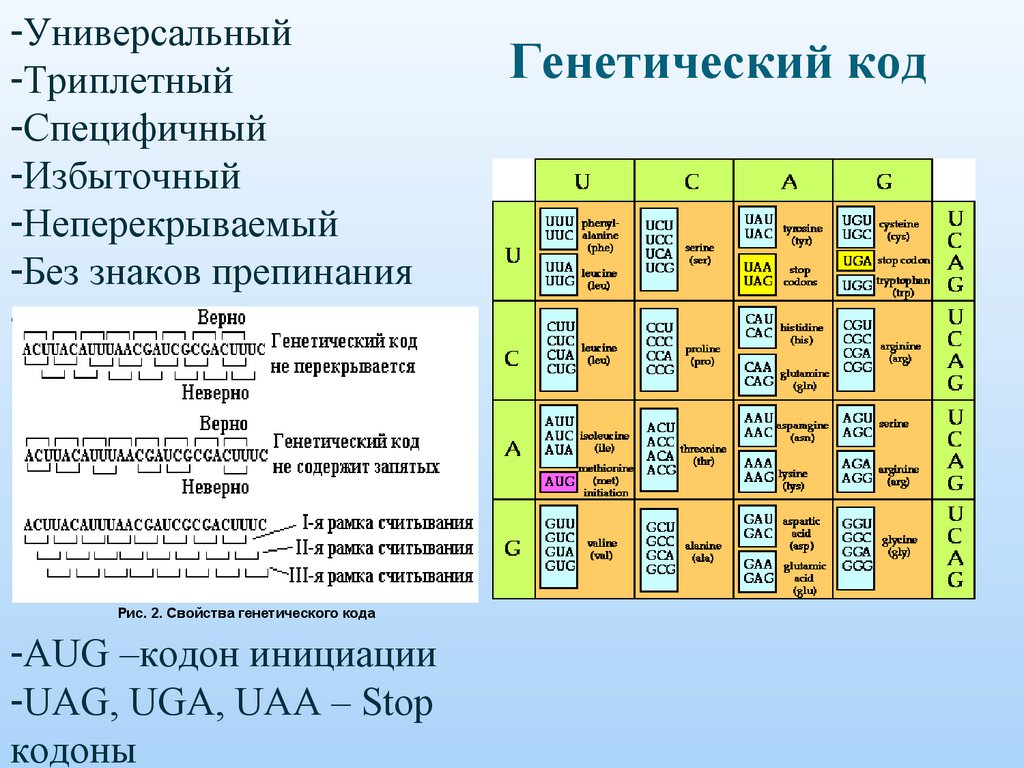
-Универсальный-Триплетный
-Специфичный
-Избыточный
-Неперекрываемый
-Без знаков препинания
-
Рис. 2. Свойства генетического кода
-AUG –кодон инициации
-UAG, UGA, UAA – Stop
кодоны
Генетический код
9.
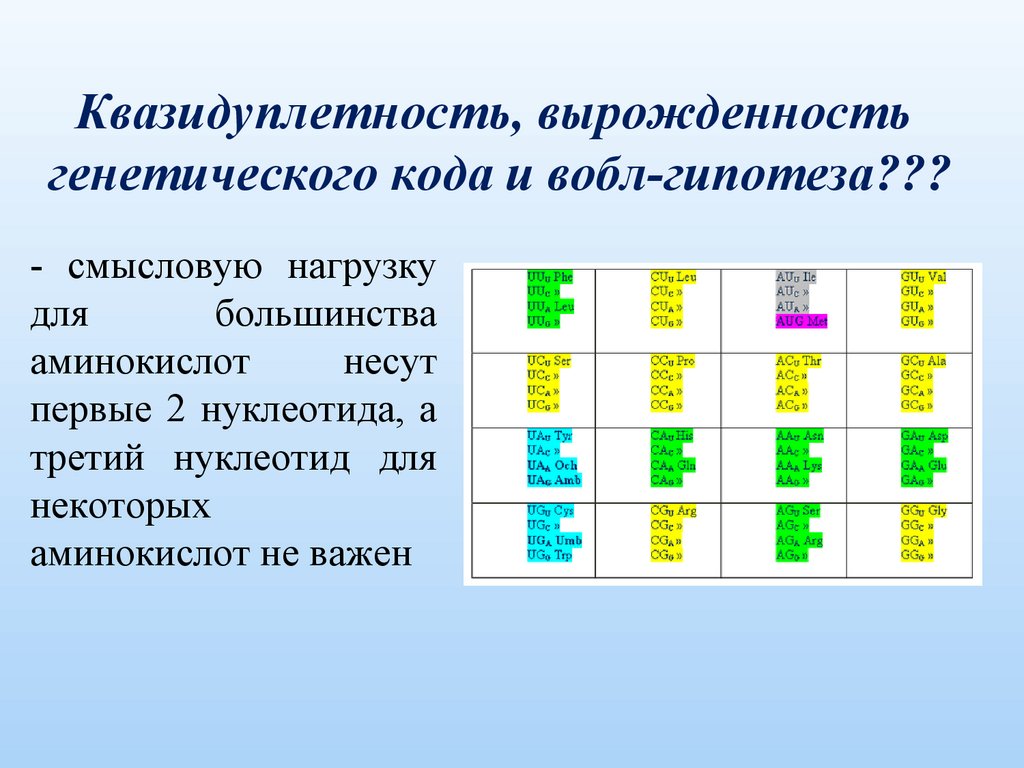
Квазидуплетность, вырожденностьгенетического кода и вобл-гипотеза???
- смысловую нагрузку
для
большинства
аминокислот
несут
первые 2 нуклеотида, а
третий нуклеотид для
некоторых
аминокислот не важен
10.
Аппарат трансляции:мРНК – матрица для синтеза полипептида
тРНК – перевод генетического кода и транспорт
аминокислот
Рибосомы – место трансляции
Аминокислоты – мономеры синтеза
Аминоацил-тРНК-синтетазы – активаторы тРНК
Пептидилтрансфераза – создание пептидных
связей между каждой новой аминокислотой и
предыдущей в растущей полипептидной цепи
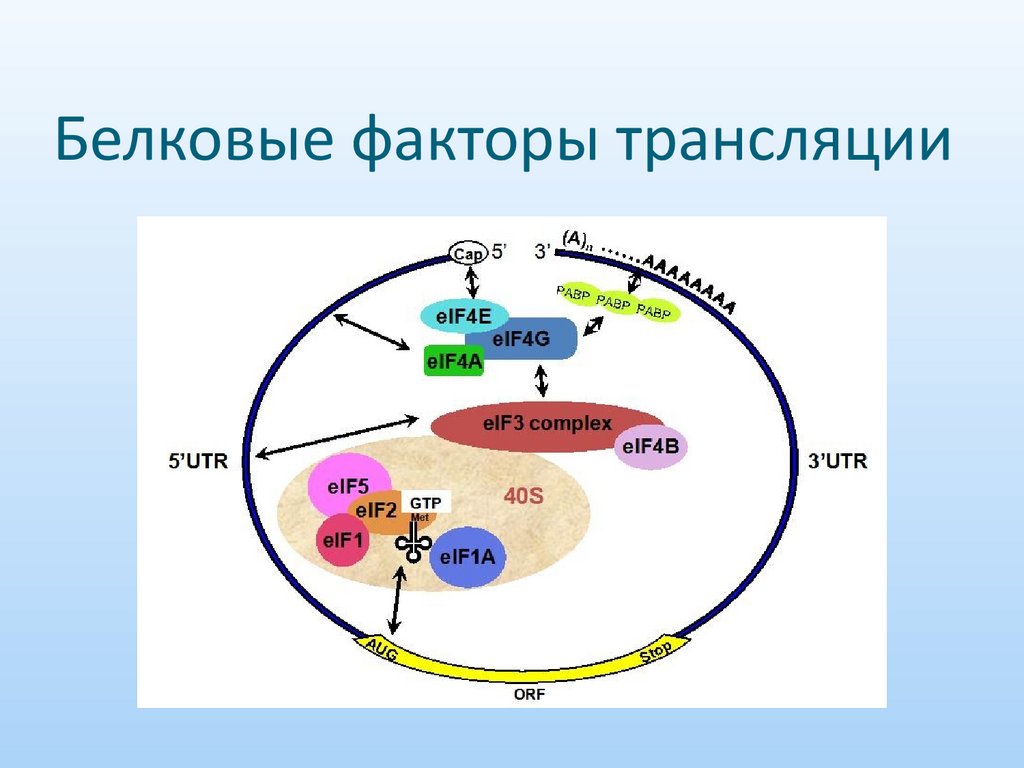
Белковые факторы трансляции
ATP, GTP – источник энергии
Mg++, Ca++ - кофакторы ферментов
11.
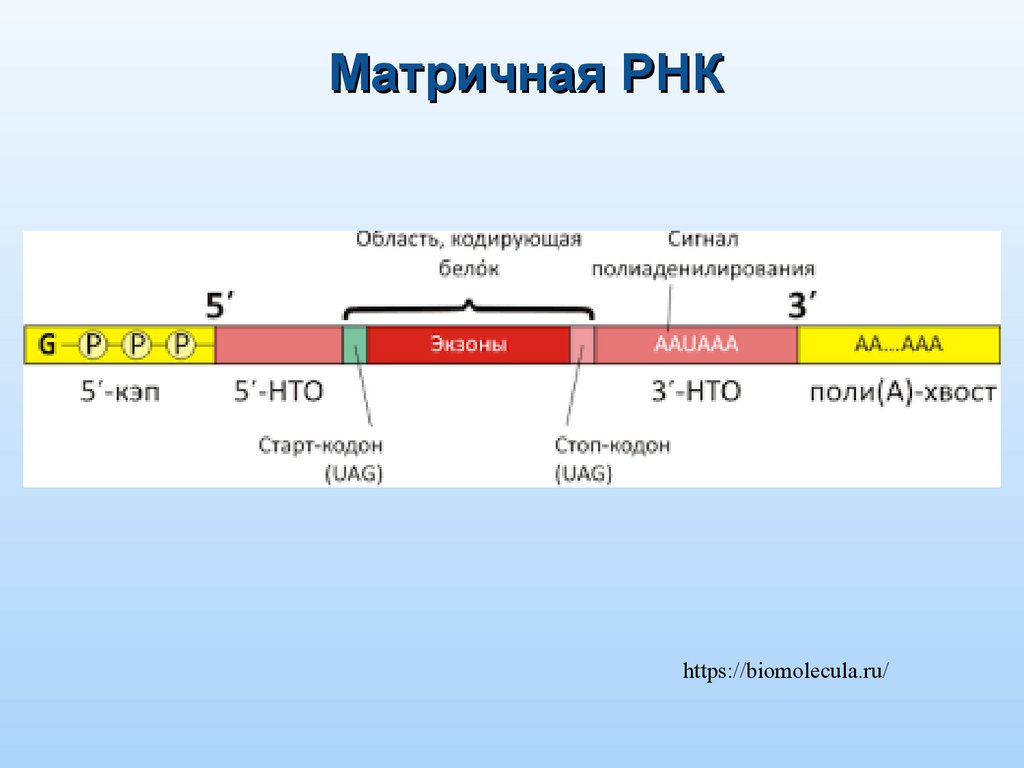
Матричная РНКhttps://biomolecula.ru/
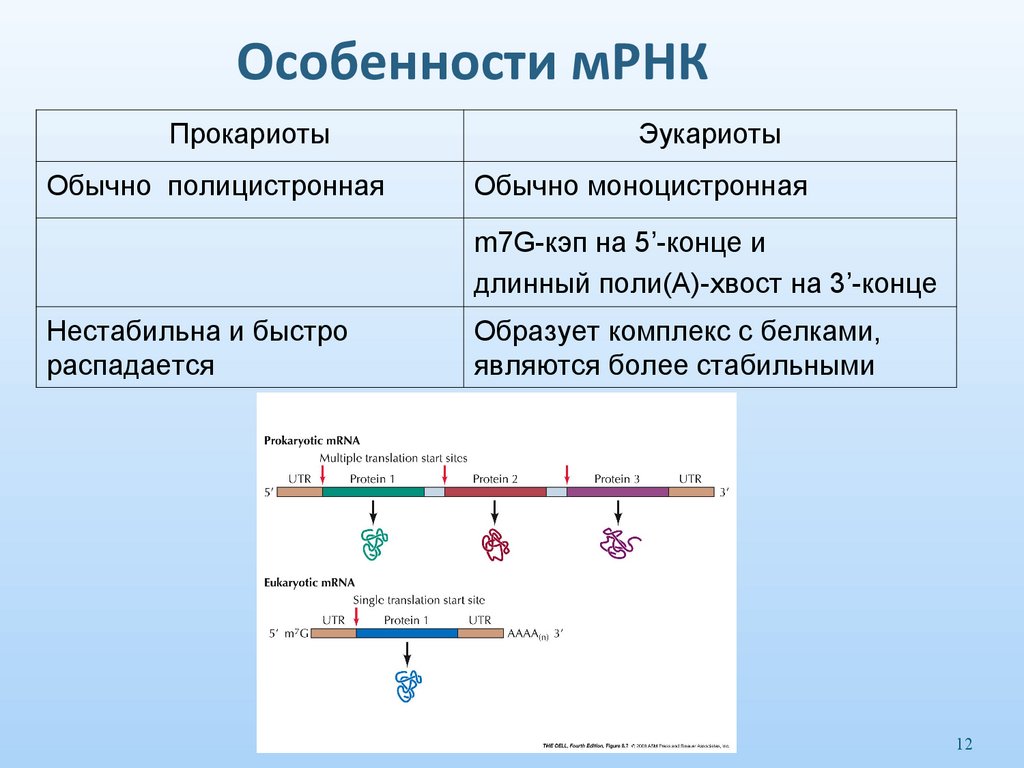
12. Особенности мРНК
ПрокариотыОбычно полицистронная
Эукариоты
Обычно моноцистронная
m7G-кэп на 5’-конце и
длинный поли(А)-хвост на 3’-конце
Нестабильна и быстро
распадается
Образует комплекс с белками,
являются более стабильными
12
13.
Особенности мРНК эукариотСпецифические последовательности в мРНК
отвечают за регуляцию ее матричной активности в
белковом синтезе
Особые структурные элементы в мРНК определяют
время жизни мРНК в клетке
Специфические последовательности в мРНК
отвечают за ее внутриклеточную локализацию
14.
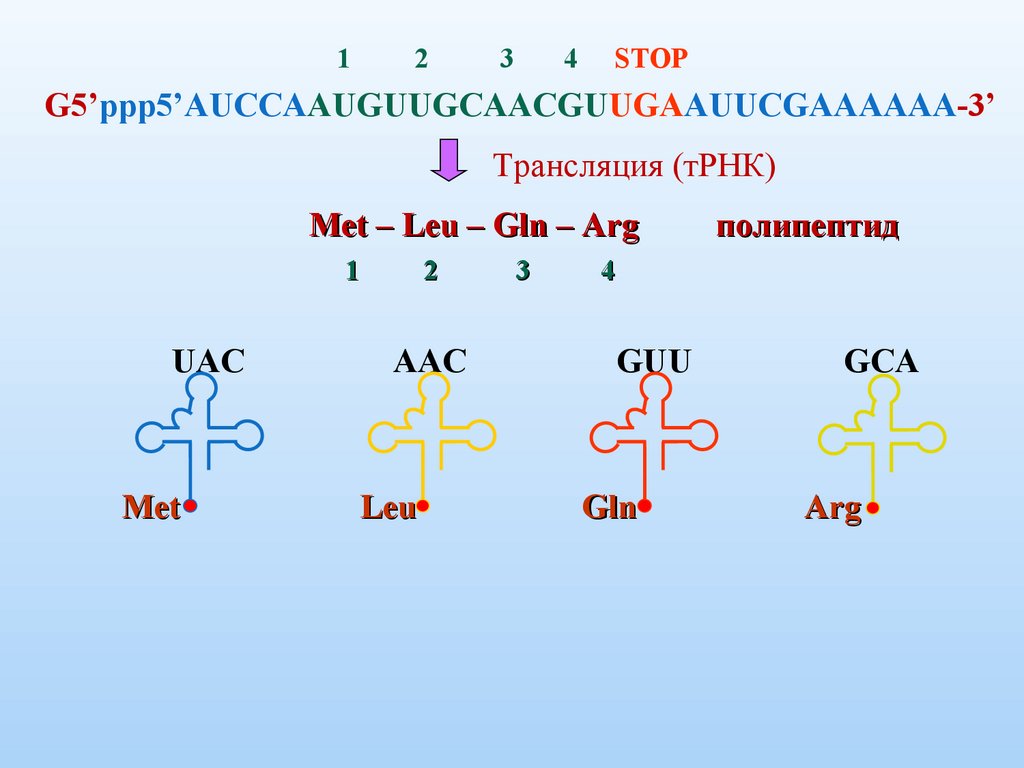
12
3
4
STOP
G5’ppp5’AUCCAAUGUUGCAACGUUGAAUUCGAAAAAA-3’
Трансляция (тРНК)
Met – Leu – Gln – Arg
1
UAC
Met
2
AAC
Leu
3
полипептид
4
GUU
Gln
GCA
Arg
15.
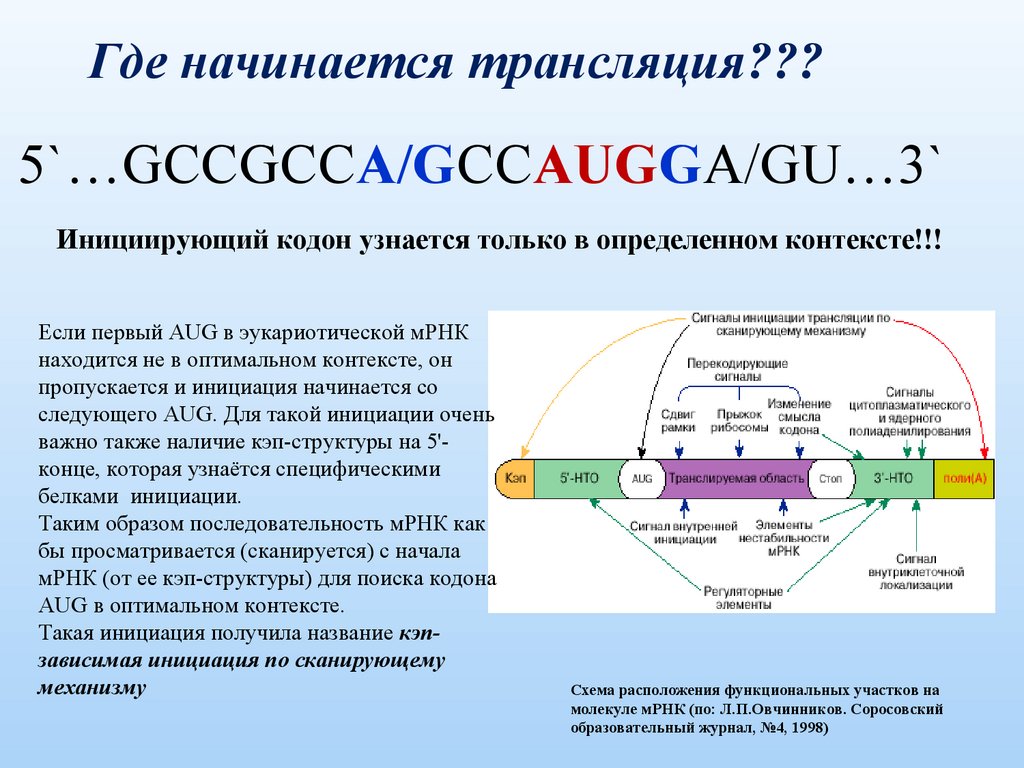
Где начинается трансляция???5`…GCCGCCA/GCCAUGGA/GU…3`
Инициирующий кодон узнается только в определенном контексте!!!
Если первый AUG в эукариотической мРНК
находится не в оптимальном контексте, он
пропускается и инициация начинается со
следующего AUG. Для такой инициации очень
важно также наличие кэп-структуры на 5'конце, которая узнаётся специфическими
белками инициации.
Таким образом последовательность мРНК как
бы просматривается (сканируется) с начала
мРНК (от ее кэп-структуры) для поиска кодона
AUG в оптимальном контексте.
Такая инициация получила название кэпзависимая инициация по сканирующему
механизму
Схема расположения функциональных участков на
молекуле мРНК (по: Л.П.Овчинников. Соросовский
образовательный журнал, №4, 1998)
16.
Распад мРНКУ прокариот в одно и то же время могут происходить три
процесса: удлинение мРНК в процессе транскрипции,
трансляция мРНК при участии нескольких рибосом и ее
распад путем постепенного укорачивания с 5' конца за счет
действия РНК-азы.
У эукариот продолжительность существования мРНК в
клетке существенно больше – от 1- минут до 2-х суток.
Короткоживущими являются мРНК регуляторных белков для
того, чтобы клетка при изменении каких-то условий смогла
быстро реагировать изменением синтеза данных белков.
Распад мРНК у эукариот происходит с 3' конца и
осуществляется 3'-РНК-азами. Причем этот процесс
происходит периодически – после каждого акта трансляции
отщепляется по 10-15 нуклеотидов. Когда в этом фрагменте
остается около 50-ти нуклеотидов, мРНК становится
доступной для РНК-аз.
17.
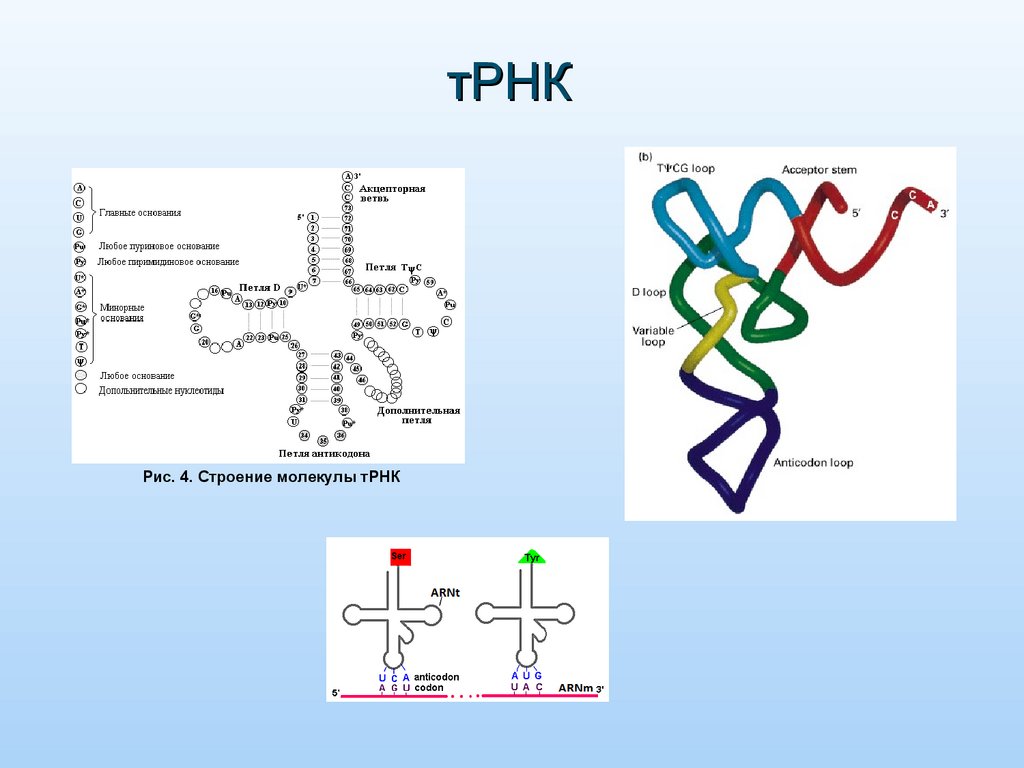
тРНКРис. 4. Строение молекулы тРНК
18.
Сколько типов тРНК в клетке???20?
64?
61?
…?
Согласно данным «Genomic tRNA Database» в
эукариотической клетке функционируют около 500
молекул тРНК, принадлежащие к 45 типам.
19.
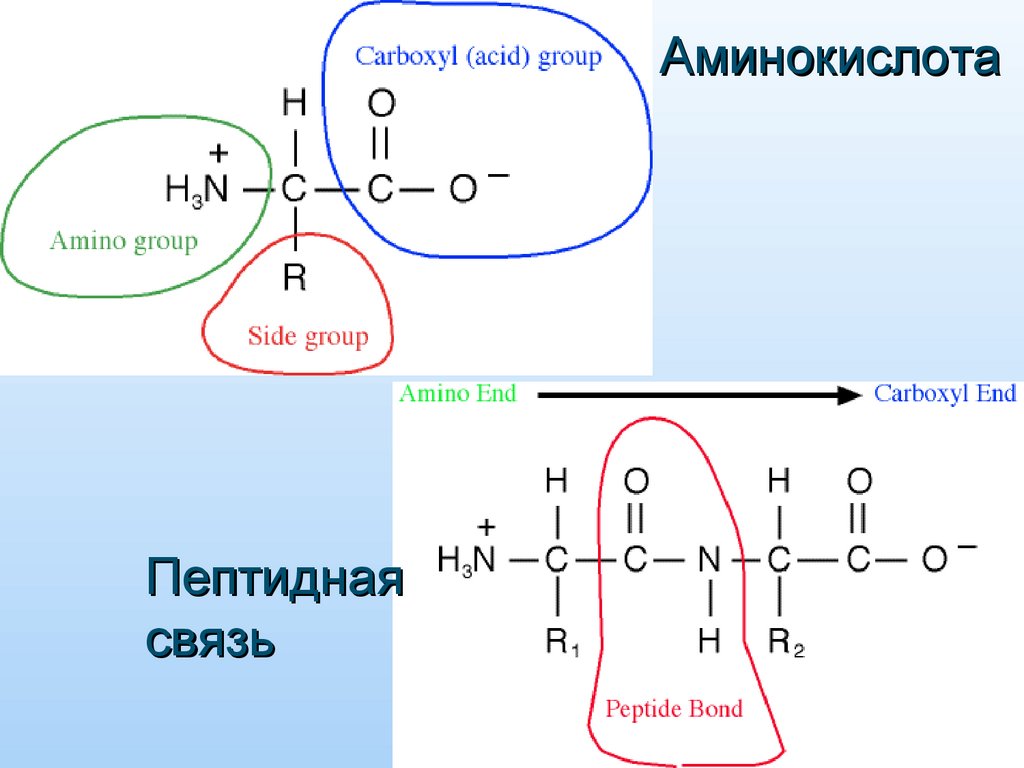
АминокислотаПептидная
связь
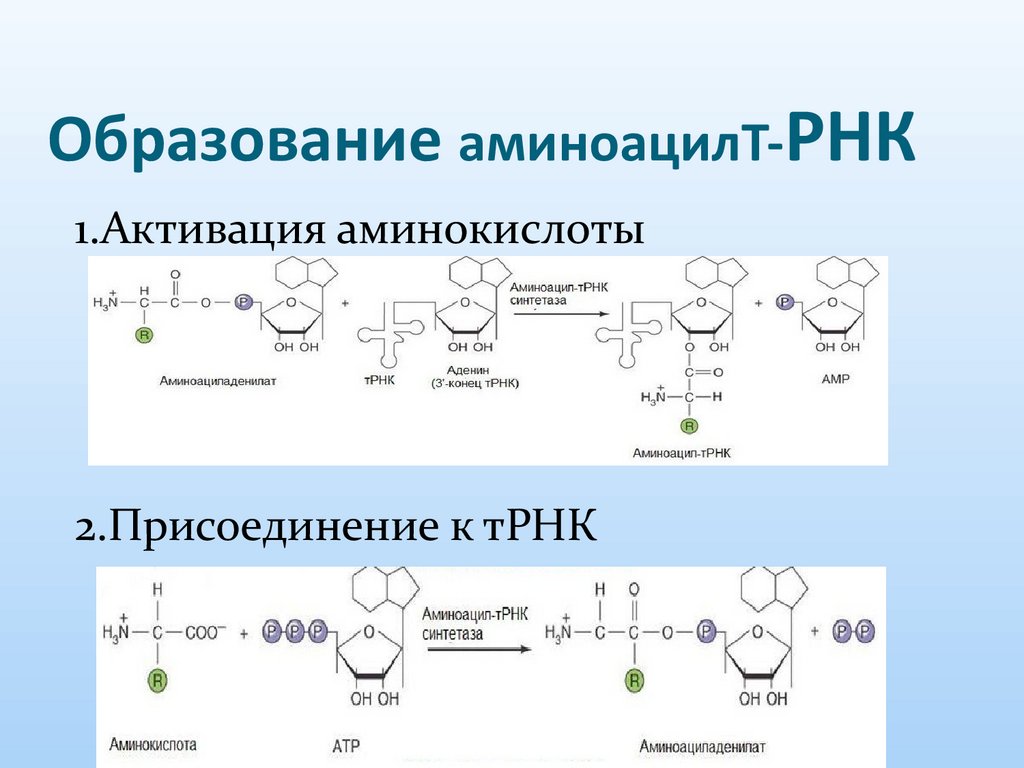
20. Образование аминоацилТ-РНК
1.Активация аминокислоты2.Присоединение к тРНК
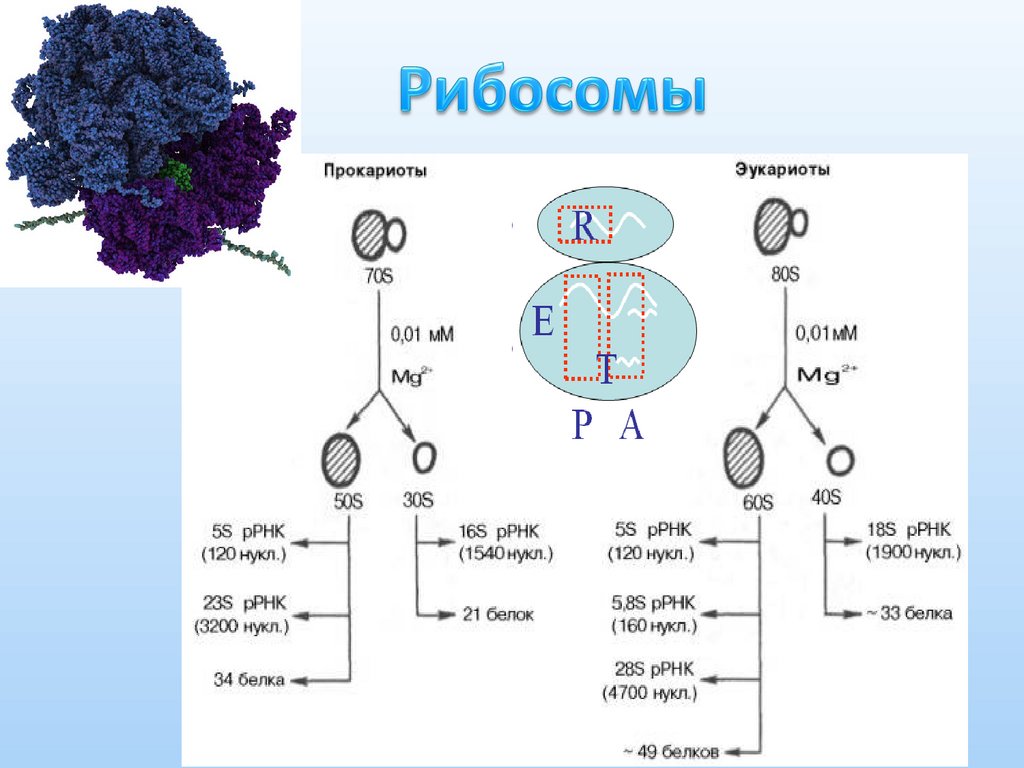
21. Рибосомы
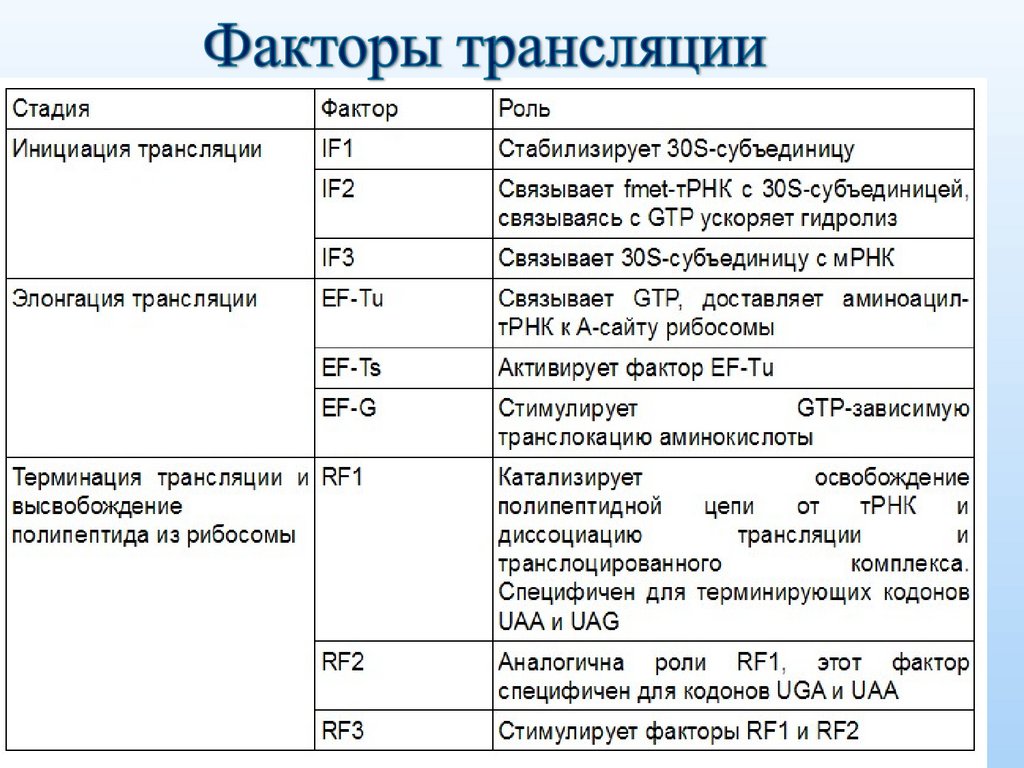
22. Белковые факторы трансляции
23.
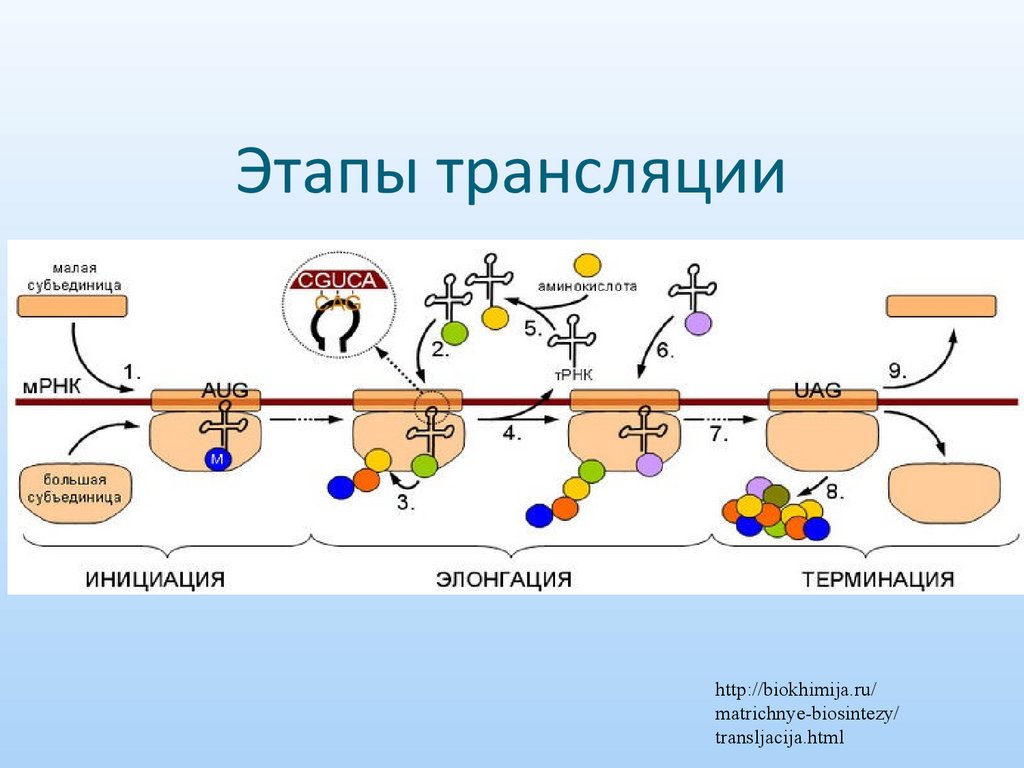
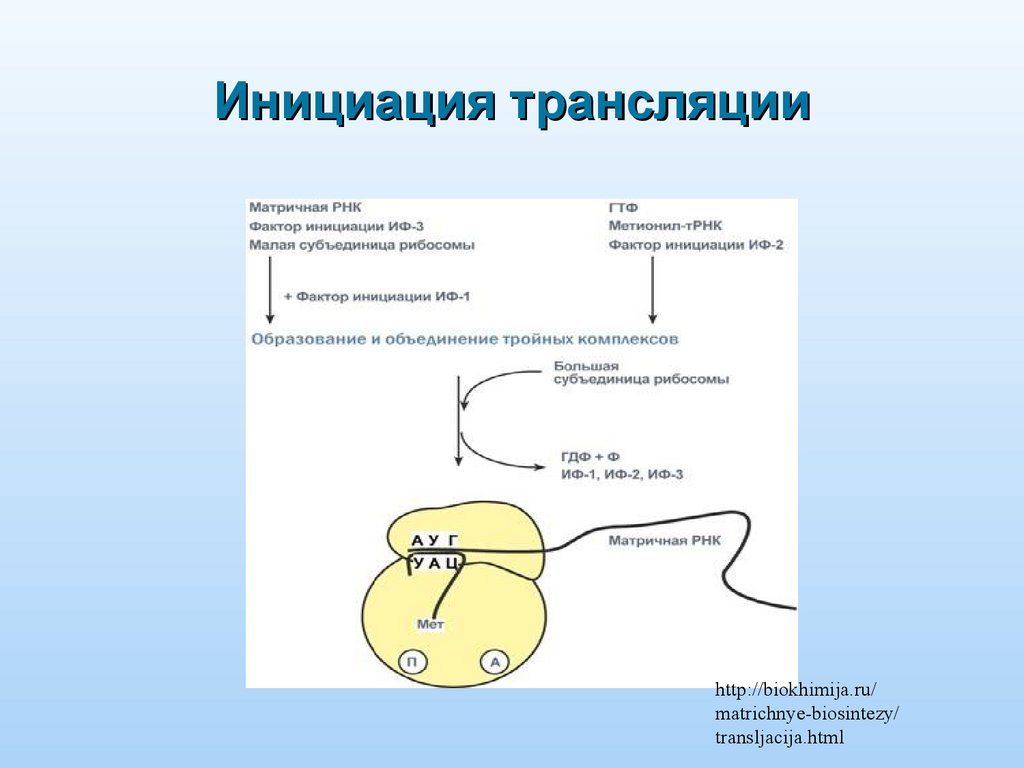
Этапы трансляции:Инициация: образование комплекса
инициации
тРНКMet+мРНК+40S+60S
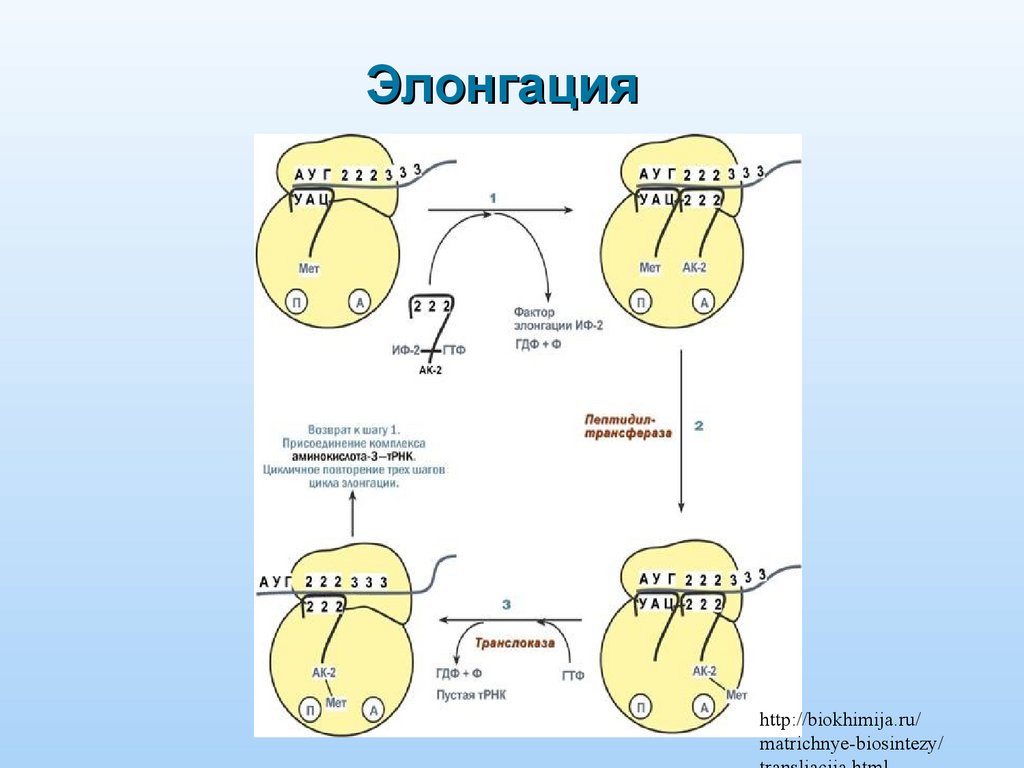
Элонгация: удлинение полипептида
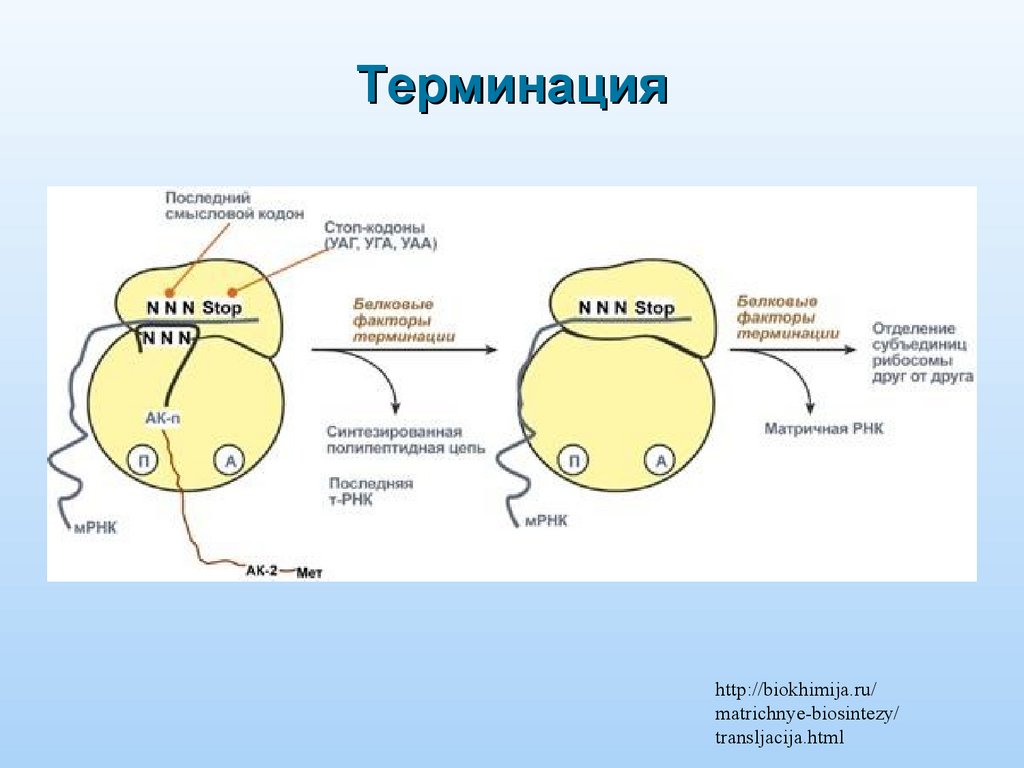
Терминация: STOP кодон +
диссоциация аппарата трансляции
24.
25. Этапы трансляции
http://biokhimija.ru/matrichnye-biosintezy/
transljacija.html
26.
Инициация трансляцииhttp://biokhimija.ru/
matrichnye-biosintezy/
transljacija.html
27.
Элонгацияhttp://biokhimija.ru/
matrichnye-biosintezy/
28.
Терминацияhttp://biokhimija.ru/
matrichnye-biosintezy/
transljacija.html
29.
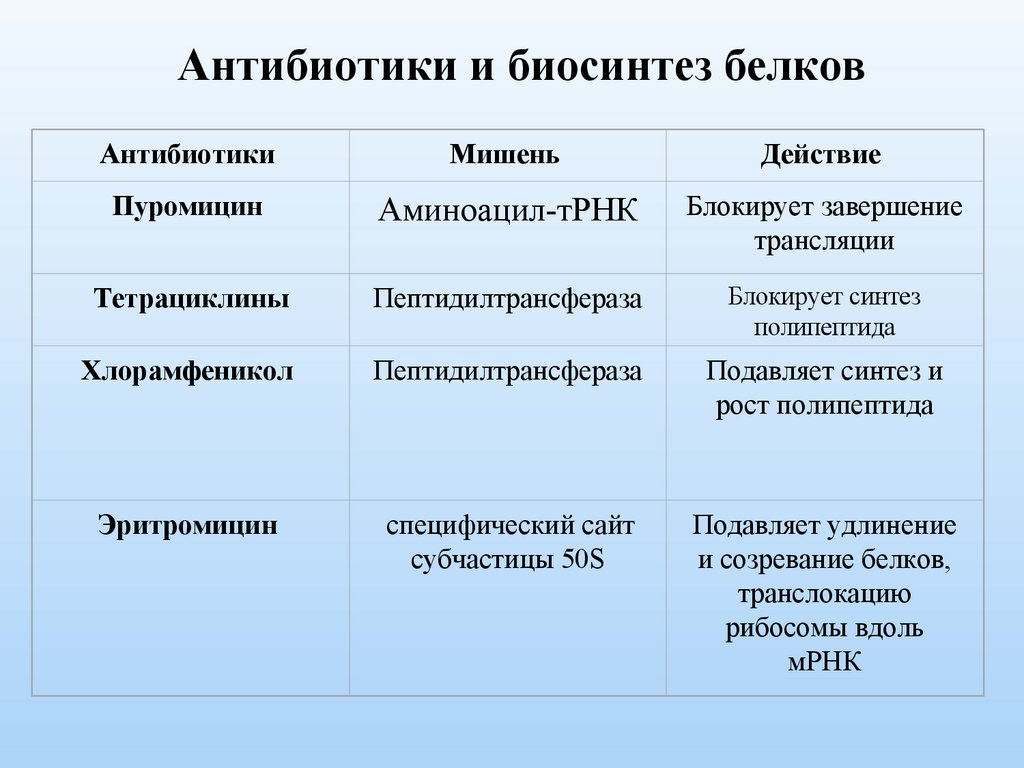
Антибиотики и биосинтез белковАнтибиотики
Мишень
Действие
Пуромицин
Аминоацил-тРНК
Блокирует завершение
трансляции
Тетрациклины
Пептидилтрансфераза
Блокирует синтез
полипептида
Хлорамфеникол
Пептидилтрансфераза
Подавляет синтез и
рост полипептида
Эритромицин
специфический сайт
субчастицы 50S
Подавляет удлинение
и созревание белков,
транслокацию
рибосомы вдоль
мРНК
30.
Процессинг (созревание) белка1. Конформация (фолдинг) – приобретение
функциональной конфигурации
2. Объединение полипептидов и образование
сложных белков
3. Качественные изменения полипептида:
- обратимые (ацетилирование, фосфорилирование);
- постоянные (гликозилирование, добавление
липидов, расщепление)
4. Взаимодействие с кофакторами (Fe++, Zn++...)
5. Присоединение коферментов (биотина, липоевой
кислоты или пиридоксальфосфата)
6. Протеолитическое расщепление белков
31.
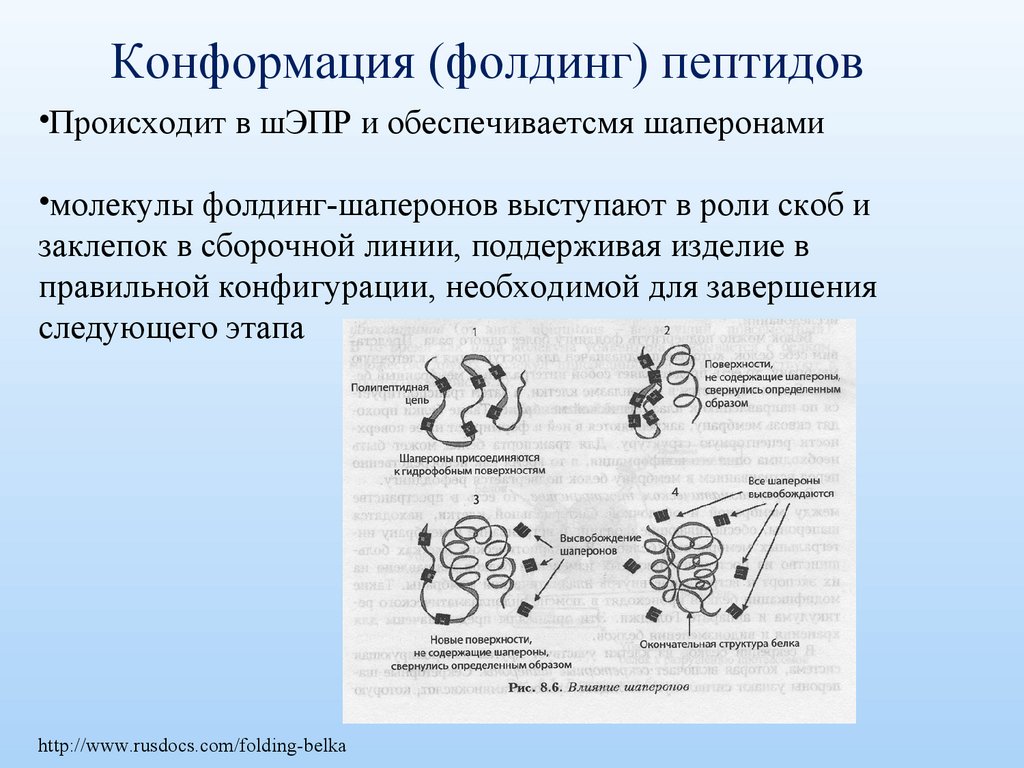
Конформация (фолдинг) пептидов•Происходит в шЭПР и обеспечиваетсмя шаперонами
•молекулы фолдинг-шаперонов выступают в роли скоб и
заклепок в сборочной линии, поддерживая изделие в
правильной конфигурации, необходимой для завершения
следующего этапа
http://www.rusdocs.com/folding-belka
32.
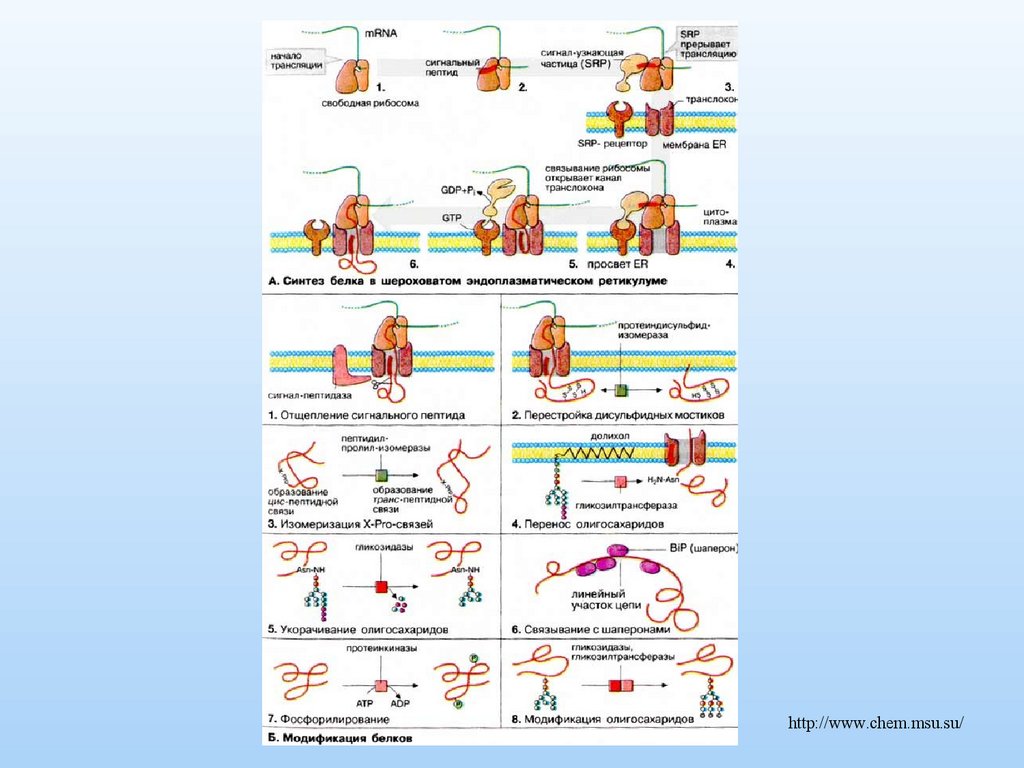
http://www.chem.msu.su/33.
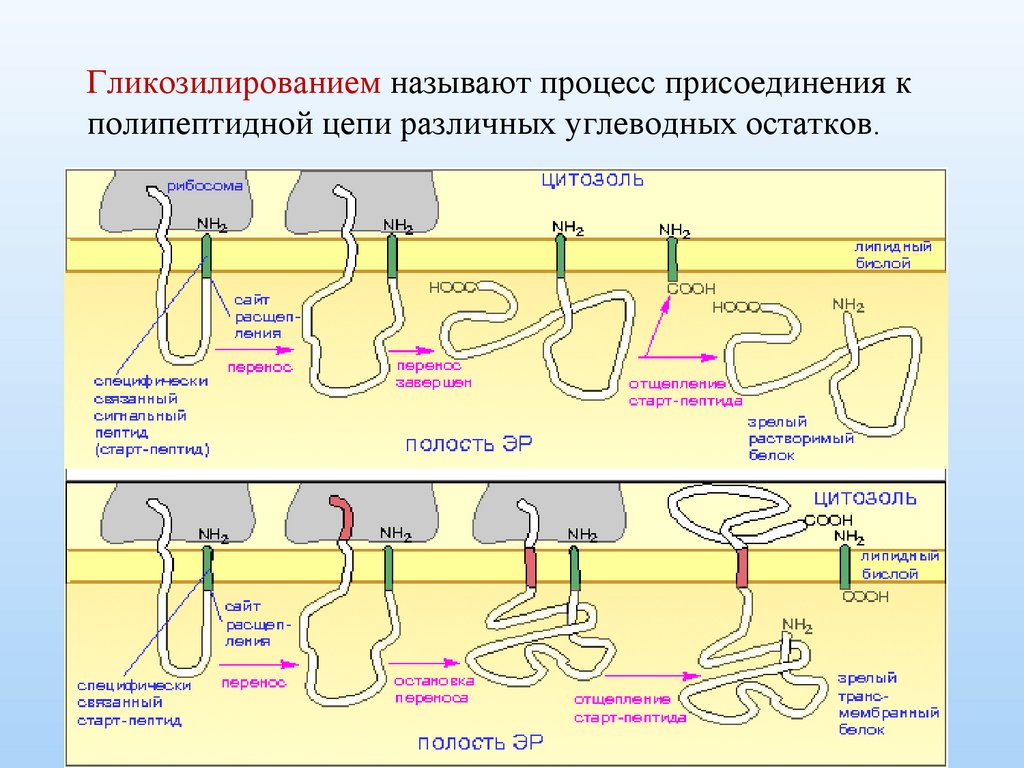
Гликозилированием называют процесс присоединения кполипептидной цепи различных углеводных остатков.
34.
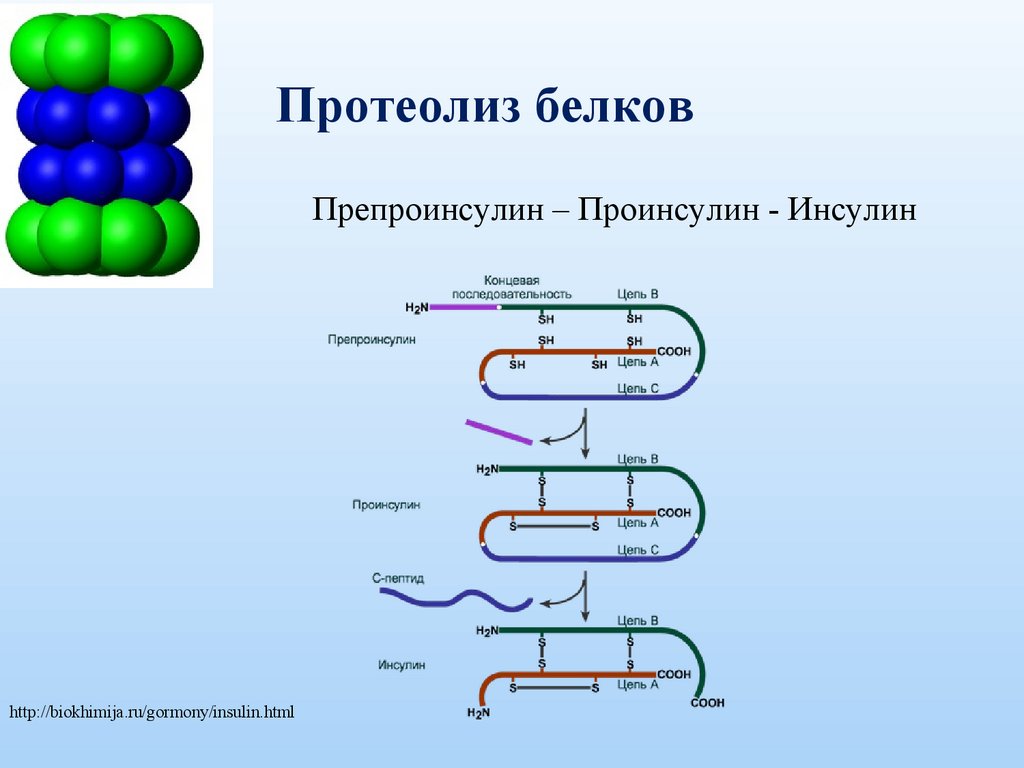
Протеолиз белковПрепроинсулин – Проинсулин - Инсулин
http://biokhimija.ru/gormony/insulin.html
35.
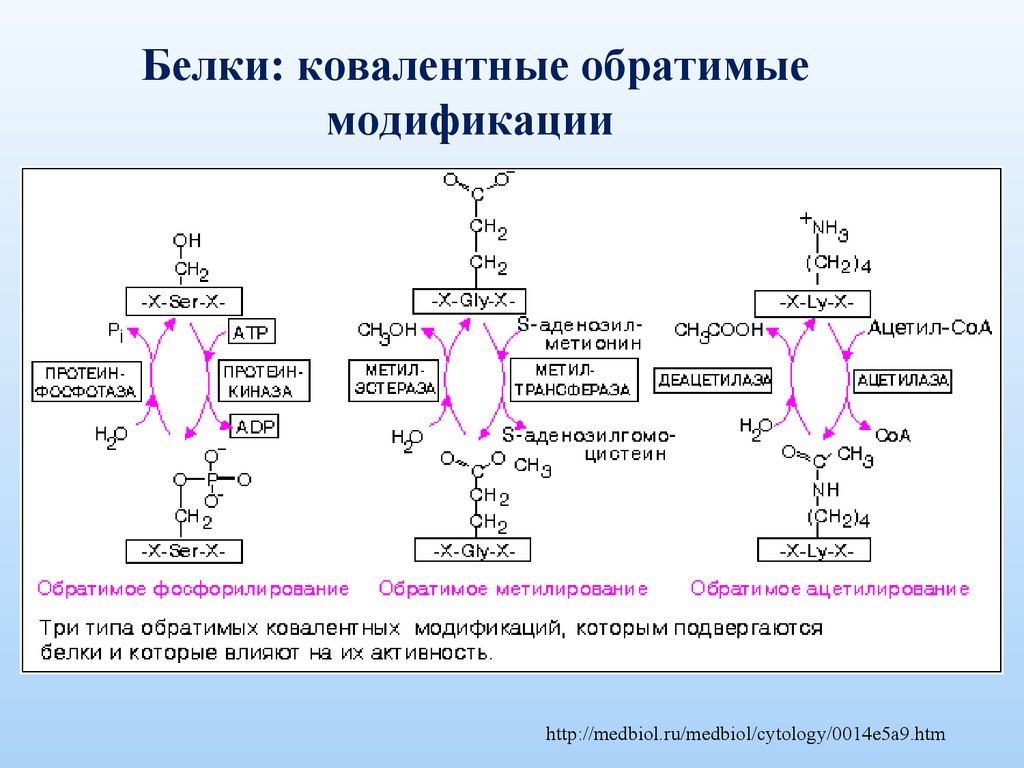
Белки: ковалентные обратимыемодификации
http://medbiol.ru/medbiol/cytology/0014e5a9.htm
36.
Фосфорилирование•является важным регулятором ферментативной
активности
•модифицирует белки добавлением отрицательно
заряженных групп к серинам, тирозинам и
треонинам
•существенно меняет химические свойства белков
В результате белок становится способным
распознавать, связать и активировать свои субстраты.
37.
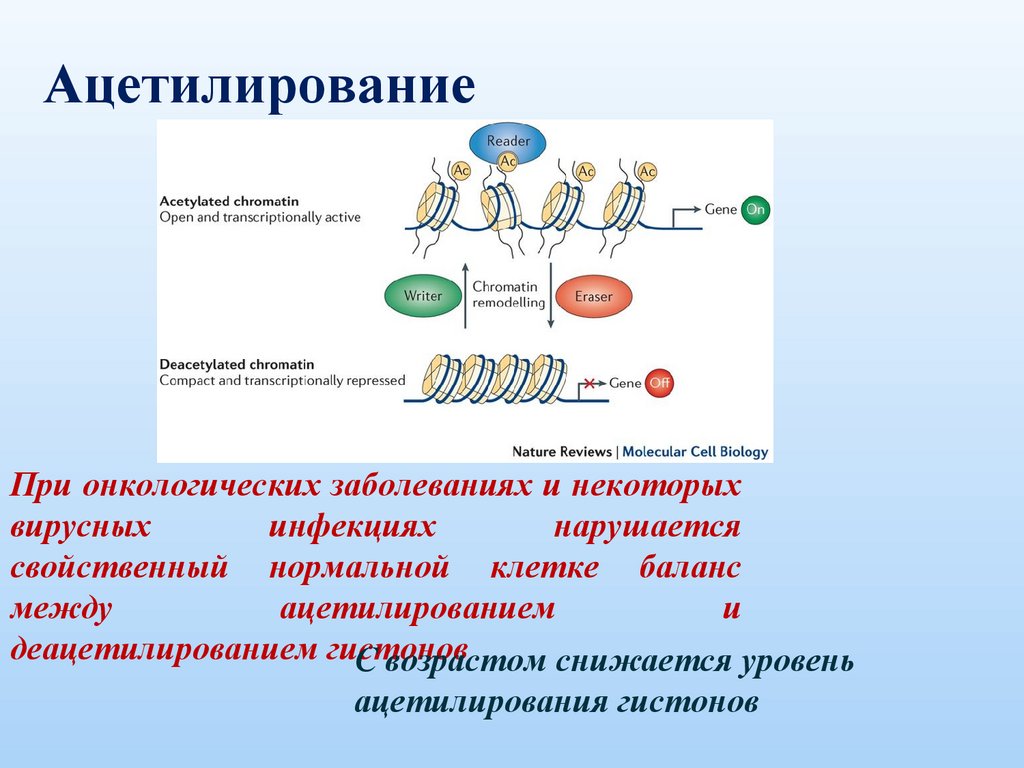
АцетилированиеПри онкологических заболеваниях и некоторых
вирусных
инфекциях
нарушается
свойственный нормальной клетке баланс
между
ацетилированием
и
деацетилированием гистонов
С возрастом снижается уровень
ацетилирования гистонов
38.
Метилирование• обеспечивается метил-трансферазами
•определяет функциональную активность белков
• принимает участие в процессах дифференциации
клеток
•является
одним из параметров, которые
характеризуют функциональное состояние клетки.
39. По времени жизни белки принято делить на четыре группы:
1)очень быстро обновляющиеся белки (1 - 2ч), например, регуляторный белоксупрессор опухолей p53, фермент орнитиндекарбоксилаза, циклины –регуляторы клеточного цикла;
2) быстро обновляющиеся белки (1 – 24 ч): ферменты РНК-полимераза I,
тирозинаминотрансфераза, белок теплового шока Hsp70, рецептор инсулина,
убиквитин;
3) медленно обновляющиеся белки (1 – 5 дней): тубулины, актины, белки
протеасомы, ферменты каталаза, особые протеиназы катепсины;
4) очень медленно обновляющиеся белки (> 5 дней): гемоглобин, гистоны в
интерфазном ядре, миозин, эластин, коллаген, цитохромы b и c.
39
40.
Нарушения посттранляционных измененийбелков и болезни человека
-Нарушение фолдинга белков лежит в основе болезни
Альцгеймера, при которой в мозге откладывается βамилоид – агрегаты белка, потерявшего свою αспирализацию. Он имеет β-складчатую структуру,
малорастворим и плохо поддается протеолизу. Амилоид
накапливается в нервных клетках, нарушает их функцию
и вызывает гибель.
Источник: https://murzim.ru/nauka/biologiya/molekuljarnajabiologija/25537-posttranslyacionnye-izmeneniya-belkov.html
41.
Прионы как причина болезнейПредполагаемое изменение характера
укладки
полипептидной
цепи
при превращении белка РгРC (а) в
прион РгРSc (б)
-Болезнь Крейтцфельда-Якоба
-Фатальная семейная бессоница
-Болезнь Куру
42.
Посттрансляционная модификация являетсяодним из механизмов разнообразия белков в
клетке человека!!!
43.
Движение – это жизнь!Гиппократ
















 biology
biology








