Similar presentations:
7b6b1f68e51d4132a477a931548d146b
1. Ацетиленовые углеводороды
Алкины2.
Алкины -вещества, в структурекоторых имеется тройная
связь
(третье валентное состояние)
Общая формула СnН2n-2
3.
4.
При тройной связи закладываетсялинейное расположение частей
молекулы под углом 180° и
сокращается межатомное
С-С расстояние 0,120нм
5.
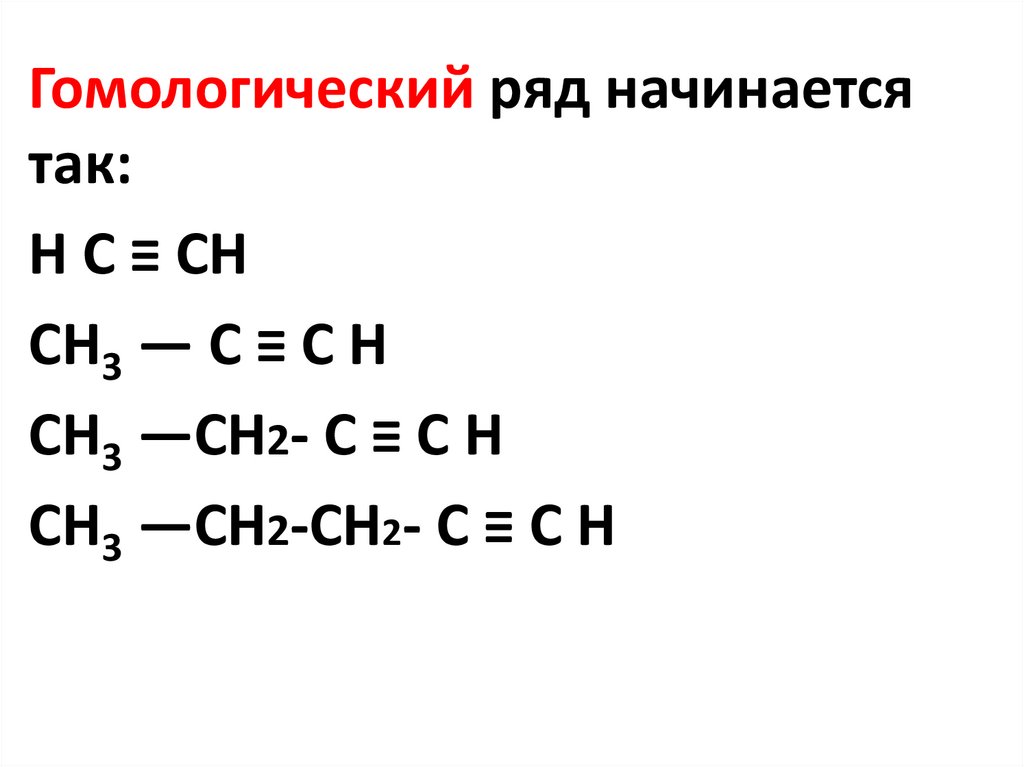
Гомологический ряд начинаетсятак:
H C ≡ CH
CH3 — C ≡ C H
CH3 —CH2- C ≡ C H
CH3 —CH2-CH2- C ≡ C H
6.
Для двух последних в этом рядувеществ возможны изомеры по
положению тройной связи:
CH3 — C ≡ C –СН3
CH3 —CH2 - C ≡ C –СН3
7.
Кроме такой изомерии, имеетсяизомерия скелета и межклассовая с
диеновыми углеводородами
CH3 —CH2- C ≡ C H
бутин-1
CH2 =CH- C H= C H2 бутадиен-1,3
8.
Геометрическая изомерия здесьотсутствует,
так как при тройной связи не может
быть двух заместителей
(валентности просто заняты)
CH3 — C ≡ C – CH3
9.
Алкины, как и алкены, имеютнепредельный характер.
Для них также наиболее характерными
будут реакции присоединения
гидрирование
галогенирование
гидрогалогенирование
10.
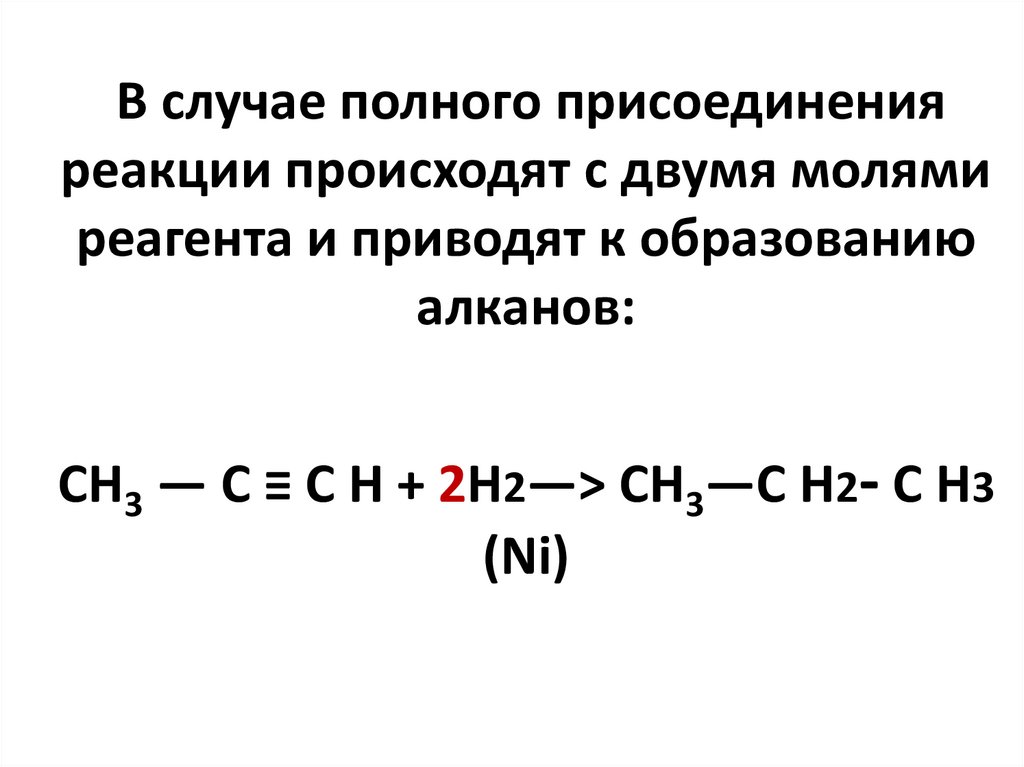
В случае полного присоединенияреакции происходят с двумя молями
реагента и приводят к образованию
алканов:
CH3 — C ≡ C H + 2H2—> CH3—C H2- C H3
(Ni)
11.
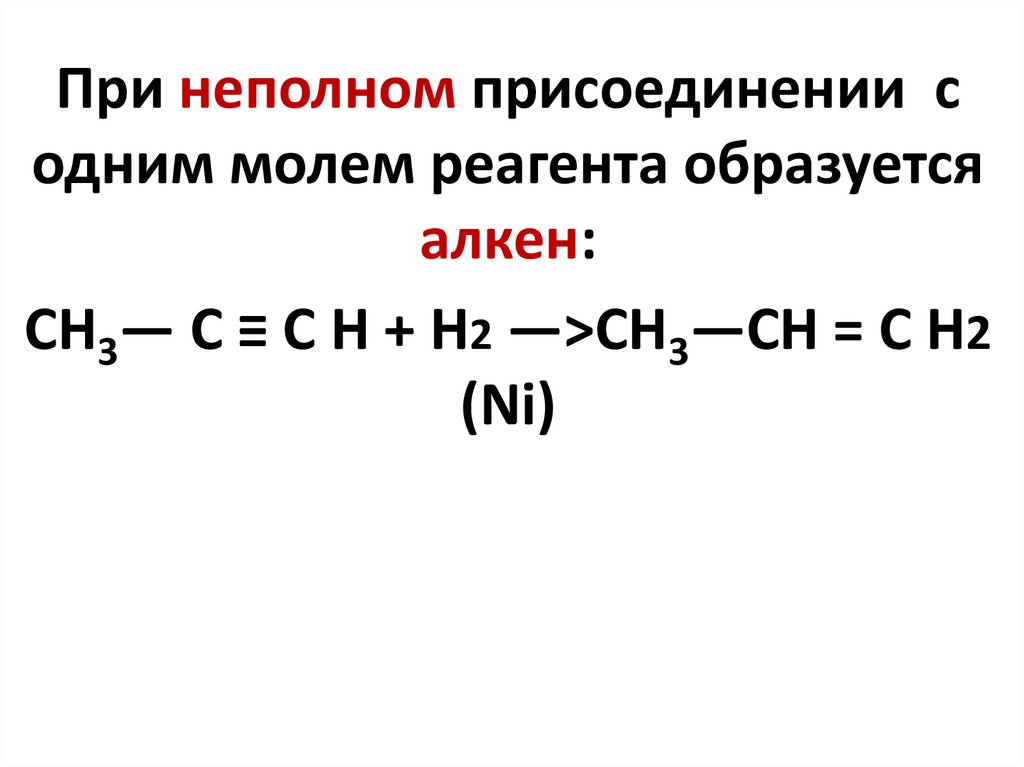
При неполном присоединении содним молем реагента образуется
алкен:
CH3— C ≡ C H + H2 —>CH3—CH = C H2
(Ni)
12.
Аналогично протекают процессыгалогенирования полного и
неполного:
CH3—C ≡C H + 2Br2 —> CH3—CBr2-CHBr2
-2 моль реагента
CH3 — C ≡ C H + Br2 —> CH3—CBr = CHBr
-1 моль реагента
13.
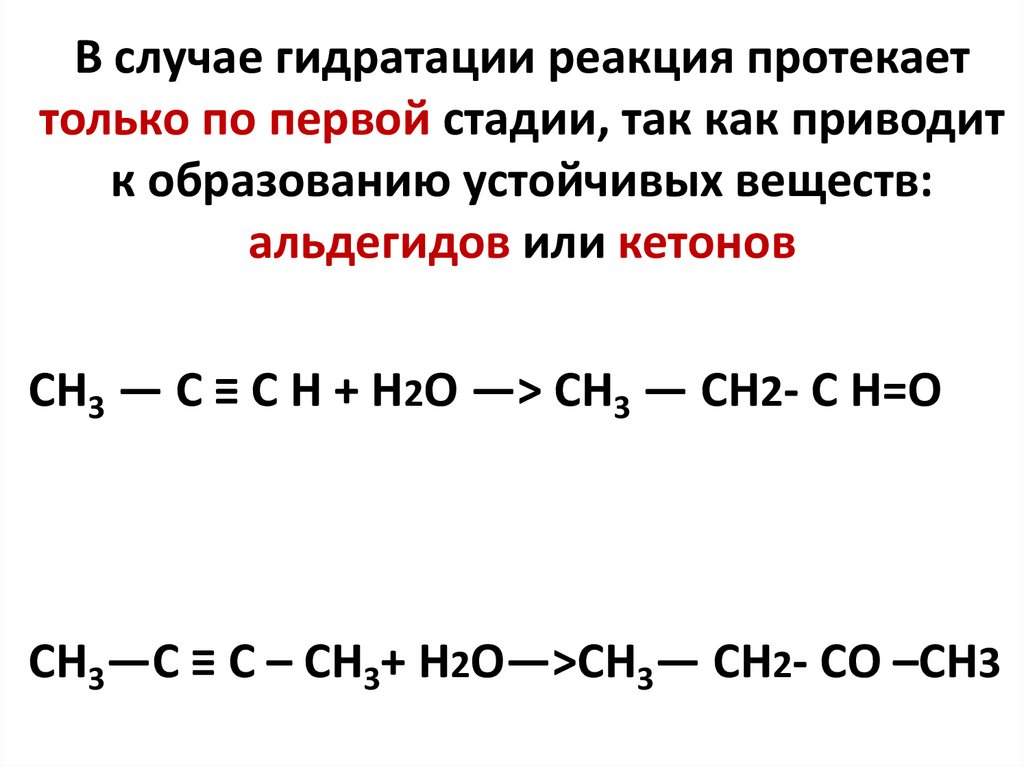
В случае гидратации реакция протекаеттолько по первой стадии, так как приводит
к образованию устойчивых веществ:
альдегидов или кетонов
CH3 — C ≡ C H + H2O —> CH3 — CH2- C H=O
CH3—C ≡ C – CH3+ H2O—>CH3— CH2- CO –CH3
14.
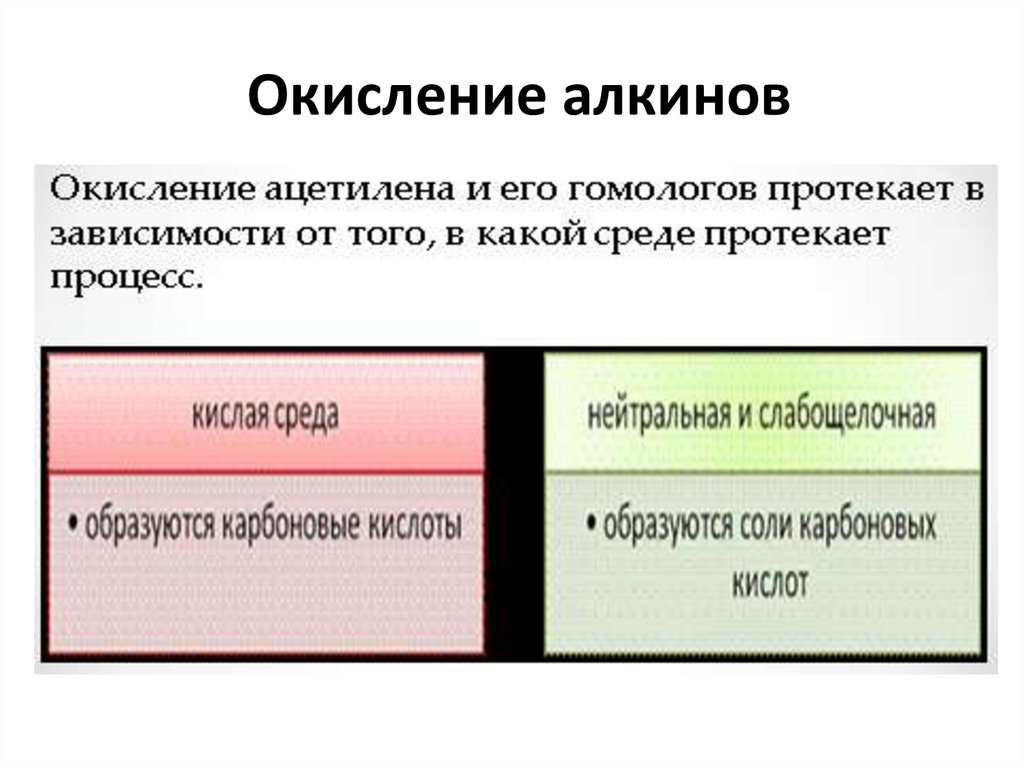
15. Окисление алкинов
16.
17.
2C-1-8e=2C+3Mn+7+3e=Mn+4
8| 3
3| 8
3HC ≡ CH +8KMnO4+H2O —>
3HOOC – COOH+ +8MnO2+8KOH+H2O
3HOOC – COOH+6KOH—> 3KOOC – COOK
+3H2O
18.
Объединим два уравнения, сократим водуслева
3HC ≡ CH +8KMnO4 —> 3KOOC – COOK+
+8MnO2+2KOH+2H2O
19.
5HC ≡ CH +8KMnO4+12H2SO4 —>5HOOC – COOH+ +8MnSO4+4K2SO4+12H2O
2C-1-8e=2C+3
Mn+7+5e=Mn+2
8| 5
5| 8
20.
21.
22.
Горение алкинов происходиткоптящим пламенем. Почему?
C3H4+4O2 —>3CO2+ 2H2O
23. Димеризация ацетилена-винилацетилен (CuCl,NH4Cl)
Димеризация ацетиленавинилацетилен (CuCl,NH4Cl)H C ≡ C H + H C ≡ C H —> CH2 = CH—C ≡ C H
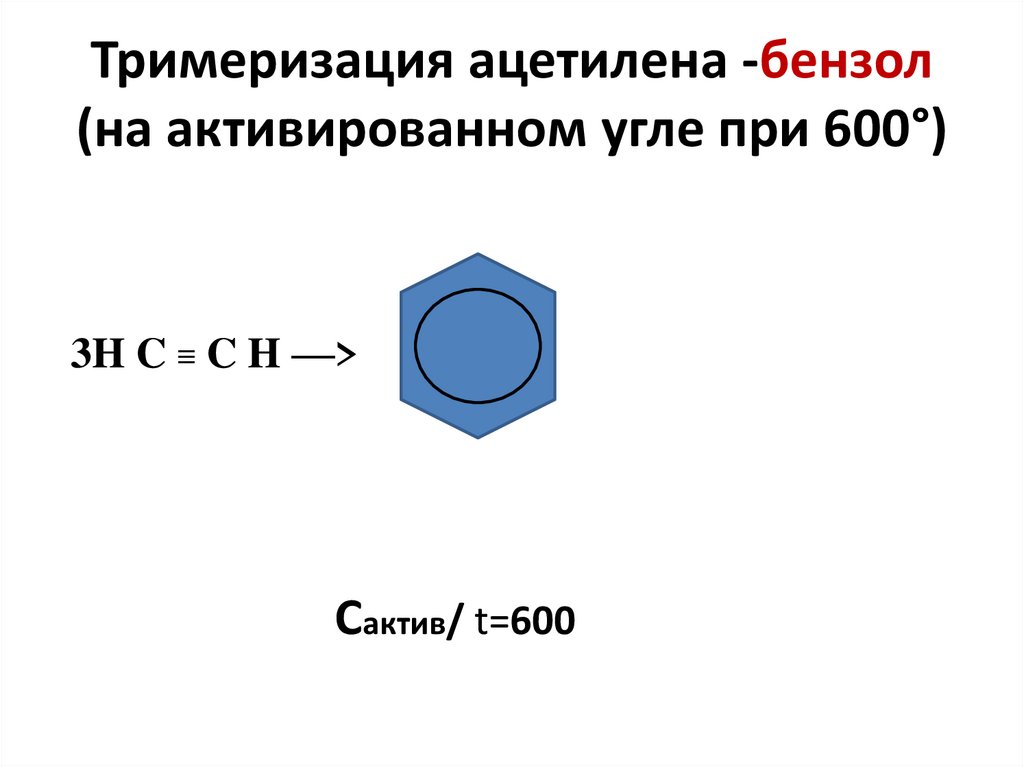
24. Тримеризация ацетилена -бензол (на активированном угле при 600°)
3H C ≡ C H —>Cактив/ t=600
25.
Реакции замещения атомов водородаУ алкинов есть еще одна характерная особенность,
они имеют подвижные атомы водорода,
находящиеся
при тройной связи HC ≡ CH
Такие атомы способны замещаться на атомы
металлов, проявляя кислые свойства.
У ацетилена таких атомов два,
у пропина и бутина-1 по одному.
26.
Такие процессы протекаютсо щелочными металлами Na,
с их гидридами NaH,
с оксидами серебра Ag2O и
одновалентной меди Cu2O
HC ≡ CH +2Na —> NaC ≡ CNa +H2↑
ацетиленид натрия
2CH3 — C ≡ C H +2Na —>2CH3—C ≡ CNa+ H2↑
пропинид натрия
27.
H C ≡ CH +Ag2O —> AgC ≡ CAg↓+H2Oацетиленид серебра (бурый осадок)
H C ≡ CH +Cu2O —> CuC ≡ CCu↓+H2O
ацетиленид меди (красный осадок)
28.
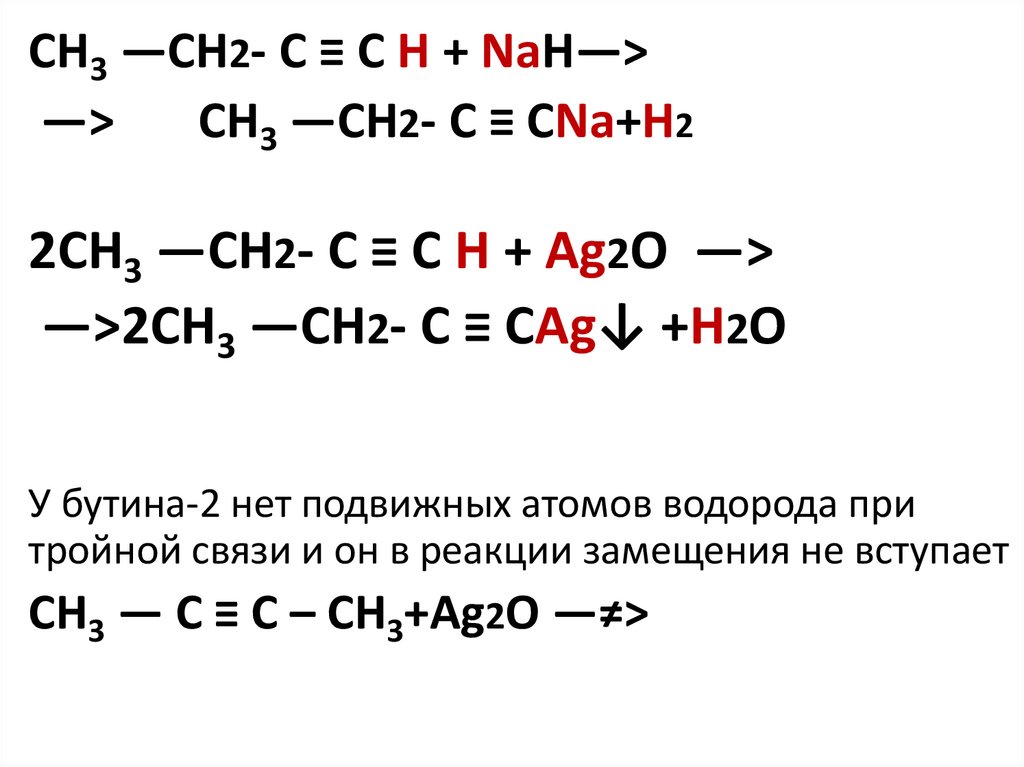
CH3 —CH2- C ≡ C H + NaH—>—>
CH3 —CH2- C ≡ CNa+H2
2CH3 —CH2- C ≡ C H + Ag2O —>
—>2CH3 —CH2- C ≡ CAg↓ +H2O
У бутина-2 нет подвижных атомов водорода при
тройной связи и он в реакции замещения не вступает
CH3 — C ≡ C – CH3+Ag2O —≠>
29.
Задача 1.Установите молекулярную формулу
алкина, содержащего12,19% водорода.
1:1,66 = 6:10
30.
Задача 2.Вычислите массу бензола, полученного
при тримеризации 5,6л ацетилена
( выход продукта составил 90%)
6,5г-теория
5,85г-пр выход











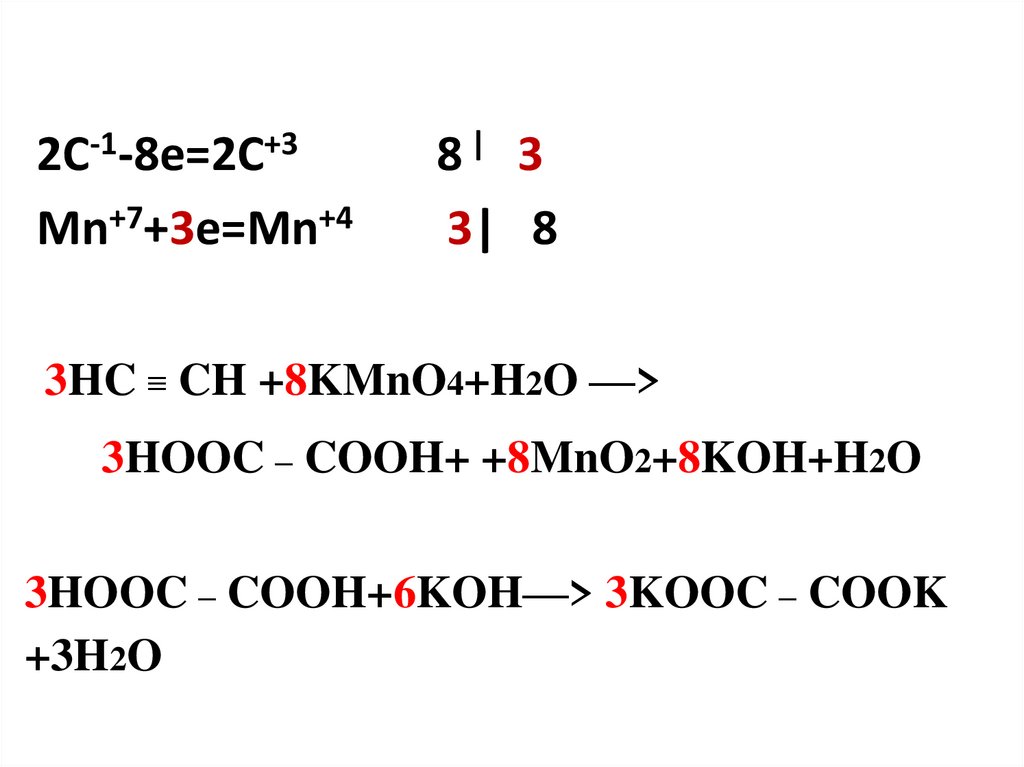











 chemistry
chemistry








