Similar presentations:
алкены - свойства
1.
2.
Агрегатное состояние:С2Н4 - С4Н8 – газы, С5Н10 – С18Н36 жидкости,
с С19Н38 – твердые вещества.
Растворимость
Алкены нерастворяются в воде.
Формула
Т плавления, °С
Т кипения, °С
С2H4
−169,1
−103,7
C3H6
−187,6
−47,7
C4H8
−185,3
−6,3
3.
4.
Реакции присоединенияСубстрат Реагент
Ni, t
С = С +
Н2
С = С +
Br2
С = С +
HCl
t, H+
С = С + H2О
n ( С = С )
Продукт
Вид реакции
С С
Н Н
С С
Br Br
С С
H Cl
Гидрирование
(восстановление)
С С
H ОН
катализатор
( С С )n
Галогенирование
(бромирование)
Гидрогалогенирование
(гидрохлорирование)
Гидратация
Полимеризация
5.
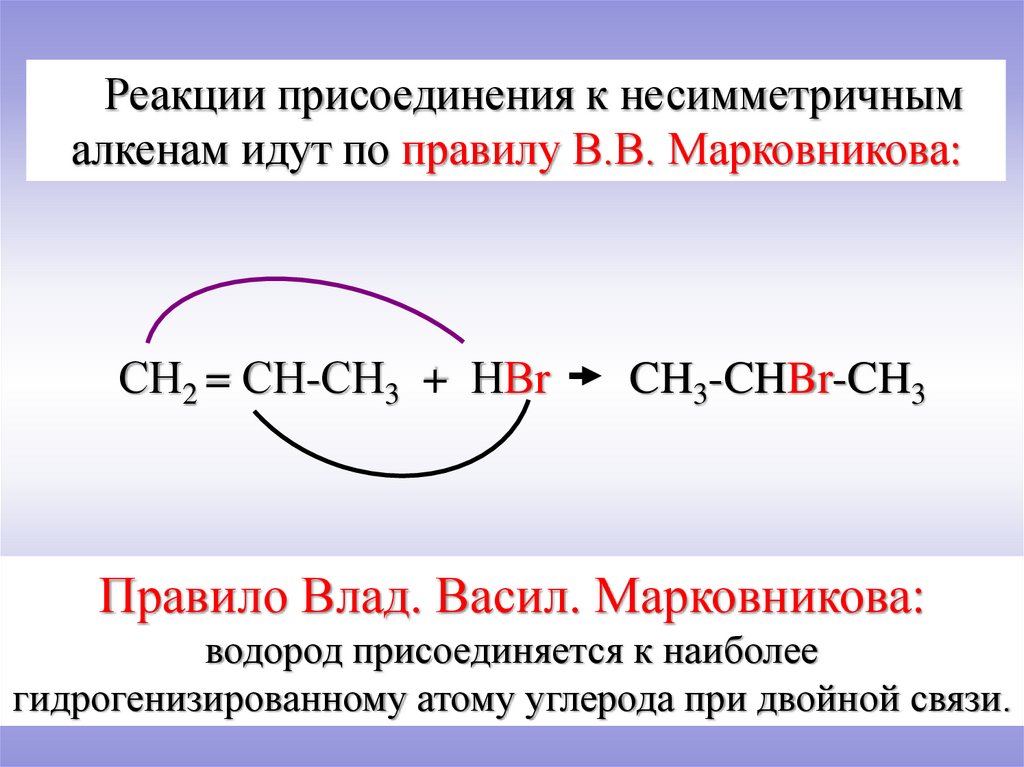
Реакции присоединения к несимметричнымалкенам идут по правилу В.В. Марковникова:
СН2 = СН-СН3 + НВr
CH3-CHBr-CH3
Правило Влад. Васил. Марковникова:
водород присоединяется к наиболее
гидрогенизированному атому углерода при двойной связи.
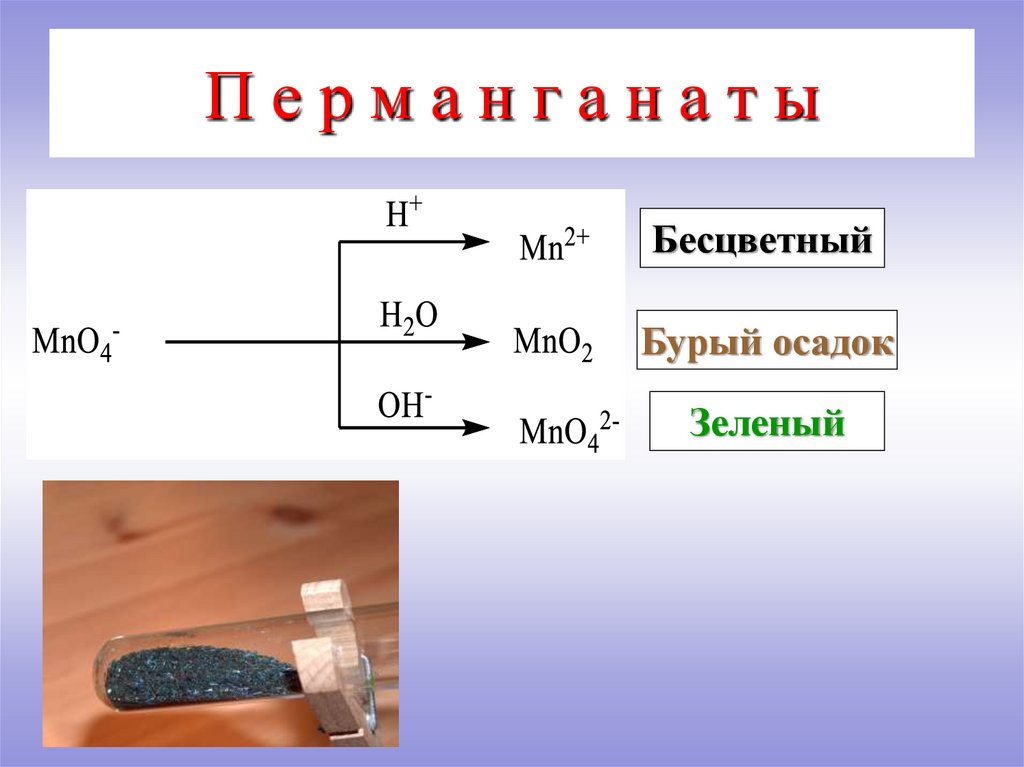
6. П е р м а н г а н а т ы
ПерманганатыБесцветный
Бурый осадок
Зеленый
7.
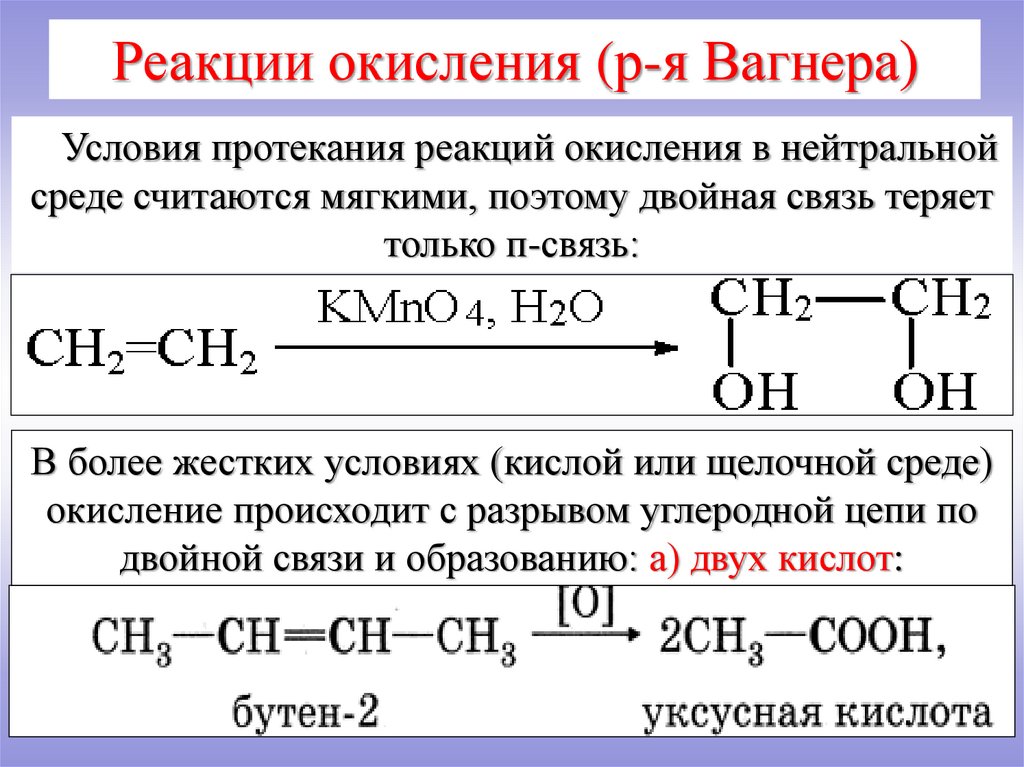
Реакции окисления (р-я Вагнера)Условия протекания реакций окисления в нейтральной
среде считаются мягкими, поэтому двойная связь теряет
только п-связь:
В более жестких условиях (кислой или щелочной среде)
окисление происходит с разрывом углеродной цепи по
двойной связи и образованию: а) двух кислот:
8.
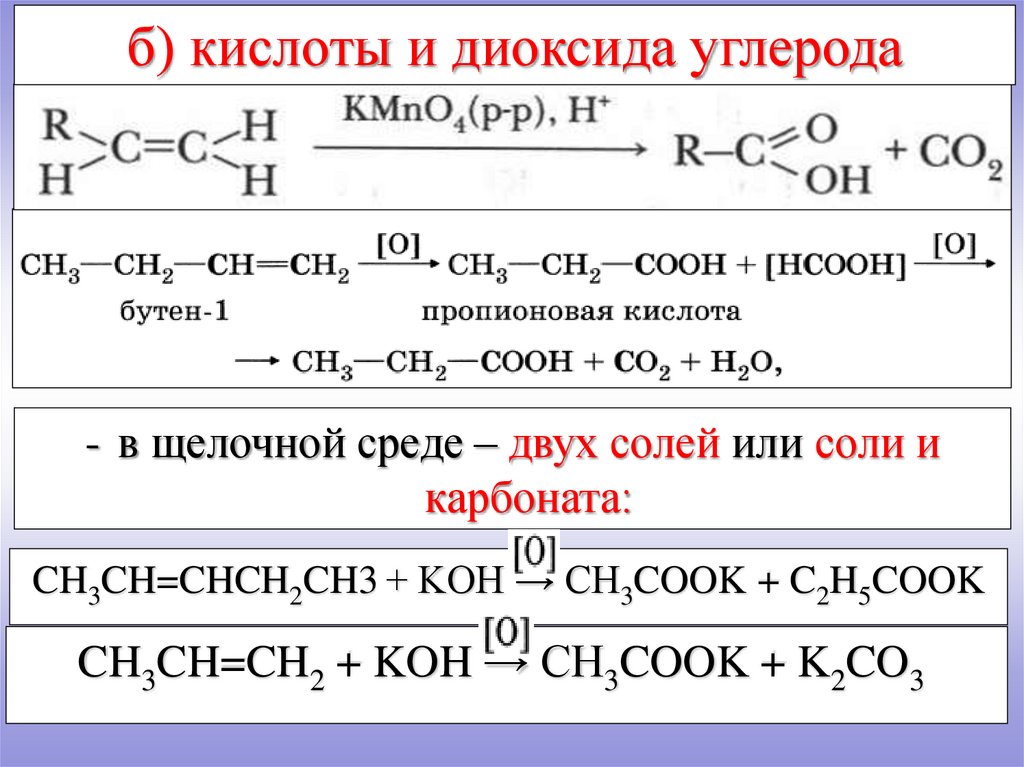
б) кислоты и диоксида углерода- в щелочной среде – двух солей или соли и
карбоната:
CH3CH=CHCH2CH3 + KOH → CH3COOK + C2H5COOK
CH3CH=CH2 + KOH → CH3COOK + K2CO3
9.
Горение алкеновCnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O
CnH2n + 3n/2O2 → nCO2 + nH2O
А в чём же разница?
10.
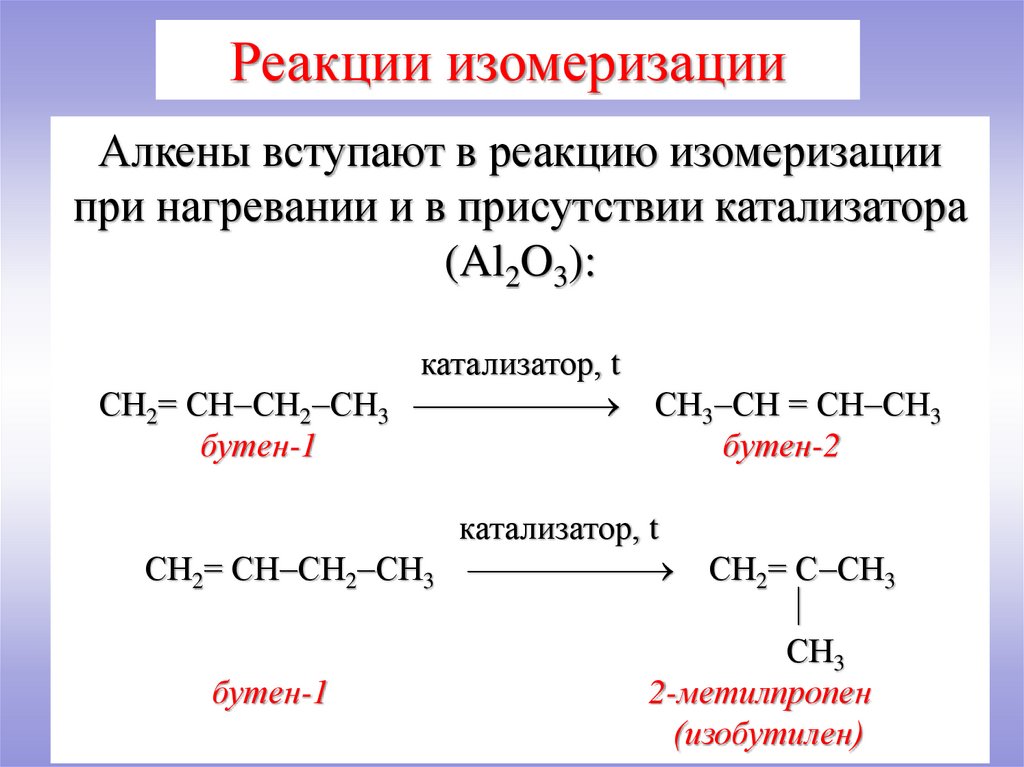
Реакции изомеризацииАлкены вступают в реакцию изомеризации
при нагревании и в присутствии катализатора
(Al2O3):
СН2= СН СН2 СН3
бутен-1
катализатор, t
СН3 СН = СН СН3
бутен-2
СН2= СН СН2 СН3
бутен-1
катализатор, t
СН2= С СН3
СН3
2-метилпропен
(изобутилен)
11.
12.
Получениеспиртов,
альдегидов, кислот.
Этилен – для
ускорения
созревания плодов.
Получение
полимеров и
пластмасс.
Получение
СК (резины).






 chemistry
chemistry








